-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVztah variability srdeční frekvence a perioperační systémové zánětlivé odpovědi
Association between heart rate variability and perioperative systemic inflammatory response
Objective:
Colorectal surgery significantly affects homeostasis. The aim of the study was to identify patients with high inflammatory response to surgical injury, objectivized by the levels of C-reactive protein (CRP), interleukin-6 (IL-6) and white cell count (WCC) measured within 48 hours after the beginning of surgery by pre-operative measurement of heart rate variability (HRV).Design:
Prospective, observational study.Setting:
Department of Anesthesiology and Intensive Care Medicine, University HospitalMaterials and methods:
HRV was measured during orthostatic load one day before surgery. The patients were divided according to the HRV results into two groups: CAR (with cardiac autonomic reactivity, n=23), and NCAR (without cardiac autonomic reactivity, n=30). Serum levels of CRP, IL-6 and WCC were obtained at 0, 12 (only IL-6), 24 and 48 hours after the beginning of surgery.Results:
The observed CAR and NCAR were significantly different at the levels of CRP at T0 (6.5±5.1 mg/L vs. 16.4±23.2 mg/L, p<0.05), T24 (70.5±33.6 mg/L vs. 95.7±49.1 mg/L, p<0.05), T48 (103.1±42.4 mg/L vs. 159.0±63.4 mg/L, p<0.001), and IL-6 at T12 (79.3±42.2 pg/mL vs. 248.2±285.2 pg/mL, p<0.05), T24 (68.0±28.0 pg/mL vs. 239.6 ± 245.8 pg/mL, p<0.001), and T48 (39.5±18.4 pg/mL vs. 195.5±162.9 pg/mL; p<0.0001). There was no significant difference in WCC between CAR and NCAR patients.Conclusion:
HRV is a method for identifying patients with high perioperative pro-inflammatory response. Statistical differences in CRP and IL-6 levels between the studied groups increased over time. IL-6 was statistically significantly different already at T24, thus enabled earlier identification of patients with higher pro-inflammatory response when compared to CRP.Keywords:
heart rate variability – systemic inflammatory response – C-reactive protein – interleukin-6 – leukocytes – colorectal surgery
Autoři: P. Reimer 1; M. Káňová 1; J. Máca 1; P. Ševčík 1; M. Burda 2; M. Adamus 3
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Ostrava a Lékařská fakulta Ostravské univerzity 1; Ústav pro výzkum a aplikace fuzzy modelování, Ostravská univerzita 2; Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Olomouc a Lékařská fakulta Univerzity Palackého v Olomouci 3
Vyšlo v časopise: Anest. intenziv. Med., 29, 2018, č. 1, s. 3-13
Kategorie: Anesteziologie - Původní článek
Souhrn
Cíl studie:
Kolorektální resekce významně ovlivňují homeostázu organismu. Cílem práce bylo zjistit, zda předoperačně měřená variabilita srdeční frekvence (heart rate variability – HRV) může identifikovat pacienty s vysokou prozánětlivou odpovědí na operační inzult objektivizovanou koncentracemi C-reaktivního proteinu (CRP), interleukinu-6 (IL-6) a leukocytů (Leu) do 48 hodin od začátku operace.Typ studie:
Prospektivní observační studie.Typ pracoviště:
Klinika anesteziologie, resuscitace a intenzivní medicíny, fakultní nemocnice.Materiál a metoda:
HRV byla měřena během ortostatické zkoušky den před operací. Pacienti byli rozděleni dle HRV do dvou skupin: KAR (s kardiální autonomní reaktivitou, n = 23) a NKAR (bez kardiální autonomní reaktivity, n = 30). Sérové koncentrace CRP, IL-6 a Leu byly vyšetřeny v časových intervalech 0, 12 (pouze IL-6), 24 a 48 hodin od začátku operace.Výsledky:
KAR a NKAR se lišily v koncentracích CRP v T0 (6,5 ± 5,1 vs. 16,4 ± 23,2 mg/l, p < 0,05), T24 (70,5 ± 33,6 vs. 95,7 ± 49,1 mg/l, p < 0,05), T48 (103,1 ± 42,4 vs. 159,0 ± 63,4 mg/l, p < 0,001) a IL-6 v T12 (79,3 ± 42,2 vs. 248,2 ± 285,2 pg/ml, p < 0,05), T24 (68,0 ± 28,0 vs. 239,6 ± 245,8 pg/ml, p < 0,001) a T48 (39,5 ± 18,4 vs. 195,5 ± 162,9 pg/ml, p < 0,0001). KAR a NKAR se signifikantně nelišily v počtu leukocytů.Závěr:
HRV je metoda k identifikaci pacientů, kteří vykazují perioperačně vysokou prozánětlivou odpověď. Statistická rozdílnost koncentrací CRP a IL-6 mezi skupinami narůstala s časem. IL-6 byl statisticky významně rozdílný již v T24, tedy časněji identifikoval pacienty s vyšší prozánětlivou odpovědí v porovnání s CRP.Klíčová slova:
variabilita srdeční frekvence – systémová zánětlivá odpověď – C-reaktivní protein – interleukin-6 – leukocyty – kolorektální chirurgieÚvod
Zánět je klíčová složka fyziologické odpovědi organismu na inzult způsobený chirurgickým traumatem. Úspěšná zánětlivá odpověď je rovnováhou mezi prozánětlivými a protizánětlivými mechanismy a vede k hojení tkání a znovuobnovení homeostázy. Pokud protizánětlivé mechanismy selhávají, organismus se dostává do prolongovaného systémového zánětlivého stavu. Ten je podkladem pro pokračující poškození tkání, které může progredovat do orgánového selhávání a v některých případech i k šokovému stavu a smrti [1]. Jedním ze zásadních regulátorů imunitní odpovědi je autonomní nervový systém (ANS). Na kontrole imunitní odpovědi se podílejí synergicky obě základní větve ANS – parasympatický nervový systém (PNS) a sympatický nervový systém (SNS). PNS reguluje imunitu inhibicí uvolňování prozánětlivých cytokinů prostřednictvím protizánětlivého efektu nervus vagus na nikotinových acetylcholinových receptorech makrofágů. Toto neuroimunitní propojení je určující pro odpověď organismu na inzult a znovunastolení homeostázy [2]. Zdatnost ANS je podkladem fyziologických rezerv organismu a jeho schopnosti adekvátně reagovat na chirurgické trauma [3].
Analýza variability srdeční frekvence (heart rate variability – HRV) je akceptovanou neinvazivní metodou ke zhodnocení autonomní nervové regulace [4, 5]. Redukovaná HRV poukazuje na sníženou funkci ANS – autonomní dysfunkci (AD). Určitá míra AD se vyskytuje u většiny chronických chorob (typickým příkladem je diabetes mellitus) a zároveň je jejich nepříznivým prognostickým faktorem (typicky u stavů po infarktu myokardu) [6, 7]. V rámci perioperačního průběhu je AD potvrzeným faktorem zhoršujícím jeho průběh, a to jak hemodynamickou nestabilitou během celkové anestezie, tak i vyšší pooperační morbiditou a mortalitou [3, 8, 9].
Kolorektální chirurgie výrazně zasahuje do integrity organismu, narušuje homeostázu a vede k vysoké prozánětlivé reakci [10]. Míru zánětu lze objektivizovat laboratorně. Mezi používané laboratorní parametry patří C-reaktivní protein (CRP) jakožto představitel proteinů akutní fáze, interleukin 6 (IL-6) jako zástupce prozánětlivých cytokinů a počet leukocytů (Leu). Produkce IL-6 je přímou buněčnou odpovědí na chirurgické trauma. Následné uvolnění IL-6 do systémové cirkulace indukuje produkci CRP hepatocyty. Zánět vede k aktivaci leukocytů, která se projevuje jejich zvýšeným průnikem do místa tkáňového poškození a jejich vyššími sérovými koncentracemi. Koncentrace IL-6 dosahuje vrcholu za 12–24 hodin od chirurgického inzultu. CRP dosahuje maxima své koncentrace v odstupu 48–72 hodin od začátku operace. Počet leukocytů dosahuje vrcholu v odpovědi na operační trauma za 24–48 hodin [11].
Současné práce potvrzují, že míra systémového zánětu vyjádřená hladinami CRP a IL-6 ovlivňuje pooperační průběh [11–17]. Doba, kdy hodnotit CRP a IL-6 vzhledem k možným pooperačním komplikacím, navíc odpovídá času dosažení vrcholu jejich plazmatických hladin v organismu: IL-6 je prediktorem možných komplikací již 24 hodin od inzultu [17], CRP lze hodnotit jako ukazatel komplikací v odstupu tří, respektive čtyř dnů [13–16]. Počet leukocytů v současné literatuře nebyl potvrzen jako samostatný marker možných pooperačních komplikací [18]. Spojitost redukované HRV a vyšších hodnot CRP a IL-6 byla potvrzena jak u pacientů s chronickými chorobami [19], tak v kritickém stavu, např. při sepsi [20]. Toto zjištění ukazuje, že zánět v organismu je pod významným vlivem autonomní regulace. HRV je neinvazivní možností predikce míry prozánětlivé odpovědi na inzult.
Cílem studie bylo zjistit vztah mezi HRV měřenou spektrální analýzou (SA) během ortostatické zkoušky den před operací a velikostí prozánětlivé odpovědi vyjádřené koncentracemi CRP, IL-6 a Leu do 48 hodin od inzultu.
Soubor a metoda
Tato prospektivní observační studie byla schválena etickou komisí Fakultní nemocnice Ostrava (číslo jednací 606/2014) a zaregistrována na ClinicalTrials.gov (identifikační kód NCT02375412). Všichni zařazení pacienti podepsali informovaný souhlas. Studie probíhala od února 2015 do prosince 2016 ve Fakultní nemocnici Ostrava. Bylo do ní zařazeno 65 pacientů, kteří měli podstoupit plánovanou kolorektální resekci. Vyřazovací kritéria byla: akutní chirurgický výkon, absence sinusového rytmu, ASA (American Society of Anesthesiologists) klasifikace 1, věk < 18 let. Demografické a anamnestické údaje byly zaznamenány předoperačně. Analyzovaný soubor pacientů a jeho rozdělení pocházejí z naší předchozí práce zabývající se předoperační HRV a vznikem pooperačních komplikací [3].
Vlastní HRV měření bylo prováděno v tiché místnosti v odpoledních hodinách den před operací. Spektrální analýza HRV byla měřena dle standardizovaných mezinárodních doporučení (Task Force Recommendations) [21] s použitím diagnostického přístroje DiANS PF8 (Olomouc, Česká republika). Z výsledného elektrokardiogramu byly jak automaticky daným softwarem, tak manuálně odfiltrovány ektopické srdeční stahy a artefakty. Výsledné R-R intervaly byly poté analyzovány modifikovanou rychlou Fourierovou transformací (FFT). Záznam byl získán ze tří po sobě následujících pozic (leh 1, stoj, leh 2); každá pozice trvala 5 minut. První pozice (leh 1) byla pokládána za adaptivní, aktivní postavení (stoj) představovalo vlastní autonomní zátěž a následné položení (leh 2) bylo bráno jako výsledná pozice pro zhodnocení spektrálních parametrů HRV [22, 23]. Výsledné měření bylo zobrazeno v grafické formě spektrálních výkonů v čase, což umožnilo celkové vizuální zhodnocení HRV dynamiky. Ke každému grafickému zhodnocení byly vypočteny následující indexy SA pro jednotlivé pozice: 1. spektrální výkon nízké frekvence (LF; 0,05–0,15 Hz) zahrnující kombinaci sympatické a parasympatické kardiální inervace; 2. spektrální výkon vysoké frekvence (HF; 0,15–0,4 Hz) odpovídající dominantně parasympatickému vlivu; 3. celkový spektrální výkon (TP; 0,05–0,4) představující sumární variabilitu v obou frekvencích (LF + HF) a 4. poměr LF a HF (LF/HF) odrážející sympatovagální interakci [4, 21]. Spektrální indexy byly vyjádřeny jak v absolutních hodnotách (ms2), tak ve formě přirozeného logaritmu (ln). Pro konečné zhodnocení HRV jsme použili TP z pozice leh 2. Pacienti byli rozděleni do dvou skupin dle kardiální autonomní reaktivity: skupina KAR (s kardiální autonomní reaktivitou) charakterizována TP ≥ 200 ms2 a grafem s typickými vrcholy spektrálního výkonu v jednotlivých frekvenčních pásmech a pozicích (obr.1) a skupina NKAR (bez kardiální autonomní reaktivity) definována TP < 200 ms2 a plochým grafem ukazujícím celkovou redukci spektrálního výkonu (obr. 2).
Obr. 1. Typický graf spektrální analýzy HRV při ortostatické zkoušce u pacientů KAR 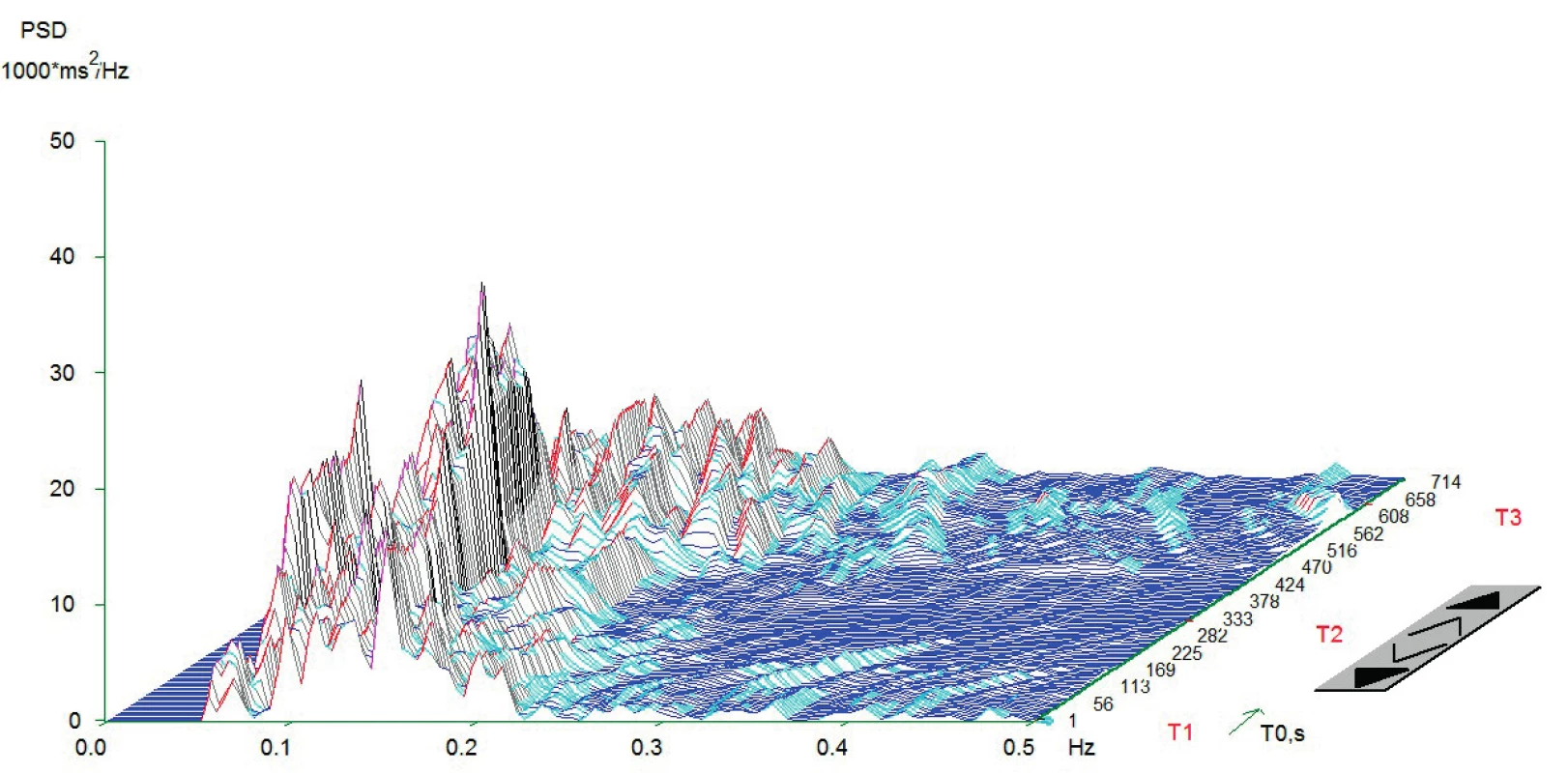
Z grafu jsou zřetelně vidět vysoké amplitudy v jednotlivých frekvenčních pásmech, které jsou podstatou dobré celkové variability srdeční frekvence. Znázorněno je typické zvýšení amplitudy v pásmu LF (0,05-0,15 Hz) a redukce v pásmu HF (0,15-0,4 Hz) v čase T2. To je dáno aktivací baroreceptorů a redukci aktivity nervus vagus po postavení. V čase T3 je vidět typicky snížení amplitudy v pásmu LF a zvýšení v HF. Příčinou je reflexní augmentace nervus vagus po položení. Osa x – frekvence oscilací R-R intervalů (Hz); osa y – hustota spektrálního výkonu (power spectral density – PSD; ms2/Hz); osa z – časový průběh záznamu s měnící se polohou pacienta (T1 = leh 1, T2 = stoj, T3 = leh 2; s). Měření provedeno na přístroji DiANS PF8 (verze 2013) společnosti Dimea Group, s.r.o./Ltd., Olomouc, Česká republika. (Archiv autora) Obr. 2. Typický graf spektrální analýzy HRV při ortostatické zkoušce u pacientů NKAR 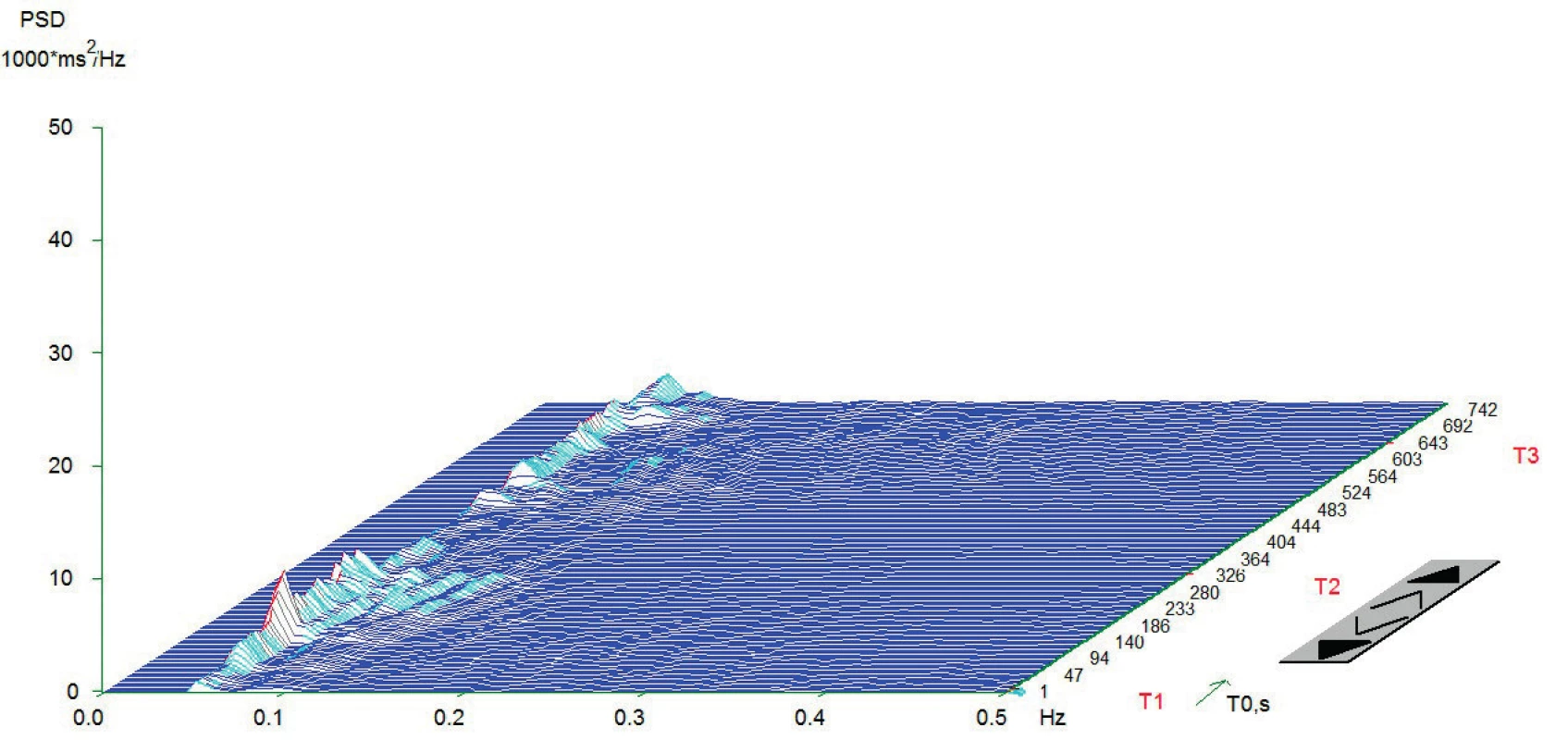
Typický plochý graf bez reaktivity na ortostatickou zátěž. Aktivita vagu v pásmu HF (0,15-0,4) je téměř vymizelá. Graf typický pro pacienty se závažnou autonomní neuropatií. Osa x – frekvence oscilací R-R intervalů (Hz); osa y – hustota spektrálního výkonu (power spectral density – PSD; ms2/Hz); osa z – časový průběh záznamu s měnící se polohou pacienta (T1 = Leh 1, T2 = stoj, T3 = Leh 2; s). Měření provedeno na přístroji DiANS PF8 (verze 2013) společnosti Dimea Group, s.r.o./Ltd., Olomouc, Česká republika. (Archiv autora) Anesteziologický a chirurgický postup byl u všech pacientů proveden standardně dle platných doporučení. Pacientům byla podána celková anestezie (CA) v kombinaci s epidurálním katétrem nebo bez něj. K úvodu do CA byl použit sufentanil (0,2–0,5 μg/kg), propofol (1,5–2,5 mg/kg) a cis-atracurium (0,15 mg/kg). K vedení doplňované CA byl použit sevofluran v kombinaci se směsí kyslíku a vzduchu; k peroperační analgetizaci byl přidáván sufentanil v dávce 0,2–0,5 μg/kg/hod. Plicní ventilace byla standardizována (6–8 ml/kg ideální tělesné váhy, PEEP 5–7 cm H2O). Anesteziologický management (perioperační podání tekutin, transfuzních přípravků a vazoaktivních látek) byl v kompetenci příslušného anesteziologa. Operační výkony byly provedeny v antibiotické profylaxi amoxicilinem s kyselinou klavulanovou a metronidazolem ve třech dávkách. Byla zaznamenána intraoperační data (trvání procedury, tekutinová bilance, podání vazoaktivních látek). Po výkonu byli pacienti přeloženi na jednotku intenzivní péče. Pooperační analgetizace byla standardizována; pacienti bez EDK byli analgetizováni intravenózně kombinací piritramidu (1–3 mg/h) a neopiátových analgetik; pacienti s předoperačně zavedeným epidurálním katétrem dostávali epidurálně analgetickou směs levobupivacainu se sufentanilem.
Perioperační zhodnocení dynamiky systémové zánětlivé odpovědi jsme provedli na základě vyšetření koncentrací CRP, IL-6 a Leu ze séra. Odběry k laboratornímu vyšetření byly uskutečněny z centrálního žilního katétru (CŽK) ihned po úvodu do CA (T0), poté v odstupu 24 hodin (T24) a 48 hodin (T48). Parametr IL-6 jsme navíc vyšetřovali v odstupu 12 hodin po úvodu do CA (T12).
Statistika
Numerická data jsou popsána dvojicí aritmetický průměr a ± směrodatná odchylka (standard deviation – SD). Kategorická data jsou charakterizována absolutním počtem a relativní četností (v %). Rozdíly mezi KAR a NKAR byly vyhodnoceny použitím dvouvýběrového t-testu (numerická data) nebo Fisherova exaktního testu (kategorická data) s výjimkou HRV parametrů, jejich rozdílnost mezi skupinami KAR a NKAR byla posouzena pomocí lineární regrese, do níž byly jako další vysvětlující proměnné zahrnuty také komorbidity a ASA klasifikace, a tudíž jsou výsledky adjustovány s ohledem na jejich možný vliv. Hodnoty p-value HRV parametrů byly také adjustovány pro mnohonásobné statistické testování (simultánní statistickou inferenci) pomocí Holmova schématu. Všechny statistické analýzy, obrázky a tabulky byly vytvořeny certifikovaným statistikem za použití statistického softwaru R verze 3.3.3. Hladina významnosti statistických testů byla stanovena na p ≤ 0,05.
Výsledky
Do studie bylo zařazeno 65 pacientů. Dvanáct pacientů bylo vyřazeno z další analýzy z následujících důvodů: zrušení operačního výkonu (n = 2), neadekvátního elektrokardiogramu (artefakty, extrasystoly, n = 7) a nekompletních perioperačních dat (n = 3). Finální analýza zahrnovala 53 pacientů (CONSORT flow diagram, obr. 3). Zkoumané skupiny se nelišily v demografických charakteristikách. Nalezli jsme mezi KAR a NKAR statisticky významné rozdíly v osobní anamnéze (infarkt myokardu: n = 0 vs. n = 6, p < 0,05; diabetes mellitus: n = 1 vs. n = 11, p < 0,01; hyperlipidémie: n = 4 vs. n = 18, p < 0,01). Tyto rozdíly v komorbiditách odpovídaly statisticky významným rozdílům v chronické medikaci (perorální antidiabetika: n = 0 vs. n = 7, p < 0,05; statiny: n = 3 vs. n = 14, p < 0,05). Rozdíly v osobní a farmakologické anamnéze se projevily v diferenci v ASA klasifikaci. KAR skupina obsahovala signifikantně více pacientů ASA II ve srovnání s NKAR (78 % vs. 47 %, p < 0,05; tab. 1).
Obr. 3. CONSORT flow diagram 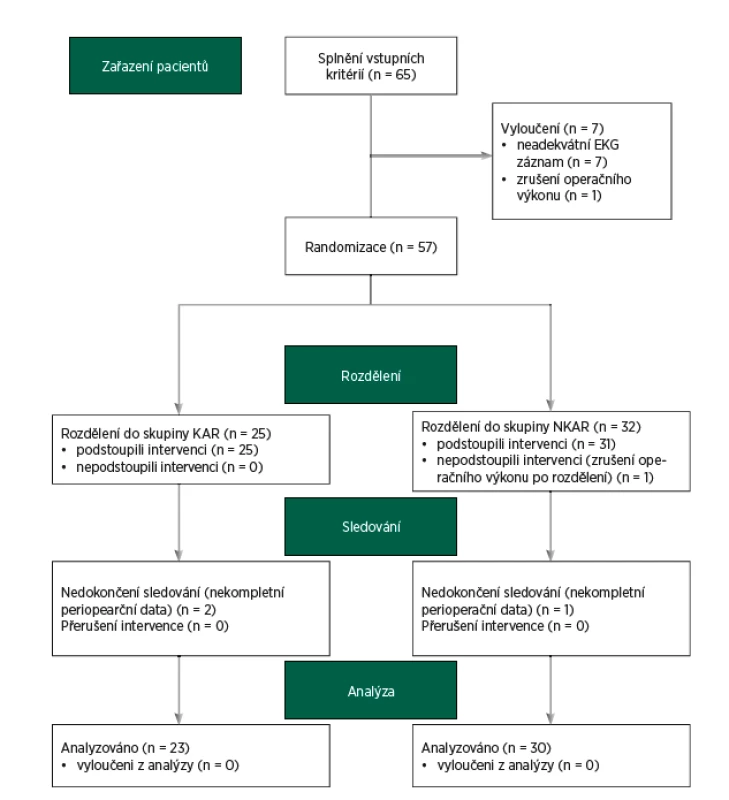
KAR (pacienti s kardiální autonomní reaktivitou); NKAR (pacienti bez kardiální autonomní reaktivity) Tab. 1. Předoperační charakteristiky pacientů 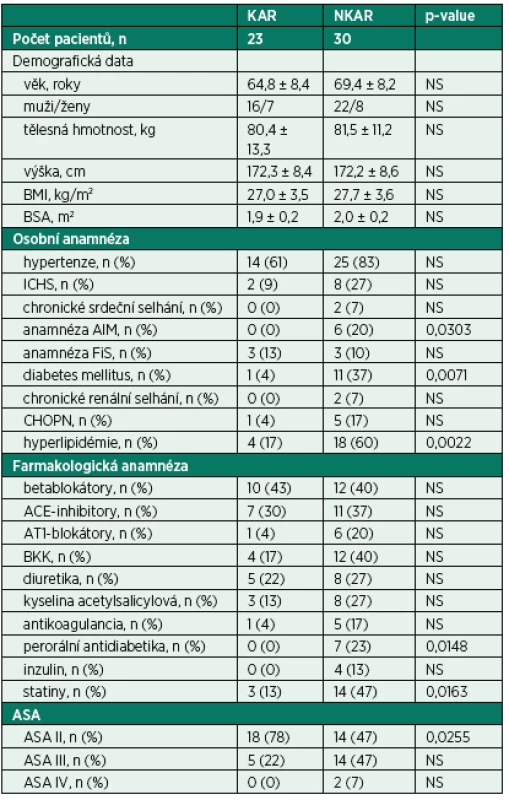
KAR – skupina s kardiální autonomní reaktivitou; NKAR – skupina bez kardiální autonomní reaktivity; *p > 0,05; NS – not significant; BMI – body mass index; BSA – body surface area; ICHS – ischemická choroba srdeční; AIM – akutní infarkt myokardu; FiS – fibrilace síní; CHOPN – chronická obstrukční plicní nemoc; ACE-inhibitory – inhibitory angiotenzin konvertujícího enzymu; AT1-blokátory – blokátory angiotenzinových receptorů typu 1; BKK – blokátory kalciových kanálů; ASA – American Society of Anesthesiologists physical status classification system Kardiální autonomní reaktivita během ortostatické zkoušky byla zjištěna u 23 pacientů (KAR) a redukovaná kardiální autonomní odpověď u 30 pacientů (NKAR). Statisticky významné rozdíly mezi studovanými skupinami byly nalezeny ve všech parametrech SA vyjádřených v absolutních hodnotách (ms2) a v podobě jejich přirozeného logaritmu (ln) ve všech třech pozicích ortostatického testu (p < 0,0001). Poměr LF/HF, tedy relativní hodnota, byl rozdílný pouze v poloze leh 1. Po výše popsané statistické adjustaci se rozdílnost mezi skupinami KAR a NKAR v absolutních a jejich logaritmických hodnotách nezměnila. V poměru LF/HF se po adjustaci obě studované skupiny mezi sebou nelišily v žádné poloze (tab. 2).
Tab. 2. Parametry spektrální analýzy HRV během ortostatické zkoušky 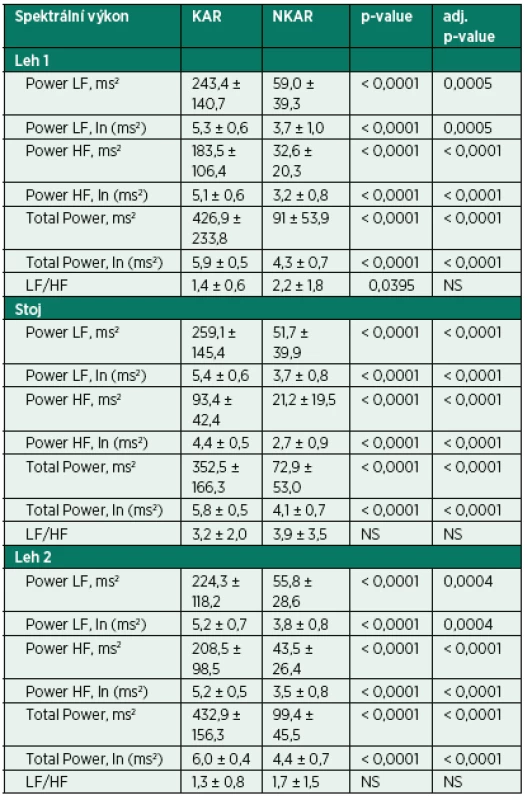
KAR – skupina s kardiální autonomní reaktivitou; NKAR – skupina bez kardiální autonomní reaktivity; *p > 0,05; NS – not significant; Power LF – výkon nízké frekvence; Power HF – výkon vysoké frekvence; Total Power – celkový výkon V rámci intraoperačních charakteristik se sledované skupiny nelišily v typu operačního výkonu, v užití laparoskopické techniky, zavedení epidurálního katétru, množství podaných tekutin a v délce trvání chirurgického výkonu a anestezie. Mezi KAR a NKAR byl nalezen statistický rozdíl v krevní ztrátě (2,7 ± 1,7 dl vs. 5,4 ± 5,4 dl,p < 0,05) a v použití aspoň jednoho vazoaktivního léku (n = 4 vs. n = 21, p < 0,001; tab. 3).
Tab. 3. Intraoperační charakteristiky 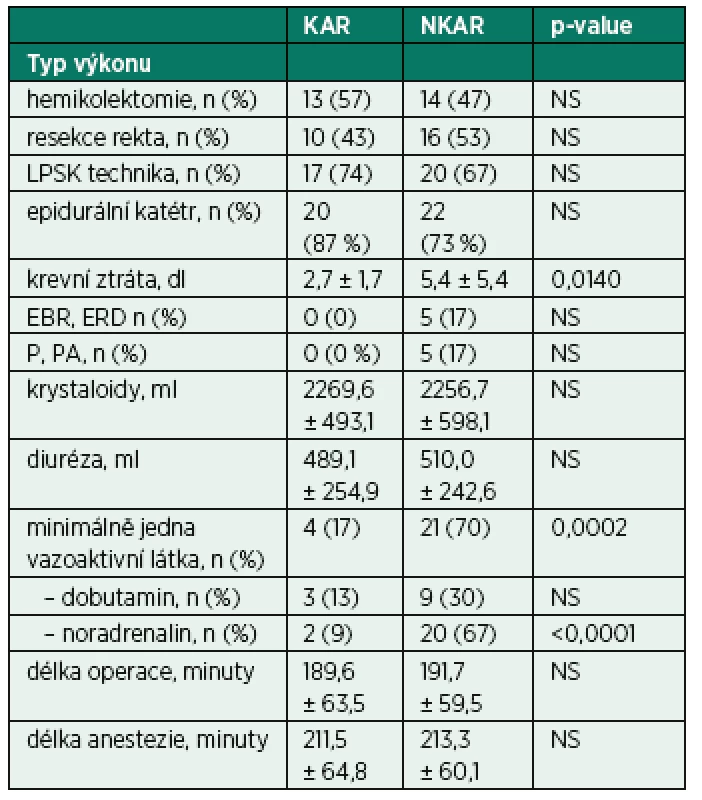
KAR – skupina s kardiální autonomní reaktivitou; NKAR – skupina bez kardiální autonomní reaktivity; *p > 0,05; NS – not significant; LPSK – laparoskopie; EBR – erytrocyty bez buffy coatu resuspendované; ERD – erytrocyty resuspendované deleukotizované; P – plazma z plné krve; PA – plazma z aferézy Nalezli jsme statisticky významnou rozdílnost mezi KAR a NKAR v perioperačních hodnotách CRP v čase T0 (6,5 ± 5,1 mg/l vs. 16,4 ± 23,2 mg/l, p < 0,05), T24 (70,5 ± 33,6 mg/l vs. 95,7 ± 49,1 mg/l, p < 0,05) a T48 (103,1 ± 42,4 mg/l vs. 159,0 ± 63,4 mg/l, p < 0,001) (obr. 4). Statistická rozdílnost mezi studovanými skupinami byla zjištěna s výjimkou času T0 v hodnotách IL-6 v časech T12 (79,3 ± 42,2 pg/ml vs. 248,2 ± 285,2 pg/ml, p < 0,05), T24 (68,0 ± 28,0pg/ml vs. 239,6 ± 245,8 pg/ml, p < 0,001) a T48 (39,5 ± 18,4 pg/ml vs. 195,5 ± 162,9pg/ml; p < 0,0001) (obr. 5). U obou měřených parametrů CRP a IL-6 se statistická rozdílnost mezi KAR a NKAR prohlubovala s časem. Rozdíl v počtu leukocytů mezi KAR a NKAR nebyl statisticky signifikantní v žádném z odběrových časů: T0 (8,9 ± 3,0 × 109/l vs. 9,1 ± 2,7 × 109/l, p > 0,05), T24 (8,9 ± 2,3 × 109/l vs.10,2 ± 3,3 × 109/l, p > 0,05) a T48 (8,8 ± 2,3 × 109/l vs. 10,0 ± 3,1 × 109/l, p > 0,05) (obr. 6).
Obr. 4. Box plot koncentrací CRP mezi skupinami KAR a NKAR v čase 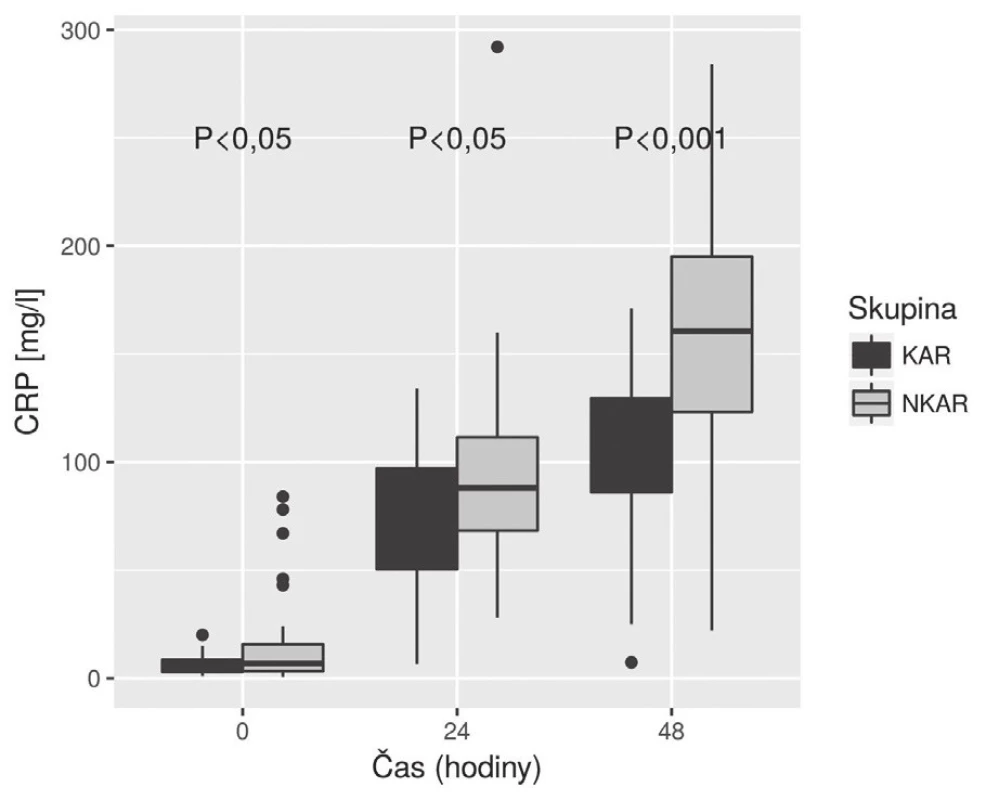
CRP – C-reaktivní protein; KAR – skupina s kardiální autonomní reaktivitou; NKAR – skupina bez kardiální autonomní reaktivity Obr. 5. Box plot koncentrací IL-6 mezi skupinami KAR a NKAR v čase 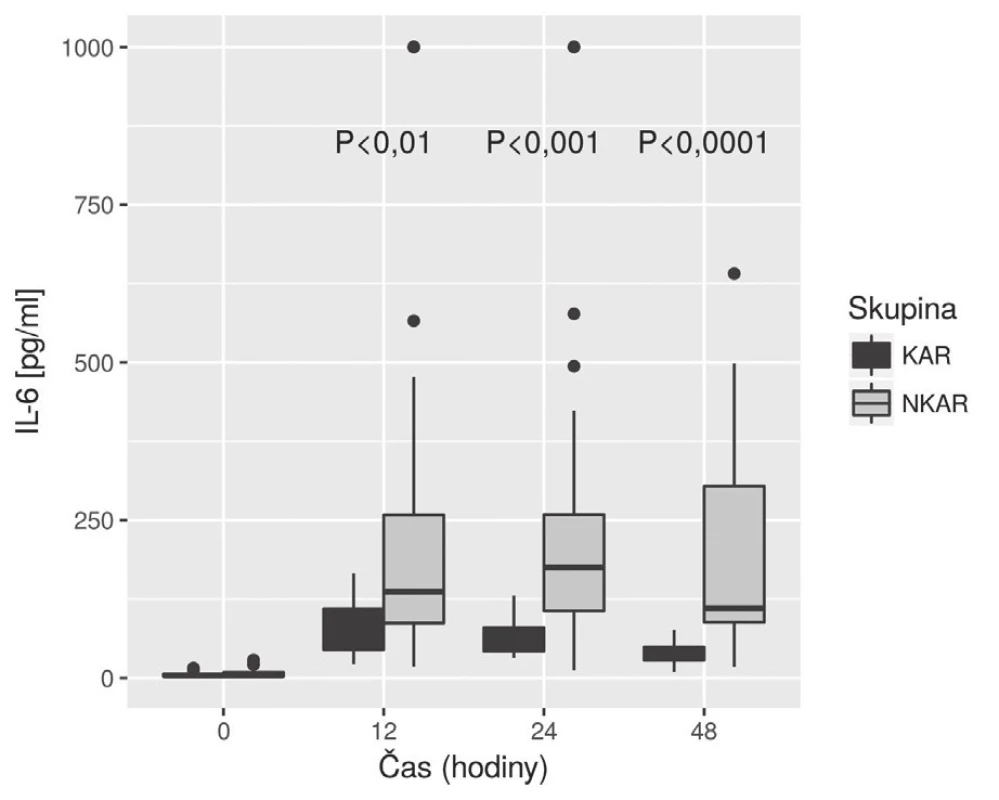
IL-6 – interleukin-6; KAR – skupina s kardiální autonomní reaktivitou; NKAR – skupina bez kardiální autonomní reaktivity Obr. 6. Box plot koncentrací Leu mezi skupinami KAR a NKAR v čase 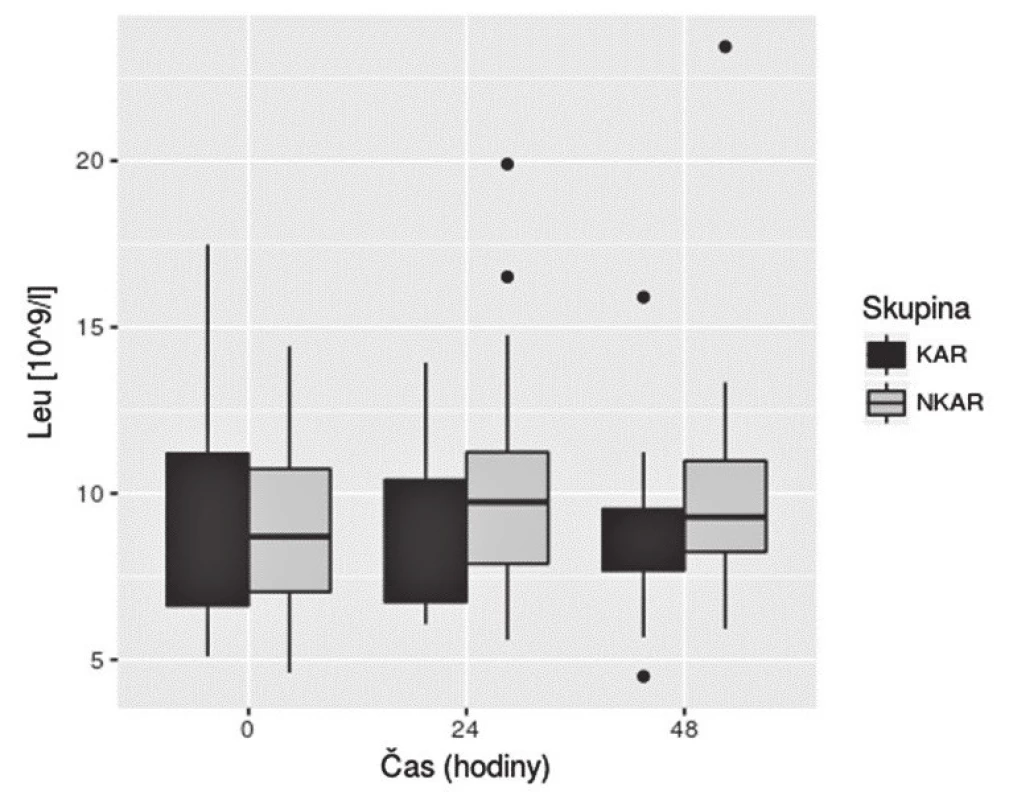
Leu – počet leukocytů; KAR – skupina s kardiální autonomní reaktivitou; NKAR – skupina bez kardiální autonomní reaktivity Diskuse
V naší studii jsme ukázali, že pacienti s redukovanou HRV (skupina NKAR) měřenou během ortostatické zkoušky den před operací vykazovali výraznější prozánětlivou odpověď objektivizovanou vyššími perioperačními hodnotami CRP a IL-6 měřenými do 48 hodin od inzultu. V počtu leukocytů se však obě studované skupiny nelišily. Naše hodnoty CRP, IL-6 a Leu v jednotlivých časech odpovídaly akceptované dynamice těchto markerů na operační inzult [11]. Navíc, jak je patrné z obr. 5, hladiny IL-6 byly mezi studovanými skupinami významně rozdílné již 24 hodin od začátku operace, což potvrzuje IL-6 jako časný ukazatel vyšší prozánětlivé odpovědi na inzult u pacientů s autonomní dysfunkcí (NKAR).
Studované skupiny se lišily ve vstupních předoperačních charakteristikách. NKAR pacienti měli více chronických komorbidit a s nimi související medikaci. Toto naše zjištění potvrzuje fakt, že většina chronických onemocnění vykazuje určitý stupeň AD [4–9], Komorbidity jsou navíc provázeny jistou mírou chronického zánětu [19], který se v naší práci potvrdil statisticky významným rozdílem v plazmatické hladině CRP v čase T0, tedy ještě před vlastním chirurgickým inzultem. Dnešní práce ukazují, že již zvýšená hladina CRP před vlastní operací vede k vyšší pooperační dlouhodobé mortalitě [16]. Vyšší nemocnost NKAR pacientů navíc korelovala s ASA klasifikací. V NKAR skupině bylo více pacientů ASA III a IV, na druhou stranu skupina KAR byla dominantně složena z ASA II pacientů. Předoperační HRV je možností objektivního zhodnocení celkových předoperační fyziologických rezerv v porovnání s ASA klasifikací, která je sice etablovaným a standardizovaným systémem, avšak jedná se o subjektivní hodnocení [3].
Intraoperační charakteristiky byly u obou skupin, s výjimkou užití vazoaktivních látek a krevní ztráty, statisticky stejné. NKAR pacienti měli významně vyšší potřebu farmakologické podpory oběhu. Toto zjištění je ve shodě s pracemi, které potvrzují, že nízká HRV predikuje hemodynamickou nestabilitu během anestezie [3, 8, 24]. Vyšší krevní ztráta u NKAR může znamenat vyšší traumatizaci tkání, nicméně statistická rozdílnost v krevní ztrátě mezi studovanými skupinami nebyla tak významná, aby zásadně ovlivnila dynamiku sledovaných prozánětlivých parametrů při jinak stejných intraoperačních charakteristikách. Zánět a koagulace jsou spolu úzce spjaty. Vyšší zánětlivý stav je však především prokoagulačním faktorem [25]. Na druhou stranu podstatným intraoperačním znakem, ve kterém se obě skupiny nelišily, bylo užití laparoskopické techniky. Miniinvazivní operativa je dnes potvrzeným aspektem snižujícím výslednou perioperační zánětlivou odpověď [11, 12].
KAR a NKAR se statisticky lišily v hladinách CRP ve všech časech a významnost narůstala s časem. V naší práci se potvrdila dynamika koncentrací CRP, která u obou skupin rostla do 48 hodin od inzultu. Naše výsledky v čase T48 jsou obdobné zjištěním v systematickém přehledu autorů Watt et al., kde byly analyzovány koncentrace CRP u kolorektálních resekcí v rozmezí 24–72 hodin od inzultu [11]. Skupina NKAR dosáhla v čase T48 nejvyšších hladin CRP a statistická rozdílnost mezi oběma skupinami byla v tomto čase nejvýznamnější. Toto zjištění ukazuje na vyšší prozánětlivý stav u pacientů NKAR, který může být poté vlastní příčinou vzniku možných pooperačních komplikací. V naší předchozí práci jsme potvrdili, že pacienti NKAR měli statisticky významně více komplikací [3]. CRP je nejčastěji zkoumaný a diskutovaný parametr stran predikce možných perioperačních komplikací. Výsledky posledních přehledových prací se shodují, že CRP nad 150 mg/l hodnoceno třetí, respektive čtvrtý den je suspektní z možných pooperačních komplikací [13–15].
Druhý parametr, který jsme použili pro laboratorní objektivizaci prozánětlivé odpovědi v časném perioperačním období, byl IL-6. V čase T0 se obě skupiny nelišily; do 12 hodin od inzultu u obou skupin hladina IL-6 stoupala, avšak poté již hladina IL-6 u skupiny KAR začala klesat a v čase T48 byl statistický rozdíl mezi oběma skupinami největší. Naše výsledky jsou ve shodě s pracemi o dynamice IL-6 v perioperačním období [11]. Navíc naše výsledky potvrzují, že dobrá autonomní regulace u KAR, především přímé protizánětlivé působení nervu vagu na nikotinových acetylcholinových receptorech makrofágů, časně blokuje zvýšené uvolnění prozánětlivých cytokinů do cirkulace [2]. IL-6 v porovnání s CRP tedy časněji identifikuje pacienty s výraznější prozánětlivou odpovědí. Naše poznatky korelují s pracemi zabývajícími se predikcí pooperačního průběhu, kde byl IL-6 potvrzen jako časný marker (24 hodiny od inzultu) možných pooperačních komplikací [17].
Třetím analyzovaným parametrem byl počet leukocytů, jež je brán jako tradiční ukazatel zánětlivého procesu v organismu. Naše výsledky korelují se závěry přehledu autorů Watt et al., ve kterém hodnoty leukocytů v odpovědi na kolorektální resekci byly 9,0 × 109/l. Zajímavým výsledkem review autorů Watt et al. je zjištění, že počet leukocytů nekoreluje s rozsahem operačního traumatu a operační technikou. Naopak koncentrace CRP a IL-6 je signifikantně vyšší u rozsáhlejších operačních výkonů a u operací provedených laparotomicky [11]. Studované skupiny KAR a NKAR se statisticky nelišily v počtu leukocytů v žádném sledovaném čase. V naší předchozí práci NKAR pacienti vykazovali více komplikací [3]; a tedy naše zjištění stejného počtu leukocytů u obou skupin potvrzuje literární údaje o nízké výpovědní hodnotě počtu leukocytů jakožto možného samostatného markeru pooperačních komplikací [18].
Význam autonomního nervového systému v regulaci zánětlivé odpovědi je dnes akceptovaným faktem [2, 4], jakož i to, že míra zánětu ovlivňuje pooperační průběh [10–17]. HRV je možností, jak autonomní regulaci organismu objektivizovat. Nicméně tato metoda není stále součástí anesteziologické praxe. Příčinou je množství metod analýzy HRV (časová, frekvenční, geometrická analýza, metody entropie a fraktální analýzy), dále množství použitých indexů a jednotek (absolutní, logaritmické, standardizované jednotky). Navíc jsou rozdíly v délce a provedení samotného měření [4, 5]. Výsledkem je, že dodnes neexistují všeobecně akceptovatelné normativní hodnoty HRV [26]. Navíc je nutné zdůraznit, že HRV je velmi citlivý biosignál, který má velkou interindividuální (věk, pohlaví, medikace, různá míra psychologického stresu při vyšetření) a intraindividuální (cirkadiální rytmus) variabilitu. Mnohé léky působí na autonomní nervovou regulaci, a tak mohou ovlivnit vlastní měření HRV. Antihypertenziva, a z nich především betablokátory, jsou léky, které nejvýznamněji ovlivňují ANS a zároveň byly v této problematice nejvíce studovány. Betablokátory přímo tlumí účinek sympatiku na beta-adrenergních receptorech. Většina prací se shoduje, že betablokátory zvyšují celkovou HRV. Navíc mnohé studie ukazují, že betablokátory vedou k znovuobnovení vagové složky u pacientů po akutním infarktu myokardu. Dalšími chronicky užívanými léky ovlivňujícími ANS jsou například ACE-inhibitory či antidepresiva [4]. Zajímavým lékem, který působí pozitivně na autonomní regulaci, především na parasympatickou složku, je centrálně působící α2 sympatomimetikum klonidin. Klonidin byl navíc zkoumán v perioperační medicíně, kdy byl podán jakožto součást premedikace. U pacientů s klonidinem nedošlo k poklesu HRV v perioperačním období [27]. Náš pohled na předoperační měření HRV je ten, že HRV objektivně sumuje vliv všech komorbidit a užívaných léků, a tak je celkovým ukazatelem fyziologických rezerv v daném momentě před operačním výkonem.
V naší práci jsme použili k měření HRV autonomní test – ortostatickou zkoušku, která zlepšuje senzitivitu vlastního měření, a tak nám lépe pomohla najít pacienty s autonomní dysfunkcí (NKAR) [22, 23]. K celkovému zhodnocení HRV jsme použili parametr TP, který reflektuje celkovou variabilitu. Hodnotu TP jsme posuzovali z konečné polohy (leh 2), která odkrývá reálné autonomní rezervy pacientů tím, že po opětovném položení dojde k reflexnímu zesílení vagového tonu, který může být v první poloze (leh 1) překryt zvýšeným psychologickým stresem. Vlastní hodnotu TP < 200 ms2, která identifikuje pacienty s výraznou autonomní neuropatií, jsme zvolili dle prací prof. Opavského [22].
Ortostatická zkouška výrazně přispívá k přesnosti krátkodobého měření HRV, avšak je časově náročnější než krátkodobé 5minutové měření za statických podmínek. K vlastnímu čistému času měření EKG záznamu (15 minut) je nutné připočíst čas k seznámení pacienta s metodou, napojení pacienta na přístroj, ke kontrole správnosti signálu a korekci artefaktů. To vše vede k tomu, že i při rutinním provádění se jedná o metodu zabírající minimálně půl hodiny. Při významném pracovním vytížení anesteziologů je proto racionální indikací měřit HRV u pacientů vážně nemocných a plánovaných k extenzivním výkonům. HRV tak může přispět k předoperační rozvaze o fyziologických limitech pacientů a následně k diskusi o rozsahu operačního výkonu. Redukovaná HRV identifikuje rizikové pacienty, kteří jsou v anestezii ohroženi hemodynamickou nestabilitou, jejíž příčina je dána primárně insuficiencí autonomní kardiovaskulární regulace. Tito pacienti častěji vyžadují farmakologickou podporu oběhu, a mohou tak profitovat z hemodynamického monitorování během anestezie. V pooperačním období by tito pacienti měli být monitorováni na intenzivní péči, protože byl u nich prokázán vyšší výskyt pooperačních komplikací [3, 8, 9].
Za možná omezení naší studie lze považovat malý studovaný vzorek pacientů, zařazení jednoho centra, statistický rozdíl v krevní ztrátě mezi studovanými skupinami a měření CRP jen do 48 hodin, přestože jeho biologická dynamika na inzult je delší.
Závěr
Předoperační měření HRV je spolehlivou metodou k identifikaci pacientů s rizikem vyšší prozánětlivé odpovědi, která může být příčinou horšího pooperačního průběhu. Standardizace postupů měření HRV a přijetí všeobecně akceptovatelných normativních hodnot pro interpretaci výsledků by mohlo měření HRV více přiblížit denní klinické anesteziologické praxi.
Práce je původní, nebyla publikována ani není zaslána k recenznímu řízení do jiného média.
Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce.
Všichni autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína.
Registrace: ClinicalTrials.gov (identifikační kód NCT02375412).
Projednání etickou komisí: Schváleno etickou komisí Fakultní nemocnice Ostrava (číslo jednací 606/2014).
Poděkování: Autoři děkují MUDr. Rudolfu Metelkovi, Ph.D., (Fakultní nemocnice Olomouc a Lékařská fakulta Univerzity Palackého v Olomouci) a prof. MUDr. Jaroslavu Opavskému, CSc., (Fakulta tělesné kultury Univerzity Palackého v Olomouci) za rady k metodice měření HRV.
Do redakce došlo dne 6. 10. 2017.
Do tisku přijato dne 4. 1. 2018.
Adresa pro korespondenci:
MUDr. Petr Reimer
E-mail: petr.reimer@gmail.com
Zdroje
1. Marik PE, Flemmer M. The immune response to surgery and trauma: Implications for treatment. J Trauma Acute Care Surg. 2012;73 : 801–808.
2. Tracey KJ. The inflammatory reflex. Nature. 2002;420 : 853–859.
3. Reimer P, Máca J, Szturz P, Jor O, Kula R, Ševčík P, Burda M, Adamus M. Role of heart rate variability in preoperative assessment of physiological reserves in patients undergoing major abdominal surgery. Ther Clin Risk Manag. 2017;13 : 1223–1231.
4. Ernst G. Heart rate variability. 1st ed. London: Springer, 2014.
5. Metelka R. Heart rate variability – current diagnosis of the cardiac autonomic neuropathy. A review. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2014;158 : 327–338.
6. Vinik AI, Ziegler D. Diabetic cardiovascular autonomic neuropathy. Circulation. 2007;115 : 387–397.
7. Kleiger RE, Miller JP, Bigger JT, Moss AJ. Decreased heart rate variability and its association with increased mortality after acute myocardial infarction. Am J Cardiol. 1987;59 : 256–262.
8. Mazzeo AT, La Monaca E, Di Leo R, Vita G, Santamaria LB. Heart rate variability: a diagnostic and prognostic tool in anesthesia and intensive care. Acta Anaesthesiol Scand. 2011;55 : 797–811.
9. McGrane S, Atria NP, Barwise JA. Perioperative implications of the patient with autonomic dysfunction. Curr Opin Anaesthesiol. 2014;27 : 365–370.
10. Máca J, Burša F, Ševčík P, Sklienka P, Burda M, Holub M. Alarmins and clinical outcomes after major abdominal surgery – a prospective study. J Invest Surg. 2017;30 : 152–161.
11. Watt DG, Horgan PG, McMillan DC. Routine clinical markers of the magnitude of the systemic inflammatory response after elective operation: A systematic review. Surgery. 2015;157 : 362–380.
12. Watt DG, McSorley ST, Horgan PG, McMillan DC. Enhanced recovery after surgery: which components, if any, impact on the systemic inflammatory response following colorectal surgery? A systematic review. Medicine (Baltimore). 2015;94:e1286.
13. Gans SL, Atema JJ, van Dieren S, Groot Koerkamp B, Boermeester MA. Diagnostic value of C-reactive protein to rule out infectious complications after major abdominal surgery: a systematic review and meta-analysis. Int J Colorectal Dis. 2015;30 : 861–873.
14. Adamina M, Steffen T, Tarantino I, Beutner U, Schmied BM, Warschkow R. Meta-analysis of the predictive value of C-reactive protein for infectious complications in abdominal surgery. Br J Surg. 2015;102 : 590–598.
15. McDermott FD, Heeney A, Kelly ME, Steele RJ, Carlson GL, Winter DC. Systematic review of preoperative, intraoperative and postoperative risk factors for colorectal anastomoticleaks. Br J Surg. 2015;102 : 462–479.
16. Pastorino U, Morelli D, Leuzzi G, Giasabella M, Suatoni P, Taverna F, Bertocchi E, Boeri M, Sozzi G, Cantarutti A, Corrao G. Baseline and postoperative C-reactive proteinlevels predict mortality in operable lung cancer. Eur J Cancer. 2017;79 : 90–97.
17. Rettig TC, Verwijmeren L, Dijkstra IM, Boerma D, van de Garde EM, Noordzij PG. Postoperative interleukin-6 level and early detection of complications after elective major abdominal surgery. Ann Surg. 2016;263 : 1207–1212.
18. Warschkow R, Steffen T, Beutner U, Műller SA, Schmied BM, Tarantino I. Diagnostic accuracy of C-reactive protein and white blood cell counts in the early detection of inflammatory complications after open resection of colorectal cancer: a retrospective study of 1,187 patients. Int J Colorectal Dis. 2012;27 : 1377.
19. Haensel A, PJ Mills, Nelesen RA, Ziegler MG, Dimsdale JE. The reationship between heart rate variability and inflammatory markers in cardiovsacular disease. Psychoneuroendocrinology. 2008;33 : 1305–1312.
20. Papaioannou VE, Dragoumanis C, Theodorou V, Gargaretas C, Pneumatikos I. Relation of heart rate variability to serum levels of C-reactive protein, intereukin 6, and 10 in patients with sepsis and septic shock. J Crit Care. 2009;24 : 625.e1–7.
21. Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. Heart rate variability, standard of measurement, physiological interpretation, and clinical use. Eur Heart J. 1996;17 : 354–381.
22. Opavský J. Autonomní nervový systém a diabetická autonomní neuropatie. Klinické aspekty a diagnostika. 1. vydání. Praha: Galén, 2002.
23. Howorka K, Pumprla J, Jirkovská A, Lacigova S, Nolan J. Modified orthostatic load for spectral analysis of short-term heart rate variability improves the sensitivity of autonomic dysfunction assessment. J Diabetes Complications. 2010;24 : 48–54.
24. Huang CJ, Kuok CH, Kuo TB, Hsu YW, Tsai PS. Pre-operative measurement of heart rate variability predicts hypotension during general anesthesia. Acta Anaesthesiol Scand. 2006;50 : 542–548.
25. Esmon CT. The impact of the inflammatory response on coagulation. Thromb Res. 2004;114 : 321–327.
26. Nunan D, Sandercock GR, Brodie DA. A quantitative systematic review of normal values for short-term herat rate variability in healthy adults. Pacing Clin Electrophysiol. 2010;33 : 1407–1417.
27. Yu HP, Hseu SS, Yien HW, Teng YH, Chan KH. Oral clonidin premedication preserves heart rate variability for patients undergoing laparoscopic cholecystectomy. Acta Anaesthesiol Scand. 2003;47 : 185–190.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2018 Číslo 1- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Metamizol a jeho pozice v léčbě bolesti
-
Všechny články tohoto čísla
- Anesteziologická léčba při spinálním traumatu
- Perioperační poranění myokardu: naše vina, nebo zánět?
- Vybrané aspekty péče o dárce orgánů s mozkovou smrtí
- Vztah variability srdeční frekvence a perioperační systémové zánětlivé odpovědi
- VAS a opioidní krize v USA
- Perioperační infuzní léčba
- Migrenici/migreničky a expozice světlu jako algeziologické téma
- Anestezie rostlin – cesta k poznání mechanismů účinku anestetik u člověka?
- Jsou sestry ohrožovány profesionálně používanými dezinficiencii?
- Doporučení pro bezpečné bolusové podávání vazopresorů na oddělení akutního příjmu
- Je nebulizovaný 3% hypertonický roztok NaCl účinný při bronchiolitidě malých dětí?
- Doporučení American Society for Enhanced Recovery a Perioperative Quality Initiative pro prevenci a léčbu pooperační gastrointestinální dysfunkce (POGD) při elektivních kolorektálních operacích
- Stanovisko výboru ČSARIM k používání pojmu „vitální indikace“ při poskytování anesteziologické péče
-
Anestezie v Rakousko-Uhersku během I. světové války a po vzniku samostatného československého státu
Část IV – Celková anestezie I - Zajímavosti, tipy a triky
-
Abstrakty z XXIV. kongresu ČSARIM
Brno, 7.–9. 9. 2017
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Perioperační infuzní léčba
- Vybrané aspekty péče o dárce orgánů s mozkovou smrtí
- Je nebulizovaný 3% hypertonický roztok NaCl účinný při bronchiolitidě malých dětí?
- Doporučení pro bezpečné bolusové podávání vazopresorů na oddělení akutního příjmu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



