-
Medical journals
- Career
Předoperační neselektivní podávání orálních nutričních doplňků pacientům podstupujícím elektivní kolorektální resekci – standard perioperační péče?
Authors: M. Tesař 1,2; P. Ostruzska 1; V. Kožušníková 1; L. Martínek 1,2; M. Zádrapová 3; L. Grasslová 3; P. Ihnát 1,2
Authors‘ workplace: Chirurgická klinika, Fakultní nemocnice Ostrava, Ostrava 1; Katedra chirurgických oborů, Lekářská fakulta Ostravské univerzity, Ostrava 2; Klinika rehabilitace a tělovýchovného lékařství, Fakultní nemocnice Ostrava, Ostrava 3
Published in: Rozhl. Chir., 2022, roč. 101, č. 5, s. 232-238.
Category: Original articles
doi: https://doi.org/10.33699/PIS.2022.101.5.232–238Overview
Úvod: Předoperační nutriční podpora u onkochirurgických pacientů je doporučována ve snaze minimalizovat negativní účinky potenciální podvýživy. Nutriční podpora má upravit patofyziologické reakce na velký chirurgický zákrok, snížit pooperační komplikace, zkrátit délku pobytu v nemocnici a urychlit rekonvalescenci. Cílem předkládané studie bylo vyhodnotit vliv předoperačně podávaných nutričních doplňků (ONS – oral nutritional supplements) na fyzický a nutriční stav pacientů podstupujících elektivní kolorektální resekci pro karcinom a posouzení soběstačnosti pacientů po operaci.
Metody: Jedná se o prospektivní, randomizovanou, unicentrickou klinickou studii navrženou k posouzení soběstačnosti a možnosti návratu pacienta k běžným aktivitám ve vztahu k předoperačně podávaným ONS u pacientů podstupujících elektivní chirurgický zákrok pro kolorektální karcinom. Pacienti zařazení do studie byli randomizováni buď k užívání ONS dvakrát denně po dobu 7 dnů před operací, nebo bez ONS.
Výsledky: Do studie bylo zařazeno celkem 100 pacientů. Četnost pooperačních komplikací byla u obou studijních skupin srovnatelná; rozdíly nebyly zjištěny ani v pooperačních hodnotách laboratorních nutričních parametrů (albumin, prealbumin). Doba hospitalizace byla u obou studijních skupin srovnatelná; pobyt na JIP byl kratší u pacientů užívajících ONS, ale rozdíl byl statisticky nevýznamný. Rozdíly mezi studijními podskupinami týkající se hmotnosti svalů nebyly statisticky významné. Soběstačnost pacientů (hodnoceno indexem Barthelové) byla v obou skupinách srovnatelná před i po operaci (p=0,717 a p=0,327).
Závěr: Neselektivní předoperační podávání ONS všem pacientům podstupujícím elektivní kolorektální resekci nesnižuje pooperační morbiditu ani neurychluje rekonvalescenci. Soběstačnost, fyzický a nutriční stav pacientů nejsou předoperační nutriční podporou ovlivněny.
Klíčová slova:
malnutrice – soběstačnost – kolorektální karcinom – proteinové výživové doplňky – pooperační morbidita
ÚVOD
Kolorektální karcinom (CRC) je nejčastějším maligním nádorem gastrointestinálního traktu a druhou nejčastěji diagnostikovanou malignitou u dospělých v ČR [1]. Přítomnost malignity může vyvolat úbytek hmotnosti a podvýživu. Odhaduje se, že až dva ze tří pacientů s CRC předoperačně zhubli, jeden z pěti pacientů dokonce ztratí více než 10 % váhy [2].
Podvýživa je spojena se zhoršeným hojením operačních ran, narušenou obranyschopností a sníženou svalovou sílou [3]. Snížení svalové síly má za následek nekvalitní rehabilitaci, horší odkašlávání, horší mobilitu a zvýšené riziko vzniku bronchopneumonie, horší soběstačnost. Všeobecně je uznáván názor, že pacienti s malignitou by měli být předoperačně nutričně podpořeni ve snaze minimalizovat negativní účinky podvýživy. Nutriční podpora má upravit patofyziologické reakce na velký chirurgický zákrok, snížit pooperační komplikace, zkrátit délku pobytu v nemocnici a urychlit tak zotavení [3,4].
Předoperační podávání perorálních doplňků výživy (ONS – oral nutritional supplements) pacientům s rizikem podvýživy doporučují společnosti ESPEN (Evropská společnost pro parenterální a enterální výživu) a ERAS (Enhanced recovery after surgery) [4,5]. Výsledky nedávného systematického přehledu o daném tématu jsou však v rozporu s těmito doporučeními. Přehledová studie publikovaná Brunsovou kol. zahrnuje výsledky 6 prospektivních klinických studií realizovaných v letech 2004 až 2016 [6]. Autoři došli k závěru, že u pacientů, kteří dostávali předoperačně ONS, nedošlo k významnému snížení celkových komplikací [7,8,9,10,11,12]. Většina publikovaných studií byla zaměřena na zkoumání vztahu mezi předoperačně podávanými ONS a pooperační morbiditou. Pokud je nám známo, není k dispozici žádná studie, která by zkoumala dopad ONS na výživový stav, svalovou sílu nebo soběstačnost pacientů podstupujících plánovanou kolorektální operaci.
Cílem předkládané studie bylo vyhodnotit vliv předoperačně podávaných doplňků výživy na fyzický a nutriční stav pacientů podstupujících elektivní kolorektální resekci a posouzení soběstačnosti pacientů po operaci.
METODY
Design studie
Jedná se o prospektivní, randomizovanou klinickou studii navrženou k posouzení soběstačnosti a možnosti návratu pacienta k běžným aktivitám ve vztahu k předoperačně podávaným ONS u pacientů podstupujících elektivní chirurgický zákrok pro kolorektální karcinom. Studie byla unicentrická, provedena ve Fakultní nemocnici Ostrava. Všichni pacienti s kolorektálním karcinomem podstupující elektivní resekci v období studie (1. leden 2019 až 31. březen 2020) byli hodnoceni z pohledu zařaditelnosti do studie. Studie byla schválena etickou komisí Fakultní nemocnice Ostrava (ref. číslo 447a/2018) a byla provedena v souladu s etickými standardy Helsinské deklarace (1964) a jejích následných dodatků. Od všech zahrnutých pacientů byl získán písemný informovaný souhlas; byla zajištěna anonymita. Studie byla zaregistrována na http://www.clinicaltrials. gov (identifikační číslo NCT 03930888).
Primárním cílem studie bylo zhodnotit změnu svalové hmoty a soběstačnosti pacientů podstupujících elektivní operaci pro kolorektální karcinom (s předoperačním ONS nebo bez něj). Sekundárním cílem studie bylo vyhodnotit změny nutričního stavu sledovaných pacientů, porovnat pooperační chirurgické komplikace u pacientů, posoudit délku hospitalizace a dobu pobytu na JIP u pacientů s/bez nutriční podpory.
Inkluzními kritérii byly věk ≥18 let a indikace k elektivní resekci kolorektálního karcinomu. Exkluzními kritérii byly generalizace onemocnění, střevní komorbidita (M. Crohn atd.), duplicitní malignita a neúplné údaje o sledování pacientů. Během období studie byli všichni zahrnutí pacienti randomizováni do jedné ze sledovaných větví (pacienti s ONS nebo bez ONS) pomocí obálkové metody (všechny obálky byly připraveny předem, v poměru 1 : 1). Pokud byl pacient během sledování vyloučen ze studie (z důvodu odmítnutí dalšího sledování, ztráty dat atd.), byla obálka vrácena k randomizaci.
Pacienti vybraní do skupiny užívající ONS užívali tyto doplňky dvakrát denně po dobu 7 dnů před operací, pacienti s diabetem užívali přípravek určený pro diabetiky. Dodatečný energetický příjem pacientů (prostřednictvím doplňků výživy) byl 2525 kJ, u diabetiků 2520 kJ denně; příjem bílkovin navíc byl 24 g, resp. 30 g bílkovin denně (diabetici).
Stav výživy a nutričního rizika byl hodnocen pomocí NRS 2002 (Nutritional risk screening) [13] a hladinami prealbuminu (transthyretinu) a albuminu (g/l) v krvi den před operací a 5. až 6. den po operaci. NRS 2002 je skórovací systém a prognostický nutriční index, který slouží k adekvátnímu posouzení podvýživy a její závažnosti. NRS 2002 je doporučován evropskou společností ESPEN pro rutinní používání v praxi [4]. Pooperační chirurgické komplikace byly hodnoceny podle klasifikace Clavien-Dindo [14].
Svalová hmota a soběstačnost pacientů byly měřeny den před operací a 5. až 6. den po operaci. Analýza tělesné hmotnosti a poměr svalů v těle byla provedena pomocí analyzátoru TANITA MC-780 MA (v % hmotnosti celého těla). Analyzátor TANITA MC-780 MA pod svalovou hmotu zahrnuje kosterní svaly, hladké svaly, jako jsou srdeční a trávicí svaly, a vodu obsaženou v těchto svalech. Soběstačnost byla hodnocena indexem Barthelové pro činnosti každodenního života. Barthelové index je stupnice (0−100 bodů), která obsahuje deset proměnných popisujících činnosti každodenního života. Každá položka je ohodnocena počtem bodů dle množství času a cizí fyzické pomoci potřebné k provedení běžné každodenní činnosti. Vyšší počet je spojen s větší pravděpodobností, že po propuštění z nemocnice bude pacient soběstačný.
Sběr dat
Všechna data byla shromažďována prospektivně. Demografická a klinická data pacientů studie (věk, pohlaví, BMI, lokalizace tumoru, stadium nádorové nemoci, hodnota CEA, hodnota NRS 2002) byla před operací vložena do databáze studie. Den před operací a 5. až 6. den po operaci byla zaznamenána následující data (resp. provedena tato měření): tělesná hmotnost (kg), hladina albuminu (g/l) a prealbuminu (g/l) v krvi, CRP (mg/l), hmotnost a procento svalů (kg a %) a Barthelové index. V průběhu sledování pacientů byla zaznamenána délka pobytu na JIP, délka hospitalizace a 30denní pooperační komplikace.
Statistická analýza
K analýze byly použity standardní metody popisné statistiky ve formě průměrů, standardních odchylek a mediánů. Podle povahy dat byly použity metody t-testu, ANOVA, Fisher nebo Kruskall-Wallisův test a chi-kvadrát test pro kategorické četnosti dat na hladině významnosti 0,05. Použité nástroje pocházejí ze systému metod matematicko-statistických programů R-project (The R Foundation for Statistical Computing).
VÝSLEDKY
Během období studie (1. 1. 2019 až 31. 3. 2020) splnilo kritéria pro zařazení a bylo hodnoceno, zda jsou způsobilí pro zařazení do studie, 221 pacientů. 66 (25,4 %) pacientů bylo vyloučeno kvůli exkluzním kritériím a 62 pacientů (28 %) odmítlo účast ve studii (CONSORT diagram, Obr. 1). Do studie bylo zařazeno 100 pacientů, kteří podstoupili analýzu.
Image 1. Consort diagram
Fig. 1: Consort diagram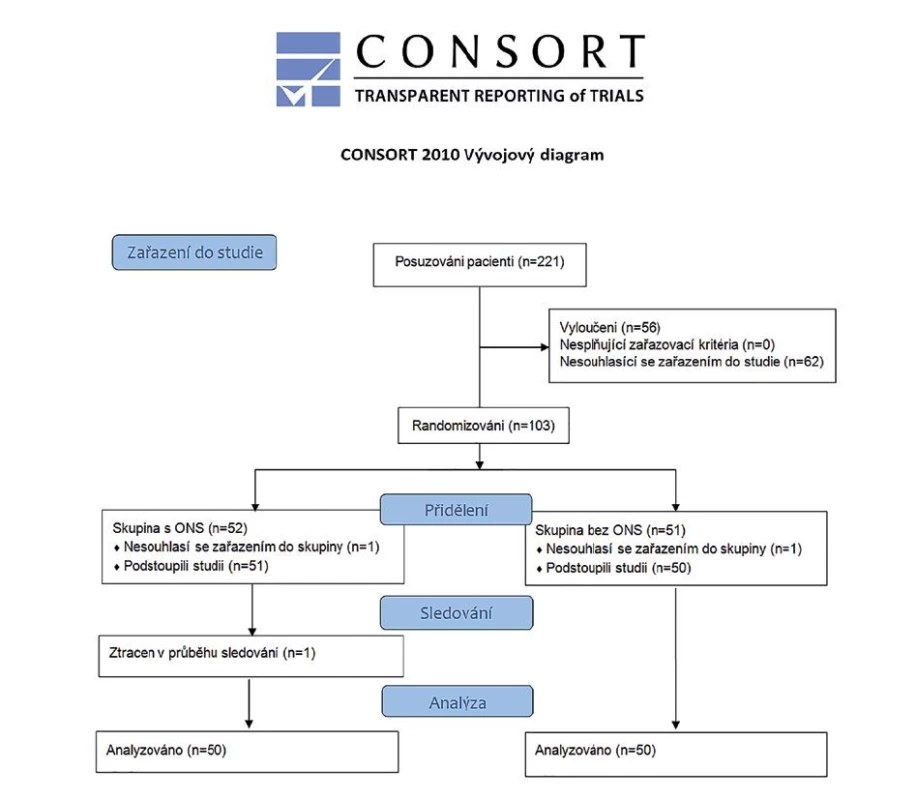
Demografické údaje a klinické charakteristiky pacientů ve studii jsou uvedeny v tabulce (Tab. 1). Průměrný věk pacientů ve studii byl 65,4 ±11,7 roku (průměr ±SD); zařazeno bylo 37 (37 %) žen a 63 (63 %) mužů. Průměrný BMI v den přijetí byl 26,8 ±5,2 kg/m2. Nádor byl lokalizován v oblasti konečníku u 40,0 % pacientů; 35 % pacientů studie bylo v I. stadiu kolorektálního karcinomu; 76 % pacientů podstoupilo laparoskopickou resekci.
Table 1. Demografická data
Tab. 1: Demographic data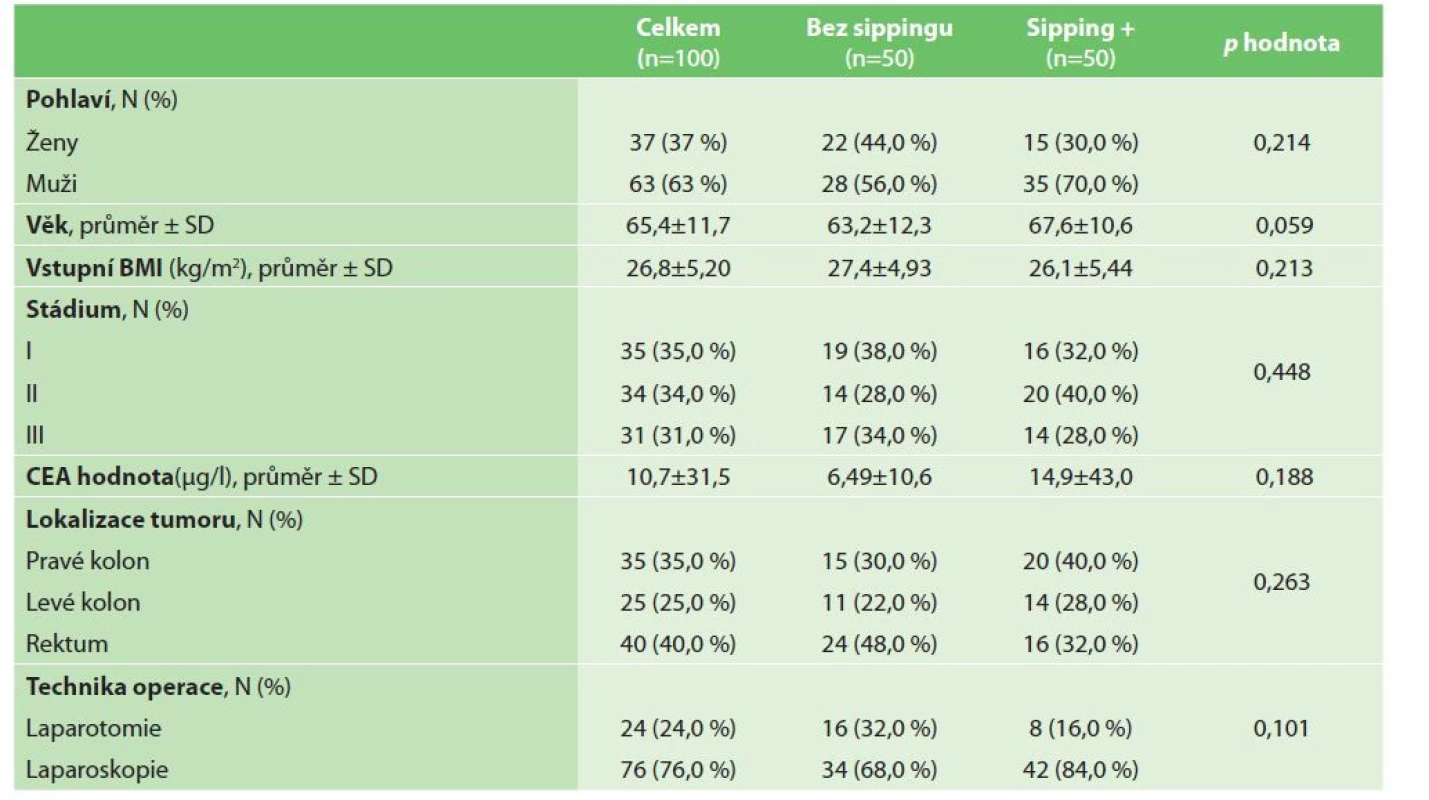
Údaje týkající se nutričního stavu sledovaných pacientů jsou uvedeny v tabulce (Tab. 2). Na základě principů hodnocení NRS 2002 byli všichni sledovaní pacienti v nutričním riziku (všichni pacienti byli vážně nemocní kvůli výskytu kolorektálního karcinomu). Průměrné skóre NRS bylo v naší studijní skupině před operací 2,24 ±1,37; 32 (32 %) pacientů trpělo podvýživou (skóre NRS ≥3 body). Obě studijní podskupiny byly srovnatelné s ohledem na skóre NRS (p=0,532). Ve studii bylo 40 (40 %) pacientů, kteří před operací zhubli; 26 (26 %) pacientů ztratilo více než 10 % tělesné hmotnosti.
Table 2. Nutriční parametry
Tab. 2: Nutrition characteristics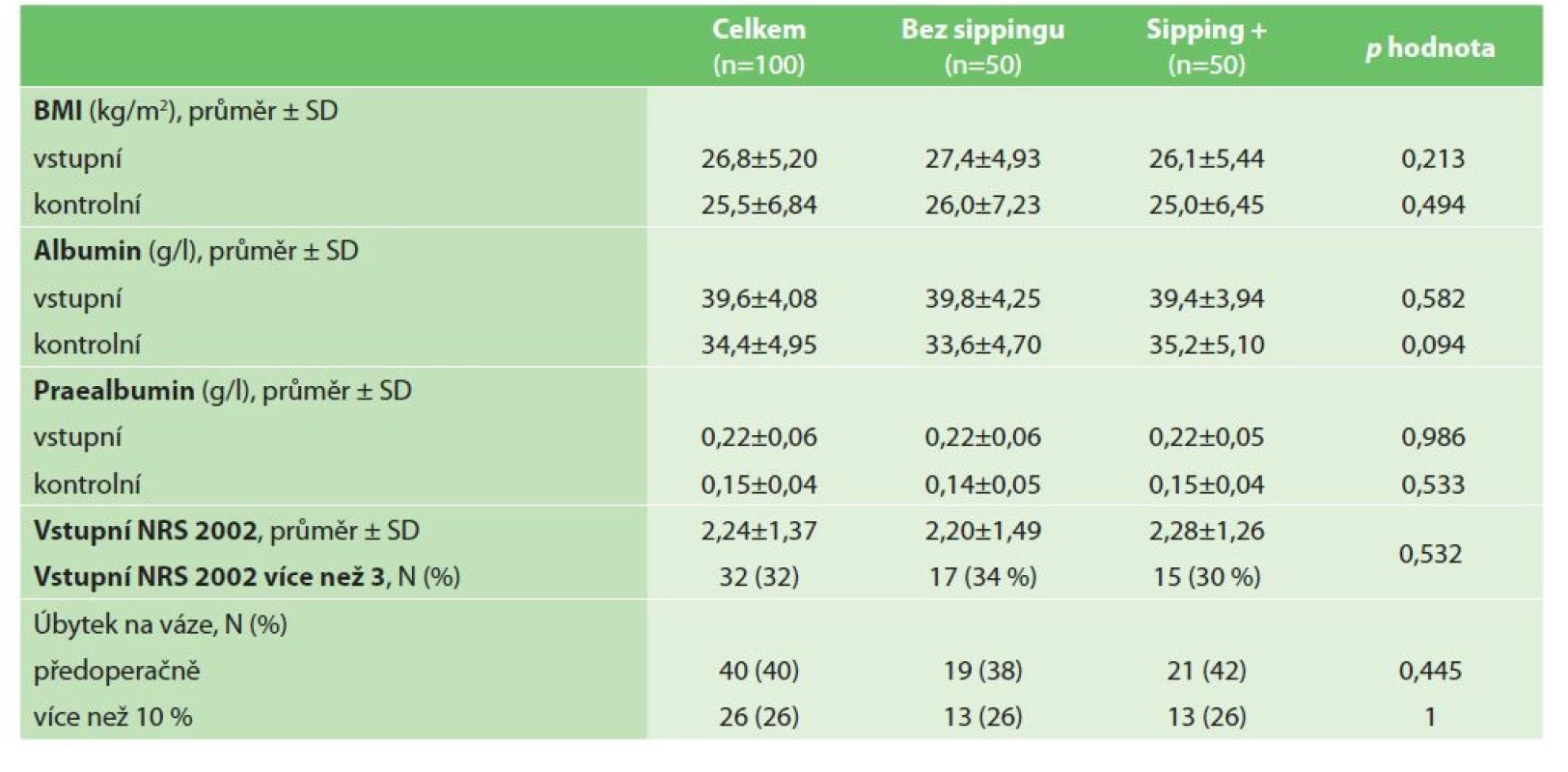
Perioperační výsledky (délka pobytu v nemocnici, délka pobytu na JIP a pooperační komplikace) jsou uvedeny v tabulce (Tab. 3). Průměrná délka hospitalizace a průměrná délka pobytu na JIP byly v obou podskupinách studie srovnatelné (p=0,807, respektive p=0,178). 30denní pooperační chirurgická morbidita byla 33 %. Drobné komplikace (Clavien-Dindo stupeň I–II) byly zaznamenány u 25 (25 %) pacientů ve studii, závažné pooperační komplikace (Clavien-Dindo stupeň III–V) u 8 (8 %) pacientů. Prevalence průměrných pooperačních komplikací byla srovnatelná v obou podskupinách studie (p=0,759). 30denní pooperační úmrtnost byla 1 % (jeden pacient zemřel po dehiscenci anastomózy po pravostranné hemikolektomii s následným rozvojem mnohočetného orgánového selhání).
Table 3. Perioperační parametry
Tab. 3: Perioperative parameters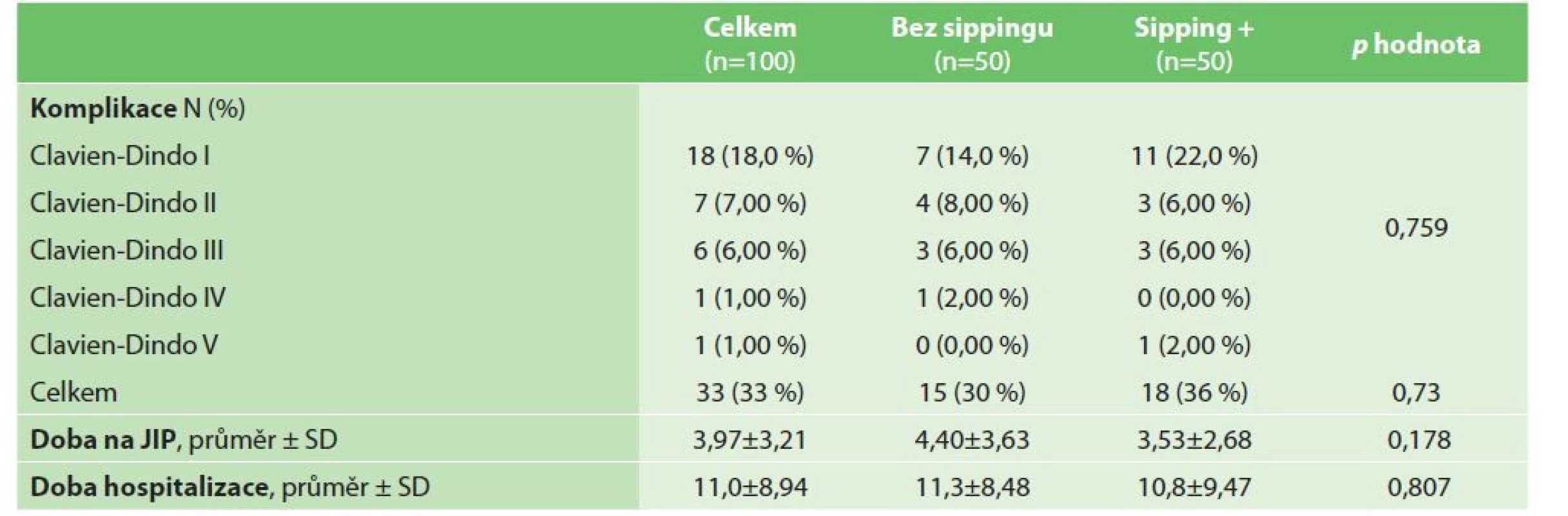
Změny nutričních parametrů pacientů studie jsou uvedeny v tabulce (Tab. 2). Pátý pooperační den klesl průměrný BMI z 26,8 ±5,2 na 25,5 ±6,84 kg/m2. Pokles BMI byl větší v kontrolní podskupině (pacienti, kteří nedostali předoperační ONS); rozdíl mezi podskupinami ovšem nebyl statisticky významný (p=0,494). Sledované laboratorní parametry (albumin a prealbumin) také vykazovaly pokles v pooperačním období. Hladiny albuminu klesly z 39,6 ±4,08 g/l na 34,4 ±4,95 g/l; prealbumin z 0,22 ±0,06 g/l na 0,15 ±0,04 g/l. Přestože byl pokles obou laboratorních parametrů znatelnější v kontrolní podskupině pacientů, rozdíly mezi podskupinami studie byly statisticky nevýznamné (p=0,0948 a p=0,533).
Parametry týkající se soběstačnosti a podílu svalstva jsou uvedeny v tabulce (Tab. 4). Analýza složení těla (analyzátorem těla TANITA MC-780 MA) před operací odhalila průměrný podíl svalové hmoty 69,9 % ±8,5. Rozdíly mezi studijními podskupinami týkající se hmotnosti svalů nebyly statisticky významné. Soběstačnost pacientů v obou studijních podskupinách (hodnoceno indexem Barthelové) byla srovnatelná před i po operaci (p=0,717 a p=0,327).
Table 4. Soběstačnost a podíl svalové hmoty
Tab. 4: Self-sufficiency and proportion of muscle mass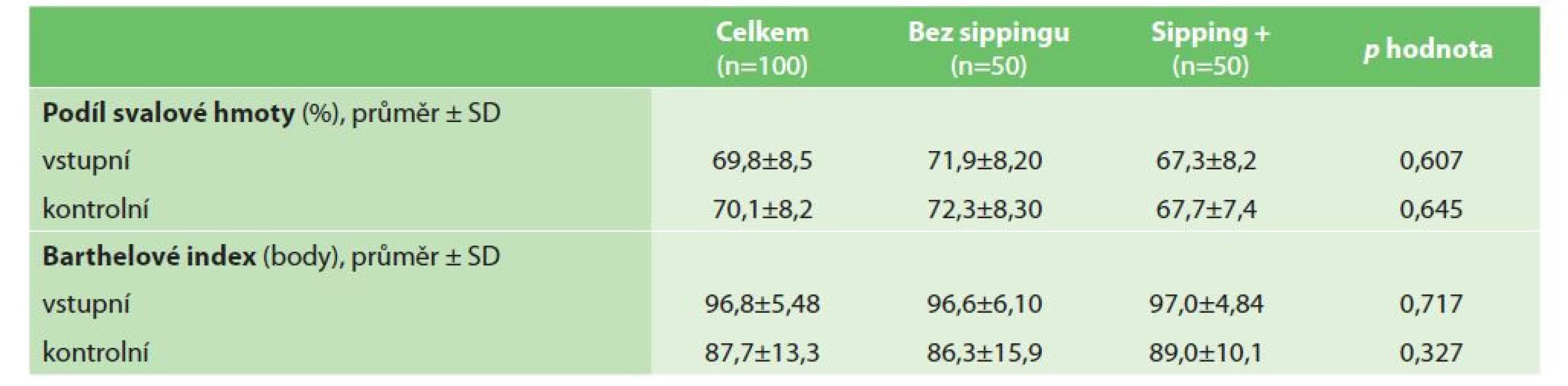
DISKUZE
Demografické a klinické charakteristiky pacientů naší studie byly srovnatelné se studiemi zabývajícími se výživou v chirurgii publikovanými v posledních letech a následně citovanými v různých metaanalýzách [6−10, 15−17]. Na základě NRS 2002 byli všichni naši sledovaní pacienti definováni jako nutričně rizikoví, podvýživa byla zjištěna u 32 % pacientů. Kolorektální karcinom způsobil úbytek hmotnosti u 40 % našich pacientů. Prevalence pacientů v nutričním riziku a podvyživených pacientů v naší studii odpovídá dostupným údajům z literatury [2,18,19,20].
Bylo jednoznačně prokázáno, že podvýživa je spojena s mnoha negativními dopady, jako jsou zhoršené hojení ran, snížená svalová síla, narušená obrana proti infekcím, prodloužené zotavení po operaci atd. [3,21,22,23]. Nepochybně by tito podvyživení pacienti měli dostávat ONS před operací. Tito pacienti však představují jen menší část pacientů podstupujících elektivní operaci kolorektálního karcinomu.
Situace u většiny pacientů s kolorektálním karcinomem je však odlišná. Není jednoznačný důkaz, že by pacienti v nutričním riziku, ale bez potvrzené podvýživy měli prospěch z ONS. Současné pokyny SKVIMP (Společnost klinické výživy a intenzivní metabolické péče), převzaté z ESPEN, však doporučují perioperační nutriční terapii všem nutričně rizikovým pacientům − doporučení č. 7 pokynů ESPEN (silná shoda − stupeň doporučení GPP – good practice points) [4]. Údaje z literatury podporující toto doporučení ESPEN nejsou přesvědčivé.
Klinické studie, publikované na toto téma, nabízejí protichůdné výsledky − někteří autoři uvádějí pozitivní vliv předoperačního sippingu na míru pooperačních komplikací, jiní nikoli [7,8,9,10,11,12]. Několik studií ukázalo, že efekt ONS na pooperační průběh je nevýznamný, pokud je ONS podáván všem pacientům podstupujícím chirurgický zákrok pro kolorektální karcinom [6,10,15,16]. Nedávná metaanalýza, publikovaná Brunsovou a kol., neprokázala významné snížení celkové míry komplikací u pacientů užívajících ONS. Totéž platí pro zkrácení délky hospitalizace a pobytu na JIP [6]. Při sledování pooperační morbidity, doby pobytu v nemocnici nebo pobytu na JIP jsme v naší studii rovněž nezaznamenali statisticky významné rozdíly mezi podskupinami (Tab. 3). Počet pooperačních komplikací byl u pacientů užívajících ONS dokonce mírně vyšší (36 % vs. 30 %, p=0,73).
Na základě našeho průzkumu literatury byly všechny dostupné klinické studie zaměřeny na korelaci mezi ONS a pooperační morbiditou. Primární zaměření této studie bylo zkoumat vliv ONS na fyzický stav, nutriční stav a pooperační soběstačnost pacientů. Inovativní koncept naší studie tedy nabízí data týkající se jiných aspektů perioperační nutriční podpory, než bývají obvykle publikovány.
Nutriční stav pacientů naší studie byl hodnocen pomocí standardizovaného dotazníku (NRS 2002), laboratorních parametrů a antropometrických měření. Naše výsledky (BMI, hladiny albuminu a prealbuminu, skóre NRS 2002) ukazují, že pacienti s kolorektálním karcinomem stadia I−III jsou nutričně rizikoví pacienti, ale pouze 1/3 z nich je podvyživená. Nutriční parametry pacientů, kteří v naší studii dostávali ONS, nebyly statisticky významně lepší ve srovnání s kontrolní podskupinou pacientů. Skutečnost, že většina pacientů s kolorektálním karcinomem není podvyživená, může vysvětlovat, proč se většině dostupných studií nepodařilo prokázat významný přínos plošného předoperačního podávání ONS u pacientů podstupujících kolorektální chirurgii [6−10,15,16].
Analýza kompozice těla (pomocí analyzátoru těla TANITA) byla při studii zaměřena na zjištění, zda podávání ONS zvyšuje podíl svalové hmoty u pacientů. Data však tuto hypotézu nepotvrdila − nezaznamenali jsme statisticky významný rozdíl svalové hmoty ani u jedné studijní podskupiny, ať předoperačně, či po operaci. Paradoxně lehce vyšší podíl svalové hmoty byl u pacientů, kteří ONS nedostali (Tab. 4).
Cílem této studie bylo zjistit, zda podávání ONS zlepšuje soběstačnost pacientů v pooperačním období (hodnoceno indexem Barthelové). Pooperačně se soběstačnost snižuje jako logický důsledek chirurgického traumatu a perioperačního stresu. Jak je ukázáno v tabulce (Tab. 4), pokles indexu Barthelové byl výraznější v podskupině pacientů bez ONS, ale rozdíl nebyl statisticky významný. V dostupné literatuře neexistuje studie zkoumající vliv ONS na soběstačnost pacientů, proto není možné adekvátně porovnat naše výsledky s literaturou. Pouze studie Gillise a kol. a Smedleyho a kol. byly podobně zaměřené − obě studie zkoumaly souvislost mezi ONS a kvalitou života pacientů jeden měsíc po operaci. Autorům obou studií se nepodařilo prokázat vyšší kvalitu života u pacientů užívajících ONS [11,16].
ZÁVĚR
Závěrem lze říci, že plošné předoperační podávání ONS všem pacientům podstupujícím elektivní kolorektální resekci nesnižuje pooperační morbiditu ani nezlepšuje rekonvalescenci. Soběstačnost, fyzický a nutriční stav pacientů nejsou předoperační nutriční podporou ovlivněny. Přestože podávání ONS nepoškozuje pacienta, vyhledávání podvyživených pacientů pro případnou předoperační nutriční podporu se zdá být nezbytné, alespoň z ekonomických důvodů.
Seznam zkratek:
ANOVA – analýza rozptylu
BMI – body mass index
CEA – karcinoembryonální antigen
CRC − kolorektální karcinom
ČR − Česká republika
ERAS − enhanced recovery after surgery
ESPEN − Evropská společnost pro parenterální a enterální výživu
GPP − good practice points
NRS 2002 − nutritional risk screening 2002
ONS − oral nutritional supplements
SKVIMP − Společnost klinické výživy a intenzivní metabolické péče
Práce podpořena grantem Nutriční podpora a její vliv na snížení svalové síly, svalové hmoty a soběstačnosti u pacientů podstupujících operační léčbu kolorektálního karcinomu na chirurgické klinice FNO, Projekt Institucionální podpory FNO, ID projektu 17/RVO-FNOs/2018.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Milan Tesař
Fakultní nemocnice Ostrava – chirurgická klinika
e-mail: Milan.tesar@fno.cz
Sources
1. Ferlay J, Ervik M, Lam F, et al. Global cancer observatory: Cancer today [on line]. Lyon, France, International Agency for Research on Cancer 2018. Available at: www: https://gco.iarc.fr/today.
2. Thoresen L, Frykholm G, Lydersen S, et al. Nutritional status, cachexia and survival in patients with advanced colorectal carcinoma. Different assessment criteria for nutritional status provide unequal results. Clin Nutr. 2013;32(1):65−72. doi:10.1016/j.clnu.2012.05.009.
3. Karlsson S, Andersson L, Berglund B. Early assessment of nutritional status in patients scheduled for colorectal cancer surgery. Gastroenterol Nurs. 2009;32(4):265−270. doi:10.1097/ SGA.0b013e3181aead68.
4. Weimann A, Braga M, Carli F, et al. ESPEN guideline: Clinical nutrition in surgery. Clin Nutr. 2017;36(3):623−650. doi:10.1016/j.clnu.2017.02.013.
5. Lassen K, Soop M, Nygren J, et al. Consensus review of optimal perioperative care in colorectal surgery: Enhanced Recovery After Surgery (ERAS) Group recommendations. Arch Surg. 2009;144(10):961−969. doi:10.1001/archsurg.2009.170.
6. Bruns ERJ, Argillander TE, Van Den Heuvel B, et al. Oral nutrition as a form of pre-operative enhancement in patients undergoing surgery for colorectal cancer: A systematic review. Surg Infect (Larchmt) 2018;19(1):1–10. doi:10.1089/ sur.2017.143.
7. Braga M, Gianotti L, Vignali A, et al. Preoperative oral arginine and n-3 fatty acid supplementation improves the immunometabolic host response and outcome after colorectal resection for cancer. Surgery 2002;132(5):805−814. doi:10.1067/ msy.2002.128350.
8. Finco C, Magnanini P, Sarzo G, et al. Prospective randomized study on perioperative enteral immunonutrition in laparoscopic colorectal surgery. Surg Endosc. 2007;21(7):1175−1179. doi:10.1007/ s00464-007-9238-4.
9. Horie H, Okada M, Kojima M, et al. Favorable effects of preoperative enteral immunonutrition on a surgical site infection in patients with colorectal cancer without malnutrition. Surg Today 2006;36(12):1063−1068. doi:10.1007/ s00595-006-3320-8.
10. Burden ST, Hill J, Shaffer JL, et al. An unblinded randomised controlled trial of preoperative oral supplements in colorectal cancer patients. J Hum Nutr Diet. 2011;24(5):441−448. doi:10.1111/j.1365 - 277X.2011.01188.x.
11. Gillis C, Loiselle SE, Fiore JF Jr, et al. Prehabilitation with whey protein supplementation on perioperative functional exercise capacity in patients undergoing colorectal resection for cancer: A pilot double-blinded randomized placebo - controlled trial. J Acad Nutr Diet. 2016;116(5):802−812. doi:10.1016/j. jand.2015.06.007.
12. Maňásek V, Bezděk K, Foltys A, et al. The impact of high protein nutritional support on clinical outcomes and treatment costs of patients with colorectal cancer. Klin Onkol. 2016;29(5):351−357.
13. Kondrup J, Rasmussen HH, Hamberg O, et al. Ad Hoc ESPEN Working Group. Nutritional risk screening (NRS 2002): a new method based on analysis of controlled clinical trials. Clin Nutr. 2003;22(3):321−336. doi:10.1016/s0261 - 5614(02)00214-5.
14. Dindo D, Demartines N, Clavien PA. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg. 2004;240(2):205−213. doi:10.1097/01.sla.0000133083.54934. ae.
15. MacFie J, Woodcock NP, Palmer MD, et al. Oral dietary supplements in preand postoperative surgical patients: a prospective and randomized clinical trial. Nutrition 2000;16(9):723−728. doi:10.1016/s0899-9007(00)00377-4.
16. Smedley F, Bowling T, James M, et al. Randomized clinical trial of the effects of preoperative and postoperative oral nutritional supplements on clinical course and costof care. Br J Surg. 2004;91(8):983−990. doi:10.1002/bjs.4578.
17. Gillis C, Buhler K, Bresee L, et al. Effects of nutritional prehabilitation, with and without exercise, on outcomes of patients who undergo colorectal surgery: A systematic review and meta-analysis. Gastroenterology. 2018;155(2):391−410.e4. doi:10.1053/j.gastro.2018.05.012.
18. Thoresen L, Frykholm G, Lydersen S, et al. Nutritional status, cachexia and survival in patients with advanced colorectal carcinoma. Different assessment criteria for nutritional status provide unequal results. Clin Nutr. 2013;32(1):65−72. doi:10.1016/j.clnu.2012.05.009.
19. Stratton, RJ, Green CJ, Ella M. Disease-related malnutrition: An evidence-based approach to treatment. CABI Publishing 2003.
20. Lopes JP, de Castro Cardoso Pereira PM, dos Reis Baltazar Vicente AF, et al. Nutritional status assessment in colorectal cancer patients. Nutr Hosp. 2013;28(2):412−418. doi:10.3305/ nh.2013.28.2.6173.
21. Buzby GP, Mullen JL, Matthews DC, et al. Prognostic nutritional index in gastrointestinal surgery. Am J Surg. 1980;139(1):160−167. doi:10.1016/0002 - 9610(80)90246-9.
22. Detsky AS, Baker JP, O‘Rourke K, et al. Predicting nutrition-associated complications for patients undergoing gastrointestinal surgery. JPEN J Parenter Enteral Nutr. 1987;11(5):440−446. doi:10.1177/0 148607187011005440.
23. Dempsey DT, Mullen JL, Buzby GP. The link between nutritional status and clinical outcome: can nutritional intervention modify it? Am J Clin Nutr. 1988;47(2 Suppl): 352−356. doi:10.1093/ajcn/47.2.352.
24. Klidjian AM, Foster KJ, Kammerling RM, et al. Relation of anthropometric and dynamometric variables to servus postoperative complications. Br Med J. 1980;281(6245):899−901. doi:10.1136/ bmj.281.6245.899.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2022 Issue 5-
All articles in this issue
- Od diagnostiky a léčby ke zdraví, chirurg by neměl stát opodál
- Endovenózní ablace křečových žil – současný stav a přehled metod
- Poranění m. pectoralis major
- Redukce průtoku arteriovenózní fistule u pacientů po transplantaci ledviny
- Předoperační neselektivní podávání orálních nutričních doplňků pacientům podstupujícím elektivní kolorektální resekci – standard perioperační péče?
- První retransplantace plic s „ECMO bridge“ v České republice − kazuistika
- Transversus abdominis release v řešení rozsáhlého chronického defektu střední čáry stěny břišní
- Transversus abdominis release v řešení rozsáhlého chronického defektu střední čáry stěny břišní
- Apendikolit ako príčina neskorých komplikácií po apendektómii − kazuistika a prehľad literatúry
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Poranění m. pectoralis major
- Endovenózní ablace křečových žil – současný stav a přehled metod
- Transversus abdominis release v řešení rozsáhlého chronického defektu střední čáry stěny břišní
- Apendikolit ako príčina neskorých komplikácií po apendektómii − kazuistika a prehľad literatúry
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

