-
Medical journals
- Career
Profylaktická ligace ductus thoracicus v prevenci chylothoraxu po resekci jícnu
Authors: T. Jínek 1; L. Adamčík 1; M. Duda 1,2; P. Buzrla 3; M. Škrovina 1,4
Authors‘ workplace: Chirurgické oddělení Nemocnice Nový Jičín, a. s., Centrum vysoce specializované onkologické péče pro dospělé Nový Jičín, Vzdělávací a výzkumný institut AGEL, o. p. s. 1; II. chirurgická klinika Lékařské fakulty Univerzity Palackého a Fakultní nemocnice Olomouc 2; Laboratoře AGEL a. s. Nový Jičín, Patologie 3; I. Chirurgická klinika Lékařské fakulty Univerzity Palackého a Fakultní nemocnice Olomouc 4
Published in: Rozhl. Chir., 2018, roč. 97, č. 7, s. 328-334.
Category: Original articles
Overview
Úvod:
Chylothorax po resekci jícnu je méně častou, ale závažnou komplikací s incidencí 1−10 %. Vzniká po poranění ductus thoracicus nebo jeho přítoků. Denní ztráty mohou dosahovat několika litrů, což může vést k hypovolemii, malnutrici a imunosupresi. Terapeutický postup není standardizován. Profylaktická ligace ductus thoracicus byla navržena během primoresekce ke snížení incidence chylothoraxu. Její onkologický benefit není znám.
Metoda:
Jde o retrospektivní unicentrickou analýzu pacientů po transtorakální resekci jícnu z let 2008−2016 operovaných na chirurgickém oddělení Nemocnice Nový Jičín, a. s. Transtorakálně (Ivor-Lewisova a McKeownova resekce) bylo operováno 58 pacientů. Profylakticky byl ligován ductus thoracicus u 31 pacientů (53 %). Byla analyzována incidence chylothoraxu a množství disekovaných uzlin ve skupině s ligací ductus thoracicus (A PTDL 31 pacientů) a bez provedení ligace (B bez ligatury 27 pacientů).
Výsledky:
Celková incidence chylothoraxu po transtorakální resekci byla 3,4 %. Chylothorax se vyskytl u dvou mužů (typ 3B) ve skupině profylaktické ligace ductus thoracicus (6,5 %) a ve skupině bez ligace pozorován nebyl. Statistický významný rozdíl nebyl potvrzen (p=0,494). Leak byl úspěšně řešen jednou torakotomickou a jednou torakoskopickou reoperací s ligaturou duktu. Disekováno bylo nesignifikantně více uzlin ve skupině s profylaktickou ligací (18 A PTDL vs. 15 B bez ligatury, p=1).
Závěr:
Profylaktická ligace ductus thoracicus v prezentovaném souboru nevedla ke snížení výskytu chylothoraxu. Torakotomická nebo torakoskopická revize pro chylothorax je dobře proveditelná. U velkoobjemové a delší dobu trvající sekrece by indikace operace měla být časná.
Klíčová slova:
chylothorax − resekce jícnu − profylaktická ligace ductus thoracicus
ÚVOD
Chylothorax po resekci jícnu představuje méně častou, avšak velmi závažnou komplikaci. Tato komplikace vzniká po poranění ductus thoracicus (DT) nebo jeho přítoků, které se nacházejí v bezprostřední blízkosti jícnu během jeho mobilizace či lymfadenektomie. Incidence se udává mezi 1−10 % bez významného rozdílu mezi transtorakální a transhiatální resekcí [1,2,3,4]. Letalita dosahuje až 50 % [5]. Častěji je tato komplikace popisována po resekcích pro malignitu, což jistě souvisí jednak s větším rozsahem resekce a také s větším množstvím těchto onkochirurgických výkonů.
Chylus obsahuje vysoké množství tuků, proteinů a lymfocytů a ztráty mohou u dospělých denně dosahovat několika litrů. Toto poranění vede k hypovolemii, malnutrici a imunosupresi, které dále zhoršují výsledky chirurgické léčby. Konzervativní léčba spočívající v kompletní parenterální nebo přísně upravené enterální výživě bývá úspěšná pouze v 50 % a selhává zejména u pacientů s vysokými odpady lymfy [5]. Neoperační léčba prodlužuje celkovou dobu hospitalizace a způsobuje signifikantní dyskomfort z drenáže [1,2].
Definitivní chirurgické ošetření formou chirurgické ligace DT, ať už miniinvazivně, nebo otevřeně, má výborné výsledky [3,6,7]. Většina autorů se dnes kloní k časné chirurgické intervenci [8,9,10]. Pro optimální načasování chirurgické revize dosud neexistuje standardní doporučení.
Vzhledem k přítomnosti četných kolaterál je ligace DT bezpečně proveditelná [11,12]. Profylaktická ligace DT během primární resekce (PTDL prophylactic thoracic duct ligation) byla navržena již v 90. letech Dougenisem a jejím cílem je snížení incidence chylothoraxu [13]. Některými autory byla PTDL doporučena jako standardní součást resekce jícnu s tím, že vede ke snížení incidence pooperačního chylothoraxu [1,3]. Jiní autoři se k PTDL stavějí odmítavě a její provedení není při resekci jícnu doporučováno [14]. Onkologický benefit podvazu ductus thoracicus zatím není znám.
Cílem studie je retrospektivní unicentrická analýza výsledků léčby chylothoraxu po transtorakální resekci jícnu na Chirurgickém oddělení Nemocnice Nový Jičín, a. s., a zhodnocení profylaktické ligace DT ve vztahu k výskytu chylothoraxu a počtu disekovaných uzlin.
METODA
V období let 2008−2016 bylo transtorakálně s krční či hrudní anastomózou (Ivor-Lewisova a Mckeownova resekce) operováno celkem 58 pacientů pro karcinom, 48 mužů a 10 žen, medián věku 63 let (rozmezí 43–78). PTDL byla provedena dle preference operatéra a skupina zahrnovala 31 pacientů (skupina A PTDL), 26 mužů a 5 žen, medián věku 61 let (rozmezí 45−76). Skupina A (A PTDL) byla srovnána se skupinou bez profylaktické ligace ve stejném období (B bez ligatury) s 27 pacienty, 22 mužů a 5 žen, medián věku 64 let (rozmezí 43−78). Byla analyzována celková incidence chylothoraxu a incidence v obou skupinách. Data byla získána retrospektivně z nemocniční databáze. Analyzovány byly demografické a onkologické údaje se zaměřením na množství disekovaných uzlin. Při výskytu chylothoraxu bylo sledováno denní množství chylózní sekrece do drénu, způsob a načasování chirurgického ošetření a výskyt následných komplikací v závislosti na přítomnost chylothoraxu. Stupeň chylothoraxu byl hodnocen dle současného mezinárodního konsenzu pro sběr dat komplikací spojených s ezofagektomií, kdy typ leaku je závislý na způsobu terapie chylothoraxu a závažnost leaku na množství denní produkce chylu do drénu (Tab. 1) [15]. Závažnost komplikace byla hodnocena dle Clavien-Dindovy klasifikace. Stadia maligního onemocnění byla řazena dle doporučení pro patologický staging (včetně neoadjuvance) pro 8. edici TNM klasifikace AJCC/UICC pro karcinom jícnu [16,17]. Nutriční status nemocných byl hodnocen dle Nutričního rizikového skóre (NRS 2002) [18]. Do další subanalýzy byli společně zařazení pacienti se skóre ≥3, tedy pacienti s váhovým úbytkem 10−15 % za poslední 3 měsíce.
Table 1. Hodnocení chylothoraxu dle Mezinárodního konsenzu ke standardizaci a sběru dat komplikací spojených s resekcí jícnu (Low 2015)
Tab. 1: Grading and evaluation of the severity of chylothorax according to the International Consensus on Standardization of Data Collection for Complications Associated with Esophagectomy (Low 2015)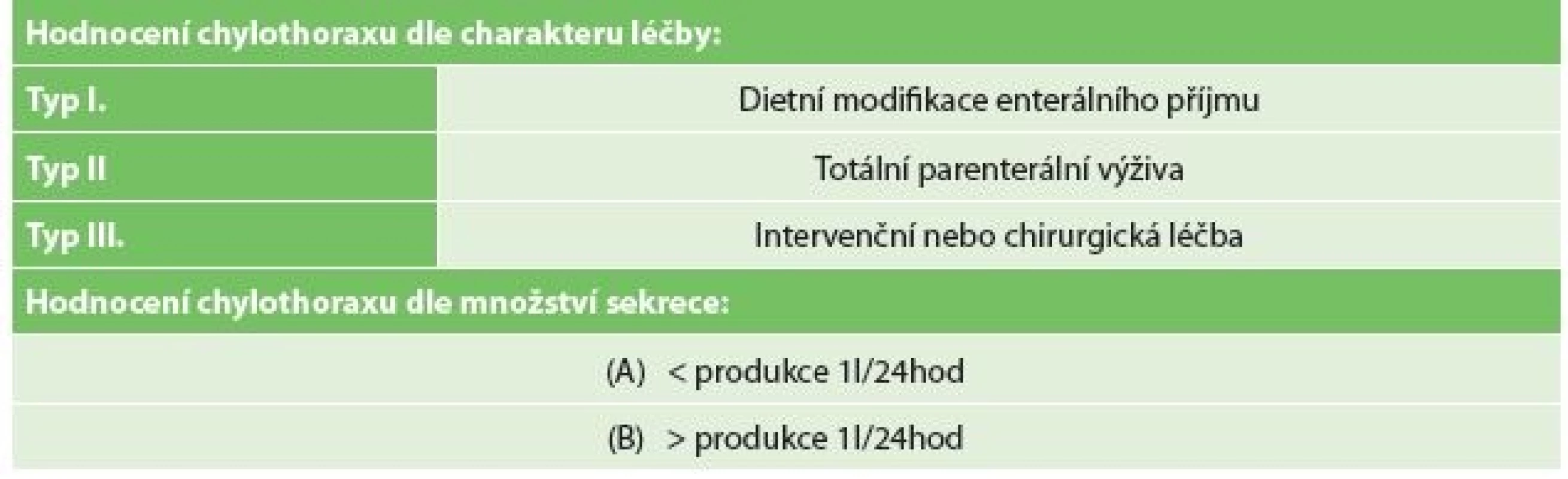
Technika profylaktické ligace ductus thoracicus
Při transtorakální resekci byla provedena ligace během hrudní fáze operace otevřeně nebo miniinvazivně v pravé pleurální dutině. Byla incidována nástěnná pleura mediálně podél průběhu vena azygos pod jejím vyústěním do vena cava superior. V preparaci bylo pokračováno v rámci hrudní lymfadenektomie kaudálně podél descendentní aorty směrem k bránici. Po částečné mobilizaci jícnu byl ductus thoracicus selektivně supradiafragmaticky vypreparován v tukové tkáni při povrchu descendentní aorty. Jeho přítomnost byla potvrzena ostrým protnutím nůžkami, při kterém byl pozorován odtok lymfy. Na distální pahýl DT u bránice byly naloženy jeden nebo dva titanové dvojité klipy (DS titanium ligature clip, Aesculap, Německo) miniinvazivním klipovačem (Obr. 1). Část DT byla nůžkami excidována a proximální pahýl byl kontrolován stejným klipem. DT byl peroperačně histologicky ověřen.
Image 1. A) torakoskopická preparace DT nad descendentní aortou (pronační poloha); B) torakoskopická klipace a přerušení DT; C) dvojitý klip supradiafragmaticky; D) Ivor- -Lewisova ezofagektomie a preparace DT (pohled z ventrální strany v boční poloze pacienta)
Fig. 1: A) thoracoscopic preparation of DT above the descending aorta; B) thoracoscopic clipping and dissection of DT; C) double clip above the diaphragm; D) Ivor-Lewis resection and prophylactic ligation of the thoracic duct (view from the ventral side in left lateral decubitus position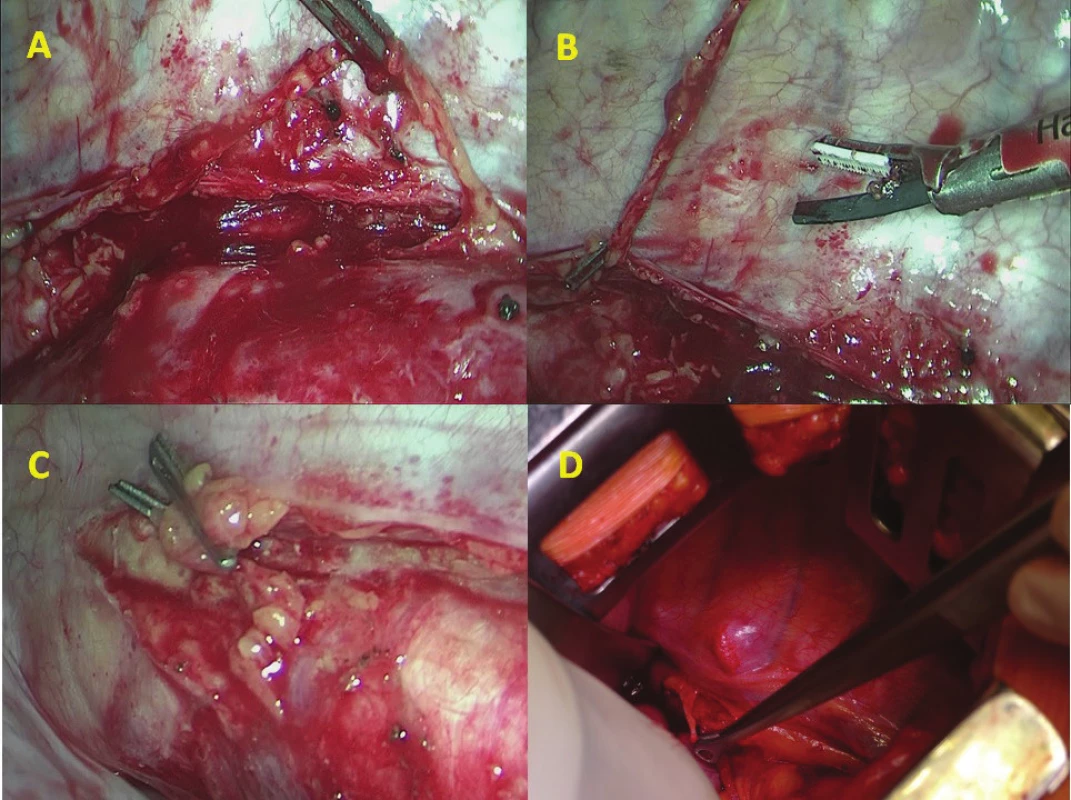
Statistická analýza
Numerická data jsou vyjádřena jako průměry se směrodatnou odchylkou nebo mediány s rozsahem hodnot. Vztahy dichotomických proměnných ke skupinám byly hodnoceny Fisherovým exaktním testem, zatímco vztahy metrických proměnných ke skupinám Welchovým t-testem po Box-Coxově transformaci původních dat směrem k symetrickému rozdělení dat a konstantnímu rozptylu (homoscedasticitě). Symetrie rozdělení a homogenita transformovaných dat byla ověřena s užitím Q-Q (kvantil-kvantilových) grafů pro normální rozdělení a histogramů. Statistická analýza dat byla provedena ve statistickém softwaru R version 3.3.3 (2017-03-06) – \“Another Canoe\“ od společnosti The R Foundation for Statistical Computing, s využitím knihoven R-commander, fBasics a AID. Testy byly dělány na hladině signifikance 0,05.
VÝSLEDKY
Chylothorax byl diagnostikován celkem u 2 mužů (3,4 %), 64 a 68 let. U obou byl ověřen biochemicky zvýšenou hodnotou triacylglycerolů a jednalo se o leaky 3B. Ve srovnání demografických údajů a komorbidit obou skupin nebyl zaznamenán žádný statistický významný rozdíl (Tab. 2). Chylothorax byl pozorován u dvou mužů ve skupině A PTDL. Při srovnání se skupinou bez ligatury DT statisticky významný rozdíl nebyl potvrzen (A PTDL 6,5 % vs. B bez ligatury 0 %, p=0,494). Při srovnání onkologických údajů včetně množství disekovaných lymfatických uzlin jsme taktéž nezaznamenali statistický významný rozdíl (18 vs. 15, p=1) (Tab. 3). Chylothorax byl diagnostikován 2. a 5. pooperační den a v obou případech se jednalo o vysokoobjemové leaky, které si vyžádaly operační revizi. U pacienta, u kterého byl chylothorax diagnostikován 2. pooperační den, byla indikována operační revize 8. pooperační den po 6 dnech plné parenterální výživy. Revize byla provedena torakoskopicky v pronační poloze (původní torakotomie po Ivor-Lewisově ezofagektomii) při selektivní plicní ventilaci. Leak byl nalezen z tangenciálního poranění duplicitního DT v oblasti pod vena azygos a kontrolován naložením dalšího titanového klipu (Obr. 2). Další průběh léčby byl již nekomplikován a pacient byl propuštěn do ambulantní péče 17. pooperační den od primooperace. U pacienta, u kterého byl chylothorax verifikován 5. pooperační den z hrudního drénu, zahrnovala konzervativní léčba totální parenterální výživu a přísné sledování bilance tekutin. Během 18 dnů došlo k respiračnímu selhání, pneumonii s nutností umělé plicní ventilace. 23. pooperační den bylo přistoupeno k operační revizi (torakotomie po torakoskopii). Byl nalezen spadlý klip po PTDL. Chylothorax byl kontrolován naložením dalšího klipu a ligatury. Tento způsob léčby vedl k delší rekonvalescenci a pacient byl propuštěn až 41. den po primární operaci (Tab. 4).
Table 2. Srovnání základní charakteristiky demografických dat souborů s PTDL (A PTDL) a souboru B bez ligatury
Tab. 2: Comparison of clinical characteristics of patients with PTDL (A PTDL) and without any ligation (B)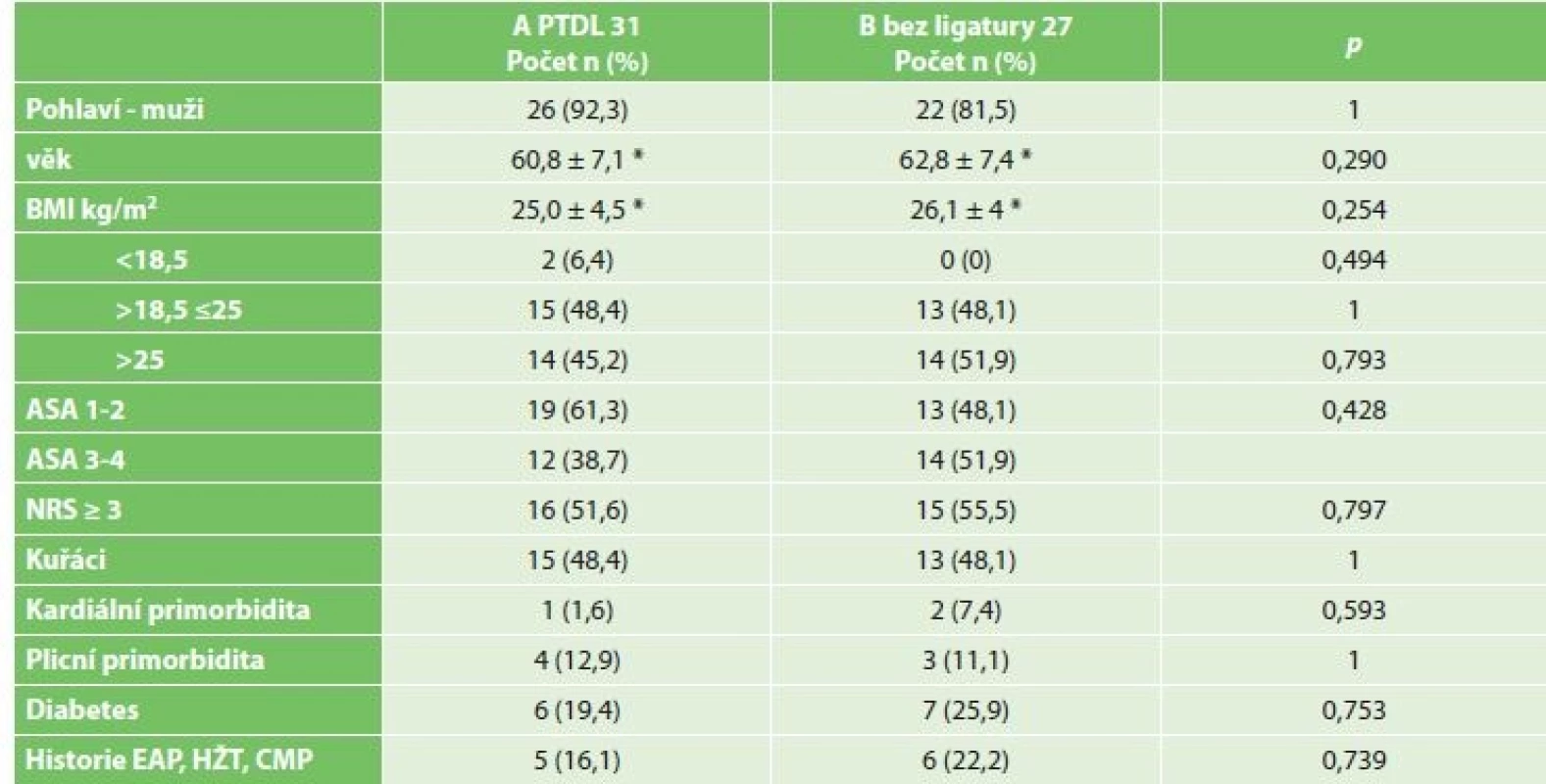
Vysvětlivky: * průměr ± SD Table 3. Srovnání incidence chylothoraxu a charakteristiky onkologického onemocnění obou souborů
Tab. 3: Comparison of the incidence of chylothorax and oncopathologic characteristics of patients in both groups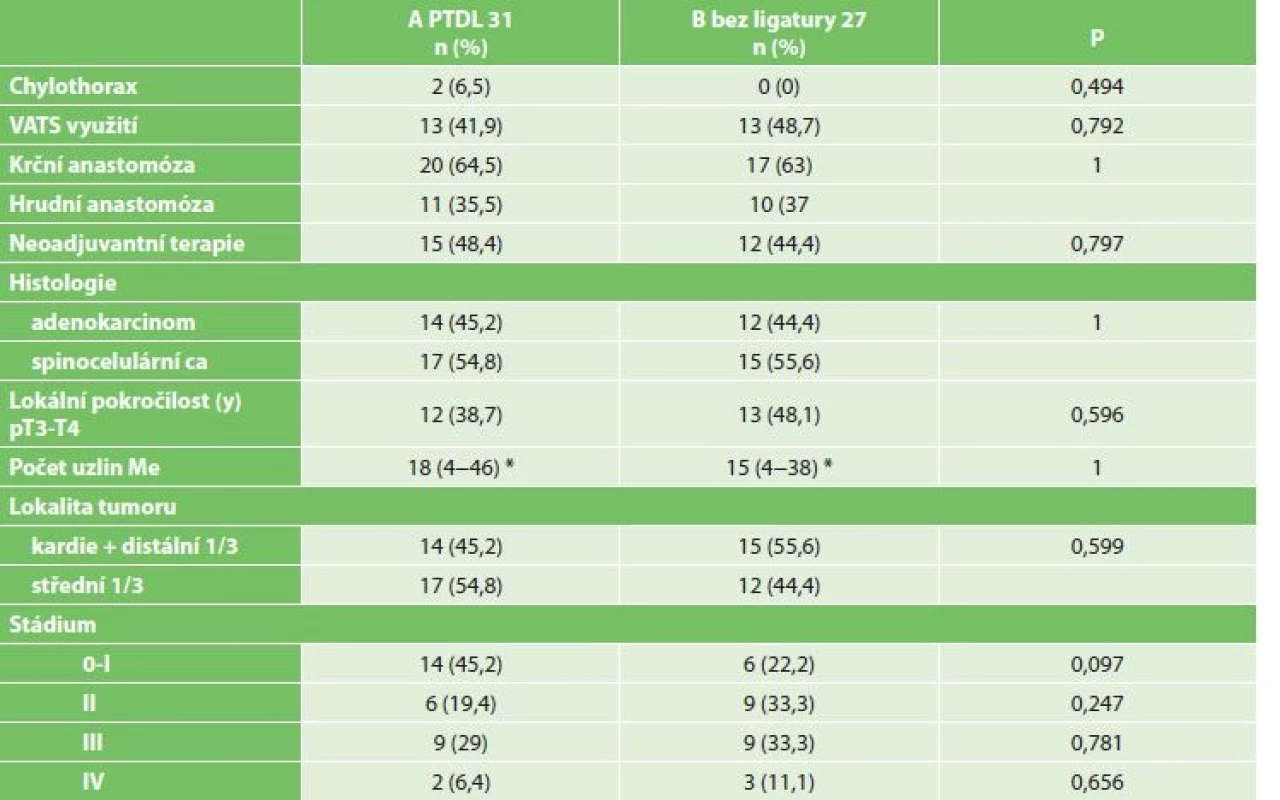
Vysvětlivky: * medián (rozsah) Table 4. Tabulka a analýza 2 pacientů s chylothoraxem po PTDL
Tab. 4: Summary of 2 patients with reported chylothorax after PTDL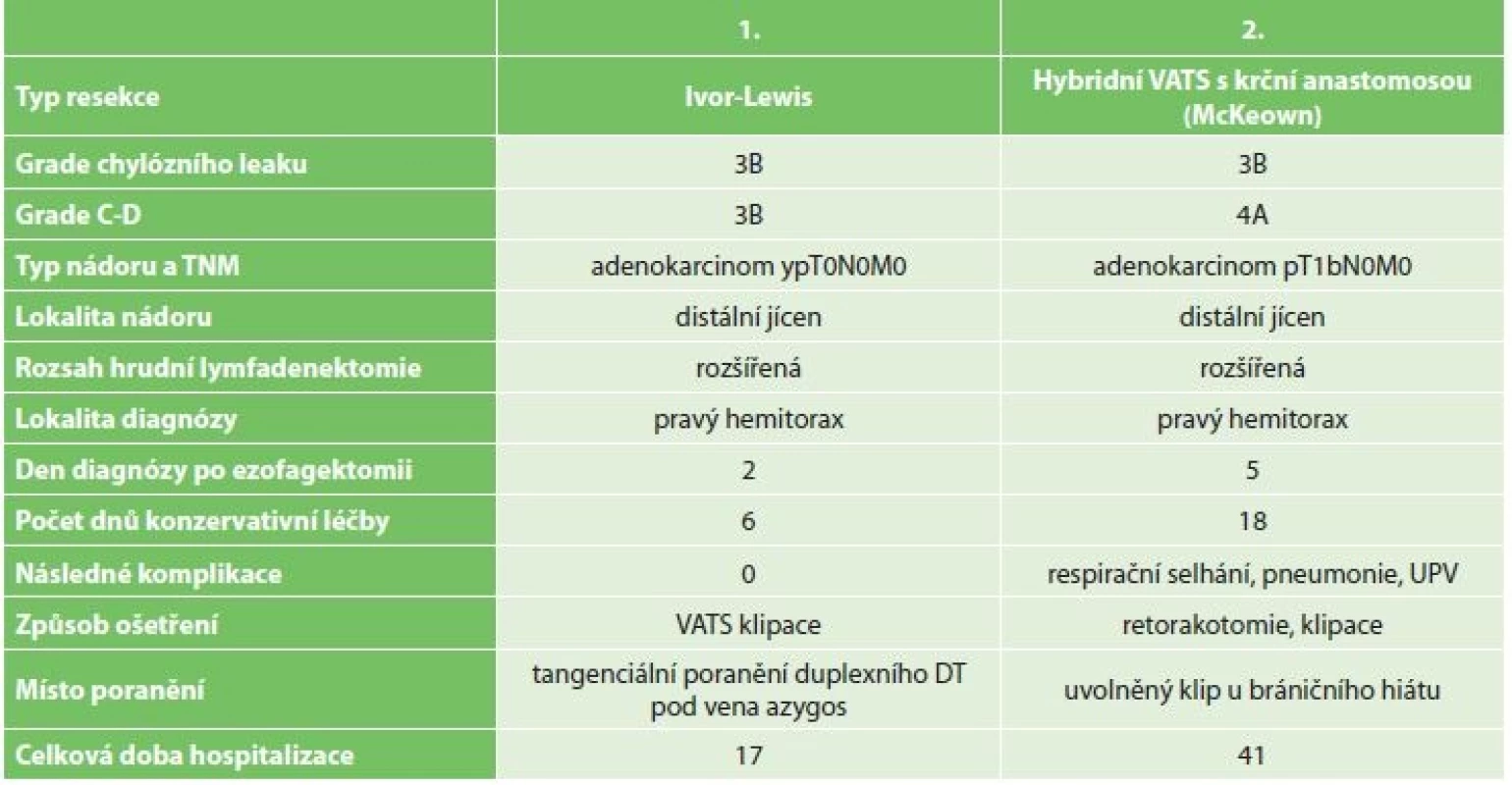
Image 2. vlevo – torakoskopická revize 8. pooperační den po Ivor-Lewisově ezofagektomii s chylothoraxem (pronační poloha pacienta), žlutá šipka označuje nástěnné poranění DT; vpravo: A ošetření leze klipem, B descendentní aorta, C fibrinem krytý plicní hilus, D žaludeční tubus využitý k rekonstrukci
Fig. 2: left – thoracoscopic revision on 8th postoperative day after Ivor-Lewis esophagectomy for chylothorax (prone position), yellow arrow showing tangential injury of the thoracic duct, right: Double clip on the duplication of DT, B descending aorta, C pulmonary hilus covered with fibrin, D gastric tube used for GI reconstruction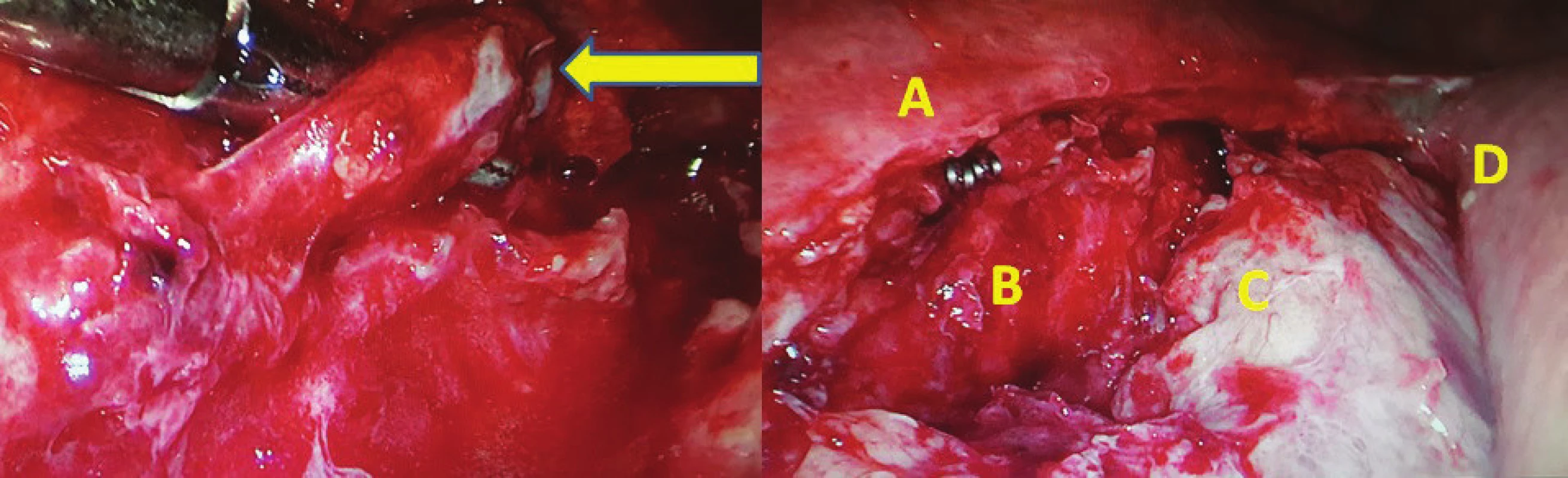
DISKUZE
Resekce jícnu je chirurgický výkon s největším výskytem pooperačního chylothoraxu [19]. Celková incidence chylothoraxu po transtorakálních resekcích jícnu v našem souboru dosáhla 3,4 %. Tato incidence je obdobná jako u většiny analýz ze specializovaných center [1,2,3,20]. V metaanalýze zahrnující 44 retrospektivních studií s 5483 pacienty, které srovnávaly pouze otevřené transtorakální a transhiatální resekce, byl zaznamenán větší výskyt po transtorakální resekci (3,4 % vs. 2,1 %) [4]. Určitý trend většího výskytu chylothoraxu po transtorakální resekci byl v současné době také prezentován po transtorakálním přístupu pittsburským pracovištěm [2]. Při analýze rizikových faktorů studie uvádějí vyšší výskyt chylothoraxu u pacientu s vyšším BMI a spinocelulárním karcinomem [1,2,3]. Oba pacienti z našeho souboru byli však operováni pro adenokarcinom distální třetiny jícnu, ale měli nadváhu s BMI 25,8 a 27,8 kg/m2.
PTDL byla navržena již v 90. letech Dougenisem. Ten ve svém souboru retrospektivně analyzoval výsledky 255 resekcí a ve skupině PTDL byla incidence chylothoraxu signifikantně nižší téměř o 7 % (2,1 % vs. 9 %, p<0,05) [13]. Lai publikoval výsledky dosud nejrozsáhlejší randomizované studie u 653 pacientů po transtorakální ezofagektomii, ve které zaznamenal také signifikantní nižší incidenci (0,3 % vs. 2,1 %, p<0,05) [21]. Oba autoři shledali ligaci jako bezpečně proveditelnou během primoresekce. Na druhou stranu jiné retrospektivní studie efekt na snížení incidence pooperačního chylothoraxu neshledaly a provedení PTDL bylo spojeno s vyšším výskytem pooperačních komplikací, jako jsou pneumonie a respirační selhání [14,22]. Recentně byla publikovaná metaanalýza ze 6 retrospektivních a 1 prospektivní studie s celkem 5254 pacienty, která potvrdila snížení incidence chylothoraxu u skupiny s PTDL. Autoři však poukazují na množství unicentrických retrospektivních dat s heterogenitou provedení resekce jícnu a také samotné techniky PTDL [23].
V současné době se dle doporučení (NCCN 2017) k rozsahu hrudní lymfadenektomie u karcinomu jícnu akceptuje její standardní nebo rozšířená forma, přičemž její technika není přesně stanovena. Cílem by mělo být odebrání nejméně 15 lymfatických uzlin ke stanovení patologického stagingu onemocnění [24]. Zastánci PTDL vidí její potenciál nejenom ve snížení incidence chylothoraxu, ale také vyzvedávají její onkologický význam [1,3]. V multicentrické studii a analýze databází ze specializovaných center bylo prokázáno, že celkové přežívání pacientů s karcinomem jícnu je nejenom závislé na metastatickém lymfatickém postižení, ale i na celkovém množství disekovaných uzlin [25]. V PTDL se standardizací hrudní lymfadenektomie vidíme tento prospěch. Důkazy onkologického benefitu v současné době nemáme a je otázkou, jak se v této problematice projeví vysoký podíl neoadjuvantní léčby u karcinomu jícnu. Současné studie neporovnávají množství disekovaných uzlin, nýbrž se soustředí na pooperační výskyt chylothoraxu. Hou ve své analýze 1804 pacientů s karcinomem neshledal PTDL jako prospěšnou k dlouhodobému celkovému přežívání [12]. V našem souboru jsme odebrali větší počet lymfatických uzlin ve skupině A (A PTDL) bez statistického významného rozdílu. Faktor patologa a podíl neoadjuvantní léčby k množství vyšetřených uzlin je však také klíčový. Ve skupině PTDL jsme zaznamenali nesignifikantně větší množství časnějších stadií karcinomu. Oba pacienti s chylothoraxem měli provedenou rozšířenou hrudní lymfadenektomii s oblastí horního mediastina.
Chirurgická technika ligace DT není uniformní a způsob jejího provedení se u různých autorů liší. Vzhledem ke křehkosti a velikosti DT je jeho samotná ligace bez přibrání okolní tukové tkáně šicím materiálem považována za rizikovou [3,13,26,27,28]. Dougenis původně ligoval DT silnou silonovou ligaturou s okolní tkání transtorakálně. Hoepner svou technikou transabdominálně obkružuje disektorem veškerou lymfaticko-tukovou tkáň podél pravého bráničního crus, až dosáhne obratlového těla. Poté stáčí disektor a celou tkáň liguje nevstřebatelným materiálem [26]. Jiní autoři zase provádějí ligaci společně s tukovou tkání „en bloc“ společně s vena azygos supradiafragmaticky [28]. Guo přerušoval DT společně s okolní tkání plastovými klipy 5 cm nad bráničním hiátem v úrovní 10. a 11. mezižebří během 135 torakoskopických ezofagektomií [11]. V našem souboru jsme DT discidovali po jeho selektivní identifikaci a verifikaci tangenciálním nastřižením při transtorakální resekci. Přerušení jsme provedli mezi titanovými klipy, které paušálně používáme u cholecystektomie. U pacienta, u něhož došlo k uvolnění klipu a výskytu chylothoraxu, byl naložen pouze 1 klip a pooperačně byla hrudní drenáž přechodně napojena na aktivní sání. Jednalo se zřejmě o kombinaci technické chyby a nitrohrudního podtlaku, která vedla k uvolnění klipu. Od té doby však používáme na DT klipy dva a dosud jsme další komplikaci nepozorovali. Mezi další příčiny výskytu chylothoraxu po PTDL patří přítomnost duplikatur a dalších anatomických variant, které se vyskytují až u 40 % populace [1,3,19,29]. Takto jsme chylothorax pozorovali u jednoho pacienta, jehož jsme časně torakoskopicky reoperovali.
V současné době nemáme k dispozici striktní algoritmus léčby chylothoraxu, který by byl založen na randomizovaných datech. K současným možnostem léčby řadíme postupy konzervativní, radiologické a chirurgické. Pilířem je vždy efektivní drenáž, sloužící ke kontrole chylózní produkce a měření jejího objemu. Léčba chylothoraxu se zahajuje vždy konzervativně a jejím cílem je snížení produkce chylu a obliterace pleurální dutiny vedoucí ke spontánnímu zastavení leaku [19,30]. Pacientům je podána parenterální nebo modifikovaná enterální výživa za přísné kontroly vnitřního prostředí a udržování euvolemie. Některými autory byly publikovány slibné výsledky za využití podávání somatostatinu, octreotidu nebo etilefrinu [31,32]. Tyto zkušenosti jsou však omezeny na malé soubory, a tak lze jejich význam chápat spíše jako podpůrný. Konzervativní léčba často selhává u pacientů s vysokoobjemovými chylózními leaky (grade B) a tento postup bývá spojován až s 50% letalitou [5].
Chirurgická ligace DT miniinvazivním nebo otevřeným přístupem má výborné výsledky a výrazně snížila v některých souborech mortalitu, i když jako každá reoperace nese také svá rizika [2,25]. Na přesném načasování chirurgické revize není mezi autory všeobecná shoda, ale většinou je příklon k časné intervenci zejména u přetrvávající vysokoobjemové sekrece. Cerfolio a Kranzfelder doporučují chirurgickou intervenci při produkci větší než 1 l/24 hod. po dobu 7 dní [8,26]. Merrigan byl již dříve radikálnější a preferoval intervenci již po 5. dni [27]. Dogue ve své práci potvrdil, že důležitější než celkový objem chylózní produkce je jeho množsví v ml/kg a shledal signifikantní a klinický rozdíl v množství chylu na 5. pooperační den po operaci, který predikoval selhání konzervativní terapie. V této studii všichni pacienti, kteří vyžadovali operaci, měli produkci >10 ml/kg/24 hod., což bylo následně potvrzeno i v pracích ze specializovaných pracovišť [2,3,33]. V našem souboru byl pacient po hybridní ezofagektomiii, u kterého jsme diagnostikovali leak 5. den po resekci jícnu. Prolongovaná konzervativní léčba vedla k následnému respiračnímu selhání, umělé plicní ventilaci a pneumonii. Chylózní leak byl definitivně kontrolován až po torakotomické revizi. Naopak časná reoperace u druhého pacienta ve stejné skupině vedla k okamžité kontrole leaku bez výskytu následných komplikací.
Samostatná operační revize pro chylothorax nese také svá úskalí. Chirurg kromě indikace musí zvážit možnosti přístupu transabdominálního či transtorakálního, a to vzhledem k celkovému stavu pacienta a předpokládané lokalizaci úniku chylu. Slibnou alternativou chirurgické intervence, která nenese rizika celkové anestezie a reintervence v pohrudniční dutině, je využití perkutánní katetrizace a embolizace DT, s níž naše pracoviště zkušenosti nemá. Kromě dobré znalosti anatomie DC musí chirurg analyzovat možnou výšku poranění. Chylothorax se může vyskytnout v obou pohrudničních dutinách, peritoneální dutině i na krku. Přístup transabdominální nevyžaduje selektivní plicní ventilaci a některými autory je doporučován k revizi bez ohledu na primární přístup k resekcí jícnu [28,29]. Intervence v proximální oblasti DT nad cisterna chyli je logická k ošetření jakékoliv chylózní fistuly v distální oblasti. Většinou autorů je popisován transtorakální přístup, který nese výborné výsledky [1,2,3,34]. První torakoskopická revize pro chylothorax po resekci jícnu byla provedena již v 90. letech Crosthwaitem a Cushierim s využitím klipu [35]. V našem souboru jsme provedli jak torakoskopii, tak torakotomii při revizi pro chylothorax. Torakoskopicky jsme operovali pacienta po předešlé posterolaterální torakotomii po Ivor-Lewisově resekci jícnu při selektivní ventilaci levé plíce. Pronační poloha nemocného, kterou využíváme i při hybridní miniinvazivní ezofagektomii, se nám jevila velmi přínosná vzhledem k dobrému přehledu s optickým zvětšením.
ZÁVĚR
Chylothorax je závažnou pooperační komplikací po resekci jícnu, která dosahuje výrazné morbidity a mortality. Profylaktická ligace ductus thoracicus ve většině studií naznačuje snížení incidence pooperačního chylothoraxu. Její jednoznačný přínos dokázán není a nelze ji v současnosti doporučovat jako standardní součást resekce jícnu. Onkologický benefit také není znám. V našem souboru jsme ve skupině profylaktické ligace zaznamenali nesignifikantně větší výskyt chylothoraxu a počtu disekovaných uzlin. U velkoobjemové a delší dobu trvající sekrece chylu by indikace k revizi měla být časná. Torakotomická nebo torakoskopická revize pro chylothorax je dobře proveditelná. Vzhledem k nízké incidenci tohoto poranění nemáme v literatuře k dispozici dostatek prospektivních randomizovaných dat.
Seznam použitých zkratek:
ASA − American Society of Anesthesiologists
BMI − body mass index
C-D − Clavien-Dindo klasifikace
CMP − cévní mozková příhoda
DT − ductus thoracicus
EAP − embolizace do plícnice
HŽT − hluboká žilní trombóza
NRS − nutriční rizikové skóre
PTDL − profylaktická ligace ductus thoracicus
SD − směrodatná odchylka
UPV − umělá plicní ventilace
VATS − videoasistovaná torakoskopie
Za statistické zpracování dat děkuji Ing. Martinu Hillovi, DrSc.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Tomáš Jínek
Nemocnice Nový Jičín, a.s.
Purkyňova 2138/16
741 01 Nový Jičín
e-mail: jinek.tomas@gmail.com
Sources
- Miao L, Zhang Y, Hu H, et al. Incidence and management of chylothorax after esophagectomy. Thorac Cancer 2015;6 : 354−8.
- Shah RD, Luketich JD, Schuchert MJ, et al. Postesophagectomy chylothorax: incidence, risk factors, and outcomes. Ann Thorac Surg 2012;93 : 897−903.
- Brinkmann S, Schroeder W, Junggeburth K, et al. Incidence and management of chylothorax after Ivor Lewis esophagectomy for cancer of the esophagus. J Thorac Cardiovasc Surg 2016;151 : 1398−1404.
- Rindani R, Martin CJ, Cox MR. Transhiatal versus Ivor-Lewis oesophagectomy: is there a difference? Aust N Z J Surg 1999;69 : 187−19
- Bolger C, Walsh TN, Tanner WA, et al. Chylothorax after oesophagectomy. Br J Surg 1991;78 : 587−8.
- Hayden JD, Sue-Ling HM, Sarela AI, et al. Minimally invasive management of chylous fistula after esophagectomy. Dis Esophagus 2007;20 : 251−5.
- Kumar S, Kumar A, Pawar DK. Thoracoscopic management of thoracic duct injury: Is there a place for conservatism? J Postgrad Med 2004;50 : 57−59.
- Cerfolio RJ. Chylothorax after esophagogastrectomy. Thorac Surg Clin 2006;16 : 49−52.
- Merrigan BA, Winter DC, O´Sullivan GC. Chylothorax. Br J Surg 1997;84 : 15−20.
- Kranzfelder M, Gertler R, Hapfelmeier A, et al. Chylothorax after esophagectomy for cancer: impact of the surgical approach and neoadjuvant treatment: systematic review and institutional analysis. Surg Endosc 2013;27 : 3530−8.
- Guo W, Zhao YP, Jiang YG, et al. Prevention of postoperative chylothorax with thoracic duct ligation during video-assisted thoracoscopic esophagectomy for cancer. Surg Endosc 2012;26 : 1332−6.
- Wurnig PN, Hollaus PH, Ohtsuka T, et al. Thoracoscopic direct clipping of the thoracic duct for chylopericardium and chylothorax. Ann Thorac Surg 2000;70 : 1662−5.
- Dougenis D, Walker WS, Cameron EW, et al. Management of chylothorax complicating extensive esophageal resection. Surg Gynecol Obstet 1992;174 : 501−6.
- Hou X, Fu JH, Wang X, et al. Prophylactic thoracic duct ligation has unfavorable impact on overall survival in patients with resectable oesophageal cancer. Eur J Surg Oncol 2014;40 : 1756−62.
- Low DE, Alderson D, Cecconello I, et al. International consensus on standardization of data collection for complications associated with esophagectomy: Esophagectomy Complications Consensus Group (ECCG). Ann Surg 2015;262 : 286−94.
- Rice TW, Ishwaran H, Kelsen DP, et al. Worldwide Esophageal Cancer Collaboration Investigators. Recommendations for neoadjuvant pathologic staging (ypTNM) of cancer of the esophagus and esophagogastric junction for the 8th ed. AJCC/UICC staging manuals. Dis Esophagus 2016;29 : 906−12.
- Rice TW, Ishwaran H, Hofstetter WL, et al. Worldwide Esophageal Cancer Collaboration Investigators. Recommendations for pathologic staging (pTNM) of cancer of the esophagus and esophagogastric junction for the 8th ed. AJCC/UICC staging manuals. Dis Esophagus 2016;29 : 897−905.
- Kondrup J, Rasmussen HH, Hamberg O, et al. Ad Hoc ESPEN Working Group. Nutritional risk screening (NRS 2002): a new method based on an analysis of controlled clinical trials. Clin Nutr 2003;22 : 321−6.
- Stolz A, Pafko P, Bicek V, et al. Chylothorax. In: Komplikace v plicní chirurgii. Praha, Grada Publishing 2010 : 124−37.
- Kim D, Cho J, Kim K, et al. Chyle leakage patterns and management after oncologic esophagectomy: A retrospective cohort study. Thorac Cancer 2014;5 : 391−7.
- Lai FC, Chen L, Tu YR, et al. Prevention of chylothorax complicating extensive esophageal resection by mass ligation of thoracic duct: a random control study. Ann Thorac Surg 2011;91 : 1770−4.
- Fu JH, Hu Y, Huang WZ, et al. Evaluating prophylactic ligation of thoracic duct during radical resection of esophageal carcinoma. Ai Zheng 2006;25 : 728−30.
- Crucitti P, Mangiameli G, Petitti T, et al. Does prophylactic ligation of the thoracic duct reduce chylothorax rates in patients undergoing oesophagectomy? A systematic review and meta-analysis. Eur J Cardiothorac Surg 2016;50 : 1019−24.
- NCCN Clinical Practice Guidelines in Oncology, Esophageal and Esophagogastric junction Cancers, Version I.2017. Available from: www:<https://www.nccn.org/professionals/physician_gls/pdf/esophageal.pdf>.
- Peyre CG, Hagen JA, DeMeester SR, et al. The number of lymph nodes removed predicts survival in esophageal cancer: an international study on the impact of extent of surgical resection. Ann Surg 2008;248 : 549−56.
- Hoeppner J, Hopt UT. Transabdominal mass ligation of the thoracic duct for the prevention of chylothorax following en bloc oesophagectomy. Eur J Cardiothorac Surg 2013;44 : 1134−6.
- Schumacher G, Weidemann H, Langrehr JM, et al. Transabdominal ligation of the thoracic duct as treatment of choice for postoperative chylothorax after esophagectomy. Dis Esophagus 2007;20 : 19−23.
- Cagol M, Ruol A, Castoro C, et al. Prophylactic thoracic duct mass ligation prevents chylothorax after transthoracic esophagectomy for cancer. World J Surg 2009;33 : 1684−6.
- Johnstone D. Anatomy of the thoracic duct and chylothorax. In: Shields TW, Locicero III J, Reed CE, et al. General thoracic surgery. 7th ed. Lippincott Williams&Wilkins 2009 : 827−33.
- Browse NL, Allen DR, Wilson NM. Management of chylothorax. Br J Surg 1997;84 : 1711−6.
- Ohkura Y, Ueno M, Iizuka T, et al. New combined medical treatment with etilefrine and octreotide for chylothorax after esophagectomy: A case report and review of the literature. Medicine (Baltimore) 2015;94:e2214.
- Collard JM, Laterre PF, Boemer F, et al. Conservative treatment of postsurgical lymphatic leaks with somatostatin-14. Chest 2000;117 : 902−5.
- Dugue L, Sauvanet A, Farges O, et al. Output of chyle as an indicator of treatment for chylothorax complicating oesophagectomy. Br J Surg 1998;85 : 1147−9.
- Hayden JD, Sue-Ling HM, Sarela AI, et al. Minimally invasive management of chylous fistula after esophagectomy. Dis Esophagus 2007;20 : 251−20:
- Crosthwaite GL, Joypaul BV, Cuschieri A. Thoracoscopic management of thoracic duct injury. J R Coll Surg Edinb 1995;40 : 303−4.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2018 Issue 7-
All articles in this issue
- Využití retrosternálně uloženého kolon v náhradě jícnu
- Stav chirurgické léčby karcinomu žaludku a gastroezofageální junkce v České republice
- Profylaktická ligace ductus thoracicus v prevenci chylothoraxu po resekci jícnu
- Karcinom jícnu – výsledky chirurgické terapie na I. chirurgické klinice FN Olomouc
- Úspěšná terapie leaku 3. stupně po ezofagektomii s hrudní anastomózou s použitím endoskopické vakuové terapie – kazuistika
- Výsledky minimálně invazivní ezofagektomie pro karcinom jícnu provedené po ischemickém conditioningu žaludku
- Hybridní torakoskopická resekce jícnu pro karcinom – retrospektivní analýza a srovnání s transhiatální ezofagektomií
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Využití retrosternálně uloženého kolon v náhradě jícnu
- Profylaktická ligace ductus thoracicus v prevenci chylothoraxu po resekci jícnu
- Karcinom jícnu – výsledky chirurgické terapie na I. chirurgické klinice FN Olomouc
- Stav chirurgické léčby karcinomu žaludku a gastroezofageální junkce v České republice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

