-
Medical journals
- Career
GIST tenkého střeva v terénu neurofibromatózy jako zdroj masivního krvácení
Authors: R. Slováček 1; Z. Adamová 1; P. Mičulka 2
Authors‘ workplace: Chirurgické oddělení Vsetínské nemocnice, a. s., přednosta: MUDr. J. Sankot 1; Oddělení patologické anatomie Vsetínské nemocnice a. s., přednosta: MUDr. P. Mičulka 2
Published in: Rozhl. Chir., 2014, roč. 93, č. 3, s. 143-146.
Category: Case Report
Overview
Neurofibromatóza I. Typu (Morbus von Recklinghausen) je autosomálně dominantně dědičné onemocnění, kdy se kromě známých a zjevných kožních lézí mohou neurofibromy vzácně tvořit i v gastrointestinálním traktu. V tomto případě však mohou v 5–25 % přecházet v gastrointestinální stromální tumory. V případě námi prezentované 69leté pacientky s neurofibromatózou I. typu byly při krvácení z trávicího traktu nalezeny v terénu mnohočetné neurofibromatózy tenkého střeva makroskopicky odlišné, krvácející léze, které byly kompletně exstirpovány. Histologicky pak byly verifikovány jako gastrointestinální stromální tumory. Při imunohistologickém vyšetření archivovaných preparátů z předchozích operací pacientky byly takto překlasifikovány jak léze rekta odstraněná před rokem, tak „polypy“ tenkého střeva, odstraněné před 32 lety.
V diskuzi autoři rozebírají možnosti vyšetření zdroje krvácení tenkého střeva a odlišení gastrointestinálních stromálních tumorů v terénu neurofibromatózy střeva. Další diskutovanou otázkou je aktivní vyhledávání gastrointestinálních tumorů u pacientů s kožní formou Mb. Recklinghausen.
Pro úspěšné řešení krvácení z gastrointestinálního traktu je nezbytná dobrá spolupráce mezi chirurgem, endoskopujícím lékařem a rentgenologem. K rychlejší diagnostice a následné léčbě je velmi prospěšná přesná znalost osobní anamnézy pacienta a možných komplikací chronických onemocnění.Klíčová slova:
neurofibromatóza – stromální – tumor – krvácení – trávicí traktÚvod
Neurofibromatóza I. typu ( Morbus von Recklinghausen) je autosomálně dominantně dědičné onemocnění s různou penetrancí genu, přibližně 50 % případů se prezentuje jako nová nemoc.
Hlavními diagnostickými kritérii jsou mnohočetné kožní fibromy, skvrny café au lait, pigmentové hamartomy duhovky a pozitivní rodinná anamnéza. Gen pro neurofibromatózu I (NF1) je identifikován na chromozomu 17. Gastrointestinální lokalizace lézí není u NF 1 neobvyklá, může se vyskytnout v různých formách – od hyperplazie neurální tkáně po gastrointestinální stromální a endokrinní tumory. V gastrointestinálním traktu (GIT) se neurofibromy častěji vyskytují v tenkém střevě, v tlustém střevě a rektu se vyskytují extrémně vzácně [1].
Gastrointestinální stromální tumory (GIST) jsou neepitelové nádory trávicího traktu tvořené vřetenovitými buňkami, které jsou diferencovány z tzv. Cajalových buněk. Ty jsou součástí střevní stěny a fungují jako peristaltický pacemaker. GISTy jsou nejčastějšími mezenchymálními nádory trávicího ústrojí (60 %), ale z celkového počtu nádorů trávicího traktu tvoří jen 2–5 %. Nejčastěji se objevují ve věku 55–65 let. Typicky postihují žaludek (60–70 %), ale mohou se vyskytnout i v tenkém střevě (20–25 %), tlustém střevě (5 %) a jícnu (do 5 %). Vzácný je jejich nález mimo trávicí trubici [2] Tab. 1.
Table 1. Výskyt GIST Tab. 1: Incidence of GIST 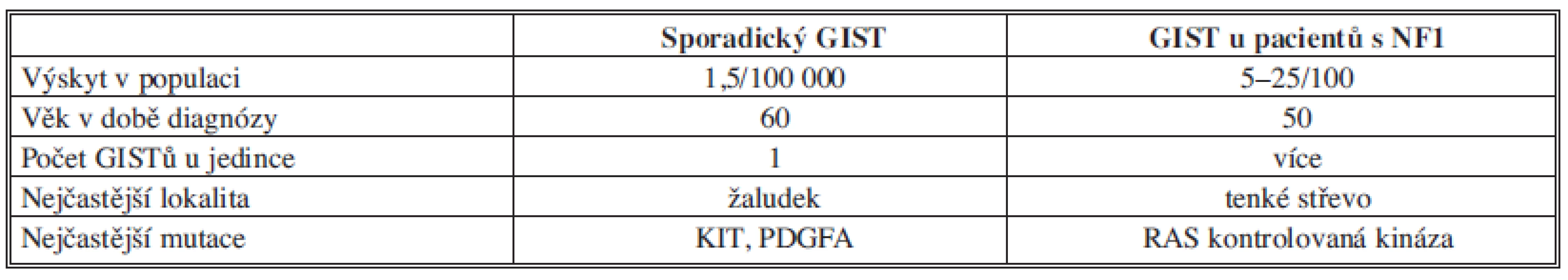
Jako zvláštní forma GISTu je v literatuře uváděn výskyt tohoto tumoru v terénu neurofibromatózy I. typu, kdy bývá mnohočetný a nejčastěji postiženou částí trávicího traktu bývá tenké střevo. Každý GIST je nutné považovat za potenciálně maligní, podle lokalizace pak nádory tenkého střeva mívají horší prognózu [3].
Kazuistika
Na naše oddělení byla přijata 69letá pacientka s neurofibromatózou I. typu (Mb. Recklinghausen), která u ní byla diagnostikována ve 44 letech věku (Klinika chorob kožních a pohlavních FN Olomouc). V anamnéze byla uvedena následující data týkající se GIT: v 37 letech operace „střevních polypů“, kdy bylo odstraněno cca 80 cm tenkého střeva. V 66 letech měla pacientka ataku melény, jako zdroj byla při gastroskopii zjištěna erozivní gastritis. V 67 letech pacientka prodělala cholecystektomii pro pokročilou gangrenózní cholecystitidu s předoperační stentáží choledochu cestou ERCP. V 68 letech byla u pacientky provedena transanálně excize susp. neurofibromu rekta, který byl histologicky popsán jako neurilemom (Schwannom) s pozitivou S-100 proteinu (Obr. 1).
Image 1. Neurofibromatóza kůže Fig. 1: Neurofibromatosis of the skin 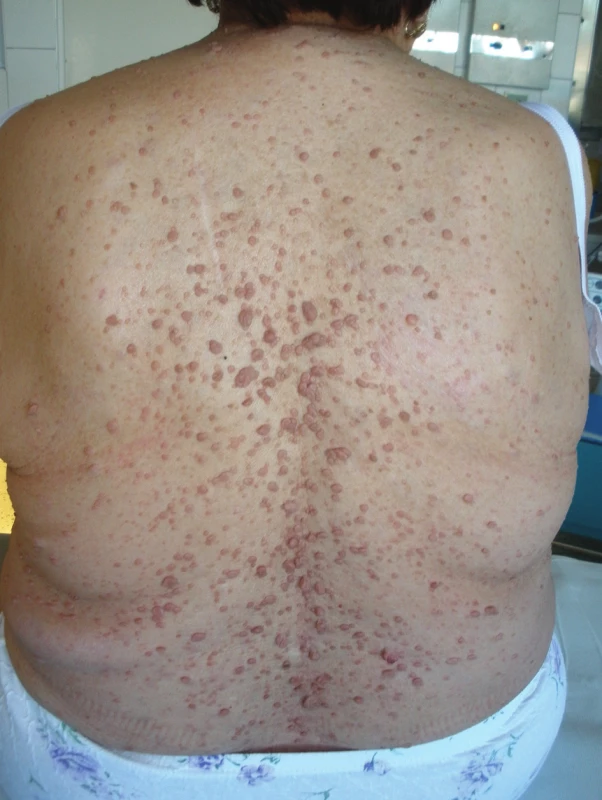
V září 2009 se pacientka dostavila na chirurgickou ambulanci pro den trvající černou stolici. Nezvracela, byla bez bolestí, před touto atakou neměla žádné potíže. Při přijetí byla oběhově stabilní, TK 130/70 mm Hg, 90 pulzů/min. Vstupní hemoglobin byl 99 g/l, postupně klesal až na 52 g/l. Při klinicky zjevném krvácení a poklesu hemoglobinu byl podáván terlipresin 1 mg i.v. každé
4 hodiny, krevní převody, do operace celkem 7 TU; koagulační faktory či mražená plazma při dobrých koagulačních parametrech nebyly podávány. Pacientka byla po celou dobu oběhově stabilní.
V den přijetí 2. 9. 2009 byla provedena akutní gastroskopie s nálezem těžké difuzní gastritidy, ale bez přítomnosti krve. Zahájili jsme podávání plné dávky blokátoru protonové pumpy (PPI) parenterálně, kontinuálně. Při pokračujících známkách krvácení měla pacientka opakovaně melénu s neúplně natrávenou krví; byla provedena 3. 9. 2009 kolonoskopie s nálezem mnohočetné klidové divertikulózy sigmatu, bez známek čerstvého krvácení, s prosáknutím Bauhinské chlopně a polypem dna céka (histologicky byl verifikován zánětlivý polyp). Dominovalo velké množství částečně natrávené krve přitékající z horních partií tenkého střeva. Vzhledem k oběhové stabilitě pacientky a snížení frekvence melén při konzervativní léčbě jsme neindikovali další vyšetření.
4. 9. 2009 ráno se znovu objevila masivní meléna s příměsí čerstvé krve. Po domluvě s radiologem jsme indikovali angioCT splanchnické oblasti, při kterém byly patrny mnohočetné polypoidní útvary tenkého střeva. V pars ascendens duodena (D4) a na duodenojejunálním přechodu se zobrazují 2 větší kulovité útvary, z jednoho z nich je patrný signifikantní únik kontrastní látky do lumina střeva, což představuje jasné známky akutního krvácení (Obr. 2,3).
Image 2. CT nativ – tumorózní léze duodena Fig. 2: Plain CT – tumorous lesions of the duodenum 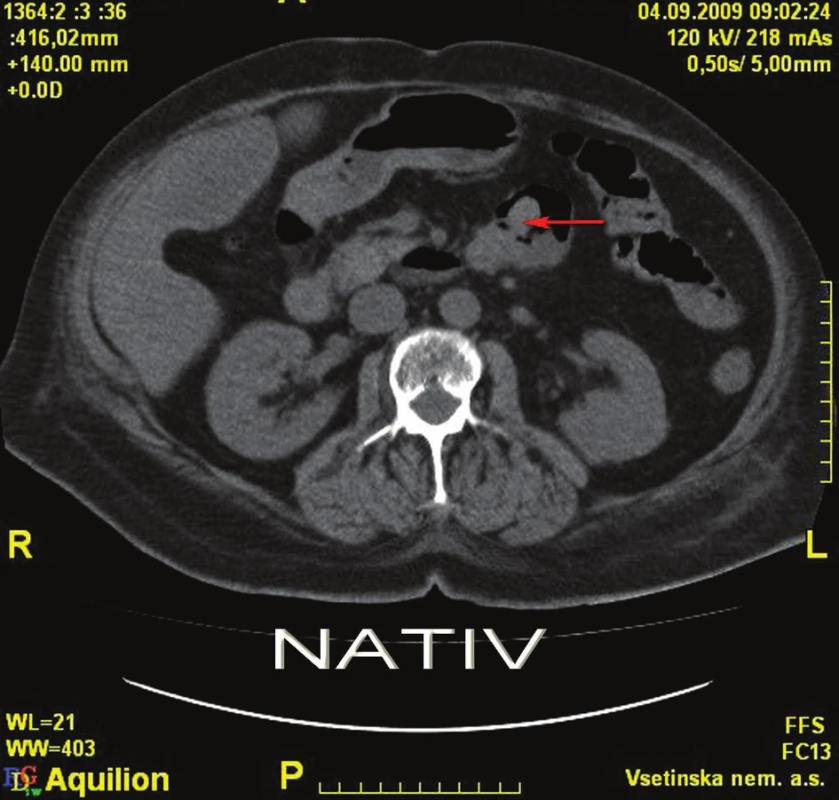
Image 3. CT kontrast – krvácení z tumoru Fig. 3: Enhanced CT – bleeding from the tumour 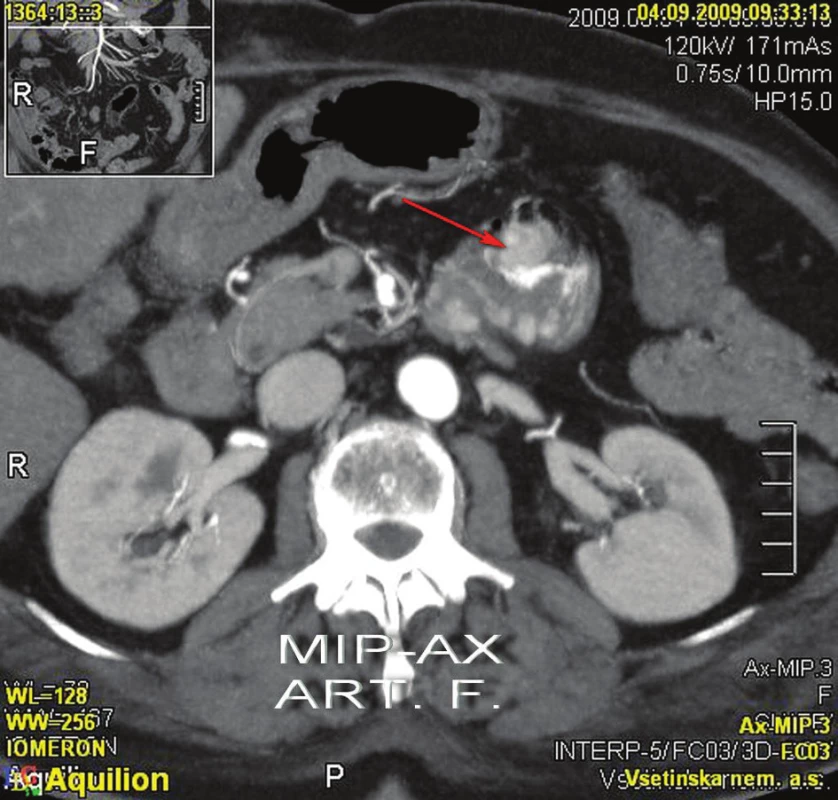
Proto vzhledem k nálezu pokračujícího významného krvácení při známém zdroji i jeho lokalizaci indikujeme urgentní operační revizi.
Při operaci ze 2 samostatných enterotomií exstirpujeme 2 kulovité útvary, orální v D4 velikosti 2,5 cm, aborální v oblasti Treitzovy řasy na zadní stěně střeva o průměru 2 cm. Na jeho vrcholu je drobná nekróza s pulzujícím krvácením. V průběhu tenkého střeva nalézáme četné, předpokládáme že neurofibromatózní uzlíky (Obr. 4).
Image 4. Exstirpovaný tumor Fig. 4: Removed tumour 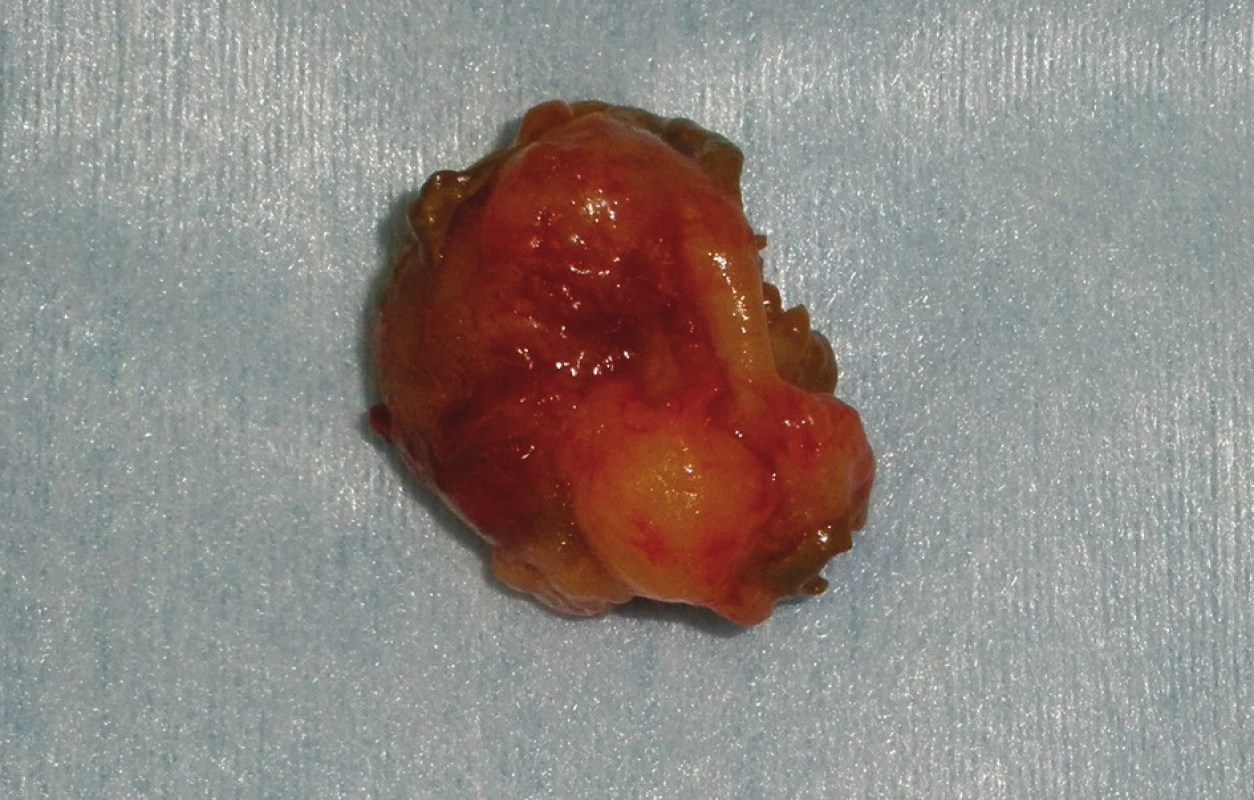
Pooperační průběh je již bez komplikací, po odchodu zbytkové melény již není známek dalšího krvácení, během 2 dnů ještě podáváme 2 TU erymasy k úpravě hladiny hemoglobinu. Pooperačně má pacientka do 3. dne subfebrilie, rána je bez známek infektu, hojí se per primam. Od 3. dne se obnovuje pasáž střevní a po odchodu zbytků starší krve či melény je dále hnědá stolice. Od 3. dne rovněž zatěžujeme střevo postupně perorálním příjmem, který pacientka dobře toleruje. 4. pooperační den překládáme pacientku z JIP na standardní oddělení. 11. pooperační den je propuštěna domů.
Při histologickém a imunohistochemickém vyšetření byly oba exstirpované tumory verifikovány jako GIST nízkého stupně malignity (CD 117 pozitivní, CD 31 pozitivní, S 100 pozitivní).
Během dalšího sledování pacientky v onkologické ambulanci (CEA, kolonoskopie, CT břicha) nebyla během 3 let zjištěna recidiva či progrese onemocnění. V současné době je pacientka bez subjektivních potíží, s pravidelnou stolicí, přítomnost krve ve stolici nepozoruje.
Diskuze
Případ naší pacientky je medicínsky zajímavý hned z několika hledisek, při jeho řešení jsme narazili na několik problematických bodů. Asi nejjednodušší se z tohoto pohledu jeví problematika krvácení do zažívacího traktu. Algoritmus diagnostiky a následné léčby je všeobecně přijatý. Ložisková léze na tenkém střevě je však hůře dosažitelná endoskopicky, enteroskop není zvláště v akutním stavu běžně k dispozici. My jsme k ozřejmění zdroje krvácení využili angioCT s velmi dobrým výsledkem. Krvácení však musí být dostatečně intenzivní, aby se intraluminálně unikající kontrastní látka zobrazila (minimálně 2 ml/min) [4].
Při operační revizi jsme odstranili jednak jednoznačně krvácející tumor, jednak druhé největší ložisko v popsané oblasti – dle pooperačního histologického vyšetření radikálně, ve zdravých okrajích. Potvrdili jsme nález z CT, že se v aborálním duodenu a jejunu nacházejí mnohočetné drobné noduly. Otázkou ale zůstává, které z nich jsou neurofibromy a které již GISTy.
Při zjištění, že se nejedná o neurofibromy, ale o GISTy, jsme nechali zpětně vyšetřit histologický materiál z předchozích excizí. Schwannom exstirpovaný z rekta předchozí rok byl po imunohistochemickém vyšetření při pozitivitě CD117 překlasifikován na GIST. Ještě větším překvapením bylo imunohistochemické vyšetření preparátu resekátu střeva z roku 1977. I zde vykazoval tumor pozitivitu na CD 117, a byl tedy po 32 letech překlasifikován z polypu střeva na gastrointestinální stromální tumor nízkého stupně malignity. Vzhledem k R0 resekci daných tumorů a nízkému stupni malignity neindikoval onkolog adjuvantní léčbu imatinib mesylátem a pacientka je pouze dispenzarizována.
Jaké metody však zvolit pro další sledování? Gastroskopie a kolonoskopie nejsou problémem, u naší pacientky byly opakovaně negativní. Pro sledování duodenojejuna je prováděno CT vyšetření. Může však jen srovnávat velikost mnohočetných neurofibromatózních uzlů v časovém odstupu, ale neodliší včasně změnu neurofibromu v GIST. Z tohoto pohledu se jako nejpřínosnější ukazuje PET/CT, při kterém lze rozlišit ložiska vychytávající fluorin-18-fluorodeoxy glukózy (FDG-PET) v aktivním tumoru, zatímco neurofibromy tuto látku neakumulují [2,5].
Pro sledování aktivity ložisek bude tato metoda přínosnější než dvoubalonová enteroskopie, kde u mnohočetných drobných lézí lze obtížně určit podezřelejší ložiska [6,7].
Poslední problematickou oblastí, na kterou jsme narazili, je otázka aktivního vyhledávání GIST mezi pacienty s neurofibromatózou I. typu. Podle literárních údajů je riziko vzniku GIST v terénu neurofibromatózy 5–25 %, a to hlavě v tenkém střevě, kde se tyto nádory vyskytují s vyšším stupněm malignity. Naše pacientka má 42letou dceru a 20letou vnučku a u obou je prokázána neurofibromatóza I. typu. Jedná se jednak o metodu, kterou pro vyhledávání použít, jednak o to, kdo má tato vyšetření koordinovat. Pracoviště kožního lékařství mají v péči pouze kožní noxy, pracoviště onkologie se pak starají o pacienty se suspektní nebo již prokázanou neoplazií.
V současnosti převládá názor, že se případné GIST u pacientů s neurofibromatózou aktivně nevyhledávají, ale při známkách gastrointestinálních obtíží jsou vyšetřeni některou z endoskopických metod nebo lépe PET/CT [2].
Závěr
Krvácení do zažívacího traktu představuje vždy potenciálně závažný stav. Při dobře fungujícím mezioborovém týmu chirurg – endoskopující lékař – radiolog je většina těchto stavů rychle a úspěšně vyřešena. Krvácející léze na tenkém střevě nebývají časté a jsou většinou obtížněji prokazatelné.
Jistým rychlým návodem zde může být důsledná osobní anamnéza a znalost možných komplikací při chronických onemocněních.
MUDr. Radim Slováček
Smetanova 1477
755 01, Vsetín
e-mail: slovacek@nemocnice-vs.cz
Sources
1. Behranwala KA, Spalding D, Wotherspoon A, et al. Small bowel gastrointestinal stromal tumours and ampularry cancer in Type I neurofibromatosis. World Journal of Surgical Onkology 2004;2 : 1.
2. Páral J, Lochman P, Kalábová H, Hadži-Nikolov D. GIST: Novodobé poznatky a léčebné modality. Rozhledy v chirurgii 2012;91 : 189–198.
3. Tsukuda K, Ikeda E, Takagi S, et al.Multiple Gastrointestinal Stromal Tumors in Neurofibromatosis Type 1 Treated with Laparoscopic Surgery. Acta Med Okayama 2007;61 : 47–504.
4. Ferda J. CT angiografie. Praha, Galén 2004 : 272–273.
5. Van den Abeele AD. The lessons of GIST-PET and PET/CT: a new paradigm for imaging. Onkologist 2008;13(Suppl):8–13.
6. Takakuraa K, Kajiharaa M, Sasakia S, et al.Use of Balloon Enteroscopy in Preoperative Diagnosis of Neurofibromatosis-Associated Gastrointestinal Stromal Tumours of the Small Bowel. Case Rep Gastroenterol 2011;5 : 308–314.
7. Matek J, Krška Z. GIST jako invaginace na tenkém střevě. Rozhledy v chirurgii 2009;88 : 425 – 427.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2014 Issue 3-
All articles in this issue
- Problematika diferenciální diagnostiky primárních nádorů jater
- Organizace a využívání tkáňové banky nádorů
- Poranenia extenzorového aparátu v zóne I – mallet deformita
- Analýza komplikací a klinicko-patologických faktorů ve vztahu k laparoskopické cholecystektomii
- Standardizace patologického vyšetření resekátu pankreatu
- Sagitální typ bércové amputace u pacientů se syndromem diabetické nohy
- GIST tenkého střeva v terénu neurofibromatózy jako zdroj masivního krvácení
- Patologická tekutinová kolekce mezenteria, diferenciální diagnostika mezenteriální cysty – kazuistika
- Obecné zásady práce s resekovanými tkáněmi a orgány určenými pro histopatologické vyšetření – požadavky patologů na chirurgy
- Lymfatické metastazování očima patologa
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Lymfatické metastazování očima patologa
- Patologická tekutinová kolekce mezenteria, diferenciální diagnostika mezenteriální cysty – kazuistika
- Sagitální typ bércové amputace u pacientů se syndromem diabetické nohy
- Poranenia extenzorového aparátu v zóne I – mallet deformita
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

