-
Medical journals
- Career
Karcinom prsu u nemocné po transplantaci ledviny – kazuistika
: M. Vachtová; V. Třeška; B. Sůvová; O. Hes 1; D. Ebelenderová 2
: Chirurgická klinika FN a LF UK v Plzni, prof. MUDr. Vladislav Třeška, DrSc. ; Šiklův patologicko-anatomický ústav, prof. MUDr. Michal Michal 1; Radiodiagnostická klinika, doc. MUDr. Boris Kreuzberg, CSc. 2
: Rozhl. Chir., 2009, roč. 88, č. 11, s. 687-690.
: Monothematic special - Original
Úvod:
Transplantace ledvin bezpochyby zlepšuje kvalitu života nemocných v chronické renální insuficienci. Pro kvalitní dlouhodobou funkci transplantované ledviny a dlouhodobé přežívání nemocných má zásadní význam imunosupresivní léčba, která však může být zejména při dlouhodobém podávání zatížena řadou komplikací. K takovým patří především komplikace infekčního charakteru a v neposlední řadě podstatně vyšší výskyt malignit v populaci transplantovaných nemocných v porovnání s běžnou populací.
Co se týká vzniku de novo karcinomu prsu po transplantaci, medián výskytu se pohybuje kolem 56 měsíců. Studiemi není prokázána jednoznačně zvýšená incidence, ale imunosuprese je příčinou vyšší biologické aktivity vlastního nádoru a častějšího postižení axilárních mízních uzlin, což vede ke kratšímu celkovému přežívání pacientek v porovnání s běžnou ženskou populací.Kazuistika:
Prezentujeme 65letou nemocnou po transplantaci kadaverózní ledviny před 7 lety, od té doby trvale na imunosupresivní léčbě. Osm let je v péči poradny mléčné žlázy, kam byla zařazena po komplexním vyšetření před zařazením na čekací listinu pro mammograficky zjištěné mikrokalcifikace v pravém prsu. Sedm let po transplantaci došlo ke vzniku karcinomu v pravém prsu. Na Chirurgické klinice FN v Plzni podstoupila operační řešení a následně byla předána do péče onkologů. Nefrology nebyla při dosud dobře fungujícím štěpu a celkově dobrém stavu indikována graftektomie. Nemocná byla v perioperačním období zajištěna zavedenou imunosupresivní léčbou, v níž pokračuje i pooperačně.Závěr:
Celkový rizikový profil pacienta po orgánové transplantaci ke vzniku malignity tvoří současně faktory imunologické, ale i tzv. neimunologické. Mezi ně patří věk, faktory genetické, životní prostředí, expozice radiačnímu a slunečnímu záření a kouření cigaret. Pod pojem imunologické faktory spadá ovlivnění především buněčné složky imunity dlouhodobým užívání imunosupresiv, ovlivnění normální lymfoproliferace buněk zajišťující onkologický dohled, vytváření podmínek pro vznik buněčných mutací a autonomního chování těchto buněk a v neposlední řadě ovlivnění i humorální složky imunity vedoucí k dysregulaci potenciálně maligních buněčných mutací v důsledku virových infekcí.
Vzniku malignity po transplantaci nelze stejně jako u běžné populace zabránit, nicméně při znalostech hlavních rizikových faktorů by mělo být snahou jejich incidenci snižovat a v případě jejího vzniku včas diagnostikovat a adekvátně léčit. Každého pacienta, který podstoupí transplantaci orgánu je nutné chápat jako rizikového ze stran vzniku malignity, což by mělo vést ke zvýšené onkologické ostražitosti a zařazení do screeningových programů, včetně pravidelných klinických i laboratorních kontrol zaměřených nejen na fungování transplantovaného orgánu.Klíčová slova:
karcinom prsu – transplantace ledviny – imunosupresivní léčba – rizikové faktoryÚVOD
Transplantace ledvin bezpochyby zlepšuje kvalitu života nemocných v chronické renální insuficienci. Pro kvalitní dlouhodobou funkci transplantované ledviny a dlouhodobé přežívání nemocných má zásadní význam imunosupresivní léčba, která však může být zejména při dlouhodobém podávání zatížena řadou komplikací. K takovým patří především komplikace infekčního charakteru a v neposlední řadě podstatně vyšší počet malignit v populaci transplantovaných nemocných v porovnání s běžnou populací. Udává se, že v souvislosti s dlouhodobou imunosupresí se riziko vzniku nádorového onemocnění zvyšuje průměrně 3,6krát oproti běžné populaci a že až 25 % pacientů přežívající 20 let po transplantaci onemocní rakovinou [1, 11]. Na druhé straně zvýšené riziko malignity je popisováno i u nemocných před transplantací ledviny, kteří jsou dialyzováni, oproti běžné populaci je jejich riziko 1,4krát vyšší [10].
Druhým důležitým, nicméně neovlivnitelným rizikovým faktorem je věk nemocných, který díky transplantaci orgánů stoupá. Co se týká zastoupení jednotlivých typů nádorů, pak na prvních místech stojí nádory, jejichž etiologie je spojována s virovou infekcí. Jedná se o non melanomové kožní nádory, jejichž riziko vzniku je až 7,4krát vyšší v porovnání s běžnou populací, non Hodgkinský lymfom i ostatní lymfoproliferativní nádory, Kaposiho sarkom, u žen nádory děložního hrdla, nádory dutiny ústní, z nádorů solidních orgánů nádory jater [6,7]. Infekčními agens těchto nádorů jsou virus Epsteina-Barrové (EBV), lidský herpetický virus 8, lidský papilomavirus a virus hepatitidy B a C [1, 3]. Z orgánových malignit je nejvyšší riziko postižení urogenitální traktu žen i mužů, nádory štítné žlázy a příštítných tělísek [4, 8, 9].
V populaci nejčastěji zastoupené maligní nádory (střevo, prs, prostata, plíce) mají po 3 letech po transplantaci s trvalou imunosupresivní léčbou 2krát vyšší riziko svého vzniku [8, 9]. Co se týká konkrétně vzniku de novo karcinomu prsu po transplantaci, medián výskytu se pohybuje kolem 56 měsíců. Studiemi není prokázána jednoznačně zvýšená incidence, ale imunosuprese je příčinou vyšší biologické aktivity vlastního nádoru, časnějšího a častějšího postižení axilárních mízních uzlin, což vede ke kratšímu celkovému přežívání pacientek v porovnání s běžnou ženskou populací[2].
KAZUISTIKA
Žena, narozena v roce 1944, podstoupila v roce 2002 transplantaci kadaverózní ledviny pro chronickou renální insuficienci (CHRI) na podkladě chronické tubulointersticiální nefritidy. Poprvé byla vyšetřena v naší prsní poradně v roce 2001 na doporučení nefrologa pro náhodný nález mikrokalcifikací na mamogramu pravého prsu před zařazením na čekací listinu. V diferenciální diagnóze bylo pomýšleno na možnou maligní etiologii, popřípadě na benigní kalcifikace při hyperparatyreóze při CHRI.
Při klinickém vyšetření nebyla shledána žádná patologie, sonograficky vyloučena přítomnost podezřelého ložiska. O rok později nemocná podstoupila uvedenou transplantaci, po níž byla zahájena imunosupresivní léčba trvající doposud. Po 5 měsících byla změněna imunosupresivní léčba ze Sandimmunu na Prograf pro jeho intoleranci. Nyní dlouhodobě užívá v kombinaci Prograf (tacrolimusum) 1,5 mg 2krát denně a Cellcept (mofetilis mycophenolas) 500 mg 2krát denně. K následující mammologické kontrole se dostavila až po 4 letech, resp. 2 letech po transplantaci. Podle kontrolní mamografie přibylo mikrokalcifikací, které radiodiagnostikem nebyly hodnoceny maligně, sonografické vyšetření (USG) opět bez průkazu solidního ložiska, klinický nález rovněž bez patologie. Až do letošního roku (2009) nemocná docházela k pravidelným klinickým i grafickým vyšetření (mamografie 1x za 2 roky, USG každoročně). Podle poslední mamografie již bylo přítomno ložisko velikosti 17x11x7 mm s mikrokalcifikacemi v místě původně popisovaném, nyní již se satelitním ložiskem v centru prsu (Obr. 2). Na USG tomuto místu odpovídala popisovaná maligně vyhlížející laločnatá léze. Nemocná byla indikována k odběru biopsie pod USG kontrolou (Obr. 1), histolog verifikoval invazivní duktální karcinom.
1. Core-cut biopsie pod USG kontrolou 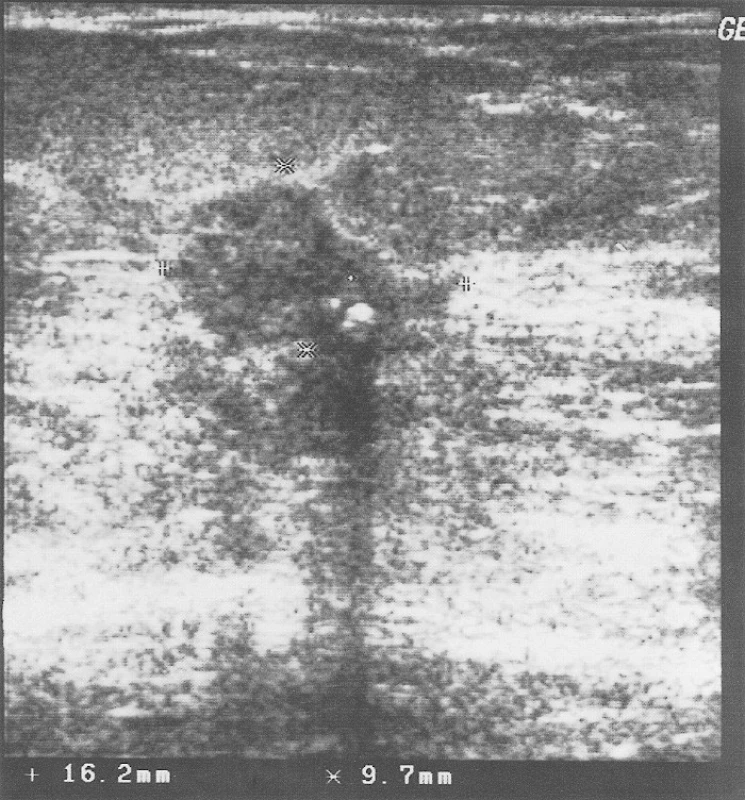
2. Mammogram pravého prsu: maligní léze s mikrokalcifikacemi a satelitním ložiskem 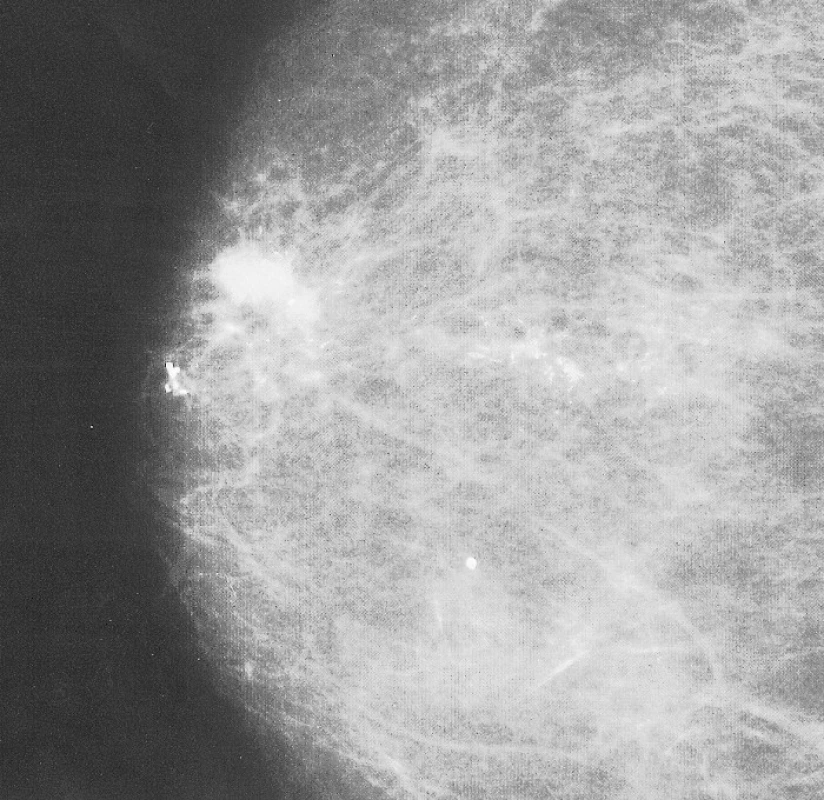
Následující týden po stanovení diagnózy byla nemocná operována, původní indikace byla k záchovné operaci s exstirpací sentinelové uzliny. Nicméně opakovanou peroperační biopsií resekátu jsme nebyli schopni zajistit dostatečný bezpečnostní okraj pro multicentrický tumor s dalšími ložiskami karcinomu in situ (CIS). I s přihlédnutím na anamnestické údaje jsme se rozhodli provést amputační výkon. Při peroperačním odečítání sentinelové uzliny bylo zjištěno metastatické postižení, byli jsme nuceni dokončit disekci axily.
Z definitivního bioptického vyšetření se jednalo o špatně diferencovaný multicentrický duktální invazivní karcinom v několika částech s ložisky CIS. Exprese estrogenových i progesteronových receptorů byla do 5 %, vysoká proliferační aktivita a slabě pozitivní exprese c-erbB2. V resekátu z axily bylo nalezeno 16 uzlin, z nichž 11 bylo infiltrováno metastázou uvedeného karcinomu. Nemocná se zhojila bez komplikací a byla předána k další léčbě na onkologické pracoviště. Zde bude následovat ozáření stěny hrudní, adjuvantní chemoterapie nebyla indikována vzhledem k předchozí transplantaci dosud fungujícího štěpu. Laboratorní hodnoty renálních testů jsou dlouhodobě velmi uspokojivé (kreatinin 110,0 mmol/l, urea 6,6 mmol/l), kalium 4,2 mmol/l, kalcium 2,76 mmol/l, clearence kreatininu 1,57 ml/s a denní diuréza je cca 3000–3500 ml/24 h.
DISKUSE
Jak známo, karcinom prsu je nejčastějším maligním onemocněním žen, ale právě zlepšující se osvětou, diagnostikou a časnou multidisciplinární léčbou nestojí na prvním místě v příčinách úmrtí. Je zajímavé, že u nemocných po orgánové transplantaci není zvýšený výskyt karcinomu prsu v porovnání s výskytem u běžné, imunosupresivní léčbou nezatížené populace.
Celkový rizikový profil pacienta po orgánové transplantaci ke vzniku malignity tvoří současně již zmíněné faktory imunologické, ale i tzv. neimunologické. Mezi ně patří věk, faktory genetické, životní prostředí, expozice radiačnímu a slunečnímu záření a kouření cigaret [1]. V zastoupení jednotlivých typů nádorů jsou geografické rozdíly související právě s prevalencí virových infekcí [3]. Pod pojem imunologické faktory spadá ovlivnění především buněčné složky imunity dlouhodobým užívání imunosupresiv, ovlivnění normální lymfoproliferace buněk zajišťující onkologický dohled, vytváření podmínek pro vznik buněčných mutací a autonomního chování těchto buněk a v neposlední řadě ovlivnění i humorální složky imunity vedoucí k dysregulaci potenciálně maligních buněčných mutací v důsledku virových infekcí [1].
Vzniku malignity po transplantaci nelze stejně jako u běžné populace zabránit, nicméně při znalostech hlavních rizikových faktorů by mělo být snahou jejich incidenci snižovat a v případě jejího vzniku včas diagnostikovat a adekvátně léčit. Co se týká imunosupresivní léčby, s ohledem na celkový stav nemocného, je doporučována po 45. roce věku redukce dávky imunosupresiva a po 60. roce věku úplná minimalizace dávky [1, 5]. Každého pacienta, který podstoupí transplantaci orgánu je nutné chápat jako rizikového ze stran vzniku malignity, což by mělo vést ke zvýšené onkologické ostražitosti a zařazení do screeningových programů, včetně pravidelných klinických i laboratorních kontrol zaměřených nejen na fungování transplantovaného orgánu.
Podle dosavadních zkušeností odstranění transplantovaného štěpu ledviny při malignitě jiného orgánu nepřináší profit pro nemocného, naopak vrácení nemocného zpět do dialyzačního programu zvyšuje mortalitu o 20–30 %. Proto u nádorů solidních orgánů není v případě dobře fungujícího štěpu indikována graftektomie, rozporuplný názor je u malignit lymfoproliferativních a u nádorů uroteliálních, kde záleží především na lokalizaci a stupni pokročilosti maligního onemocnění. Po vyřešení de novo vzniklého maligního onemocnění jsou nemocní ponecháváni na imunosupresivní léčbě, v níž jsou využívány preparáty s antiproliferativním, resp. antikancerogenním účinkem (sirolimus).
Práce byla podpořena grantem IGA MZ ČR NS 10238-3/2009.
MUDr. Monika Vachtová
Jižní Svahy 805
330 27 Vejpnice
e-mail: vachtovam@fnplzen.cz
Sources
. Dantal, J. De novo post-transplantation malignancies: incidence and risk factors. Cancer Treat Res., 2009; 146 : 11-21.
2. Buell, J. F., Hanaway, M. J., Trofe, J., Gross, T. G., Beebe, T. M., Alloway, R. R., First, M. R., Woodle, E. S. De novo breast cancer in renal transplant recipients. Transplant. Proc., 2002 Aug; 34(5): 1778–1779.
3. Haberal, A. N., Süren, D., Demirhan, B., Bilezikći, B., Celasun, B., Haberal, M. Evaluation of posttransplantation malignancies compared with de novo tumors. Transplant. Proc., 2007 May; 39(4): 1057–1062.
4. Vajdic, C. M., van Leeuwen, M. T. Cancer incidence and risk factors after solid organ transplantation. Int. J. Cancer, 2009 Oct. 15;125(8): 1747–1754.
5. Andrés, A. Cancer incidence after immunosuppressive treatment following kidney transplantation. Crit. Rev. Oncol. Hematol., 2005 Oct; 56(1): 71–85.
6. Gómez-Roel, X., León-Rodríguez, E. Malignant neoplasias in renal transplantation recipients. Rev. Invest. Clin., 2005 Mar-Apr; 57(2): 225–229.
7. Yang, T. C., Shu, K. H., Cheng, C. H., Wu, M. J., Lian, J. D. Malignancy following renal transplantation. Zhonghua Yi Xue Za Zhi (Taipei), 1998 May; 61(5): 281–288.
8. Veroux, P., Veroux, M., Puliatti, C., Amodeo, C., Makarone, M., Cappello, D., Cagli@, P. Early de novo neoplasia after renal transplantation. Tumori, 2003 Jul-Aug; 89(4 Suppl): 301–304.
9. Stratta, P., Morellini, V., Musetti, C., Turello, E., Palmieri, D., Lazzarich, E., Cena, T., Magnani, C. Malignancy after kidney transplantation: results of 400 patients from a single center. Clin. Transplant., 2008 Jul-Aug; 22(4): 424–427.
10. JAMA and Archives Journals (2006, December 20). Kidney Transplantation Linked With Increased Risk Of Various Cancers. ScienceDaily. Retrieved September 28, 2009. Dosputný na www.sciencedaily.com¬ /releases/2006/12/061219170712.htm.
11. John Wiley & Sons, Inc. (2005, September 27). Kidney Transplant Patients Face Higher Cancer Risk. ScienceDaily. Retrieved September 28, 2009. Dostupný na www.sciencedaily.com/releases/2005/09/050926074404.htm.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2009 Issue 11-
All articles in this issue
- Endovascular Treatment of Spontaneous Hemothorax in Patient with Neurofibromatosis Type I
- Pacient s entrapment syndrómom a. poplitea a infekčnou endokarditídou (kazuistika)
- Endoscopic Collection of V. Saphena Magna – Early Complication Rates
- Gastrointestinální stromální tumor – analýza vlastní sestavy pacientů, přehled literatury
- Cervical Disc Arthroplasty (Prodisc-C): Analysis of 3 to 4- Year Follow Up Results
- Prolonged Prophylaxis of Thromboembolic Disease in Patients with Colorectal Surgical Resections for Malignancy
- Case Report: Fat Embolism Syndrome – Grave Handicap after Traumatic Long-bones Fractures
- Peritonitides Caused by Gastrointestinal Perforations – Analysis of an Elderly Patient Group
- Experimental Small Intestine Transplantation
- Transgastric and Transrectal Hybrid NOTES Cholecystectomy – Experimental Study
- Laparoscopic Surgery for Rectal Carcinoma – Long-Term Outcomes
- Traumatic Brain Injuries – Effects of Alcohol and Coffein on Intracranial Pressure and Cerebral Blood Flow
- Carcinoma in a Female Patient after Kidney Transplantation – A Case Review
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Case Report: Fat Embolism Syndrome – Grave Handicap after Traumatic Long-bones Fractures
- Traumatic Brain Injuries – Effects of Alcohol and Coffein on Intracranial Pressure and Cerebral Blood Flow
- Pacient s entrapment syndrómom a. poplitea a infekčnou endokarditídou (kazuistika)
- Cervical Disc Arthroplasty (Prodisc-C): Analysis of 3 to 4- Year Follow Up Results
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

