-
Medical journals
- Career
Endovaskulární léčba spontánního hemotoraxu u neurofibromatózy I. typu
Authors: V. Chovanec 1; Miroslav Lojík 1; V. Koblížek 2; J. Vojáček 3; J. Ruta 2; O. Renc 1
Authors‘ workplace: Radiologická klinika LF UK FN, Hradec Králové, přednosta prof. MUDr. P. Eliáš, CSc. 1; Plicní klinika LF UK FN, Hradec Králové, přednosta doc. MUDr. F. Salajka, CSc. 2; Kardiochirurgická klinika LF UK FN, Hradec Králové, přednosta doc. MUDr. J. Harrer, CSc. 3
Published in: Rozhl. Chir., 2009, roč. 88, č. 11, s. 615-619.
Category: Monothematic special - Original
Overview
Autoři prezentují případ mladého muže s neurofibromatózou I. typu, u kterého vznikl spontánní levostranný hemotorax. V diagnostice měla klíčovou roli CT angiografie, protože objevila pseudoaneuryzma truncus thyreocervicalis. Tato tepna včetně vaku pseudoaneuryzmatu byla následně endovaskulárně embolizována akrylátovým lepidlem. Pacient je tři měsíce bez známek recidivy krvácení.
Klíčová slova:
neurofibromatóza – spontánní hemotorax – embolizaceÚVOD
Neurokutánní syndromy neboli fakomatózy zahrnují početnou heterogenní skupinu dědičných onemocnění, které se manifestují kožními projevy, postižením centrální nervové soustavy, změnami pojiva a viscerálními projevy. Mezi nejvýznamnější neurokutánní syndromy patří neurofibromatóza, encefalotrigeminální angiomatóza (Sturgeův-Weberův syndrom), tuberózní skleróza (Bournevillova nemoc) a retinocerebelární angiomatóza (von Hippelova-Lindauova nemoc). Neurofibromatóza (NF) je nejčastěji se vyskytující neurokutánní syndrom [1]. Má 8 typů, ze kterých se nejvíce vyskytuje I. typ tzv. von Recklighausenova choroba. Cévní postižení se u neurofibromatózy I. typu vyskytuje v 3,6 % případů [1–4].
KAZUISTIKA
Muž, 37 let, s neurofibromatózou I. typu diagnostikovanou v dětství byl přijat do spádové nemocnice pro kolaps. Ztráta vědomí následovala po náhle vzniklé bolesti levého ramene propagující se pod lopatku. Při přijetí měl oslabené dýchání vlevo a na snímku hrudníku částečné zastření levého hemitoraxu. Následně provedené CT vyšetření s intravenózně aplikovanou kontrastní látkou odhalilo zahuštěnou tekutinu v levé pleurální dutině (55-60 HU) s kompresí plíce, ale nezobrazilo zdroj krvácení. Pacient podstoupil punkci, při které aspirováno 1100 ml silně krvavé tekutiny. Stav uzavřen jako těžší hemoragická pleuritida. Nemocný byl stabilní a postupně rehabilitoval. Za tři dny měl opětovný kolaps s hypotenzí 70/40 mm Hg a poklesem v krevním obraze – erytrocyty 3,18x1012/l, hematokrit 0,27; hemoglobin 98 g/l. Pro podezření na opakované krvácení do pleurální dutiny byl pacient přeložen do naší nemocnice na oddělení urgentní medicíny, odkud byl po vyšetření a konzultaci kardiochirurgem přijat na plicní jednotku intenzivní péče. Při přijetí byl hemodynamicky stabilní s krevním tlakem 129/84 mm Hg, ale anemický s hematokritem 0,248, erytrocyty 2,98x1012/l a hemoglobinem 85 g/l. Postupně dostal tři erytrocytární masy. Při fyzikálním vyšetření byly na kůži přítomné skvrny bíle kávy, četné kožní nádory – neurofibromy a viditelná výrazná skolióza hrudní páteře. Na našem pracovišti proveden kontrolní snímek hrudníku (Obr. 1) a CT vyšetření (Emotion 6, Siemens, Erlangen, Německo) včetně CT angiografie, na které se z větve levé podklíčkové tepny plnila malá dutina průměru 12 mm uložená vysoko ve vrcholu levého hemitoraxu (Obr. 2A, B). Nález hodnocen jako falešné aneuryzma, protože na předchozím CT vyšetření nebyla ani při retrospektivním hodnocení patrná daná dutina. Pseudoaneuryzma bylo považovalo za příčinu krvácení, a proto byla indikována digitální subtrakční angiografie (Axiom Artis, Siemens, Erlangen, Německo) s následnou superselektivní embolizací. Angiografie potvrdila CT nález (Obr. 3A). Přívodná tepna byla nasondována diagnostickým DAV katétrem (William Cook Europe, Bjaeverskov, Dánsko), do kterého byl koaxiálně zaveden mikrokatétr Progreat (Terumo Europe N.V., Leuven, Belgie) (Obr. 3B). Vak pak uzavřen nevstřebatelným materiálem, který tvořila směs akrylátového lepidla (Histoacryl, B Braun Aesculap, Tuttlingen, Německo) a olejové kontrastní látky (Lipiodol Ultrafluid, Guerbet, Ceres, Francie). Lepidlo se dostalo i do větví za falešnou výduť, a tím se zabránilo eventuálnímu retrogradnímu plnění. Po kontrolní angiografii levé podklíčkové tepny (Obr. 3C) byl vpich v pravém třísle uzavřen perkutánním lepícím zařízením Angioseal (St Jude Medical Europe, Zaventem, Belgie). Pro riziko vzniku fibrotoraxu hrudní chirurg za dva dny po embolizaci videotorakoskopicky evakuoval 3 200 ml krvavé tekutiny a koagula z levé pleurální dutiny. Po výkonu přetrvávala u pacienta zhoršená ventilace s nutností bronchoskopického odsátí dýchacích cest, po které se dýchaní zlepšilo. Nemocný rehabilitoval a za 18 dní od přijetí byl propuštěn do domácí péče v dobrém stavu (Obr. 4). Nemocný má 3 měsíce po embolizaci bolesti v oblasti jizvy po torakoskopii, které jsou pouze při námaze.
Image 1. Snímek hrudníku při přijetí, na kterém je patrné zastření téměř celého levého hemitoraxu Fig. 1 Admission chest x-ray, with opacity covering nearly all of the left hemithorax 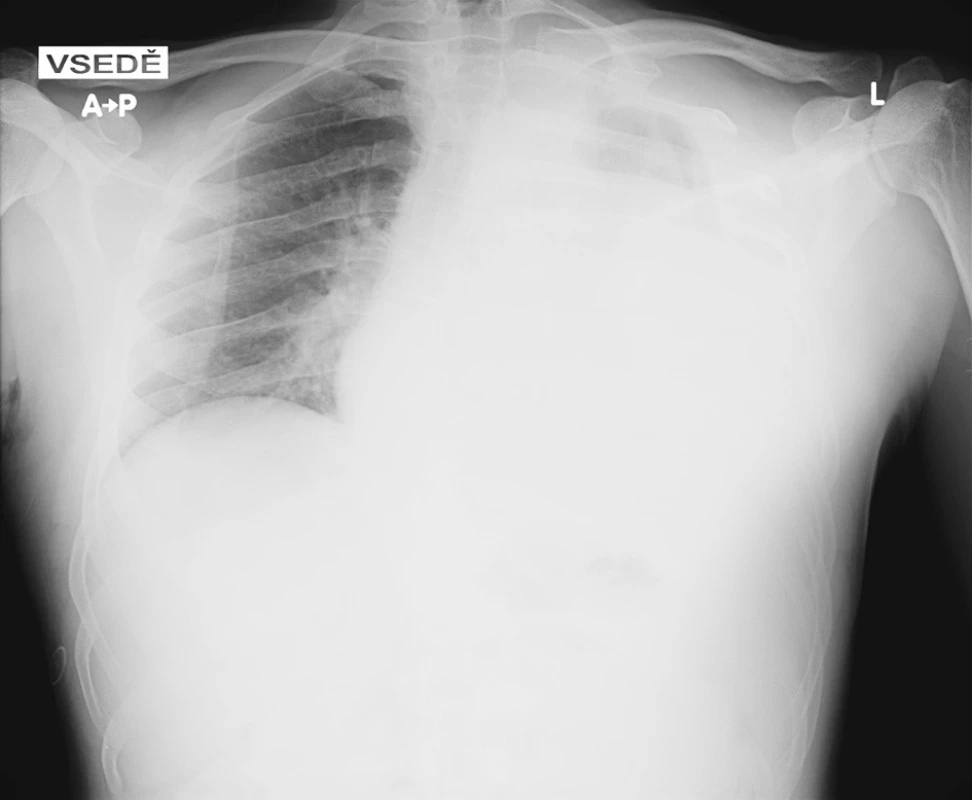
Obr. 2. Multiplanární rekonstrukce z CT angiografie. Předozadní (A) a bočný pohled (B). Uzavřená šipka označuje vak pseudoaneuryzmatu, otevřená a. subclavia sinistra Fig. 2. CT angiography multiplanar reconstruction images (MPR). Frontal (A-P) (A) and lateral (B) views. The closed arrow marks a pseudoaneurysm sac, the open arrow points at left subclavian artery 
Obr. 3. Angiogram arteria subclavia sinistra před embolizací (A), na kterém se opacifikuje dutina falešné výdutě. Superselektivní angiogram koaxiálně zavedeným mikrokatétrem(B). Kontrolní nástřik levé podklíčkové tepny po embolizaci(C) Fig. 3. Angiogram of the left subclavian artery, performed prior to embolization (A), with the pseudo-aneurysm sac opacity. A superselective angiographic view with coaxial introduction of a microcatheter (B). Postembolization control contrast injection into the left subclavian artery (C) 
Image 2. Snímek hrudníku před propuštěním. Při porovnání se vstupním snímkem je zřejmá regrese zastření levé poloviny hrudníku. V plicním vrcholu vlevo je viditelný kontrastní stín embolizačního materiálu v pseudoaneuryzmatu a větvích truncus thyreocervicalis (šipka) Fig. 4. Chest x-ray, prior to discharge from hospital. Regression of the left thoracic opacity is apparent, compared to the admission views. In the left pulmonary apex, the embolization material is within the pseudo- aneurysm and branches of the thyreocervical trunk (arrow) 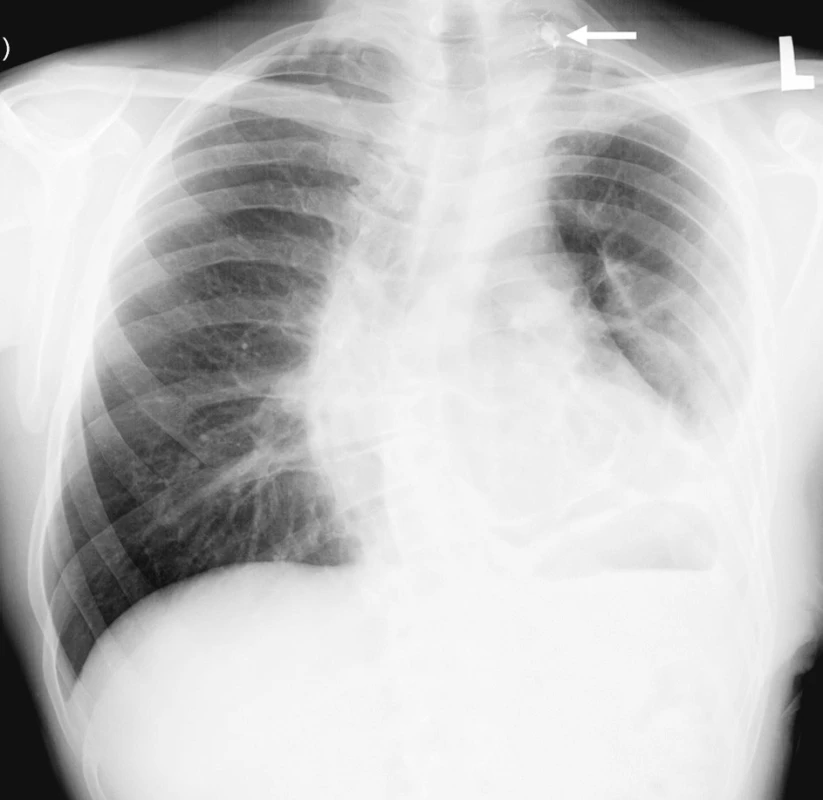
DISKUSE
Neurofibromatózu 1. typu, periferní, popsal poprvé patolog Friedrich Daniel von Recklinghausen v roce 1882. Jedná se o nejčastější formu NF s četností výskytu 1 : 3000 živých porodů. Jde o dysplazii mezodermální a neuroektodermální tkáně, která má sklon k difuznímu systémovému postižení. Onemocnění je autozomálně dominantně dědičné a postihuje stejně obě pohlaví [1, 2]. Nemoc má variabilní klinické projevy a to i v rámci jedné rodiny nesoucí alelu se stejnou mutací genu pro NF 1. Produktem genu NF 1, který je na dlouhém raménku 17. chromozomu, je protein neurofibromin. Neurofibromin funguje jako akcelerátor hydrolýzy aktivního guanosintrifosfátu na neaktivní guanosindifosfát. Tím se redukuje signalizace ke stimulaci buněčného růstu. U nemocných s neurofibromatózou jsou alely daného genu nefunkční, a tím je hladina guanosintrifosfátu vyšší, co vede k zvýšenému buněčnému růstu. Gen NF 1 má jednu z nejvyšších mutačních rychlostí známých u lidské nemoci, což vede k tomu, že kolem 50 % případů NF 1 je nových tj. spontánně vzniklých na základě de novo mutace genu pro NF 1 [2, 5]. Nyní již probíhá jak DNA tak RNA diagnostika genu NF 1, protože se jedná o dědičné onemocnění, které svého nositele stigmatizuje. Klinická diagnostická kritéria definoval Národní institut zdraví Spojených států na konferenci o neurofibromatóze v roce 1987 a o deset let později je doplnili Gutmann a spolupracovníci [5]. Musí být přítomny minimálně dva z následujících příznaků:
- šest nebo více skvrn bíle kávy (cafe-au-lait) s průměrem víc než 5 mm před pubertou nebo 15 mm po pubertě,
- dva nebo více neurofibromů nebo jeden plexiformní neurofibrom,
- pigmentace v podpaží nebo v tříslech,
- gliomy optického nervu,
- dva a více pigmentových hamartomů duhovky tzv. Lischových uzlíků,
- anomálie skeletu (dysplazie klínové kosti, kyfoskolióza, zhrubělá kompakta dlouhých kostí, difuzní zúžení žeber, rozšíření intervertebrálních foramin),
- příbuzný 1. stupně s diagnostikovanou NF 1.
Často se u ní vyskytují hamartomy centrální nervové soustavy, vrozené srdeční vady a bývá spojena i se syndromem mnohočetných endokrinních neoplazií – MEN 2b, který zahrnuje feochromocytom, medulární karcinom štítné žlázy a mnohočetné neurinomy [2]. Nemoc zkracuje délku života v průměru o 15 let a nemocní by měli být dispenzarizováni. U NF 1 se vyskytuje spontánní masivní krvácení, které může být způsobeno různými mechanismy – vaskulopatií nebo přímou infiltrací mezenchymálním tumorem jako je neurofibrom, ganglioneurom. Předpokládá se, že určitý stupeň vaskulopatie mají všichni nemocní s neurofibromatózou 1. typu [6]. Postižení cévní stěny zahrnuje proliferaci intimy, oslabení a fragmentaci medie a muscularis, vede k oslabení cévní stěny a ke zvýšení její fragility. Většina těchto lézí je klinicky asymptomatická. Oslabení cévní stěny může vést k tvorbě aneuryzmatu, případně i ke vzniku arteriovenózní fistule, proliferace intimy ke stenóze nebo okluzi příslušné cévy. Cévní projevy se vyskytují u 3,6 % nemocných s NF typu I a jedná se o stenózy (např.: extra a intrakraniální tepny – moya-moya fenomén, renální tepny, koarktace aorty) a/nebo aneuryzmata (např.: renální, interkostální, vertebrální tepny) [2–7]. Nemocní mívají často hypertenzi, která je způsobena stenózou ledvinné tepny nebo feochromocytomem [2]. Krvácení je vzácné, a pokud se vyskytne, jedná se nejčastěji o hemotorax. V úvodu je krvácení extrapleurální, po naplnění tohoto prostoru dochází k ruptuře pleury a rozvoji hemotoraxu.
Hemotorax je definován přítomností krve v pleurální dutině a jedná se o závažný stav, který může skončit i fatálně. Příčiny jsou různé a je možné jejich dělení na traumatické (úrazové a iatrogenní) a netraumatické (spontánní). Spontánní hemotorax je méně častý, nejčastěji se vyskytuje u spontánního pneumotoraxu (3–7 % spontánních pneumotoraxů je komplikováno hemotoraxem). Další příčiny lze rozdělit na poruchy koagulace (vrozené, získané), cévní (aortální disekce, arteriovenózní malformace, aneuryzma, neurofibromatóza, Ehlers-Danlos IV), tumorózní (plicní, cévní tumory, schwanom, mezoteliom atd.), různé (exostózy, extramedulární hemopoéza, endometrióza, plicní sekvestrace atd.) [3]. V určení příčiny a místa krvácení má v současnosti hlavní úlohu multidetektorové CT, které zcela nahradilo diagnostickou digitální subtrakční angiografii [3, 4, 8–10].
Léčba může být:
- a) konzervativní – náhrada krve a tekutin, klidový režim, hrudní drén,
- b) chirurgická – torakotomie, ošetření místa krvácení, evakuace koagul a eventuální rekonstrukční operace pokud krvácí velká céva a nelze primárně provést suturu místa krvácení pro fragilitu dané tepny,
- c) endovaskulární přístup, který zahrnuje embolizaci nejčastěji spirálkami, méně často s využitím akrylátového lepidla. Kromě výplně vaku se používá i trapping technika, tj. uzávěr tepny za a před vakem, sloužící k prevenci možnosti retrográdního plnění vaku aneuryzmatu. Při postižení tepny, kterou nelze uzavřít bez rizika vzniku ischemie (např. podklíčková tepna), je na zvážení zavedení dostatečně dlouhého stentgraftu.
V literatuře je popsáno 12 případů perkutánní embolizace hemotoraxu u neurofibromatózy s mortalitou 16,7 % [7–15]. Nejčastěji se jednalo o krvácení na podkladě výdutě a. intercostalis (6x) [7, 8, 10, 11, 14]. Publikovaná celková mortalita je 36%, u chirurgické léčby 33% [4].
V současnosti se doporučuje jako metoda 1. volby terapie endovaskulární léčba [3, 4, 7–10]. Chirurgická intervence by měla následovat pokud perkutánní léčba není účinná anebo k jejímu doplnění, zahrnující videotorakoskopii s odstraněním koagul, které má zabranit vzniku fibrotoraxu. Fibrotorax ohrožuje nemocného snížením respiračních funkcí, které jsou často primárně sníženy přítomnou skoliózou nebo kyfoskoliózou.
ZÁVĚR
I když neurofibromatóza I. typu není časté onemocnění, je nutno si uvědomit, že je nositel ohrožen vznikem významného krvácení, nejčastěji hemotoraxu, na který se musí myslet při náhlém vzniku obtíží spojených s kolapsovým stavem. Krvácení vzniká na podkladě vaskulopatie projevující se (pseudo)aneuryzmatem anebo tumorózní infiltrací cévní stěny. V současnosti lze zdroj krvácení identifikovat CT angiografií provedenou na multidetektorových přístrojích a pokud je nemocný hemodynamicky stabilní doporučuje se endovaskulární ošetření místa krvácení embolizací s následným odstraněním koagul videotorakoskopicky.
Použité zkratky
NF – neurofibromatóza
CT – výpočetní tomografie
HU – Hounsfieldova jednotka
MUDr. Vendelín Chovanec, Ph.D.
Sokolská 581
500 05 Hradec Králové
e-mail: chovanec.v@seznam.cz
Sources
1. Eliáš, P., Žižka, J., Černoch, Z., et al. Vrozené anomálie centrální nervové soustavy. In: Černoch, Z., Eliáš, P., Krajina, A., et al.: Neuroradiologie. 1. vyd., Hradec Králové, Nucleus HK, 2001 : 119–180.
2. Dähnert, W. Brain disorders. In: Dähnert, W.: Radiology review manual. 6. vyd. Lippincott Williams Wilkins Baltimore, 2007 : 315–319.
3. Ali, H. A., Lippmann, M., Mundathaje, U., Khaleeq, G. Spontaneous hemothorax: a comprehensive review. Chest, 2008; 134 : 1056–1063.
4. Fedoruk, L. M., English, J., Fradet, G. J. Spontaneous hemothorax and neurofibromatosis: a review of lethal combination. Asian Cardiovasc. Thorac. Ann., 2007; 15 : 342–344.
5. Gutmann, D. H., Aylswoth, A., Carey, J. C., et al. The diagnostic evaluation and multidisciplinary management of neurofibromatosis 1 and neurofibromatosis 2. JAMA, 1997; 278 : 51–57.
6. Hinsch, N., Kriener, S., Ritter, R. G., et al. Fatal haemorrhage due to extensive fragility of medium and large sized arteries and veins in a young patient with neurofibromatosis 1. Cardiovasc. Patholog., 2008, 17 : 108–112.
7. Dominguez, J., Sancho, C., Escalante, E., et al. Percutaneous treatment of a ruptured intercostal aneurysm presenting as massive hemothorax in a patient with type I neurofibromatosis. J. Thorac. Cardiovasc. Surg., 2002, 24 : 1230–1232.
8. Arai, K., Sanada, J., Kurozuki, A., et al. Spontaneous hemothorax in neurofibromatosis treated with percutaneous embolization. Cardiovasc. Intervent. Radiol., 2007, 30 : 477–479.
9. Hieda, M., Toyota, N., Kakizawa, H., et al. Endovascular therapy for massive haemothorax caused by ruptured extracranial vertebral artery aneurysm with neurofibromatosis type 1. Br. J. Radiol., 2007, 80 : 81–84.
10. Kipfer, B., Lardinois, D., Triller, J., et al. Embolization of a ruptured intercostal artery aneurysm in type I neurofibromatosis. Eur. J. Cardiothorac. Surg., 2001, 19 : 721–723.
11. Sandhu, C., Sabharwal, T. Spontaneous hemothorax in patient with neurofibromatosis treated with percutaneous embolization. Cardiovasc. Intervent. Radiol., 2008, 31 : 1260–1261.
12. Kim, S. J., Kim, C. W., Kim, S., et al. Endovascular treatment of ruptured internal thoracic artery pseudoaneurysm presenting as a massive hemothorax in a patient with type I neurofibromatosis. Cardiovasc. Intervent. Radiol., 2005, 28 : 818–821.
13. Matsumoto, I., Ohta, Y., Tsunezuka, Y., et al. Treatment of intercostal arterial aneurysm in neurofibromatosis type 1. Asian Cardiovasc. Thorac. Ann., 2007, 15: e 16–19.
14. Chang, W. C., Hsu, H. H., Chang, H., et al. Spontaneous hemothorax caused by a ruptured intercostal artery aneurysm of the subclavian artery in von Recklinghausen‘s neurofibromatosis. J. Formos. Med. Assoc., 2005, 104 : 286–289.
15. Teitelbaum, G. P., Hurwitz, R. J, Esring, B. C. Hemothorax in type I neurofibromatosis. Ann. Thorac. Surg., 1998; 66 : 569–571.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2009 Issue 11-
All articles in this issue
- Endovaskulární léčba spontánního hemotoraxu u neurofibromatózy I. typu
- Pacient s entrapment syndrómom a. poplitea a infekčnou endokarditídou (kazuistika)
- Endoskopický odběr v. saphena magna – výskyt ranných komplikací
- Gastrointestinální stromální tumor – analýza vlastní sestavy pacientů, přehled literatury
- Artroplastika krční ploténky (Prodisc-C): analýza výsledků po 3–4 letech sledování
- Prodloužená profylaxe tromboembolické nemoci u pacientů po chirurgické resekci kolorekta pro malignitu
- Syndrom tukové embolie – přehled problematiky a kazuistika: závažný průběh po traumatu dlouhých kostí
- Peritonitidy způsobené perforací trávicí trubice – analýza gerontologické skupiny pacientů
- Transplantace tenkého střeva v experimentu
- Hybridní NOTES cholecystektomie transgastrickým a transrektálním přístupem v experimentu
- Laparoskopická chirurgie karcinomu rekta – dlouhodobé výsledky
- Traumatická poranění mozku – vliv alkoholu a kofeinu na intrakraniální tlak a průtok krve mozkem
- Karcinom prsu u nemocné po transplantaci ledviny – kazuistika
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Syndrom tukové embolie – přehled problematiky a kazuistika: závažný průběh po traumatu dlouhých kostí
- Traumatická poranění mozku – vliv alkoholu a kofeinu na intrakraniální tlak a průtok krve mozkem
- Pacient s entrapment syndrómom a. poplitea a infekčnou endokarditídou (kazuistika)
- Artroplastika krční ploténky (Prodisc-C): analýza výsledků po 3–4 letech sledování
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career




