-
Medical journals
- Career
Bezpečnost biologické léčby vedolizumabem a ustekinumabem podávané v průběhu gravidity pro idiopatický střevní zánět matek – multicentrická retrospektivně-prospektivní observační studie
Authors: Pipek- B. 1 3; Ďuricová D. 4,5; Mitrová K. 4,6; Bortlík M. 5,7,8; Bouchner L. 9; Březina J. 10; Douda T. 11; Drašar T. 12; Drastich P. 10; Falt P. 2; Klvaňa P. 13; Kohout P. 14; Leksa V. 15; Novotný A. 16; Svoboda P. 3,17; Škorpík J. 18; Ulbrych J. 19,20; Veinfurt M. 21; Zbořilová B. 21; Lukáš M. 4
Authors‘ workplace: Centrum péče o zažívací trakt, Nemocnice AGEL Ostrava-Vítkovice a. s. 1; II. interní klinika – gastroenterologická a geriatrická LF UP a FN Olomouc 2; Katedra interních oborů, LF OU v Ostravě 3; Klinické a výzkumné centrum pro idiopatické střevní záněty, Klinické centrum ISCARE a. s. a 1. LF UK v Praze 4; Farmakologický ústav, 1. LF UK v Praze 5; Pediatrická klinika 2. LF UK a FN v Motole, Praha 6; Oddělení gastroenterologie, Nemocnice České Budějovice, a. s. 7; Interní klinika 1. LF UK a ÚVN Praha 8; Interní oddělení, FN Plzeň 9; Klinika hepatogastroenterologie, Transplantcentrum, IKEM, Praha 10; II. interní gastroenterologická klinika LF UK a FN Hradec Králové 11; Gastroenterologie, Krajská nemocnice Liberec, a. s. 12; Beskydské Gastrocentrum, Interní oddělení, Nemocnice ve Frýdku-Místku, p. o. 13; Interní oddělení, Thomayerova nemocnice, Praha 14; Interní oddělení, Pardubická nemocnice 15; IV. interní klinika – klinika gastroenterologie a hepatologie 1. LF UK a VFN v Praze 16; Interní klinika, FN Ostrava 17; Oddělení gastroenterologie, Nemocnice Jihlava, příspěvková organizace 18; Interní oddělení, FN u sv. Anny v Brně 19; SurGal Clinic, Brno 20; Gastroenterologické oddělení, Karlovarská krajská nemocnice a. s. 21
Published in: Gastroent Hepatol 2022; 76(1): 46-54
Category:
doi: https://doi.org/10.48095/ccgh202246Overview
Úvod: Idiopatické střevní záněty (IBD – inflammatory bowel disease) jsou onemocněním převážně mladého a fertilního věku, kdy i značná část pacientek otěhotní v průběhu nemoci. Jako nejdůležitější faktor zdárného průběhu těhotenství je klidová fáze nemoci, které dosáhneme často intenzivní protizánětlivou léčbou. Vedolizumab (VDZ) a ustekinumab (UST) jsou nové monoklonální protilátky s rozdílným mechanizmem účinku. VDZ je protilátka proti a4ß7 integrinovému receptoru, UST proti interleukinu 12/23 a obě v posledních letech rozšířily spektrum biologické léčby IBD. Cíle: Prezentace výsledků multicentrické observační studie. Primárním cílem našeho sledování bylo posoudit bezpečnost VDZ a UST na průběh gravidity, vývoj plodu a novorozence. Sekundárním cílem bylo zhodnocení transplacentárního přenosu léků prostřednictvím analýzy hladin léků v pupečníkové krvi a žilní krvi matky. Metodika: Multicentrická retrospektivně-prospektivní observační studie. Demografické údaje, informace o charakteru IBD v průběhu těhotenství a detaily terapie byly získávány z preformovaného dotazníku, údaje o porodu a stavu novorozence byly doplněny z porodnické dokumentace. Ke stanovení míry transplacentárního přenosu byly měřeny hladiny VDZ a UST z odběrů pupečníkové krve a žilní krve matky v době porodu pomocí metody ELISA. Výsledky: Od března 2019 do září 2021 bylo do studie zařazeno celkem 85 dokončených gravidit u 79 pacientek z 15 center biologické léčby IBD v České republice, z nichž 36 bylo léčeno VDZ (s mediánem věku žen 32 let) a 49 UST (s mediánem věku žen 30,5 let). Ve skupině s VDZ došlo k porodům živých dětí u 32 gravidit (88,9 %), zaznamenány byly dva časné spontánní aborty a dvě instrumentálně přerušená těhotenství (4; 11,1 %). Celkem 31 dětí (93,9 %) bylo porozeno v termínu, medián porodních hmotností byl 3 097,5 g. V linii s UST bylo porozeno 39 živých dětí (79,6 %), devět těhotenství skončilo časným spontánním abortem a jedno bylo instrumentálně přerušeno (10; 20,4 %). Celkem 38 dětí (97,4 %) bylo narozeno v termínu s mediánem porodních hmotností 3 265 g. Farmakokinetické parametry byly sledovány u 44 párů novorozenec-matka (21 VDZ, 23 UST). Medián hladin VDZ v žilní krvi matky byl 7,2 mg/l, v pupečníkové krvi novorozence 4,7 mg/l (poměr hladin v pupečníku / u matky 0,66), u UST byl medián hladin u matky 4,7 mg/l a novorozence 7,9 mg/l (poměr hladin v pupečníku / u matky 1,65). Závěr: Námi prezentované výsledky pacientek léčených pro IBD a exponovaných v průběhu gravidity minimálně jedné dávce biologické léčby UST nebo VDZ jsou v souladu s dříve publikovanými údaji a potvrzují příznivý bezpečností profil nových biologik v graviditě. Vzhledem ke stále limitovaným počtům zařazených pacientek bude potřeba do budoucna ještě dalšího sledování.
Klíčová slova:
těhotenství – vedolizumab – ustekinumab – IBD – transplacentární přenos
Úvod
Idiopatické střevní záněty (IBD – inflammatory bowel disease) zahrnují Crohno - vu chorobu a ulcerózní kolitidu. Jsou chronickým zánětlivým onemocněním zažívacího traktu diagnostikovaným převážně v adolescentním a mladším dospělém věku. Plány na založení rodiny a případné těhotenství tak zasahují do léčebného schématu našich pacientek, a aby bylo předejito případným komplikacím, je potřeba graviditu plánovat do klidové fáze nemoci a pacientky již s časovým předstihem o těchto skutečnostech informovat [1,2]. Dosažení a udržení klidového stadia IBD však vyžaduje často intenzivní protizánětlivou léčbu, včetně biologické léčby. Anti-TNFa preparáty (adalimumab, infliximab) představují první typ biologické léčby IBD a jejich bezpečné použití v průběhu těhotenství je již doloženo četnými observačními studiemi [3]. V posledních několika letech se však spektrum biologické léčby IBD rozšířilo o dvě nové monoklonální protilátky s odlišným mechanizmem účinku: protilátku proti a4ß7 integrinovému receptoru – vedolizumab (VZD) – a protilátku proti interleukinu 12/23 – ustekinumab (UST) [4–6]. I když dosavadně publikované údaje neprokazují jednoznačně negativní vliv těchto nových preparátů na průběh těhotenství a vývoj plodu, vzhledem k celkovému omezenému počtu doposud studovaných pacientek chybí spolehlivá evidence o bezpečnosti této léčby v průběhu gravidity [7–13].
Metodika
Design studie a studijní populace
Jedná se o retrospektivně-prospektivní observační multicentrickou studii, která probíhala od února 2019 do září 2021 v 15 centrech biologické léčby IBD v České republice. Zařazeny byly pacientky s IBD, které byly v období 2 měsíců před koncepcí, v době koncepce nebo v průběhu gravidity exponovány minimálně 1 dávce VZD nebo UST.
Sběr dat
Data byla sbírána pomocí preformovaného dotazníku ošetřujícím gastroenterologem pacientky. Byly zaznamenány demografické a klinické charakteristiky matky související se základní nemocí před početím, výsledek gravidity, detailní informace o biologické léčbě, jako jsou dávkování, interval podávání, potřeba intenzifikace v průběhu těhotenství. Dále pak údaje o konkomitantní léčbě, nutnosti hospitalizace, nově vzniklých chorobách v průběhu gravidity, aktivitě IBD matky kdykoli v průběhu těhotenství (hodnoceno podle ošetřujícího gastroenterologa). Závěrečná část dotazníku byla věnována způsobu vedení porodu a informacích o novorozenci včetně porodní hmotnosti, délky, pohlaví, Apgar skóre, přítomnosti vrozených vývojových vad či komplikací do 30 dní od porodu. Jako zdroj informací posloužila gastroenterologická a gynekologická zdravotní dokumentace pacientky, zdravotní průkaz dítěte a přímé dotazování matky.
Druhá část studie byla zaměřena na posouzení transplacentární farmakokinetiky nových biologik. V den porodu byla odebrána žilní krev matky a pupečníkové krve novorozence pro stanovení hladiny VZD nebo UST, a tím určení míry transplacentárního přenosu léčiva do oběhu dítěte. Odběr 3–5 ml krve byl proveden do komerční odběrové soupravy pro srážlivou krev, promíchán několikanásobným převrácením zkumavky a následně po doručení do laboratoře centrifugován po dobu 10 minut, při 1 600 otáčkách za minutu a při teplotě okolí k oddělení séra. Všechny vzorky byly analyzovány v certifikovaných laboratořích.
Sérové hladiny UST a VZD byly detekovány metodou ELISA. Jedná se o testy založené na průkazu monoklonální protilátky (mAb) ustekinumabu ELISA (IG-AB121) a mAb vedolizumabu ELISA (IG-AB116), oba vyráběné společností ImmunoGuide, AybayTech Biotechnology Ltd. Tyto testy jsou založeny na stanovování protilátek specifických pro dané léčivo (lapač Ab, klon ImunoGuide IG-9C7 pro ustekinumab a klon IG-19F3 pro vedolizumab). U ustekinumabu byla nejnižší detekovatelná hladina, kterou lze odlišit od nulového standardu, 1,5 ng/ml, zatímco horní mez detekce byla 600 ng/ml. U vedolizumabu byla analytická citlivost 5 ng/ml a horní mez 6 000 ng/ml.
Statistická analýza
Byla provedena standardní deskriptivní statistická analýza, včetně distribucí frekvencí pro kategorická data, výpočtu mediánu a průměru pro spojitá data. K analýze vztahu mezi hladinami UST a VZD v pupečníkové a žilní krvi matky s gestačním týdnem posledního podání léčiva byla použita Spearmanova korelace (ρ). Hodnota p < 0,05 byla považována za statisticky významnou. Statistické analýzy byly provedeny pomocí softwaru SPSS (verze 17.0, Chicago III, USA).
Etické aspekty
Schválení centrální etické komise proběhlo před zahájením studie v lednu 2019 v Klinickém centru ISCARE a. s. v Praze (referenční číslo: 2019/II a). Všechny účastnice studie poskytly před zařazením do sledování písemný informovaný souhlas.
Výsledky
Od března 2019 do září 2021 bylo do studie zařazeno celkem 86 dokončených gravidit u 79 pacientek z 15 center biologické léčby IBD v České republice (schéma 1).
Schéma 1. Studijní populace.
Scheme 1. Study population.
Těhotenství exponované vedolizumabem
V průběhu sledovaného období bylo dokončeno 36 těhotenství u 35 pacientek léčených VZD, s rovnoměrným zastoupením obou typů IBD (18 těhotenství s Crohnovou chorobou a 18 s ulcerózní kolitidou). Medián věku žen v době koncepce byl 32 let. Většina pacientek s Crohnovu chorobou (77,8 %) měla nekomplikovaný zánětlivý typ onemocnění, polovina (50 %) ileokolické postižení a až 44,4 % nemocných mělo anamnézu proximální lokalizace Crohnovy choroby. U všech pacientek s ulcerózní kolitidou byl přítomen extenzivní typ postižení (tab. 1).
Table 1. Demografické a klinické údaje pacientek.
Tab. 1. Demographic and clinical data of patients.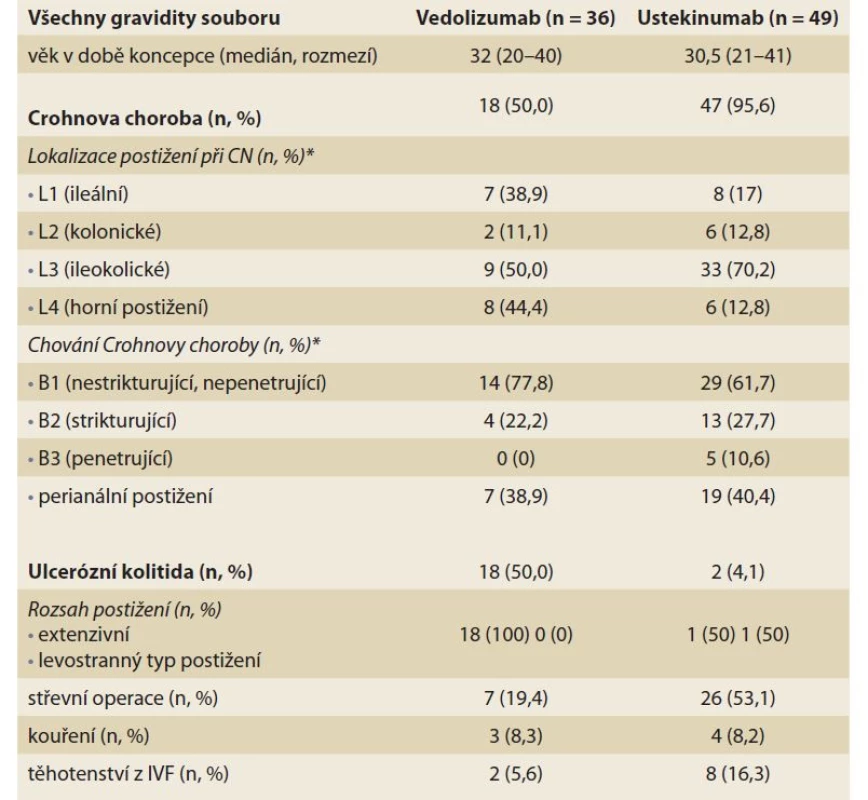
* Montrealská klasifi kace; IVF – in vitro fertilizace Průběh a výsledek těhotenství
Z 36 těhotenství exponovaných biologické léčbě VZD bylo porozeno 32 živých dětí (88,9 %) a většina dětí byla počata přirozeně (96,7 %).
Registrovali jsme čtyři (11,1 %) těhotenství, která byla ukončena předčasně. Ve dvou případech se jednalo o časné spontánní aborty do 8. t.t. gestace a u dvou nemocných došlo k umělému přerušení těhotenství z důvodu chromozomální vady typu Downova syndromu v 19. g.t. a pro vrozenou vývojovou vadu (VVV) mozku při agenesi corpus calosum v 22. g.t. Ve druhém případě se jednalo o velmi málo spolupracující pacientku, která nerespektovala doporučení pro otěhotnění v období remise svého onemocnění, nedocházela na pravidelné kontroly do gastroenterologické ambulance a nepodstoupila ani standartní screeningové vyšetření gynekologem na konci prvního trimestru těhotenství. Byla léčena pro ulcerózní pankolitidu od roku 2016, od roku 2019 intenzifikovaným VDZ v intervalu à 4 týdny, s přetrvávající aktivitou zánětu v průběhu těhotenství. Souběžně s VDZ užívala mesalazin v dávce 4 g denně, občasně analgetickou léčbu metamizolem či paracetamolem a systémové kortikoidy opakovaně odmítala.
Ve skupině těhotenství ukončených porodem bylo pět pacientek (15,6 %) léčeno intenzifikovaným režimem biologické léčby (interval aplikace po 4–6 týdnech) a u šesti nemocných (18,8 %) byla přítomna aktivita nemoci kdykoli v průběhu těhotenství. Třetina žen užívala konkomitantní léčbu azathioprinem a čtyři ženy byly léčeny topickými kortikosteroidy (12,5 %), systémové kortikosteroidy neužívala žádná pacientka. Medián gestačního týdne poslední aplikace VZD byl týden 31 (tab. 2).
Table 2. Průběh a výsledek gravidity.
Tab. 2. The course and outcome of pregnancy.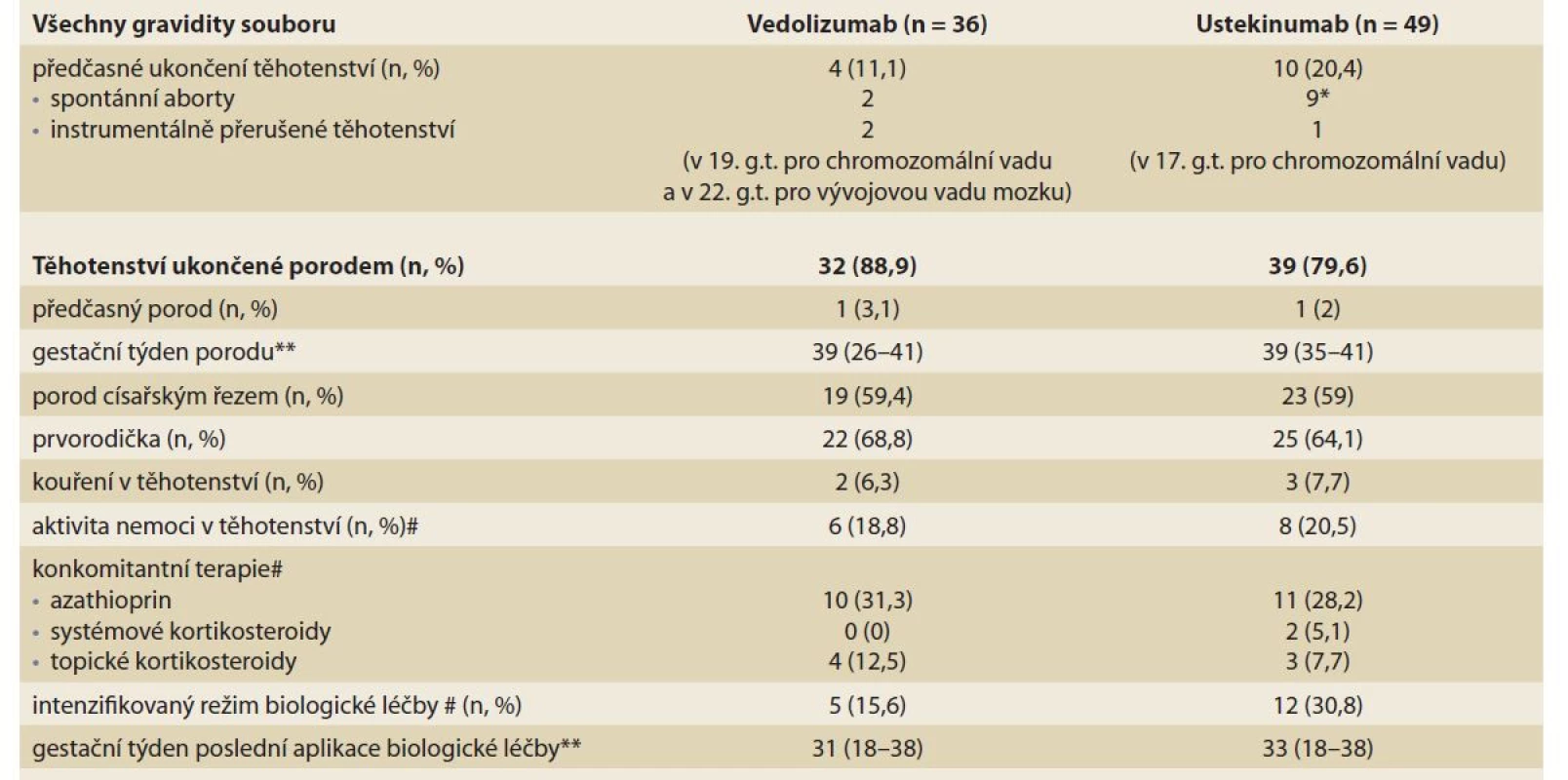
*3 časné aborty u jedné pacientky s následné zjištěnou hereditární trombofilií, #kdykoliv v průběhu těhotenství; **medián (rozmezí) Všechny děti kromě jednoho byly porozeny v termínu, císařským řezem se narodila více než polovina z nich (19; 59,4 %) a medián porodních hmotností byl 3 097 g (650–3 780). Jeden předčasný porod byl akutně ukončen císařským řezem ve 26. týdnu pro těžkou progredující preeklampsii matky a patologické průtoky plodu.
Vrozené vývojové vady byly v souboru popisovány u třech dětí (9,4 %) a jednalo se o diskrétní rozštěp rtu, hypoplazii levé ledviny a susp. sinus pilonidalis. Časné poporodní komplikace vyvinuly tři děti (9,4 %). Konkrétně šlo o:
i) protrahovanou hypoglykemii a pravostrannou streptokokovou bronchopneumonii u jednoho dítěte, s kompletní úpravou po parenterální aplikaci glukózy s hydrokortizonem a po podání antibiotické léčby;
ii) výskyt toxoalergického exantému nejasného původu;
iii) potřebu dočasné neinvazivní plicní ventilace u předčasného porodu dítěte ve 26. g.t. (tab. 3).
Table 3. Klinické údaje o novorozenci.
Tab. 3. Newborn clinical data.
*medián (rozmezí) Transplacentární farmakokinetika
Farmakokinetické parametry byly hodnoceny u 21 párů novorozenec-matka (tab. 4). Medián hladin VZD u matky byl 7,2 mg/l a v pupečníkové krvi novorozence 4,7 mg/l (poměr hladin pupečník/matka 0,66). Hladiny v pupečníkové krvi pozitivně korelovaly s mateřskými hladinami při porodu (r = 0,837; p < 0,0001) a současně s gestačním týdnem poslední aplikace (r = 0,813; p < 0,0001). Pozitivní korelaci vykazovaly i hladiny VZD v žilní krvi matky s gestačním týdnem poslední aplikace (r = 0,922; p < 0,0001). Medián gestačního týdne posledního podání VDZ byl 33, kdy nejčasněji byla biologická léčba ukončena v 1. g.t. a nejpozději v 38. g.t.
Table 4. Sérové hladiny vedolizumabu a ustekinumabu v žilní krvi matky a pupečníkové krvi v době porodu.
Tab. 4. Serum levels of vedolizumab and ustekinumab in maternal venous blood and umbilical cord blood at the time of delivery.
výsledky jsou prezentované jako medián (rozmezí), IM ratio-infant to maternal ratio – poměr hladin léčiva v pupečníku a žilní krvi matky v době porodu Těhotenství exponované ustekinumabem
Za sledované období bylo dokončeno 49 těhotenství u 44 pacientek léčených UST. Medián věku žen v době koncepce byl 30,5 let. V souboru dominovaly pacientky s Crohnovou chorobou (95,9 %) s nejčastější lokalizací zánětu v ileokolické oblasti (70,2 %). Perianální postižení kdykoli v průběhu nemoci bylo reportováno u více než třetiny léčených nemocných (40,4 %) a současný výskyt proximální lokalizace Crohnovy choroby u šesti (12,8 %) žen. Jen dvě pacientky byly léčeny UST pro ulcerózní kolitidou (tab. 1).
Průběh a výsledek těhotenství
Ze 49 gravidit exponovaných UST došlo k porodu 39 živých dětí (79,6 %). Evidovali jsme celkem deset (20,4 %) předčasně ukončených těhotenství. V devíti případech se jednalo o spontánní abort, z toho však byly tři časné potraty u jedné pacientky, u které byla následně zjištěna hereditární trombofilie jako rizikový faktor spontánních potratů. Jedno těhotenství bylo ukončeno instrumentálně pro chromozomální vadu (Downův syndrom) v 17. g.t.
Ve skupině těhotenství ukončených porodem byla třetina žen (30,8 %) léčena intenzifikovaným režimem biologické léčby (zkrácení intervalu aplikace na 4–6 týdnů) a pětina pacientek (20,5 %) měla aktivní onemocnění (tab. 2). Konkomitantní terapií azathioprinem bylo léčeno jedenáct žen (28,2 %), dvě ženy užívaly systémové (5,1 %) a tři topické kortikosteroidy (7,1 %). Medián gestačního týdne poslední aplikace UST byl týden 33 (tab. 2).
Všechny děti kromě jednoho byly porozeny v termínu s mediánem porodních hmotností 3 265 g, kdy se císařským řezem narodila více než polovina z nich (59 %). U sedmi dětí (17,9 %) byly zjištěny vrozené vývojové vady, avšak u všech až na jeden případ se jednalo o nezávažné vady (tab. 3). U jednoho novorozence byla zjištěna srdeční vada typu přetrvávajícího defektu síňového septa a současně tzv. Currarinův syndrom, který je definován jako genetická anomálie se sakrální malformací. Jednalo se o 29letou pacientku léčenou pro Crohnovu chorobu od roku 2012 a na biologické léčbě UST od roku 2020 s fyziologickým průběhem těhotenství. V průběhu těhotenství byla pacientka v remisi svého onemocnění, kromě UST neužívala žádnou jinou medikaci a nebyla léčena ani dispenzarizována v žádné odborné ambulanci.
Perinatální komplikace se objevily u tří (7,7 %) novorozenců a zahrnovaly prodlouženou poporodní adaptaci s nutností oxygenoterapie, toxoalergický exantém nejasného původu a kongenitální toxoplazmózu, která byla následně léčená daraprimem (tab. 3).
Transplacentární farmakokinetika
Farmakokinetické parametry byly sledovány u 23 párů novorozenec-matka (tab. 4). Medián hladin UST u matky byl 4,7 mg/l a v pupečníkové krvi novorozence 7,9 mg/l. Poměr hladin UST v pupečníkové krvi a v žilní krvi matky v době porodu byl 1,65.
Hladiny UST v pupečníkové krvi pozitivně korelovaly s mateřskými hladinami při porodu (r = 0,834; p < 0,0001). Pozitivní korelace byla pozorována i u hladiny UST v pupečníkové krvi s gestačním týdnem poslední aplikace (r = 0,567; p < 0,0001) a u hladiny UST v žilní krvi matky v den porodu s gestačním týdnem poslední aplikace (r = 0,767; p < 0,0001). Medián gestačního týdne posledního podání biologika byl 33, kdy nejčasněji byla biologická léčba ukončena v 18. g.t. a nejpozději v 38. g.t.
Diskuze
V této studii jsme se zabývali problematikou bezpečnosti léčby UST a VZD podávaných v průběhu těhotenství žen léčených pro IBD.
Obecné aspekty léčby Crohnovy choroby a ulcerózní kolitidy v době gravidity dominantně zahrnují plánovaní koncepce do klidové fáze onemocnění a precizní edukaci nemocných o bezpečnosti jim podávané léčby pro ně samotné i pro novorozence [14].
Všechna biologická léčiva dostupná v České republice určená pro léčbu IBD (infliximab, adalimumab, golimumab, ustekinumab a vedolizumab) jsou látky bílkovinné povahy (IgG1 monoklonální protilátky), které jsou aktivně transportovány přes placentu, a tím se dostávají i do oběhu plodu. Tento přenos začíná mezi 14. a 16. týdnem gestace a dosahuje vrcholu ve třetím trimestru těhotenství [15,16].
U anti-TNFa léčiv (infliximab, adalimumab) již máme k dispozici velké množství dat, která se týkají bezpečnosti této léčby pro samotnou pacientku, průběh těhotenství i pro novorozence, a tato biologika jsou obecně doporučována k léčbě IBD v průběhu těhotenství i kojení [1–3,17]. Dále přibývají i informace a studie prokazující dobrou bezpečnost prenatální expozice plodu anti-TNFa na dlouhodobější vývoj exponovaných dětí a riziko rozvoje infekcí [18–23].
Doposud dostupné údaje o využití VZD pro léčbu IBD v těhotenství jsou zatím limitovány počtem sledovaných pacientek. Zatím největší soubor pacientek exponovaných léčbě VDZ publikovali A. Moens et al v roce 2020, kdy prezentovali výsledky studie CONCEIVE. Jednalo se retrospektivní sledování 79 těhotenství u 73 žen léčených VDZ ve srovnání se dvěma kontrolními skupinami (těhotenství exponovaná anti-TNFa a těhotenství neexponovaná biologické ani imunosupresivní léčbě). V době koncepce mělo 36 % žen na VZD prokázánu aktivní formu IBD ve srovnání se 17 % žen v anti-TNFa skupině a 24 % ve skupině žen neléčených imunosupresivy nebo biologikem. Podíl živě narozených dětí byl signifikantně vyšší v kontrolní skupině žen neléčených imunosupresivy ani biologikem ve srovnání se skupinou exponovanou VZD (89 % kontrolní skupina vs. 78 % u pacientek léčených VZD; p = 0,038). Vyloučením pacientek s aktivitou nemoci však byly počty živě narozených dětí ve všech skupinách srovnatelné. Počet abortů byl ve všech sledovaných skupinách obdobný a riziko závažných VVV nízké (ve skupině s VDZ 5 %, v obou kontrolních skupinách 2 %) [24].
Studie CONCEIVE tak opětovně potvrdila remisi onemocnění jako základní předpoklad bezpečného průběhu těhotenství [14].
Další studie z Izraele prezentovala soubor 24 těhotenství u 21 žen exponovaných VZD. Podobně jako v předchozí studii došlo u většího počtu žen exponovaných VZD k předčasnému ukončení gravidity ve srovnání s kontrolní skupinou (37,5 vs. 0 %). Nicméně až třetina žen na VZD měla aktivní onemocnění v období koncepce ve srovnání s 13 % a 23,5 % žen v kontrolní skupině (anti-TNFa nebo konvenční terapie) [25]. Recentně byla publikována francouzská multicentrická retrospektivní studie, která srovnávala 44 těhotenství exponovaných VZD s kontrolní skupinou 76 žen na anti-TNF léčbě. K porodu živého novorozence došlo v 86 % případů léčených VZD, pět (11 %) těhotenství skončilo spontánním abortem a jedno (3 %) interrupcí. Tyto údaje byly srovnatelné s kontrolní skupinou [8].
Výsledky naší studie s 84 % graviditami ukončenými porodem živého plodu jsou v souladu s výše uvedenými údaji a podporují dobrou bezpečnost terapie VZD v průběhu gravidity.
Dostupná data o bezpečnosti UST pro léčbu IBD v těhotenství jsou obdobně jako ve skupině s VZD zatím limitována počtem sledovaných pacientek. Zatím největší soubor těhotenství exponovaných UST, který ale zatím nebyl plně publikován, zahrnoval 478 gravidit pacientek s psoriázou (334), psoriatickou artritidou (9), Crohnovou chorobu (124) a ulcerózní kolitidou (11), které byly exponovány UST 3 měsíce před koncepcí anebo v průběhu gravidity, a vycházel z údajů hlášených případů a klinických studií. Živé dítě bylo porozeno 71,3 % žen v souboru, z toho bylo 20 (5,9 %) porodů předčasných a 18,4 % žen prodělalo spontánní abort. Výskyt všech VVV byl 3,8 % (z toho 3,3 % závažných vad). Ve skupině, která byla exponována UST jen v prvním trimestru (66,5 % souboru), bylo hlášeno 65,1 % živě narozených dětí, z toho 5,3 % bylo porozeno předčasně. Ve srovnání s běžnou populací či skupinou žen léčenou anti-TNF zde nebyl pozorován signifikantní rozdíl ve frekvenci živě narozených dětí, spontánních abortů nebo VVV [26].
Francouzská multicentrická retrospektivní studie prezentovala soubor 29 pacientek léčených UST, kde 90 % žen porodilo živé dítě, v 7 % případů došlo ke spontánnímu abortu a 3 % těhotenství bylo ukončeno instrumentálně. Ani zde nebyl prokázán rozdíl v předčasných porodech, spontánních časných abortech či VVV ve srovnání s kontrolní skupinou exponovanou anti-TNFa [8]. V našem souboru žen exponovaných alespoň jedné dávce UST jsme zaznamenali 80 % těhotenství ukončených porodem živého dítěte, zatímco devět (18 %) těhotenství skončilo spontánním potratem. Nicméně tři časné aborty proběhly u jedné rizikové pacientky s následně zjištěnou hereditární trombofilií.
Záchyt jedné závažné VVV v našem souboru (2 %) je ve srovnání s předchozími studiemi nižší a jednalo se o sakrální malformaci při Currariho syndromu se současně se vyskytujícím defektem septa síní. VVV novorozence byla zachycena u pacientky-matky s Crohnovou chorobou na biologické léčbě UST od roku 2020 s fyziologickým průběhem gravidity. I v průběhu těhotenství byla pacientka v remisi svého onemocnění, kromě UST neužívala žádnou jinou medikaci a nebyla léčena ani dispenzarizována v žádné odborné ambulanci.
Druhá část studie byla zaměřena na posouzení transplacentární farmakokinetiky nových biologik u těhotných žen s IBD. Naše výsledky prokázaly odlišnou placentární farmakokinetiku obou biologik. Zatímco farmakokinetika VZD vedla k nižším hladinám v pupečníkové krvi ve srovnání s žilní krví matky v době porodu, farmakokinetika UST byla shodná s farmakokinetikou anti-TNFa léčiv. Tyto výsledky odpovídají dosavadně publikovaným (u UST zatím velmi limitovaným) údajům [27–29]. Potenciálním vysvětlením odlišného placentárního přenosu VZD by mohlo být jakési „vychytávání“ tohoto léčiva placentou. Nicméně je potřeba dalších studií k objasnění tohoto mechanizmu.
Náš soubor zahrnující 23 párů hladin UST matka/pupečníková krev je největším publikovaným souborem posuzujícím farmakokinetiku tohoto biologika. Dosud největší soubor placentární farmakokinetiky UST (celkem sedm párů novorozenec/matka) prezentovala studie Piano, s obdobným poměrem léčiva v pupečníkové krvi a žilní krvi matky v době porodu (1,4 vs. 1,65 v našem souboru).
Jedinou práci, která se zabývala clearance VDZ z oběhu kojence, publikovali Julsgaard et al v roce 2020. Ve svém souboru 50 těhotných exponovaných VDZ udávali medián poměru hladin VDZ v pupečníkové krvi dítěte a žilní krvi matky 0,44 a průměrnou clearance VDZ u kojence 3,8 měsíce. U žádného dítěte nedetekoval hladiny v půl roce věku života. Clearance VDZ je tedy považována za poměrně rychlou a nebyla nalezena korelace mezi hladinami VDZ u dítěte s rizikem rozvoje infekce v prvním půlroce života. Ani expozice VDZ ve třetím trimestru či kombinovaná imunosupresivní terapie nevedla k zvýšenému výskytu infekce [29].
Naše studie má několik limitací. I když je náš soubor ve srovnání s doposud publikovanými údaji porovnatelný, jedná se stále o relativně malý počet těhotenství k potvrzení jednoznačné bezpečnosti použití nových biologik v graviditě. Další limitací je absence kontrolní skupiny a chybějící údaje o hladinách biologik v krvi kojenců v postnatálním období k možnosti posouzení clearance těchto léčiv z oběhu dětí.
Největší předností naší práce je převážně prospektivní charakter sledování. Dle dostupných údajů je naše sledování největším prospektivním souborem pacientek exponovaných UST a taktéž dosud největším publikovaným souborem farmakokinetických dat o transplacentárním přenosu UST v léčbě těhotných pacientek s IBD.
Závěr
Naše výsledky podporují dosud publikovaná limitovaná data o bezpečnosti vedolizumabu a ustekinumabu v těhotenství a naznačují dobrý bezpečností profil těchto biologik v graviditě. Zatímco je placentární farmakokinetika ustekinumabu shodná s farmakokinetikou anti-TNFa léčiv, u vedolizumabu byl pozorován rozdílný transplacentární přenos, který vedl k nižším hladinám léku v pupečníkové krvi ve srovnání s žilní krví matky v době porodu.
ORCID autorů
B. Pipek ORCID 0000-0002-0315-8845,
D. Ďuricová ORCID 0000-0002-6090-3522,
K. Mitrová ORCID 0000-0002-1836-3745,
M. Bortlík ORCID 0000-0002-6769-3003,
T. Douda ORCID 0000-0002-5716-2655,
P. Drastich ORCID 0000-0002-5656-9242,
P. Falt ORCID 0000-0001-8843-4716,
P. Klvaňa ORCID 0000-0002-7160-6929,
P. Kohout ORCID 0000-0003-1505-9972,
A. Novotný ORCID 0000-0002-7163-6095,
P. Svoboda ORCID 0000-0002-9176-6655,
M. Lukáš ORCID 0000-0002-1463-3840.
Doručeno/Submitted: 4. 1. 2022
Přijato/Accepted: 11. 1. 2022
MUDr. Barbora Pipek
Centrum péče o zažívací trakt
Nemocnice AGEL Ostrava-Vítkovice a. s.
Zalužanského 1192/15
703 84 Ostrava-Vítkovice
Sources
1. van der Woude CJ, Ardizzone S, Bengtson MB et al. The second European evidenced-based consensus on reproduction and pregnancy in inflammatory bowel disease. J Crohns Colitis 2015; 9 (2): 107–124. doi: 10.1093/ecco-jcc/jju006.
2. Lukáš M. Idiopatické střevní záněty: nové trendy a mezioborové souvislosti. Praha: Grada Publishing 2020.
3. Bortlik M, Machkova N, Duricova D et al. Pregnancy and newborn outcome of mothers with inflammatory bowel diseases exposed to anti-TNF-a therapy during pregnancy: three-center study. Scand J Gastroenterol 2013; 48 (8): 951–958. doi: 10.3109/00365521.2013.812141.
4. Sandborn WJ, Gasink C, Gao LL et al. Ustekinumab induction and maintenance therapy in refractory Crohn‘s disease. N Engl J Med 2012; 367 (16): 1519–1528. doi: 10.1056/NEJMoa120 3572.
5. Sandborn WJ, Feagan BG, Rutgeerts P et al. Vedolizumab as induction and maintenance therapy for Crohn‘s disease. N Engl J Med 2013; 369 (8): 711–721. doi: 10.1056/NEJMoa1215739.
6. Feagan BG, Rutgeerts P, Sands BE et al. Vedolizumab as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2013; 369 (8): 699–710. doi: 10.1056/NEJMoa1215734.
7. Mitrova K, Pipek B, Bortlik M et al. Differences in the placental pharmacokinetics of vedolizumab and ustekinumab during pregnancy in women with inflammatory bowel disease: a prospective multicentre study. Therap Adv Gastroenterol 2021; 14 : 17562848211032790. doi: 10.1177/17562848211032790.
8. Wils P, Seksik P, Stefanescu C et al. Safety of ustekinumab or vedolizumab in pregnant inflammatory bowel disease patients: a multicentre cohort study. Aliment Pharmacol Ther 2021; 53 (4): 460–470. doi: 10.1111/apt.16192.
9. Terjung B, Schmelz R, Ehehalt R et al. Safety of vedolizumab in the treatment of pregnant women with inflammatory bowel disease: a targeted literature review. Therap Adv Gastroenterol 2020; 13 : 1756284820952592. doi: 10.1177/1756284820952592.
10. Moens A, van Hoeve K, Humblet E et al. Outcome of pregnancies in female patients with inflammatory bowel diseases treated with vedolizumab. J Crohns Colitis 2019; 13 (1): 12–18. doi: 10.1093/ecco-jcc/jjy142.
11. Mahadevan U, Vermeire S, Lasch K et al. Vedolizumab exposure in pregnancy: outcomes from clinical studies in inflammatory bowel disease. Aliment Pharmacol Ther 2017; 45 (7): 941–950. doi: 10.1111/apt.13960.
12. Rowan CR, Cullen G, Mulcahy HE et al. Ustekinumab drug levels in maternal and cord blood in a woman with Crohn‘s disease treated until 33 weeks of gestation. J Crohns Colitis 2018; 12 (3): 376–378. doi: 10.1093/ecco-jcc/jjx141.
13. Lund T, Thomsen SF. Use of TNF-inhibitors and ustekinumab for psoriasis during pregnancy: a patient series. Dermatol Ther 2017; 30 (3). doi: 10.1111/dth.12454.
14. de Lima A, Zelinkova Z, Mulders AG et al. Preconception care reduces relapse of inflammatory bowel disease during pregnancy. Clin Gastroenterol Hepatol 2016; 14 : 1285–1292. doi: 10.1016/j.cgh.2016.03.018.
15. Pham-Huy A, Sadarangani M, Huang V et al. From mother to baby: antenatal exposure to monoclonal antibody biologics. Expert Rev Clin Immunol 2019; 15 (3): 221–229. doi: 10.1080/1744666X.2019.1561282.
16. Kane SV, Acquah LA. Placental transport of immunoglobulins: a clinical review for gastroenterologists who prescribe therapeutic monoclonal antibodies to women during conception and pregnancy. Am J Gastroenterol 2009; 104 (1): 228–233. doi: 10.1038/ajg.2008.71.
17. Restellini S, Biedermann L, Hruz P et al. Update on the management of inflammatory bowel disease during pregnancy and brestfeeding. Digestion 2020; 101 (Suppl 1): 1–6. doi: 10.1159/000502886.
18. Klenske E, Osaba L, Nagore D et al. Drug levels in the maternal serum, cord blood and breast milk of a ustekinumab-treated patient with Crohn’s disease. J Crohns Colitis 2019; 13 (2): 267–269. doi: 10.1093/ecco-jcc/jjy153.
19. Rowan CR, Cullen G, Mulcahy HE et al. Ustekinumab drug levels in maternal and cord blood in a woman with Crohn’s disease treated until 33 weeks of gestation. J Crohns Colitis 2018; 12 (3): 376–378. doi: 10.1093/ecco-jcc/jjx141.
20. Mahadevan U, Long MD, Kane SV et al. Pregnancy and neonatal outcomes after fetal exposure to biologics and thiopurines among women with inflammatory bowel disease. Gastroenterology 2021; 160 (4): 1131–1139. doi: 10.1053/j.gastro.2020.11.038.
21. Julsgaard M, Christensen LA, Gibson PR et al. Concentrations of adalimumab and infliximab in mothers and newborns, and effects on infection. Gastroenterology 2016; 151 (1): 110–119. doi: 10.1053/j.gastro.2016.04.002.
22. Bortlik M, Machkova N, Duricova D et al. Pregnancy and newborn outcome of mothers with inflammatory bowel diseases exposed to anti - TNF-a therapy during pregnancy: three-center study. Scand J Gastroenterol 2013; 48 (8): 951–958. doi: 10.3109/00365521.2013.812141.
23. Mahadevan U, Wolf DC, Dubinsky M et al. Placental transfer of anti-tumor necrosis factor agents in pregnant patients with inflammatory bowel disease. Clin Gastroenterol Hepatol 2013; 11 (3): 286–292. doi: 10.1016/j.cgh.2012.11.011.
24. Moens A, van der Woude CJ, Julsgaard M et al. Pregnancy outcomes in inflammatory bowel disease patients treated with vedolizumab, anti-TNC or conventional therapy: results of the European CONCEIVE study. Aliment Pharmacol Ther 2020; 51 (1): 129–138. doi: 10.1111/apt.15539.
25. Bar-Gil Shitrit A, Ben Ya’acov A, Meir Livovsky D et al. Exposure to vedolizumab in IBD pregnant women appears of low risk for mother and neonate: a first prospective comparison study. Am J Gastroenterol 2019; 114 (7): 1172–1175. doi: 10.14309/ajg.0000000000000186.
26. Geldhof A, Volger S, Lin CB et al. Pregnancy outcomes in women with psoriasis, psoriatic artritis, Crohn‘s disease and ulcerative colitis treated with ustekinumab. J Crohns Colitis 2020; 14 (Suppl 1): S460. doi: 10.1093/ecco-jcc/jjz203.666.
27. Mahadevan U, Long MD, Kane SV et al. Pregnancy and neonatal outcomes after fetal exposure to biologics ant thiopurines among women withinflammatory bowel disease. Gastroenterology 2021; 160 (4): 1131–1139. doi: 10.1053/ j.gastro.2020.11.038.
28. Flanagan E, Gipson PR, Wrick EK et al. Infliximab, adalimumab and vedolizumab concentrations across pregnancy and vedolizumab concentrations in infants following intrauterine exposure. Aliment Pharmacol Ther 2020; 52 (10): 1551–1562. doi: 10.1111/apt.16102.
29. Julsgaard M, Baumgart D, Jorgensen SMD et al. Vedolizumab levels in mothers and newborns, clearance on neonates, susceptibility to infection, and achievement of developmental milestones. United European Gastroenterol J 2020; 8 : 16.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology

2022 Issue 1-
All articles in this issue
- Perspektivní rok 2022
- Buďme optimisty!
- Kvíz z klinické praxe
- Doporučení Pracovní skupiny pro idiopatické střevní záněty pro diagnostiku a medikamentózní léčbu ulcerózní kolitidy
- Komplikovaný průběh Crohnovy nemoci tenkého střeva u nemocné v osmém decenniu
- Point-of-care metoda měření hladiny infliximabu a adalimumabu u pacientů s idiopatickými střevními záněty na biologické léčbě
- Biosimilární léčba v dětské gastroenterologii – současný pohled
- Bezpečnost biologické léčby vedolizumabem a ustekinumabem podávané v průběhu gravidity pro idiopatický střevní zánět matek – multicentrická retrospektivně-prospektivní observační studie
- Remsima SC 120 mg – nová generace biosimilárních léčiv
- Význam domácej parenterálnej výživy v klinickej praxi – vlastné skúsenosti z nášho centra
- Desmoidní fibromatóza jako vzácný nádor mezenteria
- Výběr z mezinárodních časopisů
- Odešla mimořádná osobnost české gastroenterologie – Ivo Skála (17. 12. 1933 – 10. 2. 2022)
- Správná odpověď na kvíz
- Kreditovaný autodidaktický test: IBD
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Desmoidní fibromatóza jako vzácný nádor mezenteria
- Remsima SC 120 mg – nová generace biosimilárních léčiv
- Význam domácej parenterálnej výživy v klinickej praxi – vlastné skúsenosti z nášho centra
- Doporučení Pracovní skupiny pro idiopatické střevní záněty pro diagnostiku a medikamentózní léčbu ulcerózní kolitidy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


