-
Medical journals
- Career
Léčba jaterních metastáz kolorektálního karcinomu
: J. Pudil 1; S. Batko 2; K. Menclová 1; M. Rousek 1; M. Ryska 1
: Chirurgická klinika 2. LF UK a ÚVN, Praha 1; Onkologická klinika 2. LF UK a FN Motol, Praha 2
: Gastroent Hepatol 2018; 72(5): 391-396
: Gastrointestinal Oncology: Review Article
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amgh2018391Úvod:
U 60 % nemocných s kolorektálním karcinomem jsou diagnostikovány jaterní metastázy (JMKRK), ať už v době stanovení diagnózy nebo v průběhu léčby. Chirurgická léčba je nejdůležitější metodou léčby s 5letým přežíváním dosahujícím cca 50 %. Jaterní resekci však podstoupí méně než 20 % pacientů s JMKRK. Systémová léčba umožňuje u primárně neresekabilních pacientů resekční výkon, u jiných pacientů významně prodlužuje celkové přežívání. Stanovení léčebné strategie vychází z rozhodnutí multidisciplinárního týmu. Chirurgická léčba: Autoři definují technické i onkologické aspekty resekability, problematiku velikosti zbytkového jaterního parenchymu a možnosti jeho navýšení. Zmiňují možnosti chirurgické léčby – typy resekcí, víceetapové výkony, liver first approach či radiofrekvenční ablaci. Systémová léčba: Zaznamenává dynamický rozvoj, zmíněny jsou současné možnosti chemoterapie i biologické léčby, dále indikace k perioperační léčbě u resekabilních nálezů a konverzní terapii u primárně neresekabilních nálezů. Závěr: I přes pokroky v systémové léčbě představuje jaterní resekce jedinou potenciálně kurabilní metodu léčby JMKRK. Úzká spolupráce mezi chirurgy erudovanými v chirurgii jater a klinickými onkology v multidisciplinárních týmech je podmínkou navýšení resekability u pacientů s JMKRK.
Klíčová slova:
kolorektální karcinom – jaterní metastázy – resekce jater – systémová léčba
Úvod
Kolorektální karcinom (KRK) je ve světě třetí nejčastější nádor a jeho celosvětová incidence je rozdílná v závislosti na vyspělosti země [1]. Více než u 60 % nemocných s KRK jsou diagnostikovány jaterní metastázy (JMKRK). V polovině případů již v době stanovení diagnózy nebo v průběhu léčby – nejčastěji do 2 let [2]. Pacienti se synchronními metastázami dosahují horších výsledků v přežívání. Chirurgická léčba je jedinou potenciálně kurabilní metodou s 5letým přežíváním dosahujícím cca 50 % [3]. Obecně se v současnosti za iniciálně resekabilní považuje méně než 25 % pacientů [4]. Vyléčení pacienta s metastatickým onemocněním je spojeno s resekabilním onemocněním, u pacientů léčených pouze systémovou léčbou bylo 10leté přežívání zaznamenáno u méně než 1 % [5]. Společnou snahou onkologů a chirurgů je navýšit počet resekovaných pacientů. Stanovení adekvátní léčby nebo léčebné strategie by mělo vycházet z rozhodnutí multidisciplinárního týmu. Metastatický KRK již dávno nepatří mezi onemocnění, kde by jeden přístup vyhovoval všem pacientům, a proto snaha o co nejlepší léčebné výsledky vyžaduje optimalizaci přístupu.
Chirurgická léčba
Kritéria resekability se významně mění. Resekabilita má totiž aspekt technický, určený chirurgem, a aspekt onkologický definovaný rizikem budoucí recidivy. Komplexnější ESMO klasifikace podle resekability dělí pacienty na:
- iniciálně resekabilní standardním postupem;
- pacienty resekabilní při použití rozšířeného postupu – vícedobé resekce, liver first approach (LFA), metody ovlivňující nárůst zbytkového jaterního parenchymu nebo kombinace resekce a radiofrekvenční ablace (RFA);
- pacienty iniciálně neresekabilní, avšak konvertovatelné při dosažení léčebné odpovědi;
- pacienty nepravděpodobně konvertovatelné nehledě na léčebnou odpověď [6].
Zaměříme-li se na technický „chirurgický“ aspekt, můžeme vycházet z publikovaného konsenzu doporučení managementu JMKRK [7]. Jako minimální bezpečný okraj resekátu je doporučeno dodržet alespoň 1 mm (dříve 1 cm). Dále je doporučeno zachovat alespoň dva jaterní segmenty s cévním zásobením a biliární drenáží. Není zmiňován počet metastáz, ani jejich velikost. Resekci je možné provést, pokud zůstane zachováno nejméně 30 % zdravého parenchymu. Právě nedostatečný zbytkový objem jater (FLR – future liver remnant) je hlavní příčinou neresekability. Nedostatečný FLR může vést k pooperačnímu jaternímu selhání. Z těchto důvodů se upřednostňují parenchym šetřící resekce (metastasektomie) před velkými resekčními výkony. Máme však i technické možnosti navýšení objemu FLR. Tyto postupy jsou založeny na principu přerušení příslušné větve portálního řečiště, který vede k nárůstu kontralaterální části. Nejčastěji se jedná o portální venózní embolizaci – metoda intervenční radiologie (obr. 1).
1. Portální venózní embolizace.
Fig. 1. Portal venous embolisation.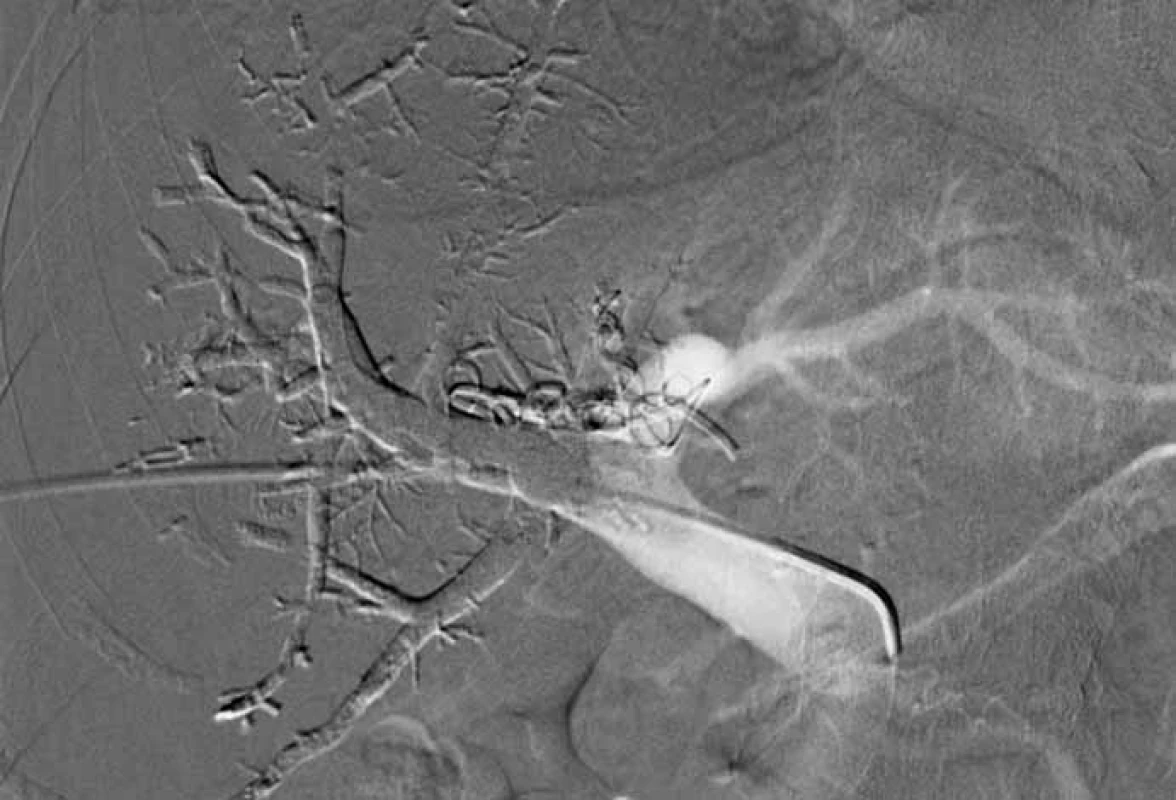
Dále existují různé modifikace dvoudobé jaterní resekce. V první době provedeme odstranění metastáz, nejčastěji z levého jaterního laloku, s podvazem pravé větve portální žíly [8]. Ve druhé době po nárůstu FLR doplníme pravostrannou hepatektomii.
Pouhá chirurgická ligace nevede k dostatečnému nárůstu FLR a je nutné ji doplnit aplikací alkoholu či kmenových mezenchymálních buněk nebo roztětím parenchymu v místě předpokládané resekce [9]. Cílem těchto metod je zvětšení objemu jaterní tkáně, který zůstane po resekci (obr. 2).
2. CT volumetrie po portální venózní embolizaci (hypertrofický levý lalok s jizvou po radiofrekvenční ablaci).
Fig. 2. CT volumetry following portal venous embolisation (hypertrophic left lobe after radiofrequency ablation).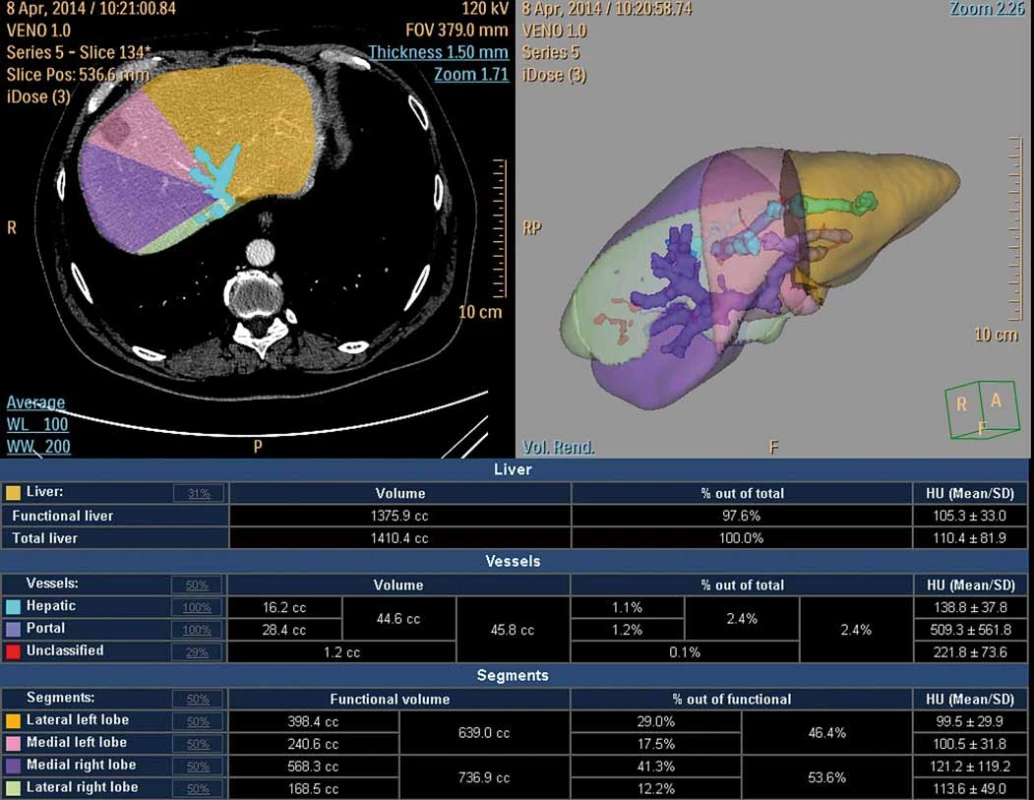
Liver first approach
Prognózu pacienta ovlivňuje daleko více generalizace než primární tumor. U mnoha pacientů s pokročilými synchronními JMKRK dochází k progresi během léčby primárního tumoru, která znemožňuje resekci jaterních metastáz. Sdružené výkony v jedné době (především velké jaterní resekce a resekce rekta) jsou zatíženy vyšší morbiditou a mortalitou [10]. V roce 2006 publikovali Mentha et al [11] prospektivní studii o 20 pacientech se synchronními JMKRK. Po iniciační fázi systémové léčby pacienti podstoupili resekci jater a po následné fázi adjuvantní chemoterapie, event. doplněné o radioterapii, resekci primárního nádoru. Daný algoritmus dokončili u 16 pacientů (80 %) s 3letým přežíváním 71 %. LFA je vyhrazen především pro tumory rekta a rektosigmatu, profit této metody musí být prokázán randomizovanými studiemi.
Radiofrekvenční ablace
Nedílnou součástí komplexní léčby pacientů s JMKRK jsou i ablativní metody, zejména RFA. Způsoby provedení jsou dva:
- perkutánní s CT či ultrasonografickou navigací;
- peroperační (laparoskopicky nebo při laparotomii).
RFA je zatížena nižší dobou hospitalizace a nižší morbiditou, ovšem za cenu horších dlouhodobých výsledků – vyšší výskyt lokální rekurence a kratší bezpříznakové přežití (DFS – disease free survival) a celkové přežití (OS – overal survival) [12,13]. Pokud nalezneme srovnatelné dlouhodobé výsledky, jedná se většinou o solitární malé léze (do 3 cm) a peroperační použití RFA (laparotomie) [14]. RFA se jeví jako vhodná u starších či polymorbidních pacientů, u reoperací pro recidivy JMKRK a u bilobárních výkonů, kdy kombinujeme resekci a RFA. Většina autorů nadále favorizuje resekční výkon [12].
Systémová léčba
Za posledních 20 let zaznamenala léčba metastazujícího KRK dynamický rozvoj, jenž vedl k signifikantnímu zlepšení prognózy onemocnění. Monoterapie 5-fluorouracilem s mediánem OS 12 měsíců [15] byla překonána zavedením novějších cytostatik, oxaliplatiny a irinotekanu na konci 90. let minulého století. Nejběžněji používané kombinace představují dublety FOLFIRI a FOLFOX/XELOX. Posunuly medián celkového přežití ke 20 měsícům [16]. Vstup cílené terapie do léčby metastazujícícho KRK v roce 2004 vedl k dalšímu zlepšení výsledků. Pevné místo zaujala léčba založená na inhibici angioneogeneze reprezentovaná bevacizumabem a afliberceptem. Antiangiogenní léčiva cílí na komunikaci mezi nádorovými buňkami a buňkami endotelu, ovlivňují mikroprostředí nádoru. Tuto léčbu je obecně možné použít u všech pacientů. Léčba cílená na receptor pro epidermální růstový faktor (EGFR – epidermal growth factor receptor), zastoupená monoklonálními protilátkami cetuximabem a panitumumabem, naproti tomu působí přímo na nádorových buňkách. Její efekt je však podmíněn neporušenou funkcí signální dráhy EGFR. Mutace, které se nejčastěji objevují v KRAS, event. NRAS a BRAF genech, vedou k přetrvávající aktivaci dráhy, na níž nemá blokáda EGFR vliv, a tudíž ani terapeutický efekt.
Pokrok v porozumění molekulární biologii, často stimulovaný výsledky epidemiologických, ale i klinických studií, ozřejmil neudržitelnost konceptu jednotné léčby pro všechny pacienty. V současnosti lze u obecné populace pacientů s metastazujícím KRK mluvit o mediánu celkového přežití cca 31 měsíců [17]. A právě heterogenita onemocnění společně s individualizovanou léčbou vedou k poměrně rozdílným výsledkům u jednotlivých podskupin onemocnění. Na jedné straně nyní stojí BRAF mutované tumory představující zhruba 7 % [18] všech KRK, které jsou při absenci mikrosatelitové instability spojeny s nejhorší prognózou onemocnění s mediánem celkového přežití 9–17 měsíců. Na druhé straně pacienti s levostrannou lokalizací nádoru wild type RAS + BRAF mohou dosahovat mediánu přežití až 38 měsíců. U resekabilního a resekovaného metastatického onemocnění je přežití srovnatelné jako u lokálně pokročilých KRK III. stadia.
Nejčastější používanou kombinační léčbou jsou dublety na bázi oxaliplatiny a 5-fluorouracilu, nejčastěji FOLFOX/XELOX nebo dublet na bázi irinotekanu a 5-fluorouracilu FOLFIRI. Volba biologické léčby k tomuto dubletu vychází z mutačního stavu RAS a BRAF proteinu – mutace jakéhokoli z nich činí anti-EGFR protilátky neúčinné a volba v 1. linii léčby připadá na bevacizumab, preferenčně kombinovaný s oxaliplatinou a 5-fluorouracilem [19]. U metastatického KRK s RAS + BRAF wild type fenotypem jsou k dispozici pro kombinaci s chemoterapií dvě monoklonální protilátky, chimérický cetuximab a plně humanizovaný panitumumab. Obě je možné použít v kombinaci s režimem FOLFOX [20,21] i FOLFIRI [22,23]. Volbu mezi podáním anti-VEGF (vascular endothelial growth factor) a anti-EGFR léčby v 1. linii léčby metastatického KRK formovaly v roce 2016 publikované výsledky retrospektivní analýzy účinnosti biologické léčby v závislosti na lokalizaci tumoru ve studiích CALGB 80405, FIRE 3, PEAK a PRIME, které ukázaly významné rozdíly v terapeutické odpovědi mezi pravým a levým tračníkem [24–26]. Karcinomy pravého tračníku (cékum až celé kolon transversum do slezinného ohbí) měly horší prognózu přežití v porovnání s levým tračníkem, ale ještě více vynikly rozdíly v účinnosti anti-EGFR protilátek mezi pravým a levým tračníkem, kde dosahovaly významně lepších výsledků. Anti-VEGF léčba dosahovala v porovnání s anti-EGFR terapií lepších výsledků u pravého tračníku a naopak horších výsledků u levého tračníku. Je vhodné poznamenat, že u všech tří studií se jednalo o retrospektivní analýzy, které vyžadují ověření v prospektivní studii, přesto jsou tyto výsledky reflektovány v guidelines NCCN (National Comprehensive Cancer Network) i ESMO (European Society for Medial Oncology).
Neoadjuvance u resekabilních nálezů
Rozhodnutí o tom, zda provést resekci metastáz v 1. době či nejdříve zahájit chemoterapii, nemusí být při zvážení všech relevantních faktorů jednoduché.
Od systémové léčby podané před samotnou resekcí očekáváme, že dokáže negativně ovlivnit populaci nádorových buněk a alespoň potenciálně eradikovat mikrometastatický rozsev, který je pod limitem detekce. V práci Bonneyho et al byl nalezen významný rozdíl v incidenci mikrometastáz (satelitní ložiska nádorových buněk v okolí jaterních metastáz, nejčastěji v 1 cm lemu jaterních metastáz) mezi skupinou pacientů léčených samotnou resekcí (65 %) a pacientů s předchozí chemoterapií (25 %) [27]. V opozici vůči použití neoadjuvantní chemoterapie u resekabilních jaterních metastáz stojí výsledky analýzy dat z mezinárodního registru LiverMetSurvey publikované v roce 2015 [28], v níž nebyl prokázán přínos neoadjuvantní chemoterapie u resekabilních jaterních metastáz a v jejímž rámci nebyla absence adjuvantní chemoterapie spojena s horším OS i DFS. V PloS One byla publikována retrospektivní studie z roku 2014 [29], která naznačila benefit neoadjuvance u rizikové podskupiny charakterizované přítomností více než dvou prognostických faktorů (primární tumor stadia T4, postižení uzlin u primárního nádoru, ≥ 4 jaterní metastázy, největší průměr metastázy ≥ 5 cm a hladina CEA (carcinoembryonic antigen) ≥ 5 ng/ml).
Konverzní léčba
U primárně resekabilních nálezů může vést systémová léčba k významné léčebné odpovědi, tzv. downsizingu, která umožní resekci. Studie PRIME, CELIM, OPUS prokázaly významný efekt při kombinaci chemoterapie a biologické léčby (zejména anti-EGFR léčba). Resekabilita v těchto skupinách primárně neresekabilních pacientů dosahovala 15–55 % [27]. OS a DFS je u těchto pacientů, při srovnání s primárně resekabilními pacienty, bez signifikantního rozdílu [28]. Klíčová role při posouzení resekability u těchto pacientů je jejich opakované prezentování na multidisciplinárních týmech. Resekci indikujeme v okamžiku dosažení operability – s délkou podávání systémové léčby narůstá perioperační morbidita (obr. 3–5) [30].
3. CT nález neoperabilního nálezu.
Fig. 3. CT scan of an inoperable finding.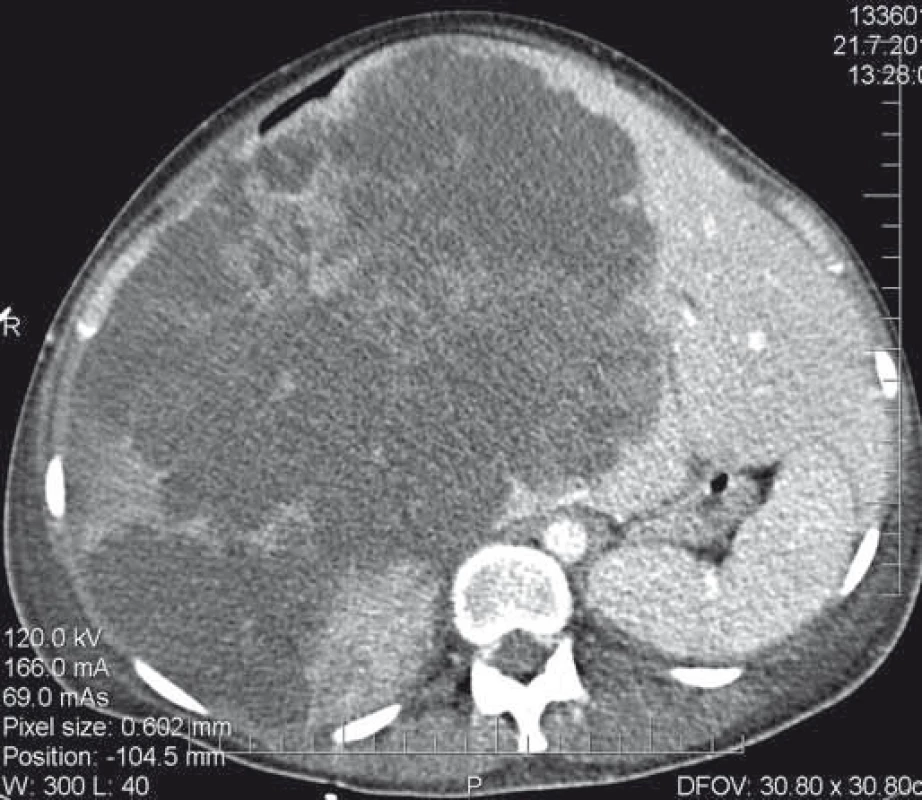
4. CT nález významné regrese po systémové léčbě.
Fig. 4. CT scan of a significant regression after systemic treatment.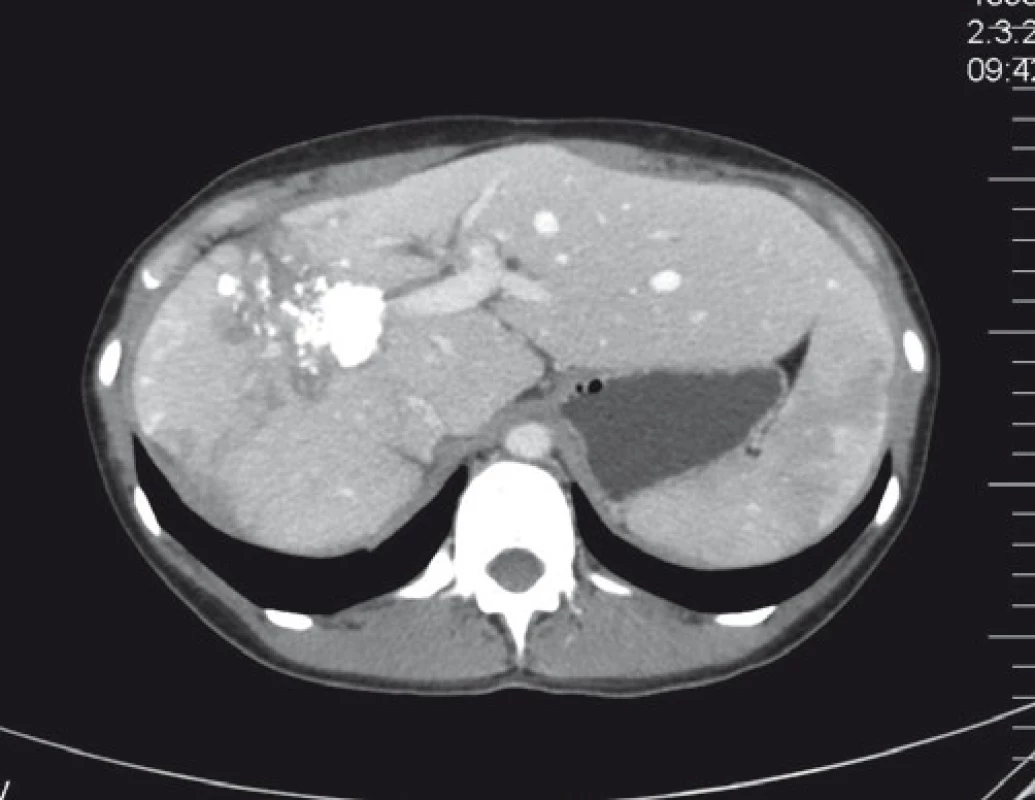
5. Resekát.
Fig. 5. Resectate.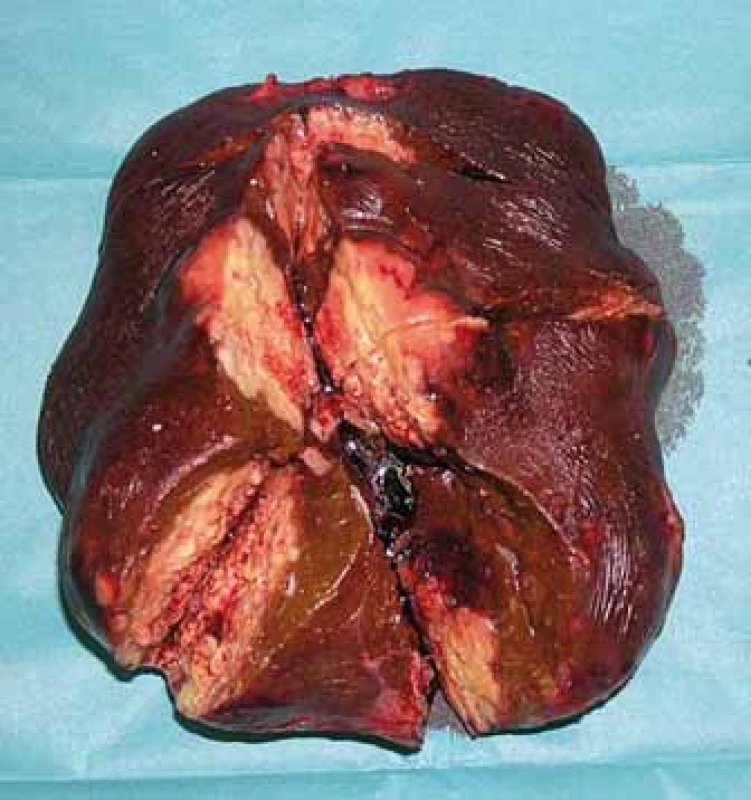
Závěr
Léčba pacientů s JMKRK nabízí širokou variabilitu postupů. Snažíme se preferovat léčbu šitou na míru (personalizovaná léčba). Chirurgická léčba zůstává zásadní léčebnou modalitou s 5letým přežíváním přes 50 %. Rozvoj technik resekcí i vývoj systémové léčby umožňuje navýšení resekability a zlepšení prognózy pacientů.
K navýšení resekability je však též třeba zlepšit spolupráci mezi chirurgy erudovanými v chirurgii jater a klinickými onkology v multidisciplinárních týmech. Soustředit bychom se měli zejména na skupinu potenciálně resekabilních pacientů.
Práce je podpořena MO 1012.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 21. 9. 2018
Přijato: 10. 10. 2018
MUDr. Jiří Pudil
Chirurgická klinika 2. LF UK a ÚVN Praha
U Vojenské nemocnice 1200
169 02 Praha 6
Sources
1. Parkin DM, Bray F, Ferlay J et al. Global cancer statistics 2002. CA Cancer J Clin 2005; 55 (2): 74–108.
2. Žaloudík J, Coufal O, Jurajda M et al. Patofyziologie jaterních metastáz kolorektálního karcinomu a důsledky pro terapii. Bull HPB 2001; 9 : 27–28. [online]. Dostupné z: http: //www.hpb.cz/cz/akce/loket/index.html.
3. Třeška V. Technika jaterních resekcí – současné možnosti. Rozhl Chir 2007; 86 (7): 335–336.
4. Biasco G, Derenzini E, Grazi G et al. Treatment of hepatic metastases from colorectal cancer: many doubts, some certainties. Cancer Treat Rev 2006; 32 (3): 214–228.
5. Dy GK, Hobday TJ, Nelson G et al. Long-term survivors of metastatic colorectal cancer treated with systemic chemotherapy alone: a North Central Cancer Treatment Group review of 3811 patients, N0144. Clin Colorectal Cancer 2009; 8 (2): 88–93.
6. Van Cutsem E, Cervantes A, Adam R et al. ESMO consensus guidelines for the management of patients with metastatic colorectal cancer. Ann Oncol 2016; 27 (8): 1386–1422. doi: 10.1093/annonc/mdw235.
7. Wakai T, Shirai Y, Sakata J et al. Histologic evaluation of intrahepatic micrometastases in patients treated with or without neoadjuvant chemotherapy for colorectal carcinoma liver metastasis. Int J Clin Exp Pathol 2012; 5 (4): 308–314.
8. Třeška V. Chirurgie jater pro metastázy kolorektálního karcinomu. Rozh Chir 2018; 97 (4): 149–155.
9. Alvarez FA, Ardiles V, Sanchez Claria R et al. Associating liver partition and portal vein ligation for staged hepatectomy (ALPPS): tips and tricks. J Gastrointest Surg 2013; 17 (4): 814–821. doi: 10.1007/s11605-012-2092-2.
10. Reddy SK, Pawlik TM, Zorzi D et al. Simultaneous resections of colorectal cancer and synchronous liver metastases: a multi-institutional analysis. Ann Surg Oncol 2007; 14 (12): 3481–3491. doi: 10.1245/s10434-007-95 22-5.
11. Mentha G, Roth AD, Terraz S et al. The ‘liver first’ approach in the treatment of colorectal cancer with synchronous liver metastases. Dig Surg 2008; 25 (6): 430–435. doi: 10.1159/000184 734.
12. Minami Y, Kudo M. Radiofrequency ablation of liver metastases from colorectal cancer: a literature review. Gut Liver 2013; 7 (1): 1–6. doi: 10.5009/gnl.2013.7.1.1.
13. Oshowo A, Gillams A, Harrison E et al. Comparison of resection and radiofrequency ablation for treatment of solitary colorectal liver metastases. Br J Surg 2003; 90 (10): 1240–1243. doi: 10.1002/bjs.4264.
14. Abdalla EK, Vauthey JN, Ellis LM et al. Recurrence and outcomes following hepatic resection, radiofrequency ablation, and combined resection/ablation for colorectal liver metastases. Ann Surg 2004; 239 (6): 818–825.
15. Poon MA, O’Connell MJ, Moertel CG et al. Biochemical modulation of fluorouracil: evidence of significant improvement of survival and quality of life in patients with advanced colorectal carcinoma. J Clin Oncol 1989; 7 (10): 1407–1418.
16. Tournigand C, André T, Achille E et al. FOLFIRI followed by FOLFOX6 or the reverse sequence in advanced colorectal cancer: a randomized GERCOR study. J Clin Oncol 2004; 22 (2): 229–237. doi: 10.1200/JCO.2004.05.113.
17. Loupakis F, Cremolini C, Masi G et al. Initial therapy with FOLFOXIRI and bevacizumab for metastatic colorectal cancer. N Engl J Med 2014; 371 (17): 1609–1618. doi: 10.1056/NEJMoa 1403108.
18. Cantwell-Dorris ER, O‘Leary JJ, Sheils OM. BRAFV600E: implications for carcinogenesis and molecular therapy. Mol Cancer Ther 2011; 10 (3): 385–394. doi: 10.1158/1535-7163.
19. Saltz LB, Clarke S, Díaz-Rubio E et al. Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase III study. J Clin Oncol 2008; 26 (12): 2013–2019. doi: 10.1200/JCO.2007.14.9930.
20. Douillard J, Siena S, Tabernero J et al. Overall survival (OS) analysis from PRIME: Randomized phase III study of panitumumab (pmab) with FOLFOX4 for first-line metastatic colorectal cancer (mCRC). J Clin Oncol 2013; 31 (Suppl) abstr 3620.
21. Qin S, Xu J, Wang L et al. First-line FOLFOX-4 ± cetuximab in patients with RAS wild-type metastatic colorectal cancer: The open-label, randomized, phase 3 TAILOR trial. [online]. Available from: https: //oncologypro.esmo.org/Meeting-Resources/ESMO-Asia-2016-Congress/First-line-FOLFOX-4-cetuximab-in-patients-with-RAS-wild-type-metastatic-colorectal-cancer-The-open-label-randomized-phase-3-TAILOR-trial.
22. Van Cutsem E, Köhne CH, Láng I et al. Cetuximab plus irinotecan, fluorouracil, and leucovorin as first-line treatment for metastatic colorectal cancer: updated analysis of overall survival according to tumor KRAS and BRAF mutation status. J Clin Oncol 2011; 29 (15): 2011–2019. doi: 10.1200/JCO.2010.33.5091.
23. Carrato A, Abad A, Massuti B et al. First-line panitumumab plus FOLFOX4 or FOLFIRI in colorectal cancer with multiple or unresectable liver metastases: A randomised, phase II trial (PLANET-TTD). Eur J Cancer 2018; 81 : 191–202. doi: 10.1016/j.ejca.2017.04.024.
24. Khattak MA, Martin H, Davidson A et al. Role of first-line anti-epidermal growth factor receptor therapy compared with anti-vascular endothelial growth factor therapy in advanced colorectal cancer: a meta-analysis of randomized clinical trials. Clin Colorectal Cancer 2015; 14 (2): 81–90. doi: 10.1016/j.clcc.2014.12. 011.
25. Pietrantonio F, Cremolini C, Petrelli F et al. First-line anti-EGFR monoclonal antibodies in panRAS wild-type metastatic colorectal cancer: a systematic review and meta-analysis. Crit Rev Oncol Hematol 2015; 96 (1): 156–166. doi: 10.1016/j.critrevonc.2015.05.016.
26. Heinemann V, Rivera F, O‘Neil BH et al. A study-level meta-analysis of efficacy data from head-to-head first-line trials of epidermal growth factor receptor inhibitors versus bevacizumab in patients with RAS wild-type metastatic colorectal cancer. Eur J Cancer 2016, 67 : 11–20. doi: 10.1016/j.ejca.2016.07.019.
27. Bonney GK, Coldham C, Adam R et al. Role of neoadjuvant chemotherapy in resectable synchronous colorectal liver metastasis; an international multi-center data analysis using LiverMetSurvey. J Surg Oncol 2015; 111 (6): 716–724. doi: 10.1002/jso.23899.
28. Adam R, de Gramont A, Figueras J et al. Managing synchronous liver metastases from colorectal cancer: a multidisciplinary international consensus. Cancer Treat Rev 2015; 41 (9): 729–741. doi: 10.1016/j.ctrv.2015.06.006.
29. Zhu D, Zhong Y, Wei Y et al. Effect of neoadjuvant chemotherapy in patients with resectable colorectal liver metastases. PLoS One 2014; 9 (1): e86543. doi: 10.1371/journal.pone.0086543.
30. Karoui M, Penna C, Amin-Hashem M et al. Influence of preoperative chemotherapy on the risk of major hepatectomy for colorectal liver metastases. Ann Surg 2006; 243 (1): 1–7.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2018 Issue 5-
All articles in this issue
- Gastrointestinal oncology
- Evaluation of colorectal cancer screening centers in the Czech Republic
- Pancreatic cancer from the patients’s point of view
- Therapy of colorectal carcinoma liver metastases
- Comparison of sulfate-based solution and polyethylene glycol solution for bowel cleansing before colonoscopy – randomized, single-blind study
- Self-expanding duodenal stents, palliative treatment of gastric outlet obstruction in malignant disease
- Six years of the National program for colorectal cancer screening in Slovakia
- Proton pump inhibitors in the light of clinical studies and the safety profile of long-term use
- Gastrointestinal tract involvement in hereditary kidney diseases
- The selection from international journals
- Laparoscopic pancreaticoduodenectomy for ampullary adenocarcinoma – a case report
- А case of fulminant hepatitis against a background of paucity of the interlobular bile ducts
-
Novel developments in small bowel diseases and intestinal microbiota,
Sherine Khater (France) – Gastro Update Europe 2018, Prague
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Proton pump inhibitors in the light of clinical studies and the safety profile of long-term use
- Self-expanding duodenal stents, palliative treatment of gastric outlet obstruction in malignant disease
- Laparoscopic pancreaticoduodenectomy for ampullary adenocarcinoma – a case report
- Pancreatic cancer from the patients’s point of view
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

