-
Medical journals
- Career
Molekulární pitva a náhlá srdeční smrt u mladých lidí
Authors: Rücklová Kristina 1; Kulvajtová Markéta 2; Krebsová Alice 3; Dobiáš Martin 4; Petřková Jana 5
Authors‘ workplace: Klinika dětí a dorostu FNKV a Klinika dětského a dorostového lékařství VFN, Praha 1; Ústav soudního lékařství 3. LF UK a FNKV, Praha 2; Centrum dědičných kardiovaskulárních onemocnění, IKEM, Praha 3; Ústav soudního lékařství a medicínského práva FNOL a LF UP, Olomouc 4; I. Interní klinika-kardiologická FNOL a LF UP, Laboratoř kardiogenomiky FNOL, Ústav lékařské genetiky FNOL a LF UP, Olomouc 5
Published in: Soud Lék., 65, 2020, No. 1, p. 2-6
Category: Review
Overview
Náhlá srdeční smrt se konstatuje v případech náhlého úmrtí v důsledku kardiovaskulárního onemocnění nebo při negativním pitevním nálezu, kdy se předpokládá možnost fatální potenciálně dědičné arytmie. Molekulární pitva by měla být indikována ve všech případech náhlé srdeční smrti, kdy je podezření na kardiomyopatii, dědičný arytmický syndrom a případně při disekci hrudní aorty. Tato dědičná kardiovaskulární onemocnění způsobují většinu případů náhlé srdeční smrti u mladých lidí do 40 let věku. Jejich dědičnost je většinou autosomálně dominantní, což znamená vysoké riziko onemocnění spojeného s náhlou srdeční smrtí u přímých příbuzných náhle zemřelých. Přesné stanovení příčiny úmrtí pomocí molekulární pitvy spolu s kardiologickým a cíleným genetickým vyšetřením přímých příbuzných může pomoci včas odhalit další členy rodiny s rizikem onemocnění a poskytuje jim možnost preventivními opatřeními úmrtí předejít. Klíčovou roli v tomto procesu primární prevence náhlé smrti hrají pitvající lékaři, kteří by měli v případě podezření na dědičné onemocnění srdce odebrat vzorky na genetickou analýzu a doporučit příbuzným zemřelého podrobné kardiogenetické vyšetření na specializovaném pracovišti. Na určení přesné příčiny úmrtí by se měl podílet multidisciplinární tým zahrnující genetiky, kardiology, psychology, pitvající lékaře a koronery.
Klíčová slova:
kardiomyopatie
Náhlá srdeční smrt (NSS) se konstatuje v případech náhlého úmrtí v důsledku kardiovaskulárního onemocnění nebo při negativním pitevním nálezu, kdy se předpokládá možnost fatální potenciálně dědičné arytmie (1). Molekulárně-genetické vyšetření tkáně zemřelého, tzv. molekulární pitva, je dle doporučení Evropské kardiologické společnosti (ESC) indikována ve všech případech NSS, když je podezření na kardiomyopatii nebo některý z dědičných arytmických syndromů (1) a dle některých autorů i při zjištěné disekci hrudní aorty (2,3). Molekulární pitva se tedy v praxi týká především náhle zemřelých mladých lidí do 35 až 40 let věku, u kterých jsou právě tato dědičná onemocnění zodpovědná za více než polovinu případů náhlé srdeční smrti (NSS) na rozdíl od starší populace, kde jednoznačně dominují koronární příhody (1). Z incidence NSS 1,9/100 000/rok ve věku 1 – 35 let zjištěné v Dánsku (4) můžeme odvodit, že v ČR zemře každý rok na NSS přibližně 78 lidí ve věku 1 – 35 let nebo 94 lidí ve věku 1 – 40 let. Molekulární pitva by tedy v ČR měla být indikována u přibližně 60 zemřelých lidí ročně. Vzhledem k tomu, že kardiomyopatie, disekce hrudní aorty a dědičné arytmické syndromy jsou většinou autosomálně dominantně dědičné, existuje 50% riziko přenosu vlohy pro toto onemocnění na potomky a vysoké riziko postižení všech přímých příbuzných. Nález kauzální varianty u zemřelého spolu s genetickým a kardiologickým vyšetřením přímých příbuzných může pomoci včas odhalit další ohrožené členy rodiny a preventivními opatřeními (úpravou životního stylu, léky, implantací kardioverteru-defibrilátoru, atd.) snížit riziko náhlého úmrtí u rodinných příslušníků (5). Jsou také možná primárně-preventivní opatření v rámci plánované gravidity, s možností preimplantační genetické diagnostiky u embryí v rámci cyklu umělého oplodnění. Proto je velmi důležité na dědičná kardiovaskulární onemocnění myslet a při pitvě odebrat materiál pro DNA analýzu.
Příčiny náhlé srdeční smrti (NSS) u mladých lidí
Příčiny NSS u mladých lidí můžeme rozdělit na strukturální a nestrukturální – nevysvětlená náhlá úmrtí s negativním pitevním nálezem (graf 1 – upraveno dle 4). Mezi strukturální příčiny NSS patří vrozené srdeční vady, myokarditidy, koronární příhody, kardiomyopatie a disekce hrudní aorty. Poslední dvě skupiny mohou být dědičné.
Graph 1. Příčiny náhlé srdeční smrti ve věku 1–35 let v Dánsku v letech 2000– 2006 na základě pitevních nálezů. Celkový počet 314. 
Kardiomyopatie se vyznačují poruchou struktury a funkce srdečního svalu. Největší riziko NSS představuje arytmogenní a hypertrofická kardiomyopatie, méně dilatační, restriktivní a nekompaktní, přičemž poslední dva typy jsou velmi vzácné.
U hypertrofické kardiomyopatie dominuje hypertrofie myokardu a diastolická dysfunkce. Její příčinou jsou nejčastěji mutace v genech pro sarkomerické (kontraktilní jednotka uvnitř kardiomyocytů) proteiny, např. těžký řetězec myosinu (MYH7) (6).
Arytmogenní kardiomyopatii charakterizuje tukově - vazivová infiltrace myokardu a její příčinou je zpravidla narušení mezibuněčných spojení-desmosomů, kdy fyzická zátěž potencuje rozpad mezibuněčných spojení a vede tak k rychlejší progresi onemocnění (7).
U dilatační kardiomyopatie jsou porušeny proteiny zajišťující spojení sarkomery se sarkolemou (buněčnou membránou), nejčastěji se jedná o porušení funkce titinu (gen TTN) (8). Kardiomyopatie bývají zpravidla odhaleny detailní pitvou a histologickým vyšetřením srdce. Nicméně fatální arytmie může proběhnout i v počáteční fázi onemocnění, kdy ještě nejsou patrné strukturální změny srdce a molekulární pitva je jedinou možností, jak příčinu úmrtí zjistit.
Aneurysmata a disekce hrudní aorty (TAAD) či jiných velkých cév představují další skupinu onemocnění s rizikem NSS. Přibližně u 20 % nemocných byl zjištěn familiární výskyt s autosomálně dominantním typem dědičnosti. TAAD se vyskytují izolovaně nebo v rámci syndromů, např. Marfanova, Loeys-Dietzova nebo vaskulárního typu Ehlers-Danlosova syndromu. Minimálně 11 genů je jednoznačně spojováno s TAAD. Jedná se např. o geny kódující proteiny, které ovlivňují TGF-beta signalizační kaskádu nebo kontrakci buněk hladkého svalstva v aortální stěně. Schopnost kontrakce těchto buněk dodává aortě potřebnou elasticitu a odolnost vůči pulsatilnímu toku krve. Existuje korelace mezi genotypem a fenotypem, takže např. mutace v genu pro receptor pro transformující růstový faktor beta (TGFBR 2) jsou asociovány s TAAD v kombinaci s intrakraniálními aneurysmaty a v současné době genotyp může ovlivnit i časování chirurgického zákroku (9). TAAD se také často nachází u lidí s bikuspidální aortální chlopní nebo prolapsem mitrální chlopně. Protože rozvoj aneurysmatu aorty bývá často asymptomatický a NSS je první manifestací onemocnění, je včasná detekce rizika onemocnění u příbuzných zásadní (10).
Nestrukturální nebo nevysvětlená úmrtí tvoří přibližně 40% případů NSS ve věku 1–35 let (4,11). Fatální arytmie se nabízí jako možné vysvětlení a zavedení molekulární pitvy zaměřené na geny podmiňující dědičné arytmické syndromy přispělo k odhalení příčiny u 13–30 % těchto případů (graf 2 – upraveno dle 12) (13,14,11). Klinické vyšetření žijících příbuzných v kombinaci s molekulární pitvou zvyšuje procento vysvětlených úmrtí z 13% na 39 % (12). Dědičné arytmické syndromy označujeme někdy jako „kanálopatie“, protože jsou způsobeny mutacemi v genech pro srdeční iontové kanály. Skrz iontové kanály proudí ionty a určují tak trvání a charakter akčního potenciálu kardiomyocytů. Alterace akčního potenciálu při poruše iontových kanálů zvyšuje riziko významných arytmií. Náhlá smrt je popisována především u katecholaminergní polymorfní komorové tachykardie (CPVT), kde dysfunkce kalciových kanálů v sarkoplasmatickém retikulu (RYR2 gen) vede ke zvýšení intracelulárního kalcia a vzniku polymorfní komorové tachykardie. Dále u syndromu dlouhého QT intervalu, kde mutace v genech pro draslíkové iontové kanály (KCNQ1, KCNH2) nebo sodíkový kanál (SCN5A), způsobují prodloužení repolarizace (dlouhý QTc interval na EKG) s rizikem vzniku časných následných depolarizací, které mohou zdegenerovat do komorové fibrilace.
Graph 2. Zastoupení patogenních nebo pravděpodobně patogenních mutací v genech pro dědičné arytmické syndromy u náhlých nevysvětlených úmrtí ve věku 1–35 let. Celkový počet 235. 
Postup při náhlém úmrtí ve věku 1–35 (40) let
Úspěšné stanovení příčiny náhlého úmrtí mladého člověka a včasná detekce ohrožených příbuzných vyžaduje dodržení standardizovaného postupu a spolupráci členů multidisciplinárního týmu, který zahrnuje prohlížejícího lékaře (např. koronera), pitvajícího lékaře, genetika a kardiologa.
Prohlížející lékař by měl získat co nejvíce informací týkajících se osobní anamnézy zemřelého (15). Řada léků užívaných z nejrůznějších důvodů může prodlužovat QT interval a způsobit významnou arytmii stejně jako geneticky podmíněný LQTS. Velmi důležité jsou předchozí kardiologické nálezy, informace o operaci srdce nebo katetrizační intervenci a EKG křivky. Přítomnost hypertenze, bolestí na hrudi a/nebo hypercholesterolémie vzbudí podezření na koronární příhodu. Na druhou stranu synkopy, palpitace nebo epilepsie by mohly svědčit pro arytmogenní příčinu při dědičném arytmickém syndromu, kardiomyopatii nebo aneurysmatu hrudní aorty s prolapsem mitrální chlopně (riziko komorových arytmií). U dětí s kardiomyopatií pátráme po multisystémovém postižení, protože více než třetina kardiomyopatií v dětství se vyskytuje v rámci metabolického nebo syndromického onemocnění. Lékařské zprávy zmiňující hepatopatii, svalovou slabost, nefropatii a/nebo oční patologii mohou svědčit pro vrozené poruchy metabolismu, dysmorfické rysy a porucha růstu pro některé syndromy. Neuromuskulární onemocnění se mohou pojit s dilatační kardiomyopatií. Vrozená hluchota může být součástí syndromu dlouhého QT intervalu, atd. Příznaky (bolest na hrudi, palpitace, synkopy) v posledních dnech nebo týdnech před smrtí mohou také naznačit, že se jedná o NSS. Kromě místa úmrtí je vhodné zaznamenat i jeho okolnosti jako je činnost v době úmrtí, neboť fatální arytmii u určitých typů dědičných arytmických syndromů spouští specifický podnět např. náhlý zvuk budíku nebo alarmu či porod (LQT2), plavání (LQT1), fyzická nebo emocionální zátěž (CPVT), spánek (LQT3) nebo horečka (syndrom Brugadových) (16).
Dále by se měl prohlížející lékař vyptat i na rodinnou anamnézu, především na výskyt nevysvětlených úmrtí v mladém věku, ischemické choroby srdeční, arytmií, kardiomyopatií, v případě aortální disekce i na výskyt vrozených vad postihujících levou polovinu srdce včetně bikuspidální aortální chlopně, aortální stenosy nebo persistující otevřené tepenné dučeje. Dále nás u příbuzných zajímá údaj o implantaci kardiostimulátoru, ICD (implantabilní kardioverter-defibrilátor), transplantaci srdce a epilepsii. Fatální arytmie se může skrývat i za utonutím dobrého plavce nebo u dopravní nehody z nepochopitelného důvodu. (Tab 1 – upraveno dle 17). Informace od prohlížejícího lékaře doplní ještě kardiolog a/nebo genetik při vyšetření příbuzných zemřelého. Prohlížející lékař by měl všechny informace spolu se zprávou od policie a ev. od RZP předat pitvajícímu lékaři, který by si mohl už před pitvou utvořit předběžnou pracovní diagnózu. Pitvající lékař je také oprávněn vyžádat si v případě potřeby doplňující informace od registrujícího lékaře, což umožňuje zákon 372 z roku 2011 o zajištění návaznosti zdravotnických služeb (zákon č. 372/2011 Sb., o zdravotních službách).
Table 1. Návrh dotazníku pro prohlížejícího lékaře pro případy náhlých úmrtí ve věku 1–40 let. 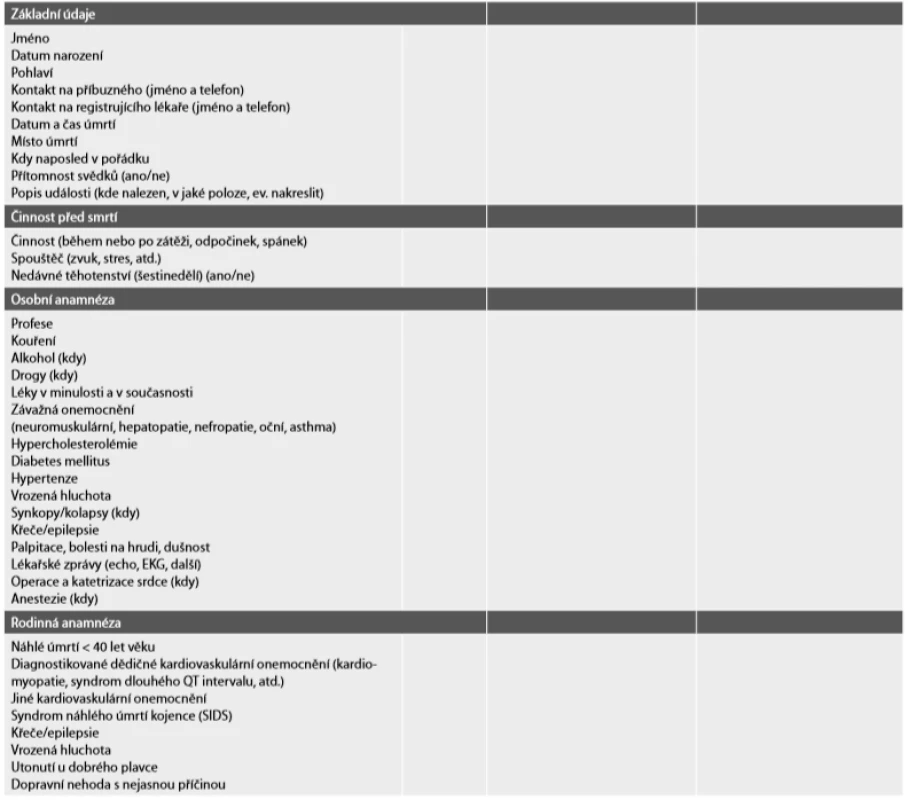
Pitvu, histologické vyšetření srdce, toxikologické, chemické a mikrobiologické vyšetření včetně PCR k průkazu virového genomu v srdci a v krvi při podezření na myokarditidu provádí soudní lékař nebo patolog na základě mezinárodních doporučení pro případy NSS (15). V případě disekce hrudní aorty by měl pitvající lékař pátrat po příznacích charakteristických pro syndromickou formu TAAD. Např. hypertelorismus, kraniosynostosa nebo rozštěp patra či uvuly může svědčit pro Loeys-Dietzův syndrom. Vysoký vzrůst, ektopie oční čočky, dlouhé končetiny, dlouhé a štíhlé prsty (arachnodaktylie), skoliosa a deformity hrudníku jsou typické pro Marfanův syndrom. Na Ehlers-Danlosův syndrom může upozornit tenká až průhledná kůže, zvýšená tvorba modřin, dysmorfické rysy v obličeji nebo přítomnost spontánní ruptury vnitřních orgánů (10,18).
Pokud pitvající lékař zjistí známky kardiomyopatie, disekce hrudní aorty (především u člověka do 50 let věku nebo s příznaky některého z výše uvedených syndromů) anebo není-li zjevná žádná kardiální ani nekardiální příčina úmrtí (potenciální dědičná arytmie), měl by odebrat krev do zkumavky s EDTA, dále vzorek srdce, jater nebo sleziny (postačí 1 cm3) a uložit do mrazáku (-80 °C) nebo uchovat ve speciálním roztoku uchovávajícím RNA „RNA later“. Tyto vzorky s informovaným souhlasem příbuzných mohou být následně využity pro DNA analýzu. Vzorky by měl odeslat do akreditované genetické laboratoře, kde používají metodu sekvenování nové generace (NGS) k vyšetření dědičných kardiovaskulárních onemocnění. V první fázi se vyšetřuje panel genů, jejichž změny způsobují kardiovaskulární onemocnění. Pokud není nalezena kauzální varianta v základním panelu genů, je možné přistoupit i k celo-exomovému nebo celo-genomovému sekvenování (19).
Pitvající lékař by měl také předat příbuzným kontakt na kardiogenetické centrum a vysvětlit jim důležitost molekulární pitvy a kardiogenetického vyšetření příbuzných zemřelého. V řadě zemí jsou tyto postupy zakotveny v legislativě a financovány z veřejného zdravotnictví.
V ČR právě probíhá pilotní studie, která by měla přinést další poznatky pro standardizaci postupů pro případy NSS mladých lidí v našich podmínkách. Kontakty na koordinátory této pilotní studie jsou uvedeny v tabulce 2.
Table 2. Kontakty na koordinátory pilotní studie o náhlé srdeční smrti mladých lidí. 
Podobný komplexní přístup zaměřený především na náhlá nevysvětlená úmrtí mladých lidí s možnou arytmogenní příčinou smrti uplatnilo v rámci grantového projektu brněnské pracoviště (20, 21).
Diskuse o standardizaci postupů u případů NSS pro soudně-lékařské pracoviště probíhá v rámci pracovní skupiny Náhlá srdeční smrt, která byla ustanovena při Výboru České společnosti Soudního lékařství a soudní toxikologie ČLS JEP.
ZÁVĚR
Molekulární pitva by měla být indikována v případech NSS s podezřením na kardiomyopatii, dědičný arytmický syndrom (při negativním pitevním nálezu) a při nálezu disekce hrudní aorty. Jedná se o většinou autosomálně dominantně dědičná onemocnění s vysokým rizikem postižení dalších rodinných příslušníků. Molekulární pitva spolu s kardiogenetickým vyšetřením prvostupňových příbuzných může odhalit genetickou příčinu úmrtí a poskytnout vysvětlení rodině a také přispět ke snížení rizika dalšího náhlého úmrtí v rodině. Smyslem molekulární pitvy tedy je, že v případě nálezu kauzální varianty DNA u zemřelého můžeme cíleným genetickým vyšetřením prvostupňových příbuzných (kaskádový rodinný screening) vybrat ty, kteří vlohu pro dané onemocnění také nesou a měli by být dlouhodobě v péči kardiologa. Naopak ti, kteří vlohu nenesou, nemusí být zbytečně zatěžováni celoživotním kardiologickým sledováním. Proto je důležité na možnou dědičnou příčinu NSS myslet, věnovat pozornost detailům v anamnéze a při fyzikálním vyšetření zemřelého, zajistit při pitvě materiál k DNA analýze a doporučit příbuzným kardiogenetické vyšetření. Klíčovou roli v záchytu případů NSS má lékař provádějící pitvu.
PODĚKOVÁNÍ
Podpořeno z programového projektu AZV Ministerstva zdravotnictví ČR s reg. č. NV18-02-00237.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Jana Petřková, Ph.D.
I. Interní klinika-kardiologická, FNOL a LF UP
I. P. Pavlova 185/6, 779 00 Olomouc
tel.: +420 588 443 213
fax: +420 588 442 500
e-mail: jana.petrkova@fnol.cz
Sources
1. Priori SG, Blomstrom-Lundqvist C, Mazzanti A, et al. 2015 ESC guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: the task force for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death of the European Society of Cardiology (ESC) endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC). Eur Heart J 2015; 36 (41): 2793-2867.
2. Ripperger T, Tröger HD, Schmidtke J. The genetic message of a sudden, unexpected death due to thoracic aortic dissection. Forensic Sci Int 2009; 187 : 1-5.
3. Gago-Díaz M, Ramos-Luis E, Zoppis S, et al. Postmortem genetic testing should be recommended in sudden cardiac death cases due to thoracic aortic dissection. Int J Legal Med 2017; 131 : 1211-1219.
4. Winkel BG, Holst AG, Theilade J, et al. Nationwide study of sudden cardiac death in persons aged 1-35 years. Eur Heart J 2011; 32 : 983-990.
5. Semsarian C, Hamilton RM. Key role of the molecular autopsy in sudden unexpected death. Heart Rhythm 2012; 9 : 145-150.
6. Marian AJ, Braunwald E. Hypertrophic cardiomyopathy: genetics, pathogenesis, clinical manifestations, diagnosis and therapy. Circ Res 2017; 121 : 749-770.
7. Corrado D, Basso C, Judge DP. Arrhythmogenic cardiomyopathy. Circ Res 2017; 121 : 784-802.
8. McNally EM, Mestroni L. Dilated cardiomyopathy: genetic determinants and mechanisms. Circ Res 2017; 121 : 731-748.
9. Pinard A, Jones GT, Milewicz DM. Genetics of thoracic and abdominal aortic diseases: aneurysms, dissections, and ruptures. Circ res. 2019; 124 : 588-606.
10. Verhagen JMA, Kempers M, Cozijnsen L, Bouma BJ, Duijnhouwer AL, Post JG, et al. Expert consensus recommendations on the cardiogenetic care for patients with thoracic aortic disease and their first-degree relatives. Int J Cardiol 2018; 258 : 243-248.
11. Bagnall RD, Weintraub RG, Ingles J, et al. A prospective study of sudden cardiac death among children and young adults. N Engl J Med 2016; 374 : 2441-2452.
12. Lahrouchi N, Raju H, Lodder EM, et al. Utility of post-mortem genetic testing in cases of sudden arrhythmic death syndrome. JACC 2017; 69 (17): 2134-2145.
13. Marcondes L, Crawford J, Earle N, et al. Long QT molecular autopsy in sudden unexplained death in the young (1-40 years old): lessons learnt from na eight year experience in New Zealand. PLOS ONE 2018; 1-17.
14. Tester DJ, Medeiros-Domingo A, Will ML, Haglund CM, Ackerman MJ. Cardiac channel molecular autopsy: insights from 173 consecutive cases of autopsy-negative sudden unexplained death referred for postmortem genetic testing. Mayo Clin Proc 2012; 87(6): 524-539.
15. Basso C, Aguilera B, Banner J, et al. Guidelines for autopsy investigation of sudden cardac death: 2017 update from the Association for European Cardiovascular Pathology. Virchows Arch 2017; 471 : 691-705.
16. Skinner JR, Winbo A, Abrams D, Vohra J, Wilde AA. Channelopathies that lead to sudden cardiac death: clinical and genetic aspects. Heart, Lung and Circulation 2019; 28 : 22-30.
17. Post-mortem in sudden unexpected death in the young: Guidelines on autopsy practice. Prepared by the members of Trans-Tasman Response AGAinst sudden Death in the Young (TRAGADY). Endorsed by the Royal College of Pathologists of Australasia. Officially endorsed by the National Heart Foundation of New Zealand.
18. Erbel R, Aboyans V, Boileau C, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases: document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult. The task force for the diagnosis and treatment of aortic diseases of the European Society of Cardiology (ESC). Eur Heart J. 2014; 35 (41): 2873-2926.
19. Pinard A, Salgado D, Desvignes JP, Rai G, Hanna N, Arnaud P, et al. WES/WGS Reporting of Mutations from Cardiovascular „Actionable“ Genes in Clinical Practice: A Key Role for UMD Knowledgebases in the Era of Big Databases. Hum Mutat 2016; 37(12): 1308-1317.
20. Sepši M, Zeman M, Synková I, et al. Náhlá srdeční smrt a její diagnostika. Kardiol Rev Int Med 2017; 19(4): 247-250.
21. Zeman M, Sepši M, Vojtíšek T, Šindler M. Suddenly deceased young individuals autopsied at the Department of forensic medicine, Brno - analysis. Soud
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inForensic Medicine

2020 Issue 1-
All articles in this issue
- Molekulární pitva a náhlá srdeční smrt u mladých lidí
- Správa zo študijného pobytu v DAN Europe (Taliansko) v dňoch 15.07. – 03.08.2019
- XI. Mezinárodní kongres úrazové chirurgie a soudního lékařství a národní kongres české společnosti úrazové chirurgie ČLS JEP
- XXVII. Ostravské dny forenzních věd
- 30 rokov Osteuropaverein Rechtsmedizin
- 98. Internationale Jahrestagung der Deutschen Gesellschaft für Rechtsmedizin
- 27th International Meeting on Forensic Medicine Alpe – Adria – Pannonia
- Medico Legal Conference Nepal and 10th International Conference Indian Association of Medico-Legal Experts
- Forensic Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Molekulární pitva a náhlá srdeční smrt u mladých lidí
- XXVII. Ostravské dny forenzních věd
- Správa zo študijného pobytu v DAN Europe (Taliansko) v dňoch 15.07. – 03.08.2019
- XI. Mezinárodní kongres úrazové chirurgie a soudního lékařství a národní kongres české společnosti úrazové chirurgie ČLS JEP
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

