-
Medical journals
- Career
Výskyt orální HPV infekce u zdravé populace – systematický přehled se zaměřením na evropskou populaci
: S. Simonidesová 1,2; E. Hamšíková 2; J. Klozar 1; R. Tachezy 3
: Klinika otorinolaryngologie a chirurgie hlavy a krku, 1. lékařská fakulta, Univerzita Karlova v Praze, Fakultní nemocnice v Motole, Praha 1; Oddělení imunologie, Ústav hematologie a krevní transfuze, Praha 2; Katedra genetiky a mikrobiologie, Přírodovědecká fakulta UK, Praha 3
: Epidemiol. Mikrobiol. Imunol. 67, 2018, č. 4, s. 175-183
: Review Article
Úvod:
Lidské papilomaviry (HPV), patřící do skupiny malých nádorových DNA virů, jsou kauzálně spojeny s karcinomem děložního hrdla a částí dalších anogenitálních, orálních a orofaryngeálních karcinomů mužů i žen. Cílem tohoto systematického přehledu je přinést souhrnné aktuální informace o výskytu orálních HPV u zdravé populace v Evropě.
Metodika:
Systematický přehled evropských studií o prevalenci orálních HPV infekcí publikovaných od ledna 2011 do září 2017.
Výsledky:
Celková prevalence orálních HPV infekcí u zdravé populace se pohybuje v rozmezí 1,2–11,6 %, vysoce rizikové typy HPV (HR HPV) byly nalezeny u 2,2–7,2 % a typ HPV16 u 0,2–2,9 % jedinců. Celková prevalence orálních HPV infekcí byla výrazně vyšší u mužů, kteří měli sex s muži, ve srovnání s heterosexuálními muži a ženami.
Závěr:
Prevalence orální HPV infekce v evropských populacích je srovnatelná s výsledky studií z USA a Asie. Na rizikové faktory orální HPV infekce u zdravé populace se však evropské studie příliš nezaměřovaly. Statisticky významný vztah mezi orálním sexem, kouřením a orální HPV infekcí, pozorovaný v rozsáhlých studiích z USA, potvrdila jen jedna evropská studie.
Klíčová slova:
HPV – infekce – prevalence – Evropa – rizikové faktory
ÚVOD
Lidské papilomaviry (HPV) jsou malé neobalené viry, které infikují výhradně epiteliální tkáně a vyvolávají tvorbu lézí či perzistují bez klinických projevů. Jejich životní cyklus je striktně vázán na diferenciační program keratinocytů. Viry mikroabrazemi vstupují do cílové buňky, v první fázi se tvoří pouze omezené množství virové DNA ve formě epizomů a poté, co buňka přejde do stadia diferenciace a putuje k povrchu epitelu, tvoří se postupně, v závislosti na stupni diferenciace, časné virové proteiny a tisíce kopií virové DNA. V horních kompletně diferencovaných vrstvách epitelu se pak produkují kapsidové proteiny a vznikají infekční viriony, které se uvolňují z odlupujících se buněk. V případě infekce sliznic HPV může dojít k procesu, kdy se diferenciace infikovaných keratinocytů zastaví a tyto množící se buňky dosáhnou až povrchu epitelu. Z hlediska viru je taková situace velmi nevýhodná, neboť taková buňka neposkytuje viru prostředí umožňující jeho replikaci a vznik infekčních částic. Právě takto pozměněné buňky nacházíme v intraepiteliálních lézích různé závažnosti. V méně závažných lézích najdeme velké spektrum různých genotypů HPV, ale s progresí lézí počet detekovaných typů klesá a v nejzávažnějších lézích nacházíme pak už jen typy vysoce rizikové (high risk, HR) [1]. Pokud není závažná premaligní léze chirurgicky odstraněna, může dojít k malignímu zvratu. Tento proces je však dlouhodobý, v řádech několika let.
HPV jsou heterogenní skupina virů zařazených do pěti rodů. V současné době je známo více než 200 genotypů HPV. HPV z rodu alfa (alfa-PV) jsou označovány jako slizniční, z rodu beta, gama, mu a nu jako kožní. Alfa-PV jsou dále děleny na vysokorizikové a nízkorizikové (LR, low risk) typy. Kožní infekce HPV typy z rodu beta (beta-PV) je velmi častá, ale u imunokompetentních osob většinou asymptomatická. Jako kofaktor se však účastní tyto viry při maligní transformaci lézí Epidermodysplasia verruciformis a iniciaci vzniku nemelanomových nádorů kůže. Většina studií se ale zaměřuje na studium prevalenci typů alfa-PV, které vyvolávají většinu HPV-asociovaných slizničních lézí, a to jak maligních, tak benigních [2].
LR HPV z rodu alfa vyvolávají především vznik genitálních bradavic a rekurentní laryngeální papilomatózy a vysocerizikové alfa typy jsou spojeny s cervikálními, vaginálními, penilními, análními, orálními a orofaryngeálními nádory. HPV16 byl prvním typem HR HPV, nalezeným v buňkách karcinomu děložního hrdla a je také nejčastějším typem ve všech malignitách lidí asociovaných s papilomaviry [3].
Jak bylo uvedeno výše, HPV infekce je rovněž spojena se vznikem nádorů hlavy a krku. Bylo zjištěno, že pacienti s orálním a orofaryngeálním karcinomem s nálezem HPV16 v nádorových buňkách jsou v porovnání s pacienty s orofaryngeálním karcinomem bez asociace HPV16 přibližně o 10 let mladší, mají méně komorbidit, významně nižší expozici alkoholu a tabáku a prognóza jejich onemocnění je lepší. Imunohistochemicky potvrzená nadměrná exprese nádorového supresorového proteinu p16, lokalizovaná v jádrech a cytoplazmě nádorových buněk, je nyní rutině používaným biomarkerem pro HPV-zprostředkovanou karcinogenezi a tím i pozitivním prognostickým faktorem pro pacienty s nádory hlavy a krku. Tyto změny jsou nově obsaženy i v 8. vydání TNM klasifikace, stagingový manuál American Joint Committee on Cancer (AJCC) [4].
U pacientů s nádory orofaryngu výskyt orální HPV infekce koreluje s HPV pozitivitou nádorové tkáně [5]. Prevalence orální HPV infekce u zdravých jedinců však byla zkoumána jen v omezeném počtu studií a rizikové faktory pro její výskyt nejsou dosud zcela objasněny.
Studie sledující frekvenci výskytu HPV v buňkách dutiny ústní a orofaryngu u zdravých jedinců ukázaly prevalenci HPV v rozmezí od 0,6 % do 14,0 %. Nejnižší prevalence (4/662) byla pozorována v Japonsku [6]. Naopak nejvyšší prevalenci 14,0 % zaznamenali v Mexické studii, zahrnující 390 žen s průměrným věkem 31 let [7].
Tento přehled prevalence HPV ve zdravé populaci považujeme za důležitý, jelikož incidence karcinomů orofaryngu v posledních letech významně stoupá prakticky ve všech zemích, kde je možné údaje dohledat v onkologickém registru. Ve skupině pacientů s těmito nádory stoupá podíl nádorů asociovaných s vysoce rizikovými typy HPV. V České republice bylo na začátku tisíciletí přibližně 60,0 % nádorů patrové mandle HPV pozitivních [8]. Zkoumání prevalence orální HPV infekce u zdravých jedinců a rizikových faktorů této infekce může přispět k definování preventivních opatření pro tento druh malignit.
MATERIÁLY A METODY
Strategie vyhledávání
Vyhledávací systém PubMed National Institutes of Health byl používán při hledání klíčových slov „HPV“ nebo „papillomavirus“, „oral“ nebo „oropharyngeal“ a „prevalence“ ve studiích zaměřených na lidský druh, publikovaných v angličtině od ledna 2011 do konce září 2017. Celkově bylo nalezeno 294 článků. Vyloučeny byly články zaměřené na orofaryngeální karcinom a premaligní léze (n = 108), HIV infikované nebo imunosuprimované subjekty (n = 29), na subjekty, které nebyly testovány na orální HPV infekci (n = 28) a na neevropské populace (n = 105). Výsledkem bylo 26 studií zkoumajících prevalenci HPV v dutině ústní a orofaryngu u zdravých jedinců v evropském regionu. Pokud jde o studie zaměřené na osoby infikované HIV, byla-li jako kontrola zahrnuta HIV--negativní osoba, tyto negativní kontroly byly zahrnuty do analýzy. Do přehledu byly zařazeny i studie zaměřené na novorozence. Mezi rizikové skupiny řadíme ženy s cervikální infekcí, ženy s cervikálními lézemi, jedince s kondylomaty a muže mající sex s muži.
Z vybraných studií byly extrahovány následující údaje: první autor, ročník publikace, země, studovaná populace, počet subjektů, pohlaví, věk, metoda odběru vzorků, metoda detekce HPV a metoda genotypizace HPV, celková prevalence HPV, prevalence HR HPV a prevalence HPV16 (tab. 1).
1. Evropské studie HPV prevalence v dutině ústní ve zdravé populaci za období let 2011–2017
Table 1. European studies of HPV prevalence in the oral cavity of healthy populations from 2011–2017

Vysvětlivky: k = kontroly; *Ž = ženy; M = muži; D = děti; HSIL = high-grade squamous intraepithelial lesion; NA = neuvedeno; RFLP = restrikční analýza amplikonů; PCR = polymerázová řetězová reakce; Luminex = typizace amplikonů pomocí technologie Luminex
**detailní popis metod viz reference, GP PCR, MY PCR, SPF 10 PCR, PGMY PCR, L1C1 PCR = polymerázová řetězová reakce, studie označené šedě analyzovaly i výskyt beta-PV. Note: k = controls; * Ž = women; M = men; D = children; HSIL = high-grade squamous intraepithelial lesion; NA = not addressed; RFLP = restriction fragment length polymorphism; PCR = polymerase chain reaction; Luminex = amplicon typing technology
**for detailed description of the methods, see references. GP PCR, MY PCR, SPF 10 PCR, PGMY PCR, L1C1 PCR = polymerase chain reactions, studies highlighted in grey also analysed the prevalence of beta-PV typesVÝSLEDKY
Celkově bylo zařazeno 26 studií, které zahrnovaly 10 236 subjektů (4 352 mužů, 5 071 žen a 813 jedinců neznámého pohlaví, věkový rozsah od narození do věku 82 let). Studie byly prováděny na populaci Itálie (n = 7), Švédska (n = 4), Finska (n = 4), Řecka (n = 2), Polska (n = 2), Rakouska, Skotska, Nizozemí, Německa, Maďarska, Chorvatska a Dánska (n = 1).
Použitá metoda odběru byla: orální stěr (N = 11), orální výplach (N = 13), kombinace stěru a orálního výplachu (N = 1) a biopsie ze sliznice (N = 1). V studiích, kde byla použita jako metoda odběru výplach, byla prevalence HPV nižší (prevalence v rozmezí: 1,0–10,3 %; průměr: 4,7 % ve skupině nerizikových, rizikové skupiny s maximální prevalencí 17,3 %; průměr: 7,8 %) než ve studiích, kde metodou odběru byl stěr (prevalence v rozmezí: 1,2–18,3 %; průměr: 10,3 % ve skupině nerizikových, rizikové skupiny s maximální prevalencí 19,6 %; průměr: 12,8%).
1. Používané metody detekce a genotypizace HPV
S výjimkou jedné studie všechny použily k detekci HPV polymerázovou řetězovou reakci (PCR), tedy metodu amplifikující vybrané úseky genomu. Použité primery byly převážně cílené do L1 genu a jednalo se o směs primerů nebo primery degenerované: GP5 +/GP6 + (N = 9), PGMY09/PGMY11 (N = 6), a MY09/MY11 (N = 3), SPF 10 (N = 2), L1C1 (N = 1) a dále nespecifikované PCR (N = 5). Všechny tyto primery umožňují záchyt širokého spektra HPV typů. Vzhledem k různorodosti použitých detekčních systémů v tomto přehledu není možné statisticky vyhodnocovat případné rozdíly v prevalenci HPV zjištěné v závislosti na použité metodě.
HPV genotypy byly stanovovány za využití Luminexu (N = 11), sekvenace (N = 8), hybridizace (N = 4), polymorfismu délky restrikčních fragmentů /restriction fragment length polymorphism = RFLP/ (N = 1), nebo blíže nespecifikovanou genotypizací (N = 2). Výhodou všech metod, s výjimkou sekvenace, je možnost detekovat i vícenásobnou infekci. Celkově bylo ve studiích detekováno 20 HR HPV typů (HPV 16, 18, 26, 31, 33, 35, 39, 42, 45, 51, 52, 53, 56, 58, 59, 66, 68,73, 82, 86) a 15 LR HPV typů (HPV 6, 11, 30, 42, 43, 44, 54, 55, 57, 69, 70, 81, 84, 89 a 90).
2. Orální prevalence HPV infekce
2. 1 Prevalence orální HPV infekce u dospělých
Celkově sedm evropských studií bylo zaměřeno na zdravou dospělou populaci. Celková prevalence orální HPV infekce ve zdravé populaci se pohybovala v rozmezí 1,4–18,1 % (tab. 2).
2. Studie HPV prevalence v dutině ústní zaměřené na zdravé dobrovolníky s počtem subjektů 100 a více a rizikové faktory orální HPV infekce
Table 2. Studies of HPV prevalence in the oral cavity on 100 or more healthy volunteers and risk factors for oral HPV infection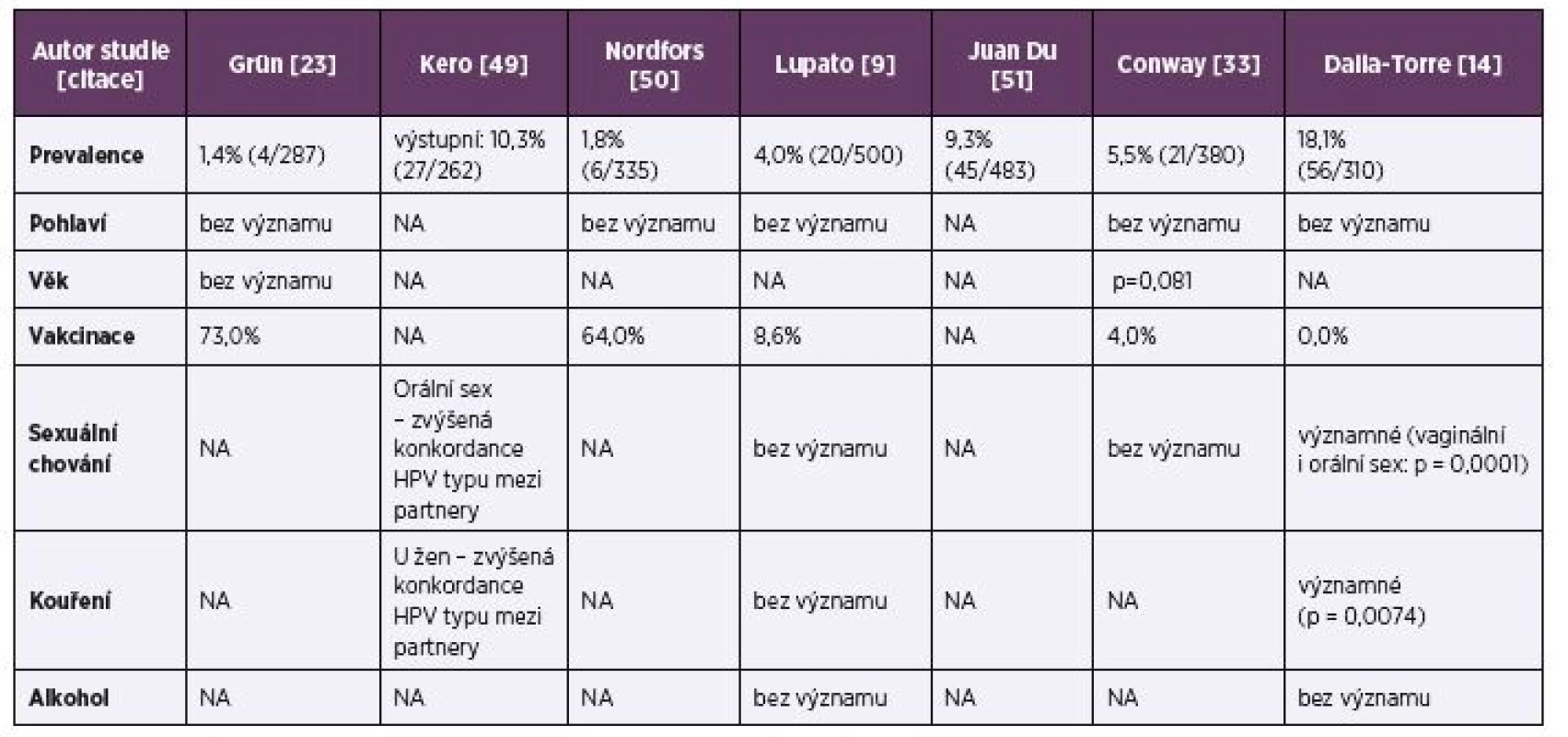
NA – studie se nevyjadřuje k dané otázce
NA – the study does not address the issuePrevalence vysoce rizikových typů HPV byla v rozmezí 2,2–7,2 %, z toho HPV16 pozitivita byla zjištěna u 0,2 % až 2,9 % jedinců. Největší studie na zdravé evropské populaci byla provedena v Itálii. Zahrnovala celkem 500 jedinců ve věku 19–35 let. Pozitivita na HPV byla zjištěna u 4,0 % zkoumané populace, HR HPV u 2,2 % a HPV16 u 1,6 % probandů [9].
2.2 Prevalence orální HPV infekce u dětí a dospívajících
Pět studií bylo zaměřeno na prevalenci orální HPV infekce u dětí. Největší polská studie zkoumající prevalenci orální HPV infekce u dětí a dospívajících s více než 4 000 probandy ve věku 10–18 let zjistila celkovou prevalenci 1,1 % [10]. V italské studii novorozenců (N = 177) ve věku 0–6 měsíců byla prevalence 14,0 % (HR: 3,4 %; HPV16 : 1,7 %). Finská studie sledovala novorozence matek s převážně vaginálním porodem a ukázala, že s odstupem několika měsíců od narození dochází ke snížení prevalence orálních HPV infekcí (prevalence HPV při narození: 22,5 %; 1. měsíc od narození: 18,7 %; 2. měsíce od narození: 16,9 %). Tato orální HPV infekce tedy představuje spíše osídlení dutiny ústní než infekci v pravém slova smyslu [11].
3. Perzistence orální HPV infekce
Dvě studie na finské populaci studovaly přetrvávání orální HPV infekce. Prevalence a perzistence HPV v dutině ústní byla sledována u žen po dobu 6 let, přičemž nejčastější byla infekce HPV16 (10,5 %) s průměrnou dobou perzistence 18,6 měsíců [12]. Další finská studie, tentokrát zaměřená na muže, ukázala rovněž jako nejčastější typ HPV16 (15,3 %). Průměrná doba přetrvávání infekce HPV16 byla pouze o málo delší, 21,7 měsíce. Jako rizikový faktor pro delší perzistenci HPV bylo identifikováno kouření [13].
4. Rizikové faktory pro orální HPV infekci
Rakouská studie zahrnující 310 nevakcinovaných subjektů s věkovým průměrem 26,5 let uvádí jako statisticky významný rizikový faktor kouření (méně než 5 balíčkoroků: p = 0,0215; více než 5 balíčkoroků: p = 0,0074). Dalším statisticky významným rizikovým faktorem je sexuální chování, a to jak orální sexuální styk (6–10 sexuálních partnerů: p = 0,0437; více než 11 sexuálních partnerů: < 0,0001), tak vaginální pohlavní styk, který je statisticky významný při počtu 11 a více sexuálních partnerů (p = 0,0001) [14].
Infekce v oblasti genitálního ústrojí jsou považovány za možný rizikový faktor pro HPV infekci v dutině ústní. Italská studie zaměřená na ženy s cervikální infekcí zjistila prevalenci orální HPV infekce 14,3 % (14/98). Jako jediný rizikový faktor byl popsán nízký věk začátku pohlavního života. Sexuální chování (počet partnerů pro vaginální a orální pohlavní styk), ani samotná přítomnost cervikální infekce nezvyšovala riziko orální HPV infekce [15].
V dánské studii byla prevalence orální HPV infekce u pacientů, kteří se léčili s genitálními bradavicemi (kondylomata) 10,4 % (HR: 6,6 %; LR: 3,8 %; HPV16 : 2,7 %). Kondylomata byla u mužů převážně penilní, u žen vulvární a přibližně jedna třetina kondylomat byla lokalizována perianálně. U mužů majících sex s muži byla perianální kondylomata nejčastější (75,0 %). Konkordance mezi HPV typy nalezenými v anální oblasti a dutině ústní byla statisticky významně nižší než konkordance mezi nálezem v dutině ústní a v oblasti genitálií (21,7 %, vs. 60,9 %) [16].
Dosud byly publikovány dvě studie zaměřené na prevalenci HPV v populaci mužů, kteří mají sex s muži. V nizozemské studii orální HPV prevalence byla prevalence HPV, HR HPV typů a HPV16 6,8 %, 6,1 % a 3,2 %. Hodnoty prevalence HPV u mužů, kteří měli sex s muži, byly v této studii statisticky významně vyšší ve srovnání s heterosexuálními muži [17]. V italské studii zaměřené na muže praktikující sex s muži byla prevalence orální HPV infekce u HIV pozitivních vyšší (27,8 %) než u HIV negativních (17,3 %), ale tento rozdíl nebyl statisticky signifikantní [18].
Další studie z Itálie zkoumala rizikové faktory prevalence orální HPV infekce v centru pro léčbu závislosti (58,0 % jedinců drogově závislých, 98,0 % jedinců pravidelně užívajících alkohol, 88,0 % uživatelů marihuany). Ve vstupních odběrech byla prevalence orální HPV infekce těchto rizikových skupin:15,0 %; HR HPV: 13,0 %; HPV16 : 3,0 %. Při kontrolním odběru jedinců pozitivních při zařazení do studie přetrvávala pozitivita vzorků po dvou letech u jedné třetiny subjektů. Nebyla však nalezena souvislost mezi orální HPV infekcí a věkem, pohlavím, HIV nebo HCV statusem, expozicí alkoholu nebo užíváním drog [19].
Finská studie zkoumala u rodin s kojícím dítětem přenos HPV infekce mateřským mlékem. Podle výsledků může HPV v mateřském mléce u kojících matek perzistovat a může sloužit k přenosu HPV infekce na ústní sliznice partnera, ale ne potomka. Při dalším sledování se potvrdila významná asociace přenosu z mateřského mléka na partnera. V této studii byly zkoumány jen alfa-PV typy. Přenos HPV infekce lze s největší pravděpodobností vysvětlit obnovením sexuálních praktik mezi páry s odstupem několika týdnů od porodu. Dalo by se rovněž diskutovat o tom, zda HPV pochází z mateřského mléka, nebo zda jde o kontaminaci z kůže prsou a bradavek [20]. V minulosti italská studie ukázala, že očištěním povrchové kožní vrstvy bradavky před odběrem se významně sníží prevalence alfa-PV a beta-HV v duktálním výplachu, mlezivu a mléku [21].
DISKUSE
Prevalence – přehledové studie ve světě
Většina publikovaných studií prevalence HPV v dutině ústní se zaměřovala na detekci alfa-PV typů. Prevalenci beta-HPV typů se věnoval ve své publikaci Sabol et al., který zjistil, že u 67 kontrolních jedinců byla prevalence orálních beta-HPV typů 56,7 %. Nejčastějšími beta-HPV typy byly HPV38 (11,9 %), HPV110 (11,9 %) HPV8 (10,4 %) a HPV24 (10,4 %) [2]. V evropských studiích byly nalezeny beta-PV typy v dutině ústní u dětské populace (nejčastěji detekovaný HPV12, HPV27) a u žen s cervikální infekcí (nejčastěji detekovaný HPV3, HPV10, HPV107) [10, 15, 22].
Evropské studie zaměřené na alfa-PV typy shodně ukázaly, že nejběžnějším typem alfa-PV infekce v ústní dutině, je HPV16 [23, 24]. Prevalence alfa-PV v evropských studiích (HPV: 1,2–11,6 %, HR HPV: 2,2–7,2 % a HPV16 : 0,2 až 2,9 %) byla shodná s výsledky studií z USA a Asie. Americká přehledová studie prevalence orální HPV infekce zahrnovala 18 studií, celkem se 4 581 zdravými probandy a zjistila, že prevalence orální HPV infekce byla 4,5 %, HR HPV infekce 3,5 % a HPV16 infekce 1,3 % [25]. Asijská přehledová studie zařadila 29 studií provedených v období let 2012–2015. V této studii bylo celkově 22 756 probandů. Výsledky ukázaly prevalenci orální HPV infekce 5,5 %; HR HPV: 2,7 % a HPV16 : 1,0 % [26].
Perzistence
Délka perzistence HPV v dutině ústní byla v evropských studiích shodná s výsledky studie z USA. Kreimer et al. ve své studii zkoumali orální HPV infekci u 1626 mužů po dobu 4 let. Výsledky prokázaly, že průměrná doba perzistence HPV16 byla 7,3 měsíce a většina HPV infekcí v dutině ústní vymizela do 1 roku [27]. Tyto výsledky potvrzuje také australská přehledová publikace, která zjistila průměrnou dobu přetrvávání HPV infekce v dutině ústní 6,5–18 měsíců, zatímco u HPV16 byla doba perzistence delší: 7–22 měsíců [28]. Finské studie ukázaly dobu perzistence HPV infekce v dutině ústní 6–30 měsíců a přetrvávání HPV16 infekce po dobu 18–22 měsíců.
Metoda odběru
Vyšší prevalenci HPV bychom očekávali v případě pacientů bez nálezu v dutině ústní u vzorků odebraných jako výplach, neboť tato metoda odběru zahrne celou dutinu ústní. Vyšší prevalenci ve stěrech lze vysvětlit vyšší razancí odběru, ale tuto hypotézu by bylo třeba ověřit na párových vzorcích. Lawton et al. hodnotili metody odběru a dospěli k výsledkům, že výplach dutiny ústní je nejlepší metoda odběru. Pozitivitu nálezu lze zvýšit kombinací s jinými metodami odběru [29]. Opačné výsledky byly nalezeny ve studii Jarboe et al., kde při porovnání efektivity odběru byla detekce orální HPV infekce u vzorků stěru vyšší než u výplachu [30]. V přehledu evropských studií byl vyšší záchyt orálních HPV při metodě odběru stěr v porovnání se studiemi, kde metodou odběru byl výplach (viz tab. 1).
Pohlaví
Evropské studie nepotvrdily statisticky významnou souvislost mezi prevalenci orální HPV infekce a pohlavím (viz tab. 2). Podobně v americké přehledové studii byla prevalence HPV u obou pohlaví shodná (4,6 % vs. 4,4 %) [25]. Současné studie uvádějí prevalenci HPV nižší u žen (2,9 %) než u mužů (4,7 %), což by mohlo být vysvětleno poklesem rychlosti šíření HPV infekce u žen v souvislosti s očkováním proti HPV [26].
Věk
Věkově závislá prevalence HPV v dutině ústní byla v některých studiích prokázána a v jiných nikoliv.
V největší studii v USA, která zahrnovala 5579 probandů ve věku 14–69 let, byla orální HPV infekce detekována u 4,0 % vzorků. Nejvyšší prevalence byla pozorována ve věkové skupině 30–34 let (7,0 %) a 60–64 (11,0 %). Autoři studie uvádějí jako možné vysvětlení 2 vrcholů infekce zvýšenou sexuální aktivitu při prvním zvýšení prevalence a sníženou efektivitu imunitních mechanismů v důsledku stárnutí při druhém maximu [31]. Naopak studie autorů Hang et al. ukázala v rozporu s výše zmíněnou studií, že se HPV prevalence snižuje se stoupajícím věkem [32].
Z evropských prevalenčních studií asociaci mezi věkem a prevalencí orálních HPV infekcí zkoumala pouze skotská studie s probandy ve věkovém rozmezí 16–69 let. Největší prevalence orální HPV byla ve věkové kategorii 26–39 let (10,4 %), nejnižší ve věkové skupině 16–25 let (2,6 %) [33].
Rizikové faktory
HPV infekce je přenášena do ústní dutiny intimním sexuálním kontaktem. Pokud jde o orální sex, jeho úloha při přenosu HPV infekce je nejasná. Několik mimoevropských studií zjistilo, že sexuální chování (tj. rodinný stav, počet sexuálních partnerů, rizikoví sexuální partneři, vaginální a orální sex) [24, 31, 34, 35], kouření a pití alkoholu [31, 35] jsou významnými rizikovými faktory pro orální HPV infekci. Naopak studie Kreimer et al. zaměřená na rizikové faktory v mužské populaci, tuto souvislost nepotvrdila [27].
V přehledu evropských studií jako statisticky významný rizikový faktor uvádí kouření a sexuální chování (počet sexuálních partnerů na orální a vaginální sex) jen jedna rakouská studie [14] – viz tabulka 2. Ostatní studie buď dané rizikové faktory nezkoumaly, nebo neprokázaly, že by se jednalo o faktory rizikové.
V severoamerické studii zaměřené na souvislost orální HPV infekce se sexuálním chováním byla vyšší prevalence detekována u osob, které v období posledních 3 měsíců měli orální pohlavní styk [36].
Jak naznačují výsledky metaanalýzy Shigeishiho et al., mezi další rizikové faktory patří i změny v dutině ústní. Nedostatečná ústní hygiena zvyšuje riziko infekce HPV. Při porovnání uživatelů zubních protéz se prokázal vyšší výskyt infekce HPV u pacientů se špatnou ústní hygienou [37].
Kouření bylo prokázáno jako další rizikový faktor zvyšující prevalenci orální HPV infekce. Vysvětlením může být indukce zánětu a potlačení imunitních mechanismů chemickými látkami obsaženými v tabáku [24, 26, 27, 35]. Ve studii Gillisona et al. autoři ukazují, že ženy kuřačky mají mnohem vyšší prevalenci orální HPV infekce než muži kuřáci, i když obecně je prevalence vyšší u mužů. Kouření je tedy považováno za významný rizikový faktor, zejména u žen [31].
Prevence
Prevenci HPV asociovaných nádorů lze provádět dvěma cestami: primární prevencí profylaktickou vakcinací proti HPV u dětí obou pohlaví a také sekundární prevencí nebo včasnou identifikací počátečních stadií (sérologicky pozitivní protilátky proti HPV16 E6 onkoproteinům). Tato opatření by tak postupně mohla vést k eradikaci karcinomů hlavy a krku spojených s HPV, jejichž výskyt v posledních letech rychle roste. Odhaduje se, že pokud se udrží současné trendy, budou v budoucnosti HPV asociované malignity patřit k nejčastějším nádorům hlavy a krku [38].
Právě dlouhé období mezi orální infekcí HPV a vznikem karcinomu ústní dutiny a orofaryngu by mohlo představovat prostor pro sekundární prevenci.
HPV-pozitivním pacientům budeme patrně v budoucnosti moci nabídnout, kromě pečlivého sledování, také preventivní intervenci ve formě tonzilektomie. Souvislost mezi tonzilektomií a výskytem orofaryngeálního karcinomu byla zkoumána ve studii využívající data z dánského registru rakoviny pro období let 1977–2012. Podle této studie oboustranná tonzilektomie významně snižuje riziko vzniku nádorů orofaryngu [39].
Tento přehled evropské literatury má určité nedostatky. Studií je malé množství a jsou velmi různorodé jak co do použitých detekčních metod HPV, tak i co do způsobu odběru klinického materiálu. Studie se též značně liší analyzovanou populací z hlediska věku, pohlaví, sexuální orientace, počtu probandů a geografické lokalizace.
ZÁVĚRY
Světové studie zejména z USA a Asie potvrdily, že sexuální chování a kouření souvisejí s orální HPV infekcí u zdravých jedinců. Současně kouření bylo prokázáno jako významný rizikový faktor pro orální infekci HPV u žen. Evropských studií zaměřených na prevalenci orální HPV infekce ve zdravé populaci a zkoumání rizikových faktorů této infekce je stále málo a často jsou zaměřeny na úzký okruh pacientů nebo dobrovolníků se specifickým problémem. Nicméně publikované studie na Evropské populaci ukazují srovnatelnou prevalenci HPV v dutině ústní u zdravých jedinců jako studie z jiných kontinentů a populací. Souvislost prevalence těchto infekcí se sexuálním chováním a kouřením byla potvrzena zatím jen v jedné evropské studii. Je tedy zapotřebí dalších studií, které potvrdí, či vyvrátí zjištěné skutečnosti.
Grantová podpora: GAUK č. 114216.
Do redakce došlo dne 28. 2. 2018.
Adresa pro korespondenci:
MUDr. Simona Simonidesová
Klinika ORL a chirurgie hlavy a krku
1. LF a FN v Motole
V Úvalu 84
150 06 Praha 5
e-mail: ssimonidesova@gmail.com
Sources
1. Cubie HA. Diseases associated with human papillomavirus infection. Virology, 2013;445 : 21–34.
2. Sabol I, Smahelova J, Klozar J, Mravak-Stipetic M, Gheit T, Tommasino M, Grce M, Tachezy R. Beta-HPV types in patients with head and neck pathology and in healthy subjects. J Clin Virol, 2016;82 : 159–165.
3. Durst M, Gissmann L, Ikenberg H, Zur HH. A papillomavirus DNA from a cervical carcinoma and its prevalence in cancer biopsy samples from different geographic regions. Proc Natl Acad Sci U S A, 1983;80 : 3812–3815.
4. Lydiatt WM, Patel SG, O‘Sullivan B, Brandwein MS, Ridge JA, Migliacci JC, Loomis AM, Shah JP. Head and Neck cancers-major changes in the American Joint Committee on cancer eighth edition cancer staging manual. CA Cancer J Clin, 2017;67 : 122–137.
5. Tachezy R, Klozar J, Rubenstein L, Smith E, Salakova M, Smahelova J, Ludvikova V, Rotnaglova E, Kodet R, Hamsikova E. Demographic and risk factors in patients with head and neck tumors. J Med Virol 2009;81 : 878–887.
6. Kurose K, Terai M, Soedarsono N, Rabello D, Nakajima Y, Burk RD, Takagi M. Low prevalence of HPV infection and its natural history in normal oral mucosa among volunteers on Miyako Island, Japan. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2004;98 : 91–96.
7. Gonzalez-Losa MR, Barrera ES, Herrera-Pech V, Conde-Ferraez L, Puerto-Solis M, Ayora-Talavera G. Epidemiology of oral HPV in the oral mucosa in women without signs of oral disease from Yucatan, Mexico. Braz J Microbiol, 2015;46 : 301–306.
8. Rotnaglova E, Tachezy R, Salakova M, Prochazka B, Koslabova E, Vesela E, Ludvikova V, Hamsikova E, Klozar J. HPV involvement in tonsillar cancer: Prognostic significance and clinically relevant markers. Int J Cancer, 2011;129 : 101–110.
9. Lupato V, Holzinger D, Hofler D, Menegaldo A, Giorgi RP, Del MA, Da Mosto MC, Pawlita M, Boscolo-Rizzo P. Prevalence and Determinants of Oral Human Papillomavirus Infection in 500 Young Adults from Italy. PLoS One, 2017;12:e0170091.
10. Durzynska J, Pacholska-Bogalska J, Kaczmarek M, Hanc T, Durda M, Skrzypczak M, Gozdzicka-Jozefiak A. HPV genotypes in the oral cavity/oropharynx of children and adolescents: cross-sectional survey in Poland. Eur J Pediatr, 2011;170 : 757–761.
11. Koskimaa HM, Waterboer T, Pawlita M, Grenman S, Syrjanen K, Syrjanen S. Human papillomavirus genotypes present in the oral mucosa of newborns and their concordance with maternal cervical human papillomavirus genotypes. J Pediatr, 2012;160 : 837–843.
12. Rautava J, Willberg J, Louvanto K, Wideman L, Syrjanen K, Grenman S, Syrjanen S. Prevalence, genotype distribution and persistence of human papillomavirus in oral mucosa of women: a six-year follow-up study. PLoS One, 2012;7:e42171.
13. Kero K, Rautava J, Syrjanen K, Willberg J, Grenman S, Syrjanen S. Smoking increases oral HPV persistence among men: 7-year follow-up study. Eur J Clin Microbiol Infect Dis, 2014;33 : 123–133.
14. Dalla TD, Burtscher D, Solder E, Widschwendter A, Rasse M, Puelacher W. The impact of sexual behavior on oral HPV infections in young unvaccinated adults. Clin Oral Investig, 2016;20 : 1551–1557.
15. Termine N, Giovannelli L, Matranga D, Caleca MP, Bellavia C, Perino A, Campisi G. Oral human papillomavirus infection in women with cervical HPV infection: new data from an Italian cohort and a metanalysis of the literature. Oral Oncol, 2011;47 : 244–250.
16. Kofoed K, Sand C, Forslund O, Madsen K. Prevalence of human papillomavirus in anal and oral sites among patients with genital warts. Acta Derm Venereol, 2014;94 : 207–211.
17. van Rijn VM, Mooij SH, Mollers M, Snijders PJ, Speksnijder AG, King AJ, de Vries HJ, van EA, van der Klis FR, de Melker HE, van der Sande MA, van der Loeff MF. Anal, penile, and oral high-risk HPV infections and HPV seropositivity in HIV-positive and HIV-negative men who have sex with men. PLoS One, 2014;9:e92208.
18. Rollo F, Latini A, Pichi B, Colafigli M, Benevolo M, Sinopoli I, Sperduti I, Laquintana V, Fabbri G, Frasca M, Cristaudo A, Giuliani M, Dona MG. Prevalence and determinants of oral infection by Human Papillomavirus in HIV-infected and uninfected men who have sex with men. PLoS One, 2017;12:e0184623.
19. Pugliese DB, Bruzzesi G, Montaldo C, Porcu L, Landi M, Mastinu A, Torri V, Licitra L, Locati LD. Oral prevalence and clearance of oncogenic human papilloma virus in a rehabilitation community for substance abusers in Italy: a case of behavioral correction? J Oral Pathol Med, 2015;44 : 728–733.
20. Louvanto K, Sarkola M, Rintala M, Syrjanen K, Grenman S, Syrjanen S. Breast Milk is a Potential Vehicle for HPV Transmission to Oral Mucosa of the Spouse. Pediatr Infect Dis J, 2017.
21. Cazzaniga M, Gheit T, Casadio C, Khan N, Macis D, Valenti F, Miller MJ, Sylla BS, Akiba S, Bonanni B, DeCensi A, Veronesi U, Tommasino M. Analysis of the presence of cutaneous and mucosal papillomavirus types in ductal lavage fluid, milk and colostrum to evaluate its role in breast carcinogenesis. Breast Cancer Res Treat, 2009;114 : 599–605.
22. Martinelli M, Zappa A, Bianchi S, Frati E, Colzani D, Amendola A, Tanzi E. Human papillomavirus (HPV) infection and genotype frequency in the oral mucosa of newborns in Milan, Italy. Clin Microbiol Infect, 2012;18:E197–E199.
23. Grun N, Ahrlund-Richter A, Franzen J, Mirzaie L, Marions L, Ramqvist T, Dalianis T. Oral human papillomavirus (HPV) prevalence in youth and cervical HPV prevalence in women attending a youth clinic in Sweden, a follow up-study 2013-2014 after gradual introduction of public HPV vaccination. Infect Dis (Lond), 2015;47 : 57–61.
24. Dahlstrom KR, Burchell AN, Ramanakumar AV, Rodrigues A, Tellier PP, Hanley J, Coutlee F, Franco EL. Sexual transmission of oral human papillomavirus infection among men. Cancer Epidemiol Biomarkers Prev, 2014;23 : 2959–2964.
25. Kreimer AR, Bhatia RK, Messeguer AL, Gonzalez P, Herrero R, Giuliano AR. Oral human papillomavirus in healthy individuals: a systematic review of the literature. Sex Transm Dis, 2010;37 : 386–391.
26. Shigeishi H, Sugiyama M. Risk Factors for Oral Human Papillomavirus Infection in Healthy Individuals: A Systematic Review and Meta-Analysis. J Clin Med Res, 2016;8 : 721–729.
27. Kreimer AR, Pierce Campbell CM, Lin HY, Fulp W, Papenfuss MR, Abrahamsen M, Hildesheim A, Villa LL, Salmeron JJ, Lazcano-Ponce E, Giuliano AR. Incidence and clearance of oral human papillomavirus infection in men: the HIM cohort study. Lancet, 2013;382 : 877–887.
28. Wood ZC, Bain CJ, Smith DD, Whiteman DC, Antonsson A. Oral human papillomavirus infection incidence and clearance: a systematic review of the literature. J Gen Virol, 2017;98 : 519–526.
29. Lawton G, Thomas S, Schonrock J, Monsour F, Frazer IH. Human papillomaviruses in normal oral mucosa: a comparison of methods for sample collection. J Oral Pathol Med, 1992;21 : 265–269.
30. Jarboe EA, Willis M, Bentz B, Buchmann L, Hunt J, Ellis G, Layfield L. Detection of human papillomavirus using hybrid capture 2 in oral brushings from patients with oropharyngeal squamous cell carcinoma. Am J Clin Pathol, 2011;135 : 766–769.
31. Gillison ML, Broutian T, Pickard RK, Tong ZY, Xiao W, Kahle L, Graubard BI, Chaturvedi AK. Prevalence of oral HPV infection in the United States, 2009–2010. JAMA, 2012;307 : 693–703.
32. Hang D, Liu F, Liu M, He Z, Sun M, Liu Y, Li J, Pan Y, Ning T, Guo C, Liang Y, Xu R, Zhang L, Cai H, Ke Y. Oral human papillomavirus infection and its risk factors among 5,410 healthy adults in China, 2009–2011. Cancer Epidemiol Biomarkers Prev, 2014;23 : 2101–2110.
33. Conway DI, Robertson C, Gray H, Young L, McDaid LM, Winter AJ, Campbell C, Pan J, Kavanagh K, Kean S, Bhatia R, Cubie H, Clarkson JE, Bagg J, Pollock KG, Cuschieri K. Human Papilloma Virus (HPV) Oral Prevalence in Scotland (HOPSCOTCH): A Feasibility Study in Dental Settings. PLoS One, 2016;11:e0165847.
34. Antonsson A, Cornford M, Perry S, Davis M, Dunne MP, Whiteman DC. Prevalence and risk factors for oral HPV infection in young Australians. PLoS One, 2014;9:e91761.
35. Cook RL, Thompson EL, Kelso NE, Friary J, Hosford J, Barkley P, Dodd VJ, Abrahamsen M, Ajinkya S, Obesso PD, Rashid MH, Giuliano AR. Sexual behaviors and other risk factors for oral human papillomavirus infections in young women. Sex transm dis, 2014;41 : 486–492.
36. D‘Souza G, Kluz N, Wentz A, Youngfellow RM, Griffioen A, Stammer E, Guo Y, Xiao W, Gillison ML. Oral Human Papillomavirus (HPV) Infection among Unvaccinated High-Risk Young Adults. Cancers (Basel), 2014;6 : 1691–1704.
37. Nishimura Y, Maeda H, Hattori M, Azumaya F, Muramatsu I, Kameyama Y, Tanaka Y, Kawaguchi T. Human papillomavirus infec-tion in the oral cavity of denture wearers. Nihon Hotetsu Shika Gakkai Zasshi, 2004;48 : 713–722.
38. Kreimer AR: Prospects for prevention of HPV-driven oropharynx cancer. Oral Oncol, 2014;50 : 555–559.
39. Fakhry C, Andersen KK, Christensen J, Agrawal N, Eisele DW. The Impact of Tonsillectomy upon the Risk of Oropharyngeal Carcinoma Diagnosis and Prognosis in the Danish Cancer Registry. Cancer Prev Res (Phila), 2015;8 : 583–589.
40. Tatar TZ, Kis A, Szabo E, Czompa L, Boda R, Tar I, Szarka K. Prevalence of human papillomaviruses in the healthy oral mucosa of women with high-grade squamous intra-epithelial lesion and of their partners as compared to healthy controls. J Oral Pathol Med, 2015;44 : 722–727.
41. Szydlowski J, Jonczyk-Potoczna K, Pucher B, Buraczynska-Andrzejewska B, Prauzinska M, Kolasinska-Lipinska J, Krauss H, Piatek J, Zukiewicz-Sobczak W. Prevalence of human papillomavirus (HPV) in upper respiratory tract mucosa in a group of pre-school children. Ann Agric Environ Med, 2014;21 : 822–824.
42. Migaldi M, Pecorari M, Forbicini G, Nanni N, Grottola A, Grandi T, Delle DG, Leocata P, Trovato D, Sgambato A. Low prevalence of human papillomavirus infection in the healthy oral mucosa of a Northern Italian population. J Oral Pathol Med, 2012;41 : 16–20.
43. Mammas IN, Sourvinos G, Giamarelou P, Michael C, Spandidos DA. Human papillomavirus in the oral cavity of children and mode of delivery: a retrospective study. Int J STD AIDS, 2012;23 : 185–188.
44. Adamopoulou M, Vairaktaris E, Nkenke E, Avgoustidis D, Karakitsos P, Sioulas V, Nisyrios T, Yapijakis C. Prevalence of human papillomavirus in saliva and cervix of sexually active women. Gynecol Oncol, 2013;129 : 395–400.
45. Mravak-Stipetic M, Sabol I, Kranjcic J, Knezevic M, Grce M. Human papillomavirus in the lesions of the oral mucosa according to topography. PLoS One, 2013;8:e69736.
46. Meyer MF, Huebbers CU, Siefer OG, Vent J, Engbert I, Eslick GD, Valter M, Klussmann JP, Preuss SF. Prevalence and risk factors for oral human papillomavirus infection in 129 women screened for cervical HPV infection. Oral Oncol, 2014;50 : 27–31.
47. Grun N, Mbuya W, Ternhag A, Ramqvist T, Ahlberg A, Jangard M, Dalianis T, Hammarstedt-Nordenvall L. Human papillomavirus prevalence in mouthwashes of patients undergoing tonsillectomy shows dominance of HPV69, without the corresponding finding in the tonsils. Infect Dis (Lond), 2017;49 : 588–593.
48. Visalli G, Curro M, Facciola A, Riso R, Mondello P, Lagana P, Di PA, Picerno I, Spataro P. Prevalence of human papillomavirus in saliva of women with HPV genital lesions. Infect Agent Cancer, 2016;11 : 48.
49. Kero K, Rautava J, Louvanto K, Syrjanen K, Grenman S, Syrjanen S. Genotype-specific concordance of oral and genital human papillomavirus infections among marital couples is low. Eur J Clin Microbiol Infect Dis, 2016;35 : 697–704.
50. Nordfors C, Grun N, Haeggblom L, Tertipis N, Sivars L, Mattebo M, Larsson M, Haggstrom-Nordin E, Tyden T, Ramqvist T, Dalianis T. Oral human papillomavirus prevalence in high school students of one municipality in Sweden. Scand J Infect Dis, 2013;45 : 878–881.
51. Du J, Nordfors C, Ahrlund-Richter A, Sobkowiak M, Romanitan M, Nasman A, Andersson S, Ramqvist T, Dalianis T. Prevalence of oral human papillomavirus infection among youth, Sweden. Emerg Infect Dis, 2012;18 : 1468–1471.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2018 Issue 4-
All articles in this issue
- Prion diseases with a focus on Creutzfeldt-Jakob disease, a summary of the incidence of Creutzfeldt-Jakob disease in the Czech Republic over the last 17 years, 2000–2017
- Properties of Staphylococcus aureus strains from food processing staff
- The prevalence of oral HPV infection in healthy populations: A systematic review with a focus on European populations
- Epidemiology of selected Mycobacterium tuberculosis complex members in the Czech Republic in 2000–2016
- Cerebrospinal Fluid Pleocytosis following Meningococcal B vaccination in an Infant
- Microorganisms named after geographical locations and personal names of Czech and Slovak microbiologists
- Antimicrobial effect of novel hydrogel matrix based on natural polysaccharide Sterculia urens
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Prion diseases with a focus on Creutzfeldt-Jakob disease, a summary of the incidence of Creutzfeldt-Jakob disease in the Czech Republic over the last 17 years, 2000–2017
- The prevalence of oral HPV infection in healthy populations: A systematic review with a focus on European populations
- Properties of Staphylococcus aureus strains from food processing staff
- Epidemiology of selected Mycobacterium tuberculosis complex members in the Czech Republic in 2000–2016
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

