-
Medical journals
- Career
Antibiotická rezistence u netyfových sérovarů Salmonella spp. v České republice
Authors: Žemličková Helena; Dědičová Daniela; Jakubů Vladislav; Mach Jakub; Kolínská Renata; Malíková Eliška; al. Urbášková Pavla Et * **
Authors‘ workplace: Státní zdravotní ústav, Praha
Published in: Epidemiol. Mikrobiol. Imunol. 62, 2013, č. 2, s. 43-49
* korespondující autor
**V. Adámková, N. Bartoníková, M. Bártová, E. Bendová, T. Bergerová, Z. Bohunová, E. Čápová, M. Dovalová, M. Glasnák, M. Hanslianová, V. Hásková, B. Heinigeová, N. Hermanová, M. Horníková, B. Horová, E. Chmelařová, J. Janečková, P. Ježek, V. Jindrák, I. Kohnová, L. Kolářová, D. Krčková, V. Kůrková, P. Linhart, M. Machučová, J. Miklová, J. Niemczyková, O. Nyč, B. Ochvatová, A. Ouertani, P. Paterová, Z. Pokorná, J. Pomykal, A. Sekáčová, J. Scharfen, H. Skačáni, A. Steinerová, E. Šimečková, M. Štolbová, R. Tejkalová, L. Trojan, E. Uhlířová, L. Vašková, E. Veselá, E. Zálabská, D. Zamazalová, R. Záruba, J. ŽeleznáOverview
Cíl práce:
Zjistit antibiotickou rezistenci a frekvenci výskytu multirezistentních kmenů u netyfových sérovarů salmonel, izolovaných od lidí.Materiál a metodiky:
Konsekutivní izoláty salmonel, izolované v průběhu studie od pacientů ve 48 mikrobiologických laboratořích v průběhu měsíce května roku 2012, byly analyzovány v příslušných referenčních laboratořích SZÚ. Kmeny byly reidentifikovány a byly zjištěny jejich sérovary. K zjištění citlivosti byla použita mikrodiluční metoda stanovení minimálních inhibičních koncentrací 11 antibiotik.Výsledky:
Mezi celkem 25 sérovary, zjištěnými v souboru 637 kmenů Salmonella enterica, byl nejpočetněji zastoupen sérovar Enteritidis (87,0 %), následoval sérovar Typhimurium (4,9 %), monofázická varianta Typhimurium 4,[5],12:i: - (2,0 %) a Mbandaka (0,6 %), kmeny ostatních sérovarů se vyskytovaly ojediněle. Celkem 558 kmenů (87,6 %) bylo citlivých ke všem vyšetřovaným antibiotikům, ostatní kmeny (n = 79) byly rezistentní k jednomu nebo k více antibiotikům.Prevalence rezistence v celém souboru 637 kmenů k jednotlivým antibiotikům byla následující:
ampicilin 8,5 %, tetracyklin 5,7 %, sulfamethoxazol 5,2 %, ciprofloxacin 3,8 %, chloramfenikol 2,5 %, kmeny rezistentní ke gentamicinu, trimethoprimu a cefalosporinům 3. a 4. generace se vyskytly jen ojediněle (≤ 0,5 %), k meropenemu nebyl rezistentní žádný kmen. Tři producenti širokospektré betalaktamázy byli multirezistentní, a u dvou z nich izolovaných od dvojčat byl zjištěn odlišný vzor rezistence.
Mezi rezistentními kmeny byl nejčastěji zastoupen sérovar Enteritidis (49,4 %), následovaly sérovary Typhimurium (26,6 %) a monofázická varianta Typhimurium (15,2 %). Zatímco podíl rezistentních kmenů mezi všemi kmeny sérovaru Enteritidis v souboru byl pouze 7% (39 z 554 kmenů), u sérovarů Typhimurium a jeho monofázické varianty 4,[5],12:i: - činil podíl rezistentních kmenů 66,7 %, respektive 92,3 %. Rezistentní byly dále všechny kmeny sérovarů Virchow (n = 3), Kentucky (n = 1), Newport (n = 1), dva ze tří kmenů sérovaru Infantis, a jeden ze dvou kmenů sérovaru Stanley. Všech pět izolátů z krve patřilo k sérovaru Enteritidis, jeden z nich byl rezistentní k ciprofloxacinu. Mezi 79 rezistentními kmeny bylo 26,6 % samostatně rezistentních k ampicilinu a 24,1 % k ciprofloxacinu, multirezistence (rezistence ke třem a více antibiotikům) byla potvrzena u 43,0 % kmenů.Závěry:
Přes relativně nízkou prevalenci rezistence k vyšetřovaným antibiotikům v souboru 637 kmenů byly shledány tyto znepokojivé nálezy: výskyt kmenů Salmonella enterica rezistentních k lékům volby salmonelových infekcí ciprofloxacinu nebo k cefalosporinům vyšších generací, a prevalence multirezistence u dvou třetin kmenů sérovaru Typhimurium a s výjimkou jednoho u všech kmenů jeho monofázické varianty 4,[5],12:i:-.Klíčová slova:
netyfové salmonely – sérovary – antibiotická rezistenceÚVOD
Netyfové kmeny salmonel jsou v současné době druhou nejčastější příčinou bakteriálních gastroenteritid v zemích Evropské unie [1]. Nekomplikovaná onemocnění způsobená salmonelami jsou obvykle samoúzdravná a jejich léčba vyžaduje nejvýše podpůrná opatření sestávající z náhrady tekutin a odpočinku. Podání antibiotik v těchto případech naopak vylučování salmonel prodlužuje [2]. Sérovary netyfových salmonel jsou geneticky blízce příbuzné, některé z nich jsou však častěji spojeny se vznikem invazivních infekcí [3]. Léčba účinnými antibiotiky je nezbytná u pacientů se salmonelovou bakteriémií, meningitidou, infekcí kloubů, nebo i u gastroenteritid osob se základním oslabujícím onemocněním, dětí mladších dvou měsíců věku, v těhotenství a u starších pacientů [2].
Zdrojem infekcí jsou téměř výlučně nedostatečně tepelně upravené potraviny živočišného původu, kontaminované salmonelami při výrobě, zpracování, skladování nebo distribuci. Používání antibiotik v chovech zvířat primárně selektuje kmeny salmonel s antibiotickou rezistencí, jejichž frekvence výskytu je mnohonásobně vyšší než u lidí [1]. Jak ukázal první nález salmonel rezistentních ke kolistinu u 21 % prasat, jimž byl kolistin podáván v potravě [4], může být tento proces zisku rezistence velmi rychlý v důsledku vysoké mutační rychlosti, která je u kolistinu mnohonásobně vyšší než u jiných antibiotik [5]. Fluorochinolony jsou dokonce schopny selektovat salmonely s mnohočetnou antibiotickou rezistencí [6]. U kmenů salmonel, izolovaných od potravinových zvířat, byly prokázány geny rezistence ke všem antibiotikům používaným v humánní medicíně včetně plazmidy šířené rezistence k fluorochinolonům [7, 8, 9], cefalosporinům vyšších generací [9] a karbapenemům [10].
Z těchto důvodů je zapotřebí sledovat stav a trendy antibiotické rezistence k antibiotikům doporučovaným k léčbě salmonelových infekcí, zejména k cefalosporinům vyšších generací a fluorochinolonům [2], a také k dalším antibiotikům, významným z hlediska epidemiologie rezistence.
Naše předchozí studie, provedená v roce 2000, ukázala poměrně nízkou prevalenci antibiotické rezistence salmonel izolovaných od lidí [11]. Vzhledem k tomu, že rezistence salmonel se v čase může měnit, rozhodli jsme se zjistit:
- celkovou prevalenci antibiotické rezistence salmonel izolovaných od lidí během jednoho měsíce roku 2012,
- výskyt rezistence u jednotlivých sérovarů,
- frekvenci výskytu multirezistentních kmenů.
MATERIÁL A METODY
Organizace studie. V první polovině roku 2012 byly vyzvány mikrobiologické laboratoře, sdružené v Pracovní skupině pro monitorování rezistence při Národní referenční laboratoři (NRL) pro antibiotika SZÚ Praha, aby se zúčastnily sběru kmenů salmonel, izolovaných v průběhu měsíce června.
Laboratoře. Sběru se zúčastnilo 48 mikrobiologických laboratoří. Do souboru byly zařazeny konsekutivní kmeny salmonel, izolované při rutinním mikrobiologickém vyšetřování klinických vzorků pacientů. Opakované izoláty od jednoho pacienta byly vyřazeny. Laboratoře zasílaly kmeny a základní údaje o pacientech do SZÚ, kde v NRL pro salmonely byly kmeny podrobně identifikovány a v NRL pro antibiotika byla vyšetřena jejich citlivost.
Kmeny. Izoláty na transportních půdách byly okamžitě po doručení do NRL pro salmonely zpracovávány metodami běžně používanými v rámci klasifikace čeledi Enterobacteriaceae, včetně systému MALDI TOF – Biotyper. Z celkem 674 kmenů, zaslaných v rámci této studie zúčastněnými laboratořemi, bylo v NRL pro salmonely vyřazeno 37 kmenů (dva kmeny nevyrostly, 7 kmenů byly jiné druhy čeledi Enterobacteriaceae, a 28 kmenů byly opakované izoláty od jednoho pacienta). U konfirmovaných kmenů byl specifikován sérotyp. Sérologická diagnostika byla prováděna metodou sklíčkové aglutinace s komerčními hyperimunními králičími séry několika výrobců (SIFIN, BioRad, Denka Seiken a Reagensia). Zařazení k jednotlivým sérovarům bylo provedeno na základě antigenní formule podle Whitteova-Kauffmannova--Le Minoreova schématu [12]. Kmeny identifikované jako monofázická varianta Typhimurium (sérotyp S.4,[5],12:i:-) byly dotypovány rovněž pomocí PCR průkazu genů fliB-fliA a fljB, které jsou specifické pro sérovar Typhimurium nebo kódují protein druhé bičíkové fáze.
Kmeny byly uchovávány na kryokonzervách a před vyšetřením antibiotické citlivosti vyočkovány na živný agar.
Vyšetření citlivosti. Minimální inhibiční koncentrace (MIC) antibiotik byly vyšetřeny mikrodiluční metodou pro gramnegativní střevní tyčky [13]. Pro studii byly připraveny mikrotitrační destičky s 11 antibiotiky v Muellerově-Hintonové bujonu. Zdrojem většiny antibiotik byly tablety Mast, jen substance sulfamethoxazolu byla od firmy Merck. Rozmezí osmi koncentrací antibiotik ředěných dvojnásobně geometrickou řadou bylo následující: 8–0,063 mg/l pro cefotaxim, ceftazidim, cefepim, meropenem, gentamicin, trimethoprim, 32 – 0,25 mg/l pro ampicilin a tetracyklin, 64 – 0,5 mg/l pro chloramfenikol a 512 – 8 mg/l pro sulfamethoxazol. K přípravě testovacích destiček bylo použito rozplňovací zařízení Dynex pro přípravu mikrotitračních destiček s antibiotiky v 96 jamkách. Destičky s antibiotiky byly uchovány při -80 °C. K hodnocení a interpretaci výsledků podle klinických breakpointů antibiotik byla použita příslušná kritéria [14, 15]. Produkce širokospektré betalaktamázy byla vyšetřena podle doporučené diskové metody [16].
VÝSLEDKY
Soubor kmenů. V souboru 637 kmenů převažovaly kmeny ze stolice (98,9 %), 5 kmenů (0,8 %) pocházelo z krve, dalších 6 kmenů mimostřevního původu tvořily izoláty z moči, hnisu a výtěr z pochvy, u 13 kmenů nebyl původ udán. Všechny kmeny patřily k druhu Salmonella enterica a zahrnovaly celkem 25 sérovarů. Nejčastěji byl izolován sérovar Enteritidis, který tvořil 89,6 % kmenů souboru, následovaly sérovary Typhimurium (4,7 %), jeho monofázická varianta 4,[5],12:i (2,0 %) a Mbandaka (0,6 %), ostatní sérovary se vyskytovaly v méně než v 0,6 %. Všech pět izolátů z krve patřilo k sérovaru Enteritidis. Přehled sérovarů a počet kmenů jednotlivých sérovarů v souboru uvádí tabulka 1.
Rezistence k antibiotikům. Rozmezí MIC antibiotik a koncentrace inhibující 50 % a 90 % kmenů jsou uvedeny v tabulce 2. Hodnoty MIC50 a MIC90 jsou u osmi z jedenácti antibiotik identické, u ampicilinu, gentamicinu a trimethoprimu jsou hodnoty MIC90 vyšší než MIC50 jen o jeden stupeň ředění dvojnásobně geometrickou řadou. V tabulce 2 jsou dále uvedeny breakpointy antibiotik pro kategorizaci citlivosti EUCAST [14], které platí jako standard v zemích Evropské unie, a pro tetracyklin a sulfamethoxazol, které EUCAST neuvádí, jsou použita kritéria Clinical and Laboratory Institute, USA [15]. Kmeny, inhibované vyšší koncentrací antibiotika než je koncentrace udaná jako breakpoint pro citlivost, jsou rezistentní (a zahrnují i kmeny s intermediární rezistencí). Celkem 558 kmenů (87,6 %) bylo citlivých ke všem vyšetřovaným antibiotikům. K ampicilinu bylo rezistentních nejvíce kmenů (8,5 %), k tetracyklinu 5,7 % kmenů, k sulfamethoxazolu (a tudíž ke skupině sulfonamidů) 5,2 %, k ciprofloxacinu (a k ostatním fluorochinolonům) 3,8 % a k chloramfenikolu 2,5 % kmenů. Žádný kmen nebyl rezistentní k meropenemu, počet kmenů rezistentních ke gentamicinu, k trimethoprimu, cefalosporinům 3. generace cefotaximu a ceftazidimu a cefalosporinu 4. generace cefepimu nepřesáhl 0,5 %. Čtyři z pěti kmenů izolovaných z krve byly citlivé ke všem vyšetřovaným antibiotikům, jeden kmen byl rezistentní k ciprofloxacinu (MIC 0,25 mg/l).
Rezistentní sérovary. Mezi 637 kmeny salmonel bylo 79 kmenů (12,4 %) rezistentních k jednomu nebo více z 11 vyšetřovaných antibiotik. Rezistentní kmeny patřily k osmi z celkového počtu 25 sérovarů. Názvy všech sérovarů zastoupených v souboru a distribuce rezistentních kmenů u osmi sérovarů jsou v tabulce 1. Počet rezistentních kmenů v celkovém počtu kmenů jednotlivých sérovarů byl následující: 39 z 554 kmenů sérovaru Enteritidis (7 %), 20 z 30 kmenů (66,7 %) sérovaru Typhimurium a 12 ze 13 kmenů (92,3 %) monofázické varianty Typhimurium, dva ze tří kmenů sérovaru Infantis, jeden ze dvou kmenů sérovaru Stanley, jediný kmen sérovarů Kentucky a Newport a všechny tři kmeny sérovaru Virchow (viz tab. 2). Polovina rezistentních kmenů byla monorezistentní jen k ampicilinu (26,6 %), respektive jen k ciprofloxacinu (24,1 %), téměř všechny zbývající kmeny byly multirezistentní (43,0 %), to znamená rezistentní ke třem a více skupinám antibiotik (tab. 3). Tři kmeny, u nichž byla potvrzena produkce širokospektré betalaktamázy (ESBL), patřily k sérovaru Typhimurium a pocházely od dětí z jedné lokality. Producenti ESBL od ročního dítěte a jednoho z pětiletých dvojčat měli stejný vzor rezistence ke třem skupinám antibiotik, zatímco izolát od druhého z dvojčat byl rezistentní k pěti skupinám antibiotik (viz tab. 3). Tyto kmeny jsou dále analyzovány a výsledky budou zveřejněny v samostatné publikaci.
Table 1. Sérovary <i>Salmonella enterica</i> v souboru 637 kmenů salmonel, počet kmenů a počet rezistentních kmenů* jednotlivých sérovarů Table 1. Serovars of <i>Salmonella enterica</i> among 637 study strains, numbers of strains and resistant strains* by serovar 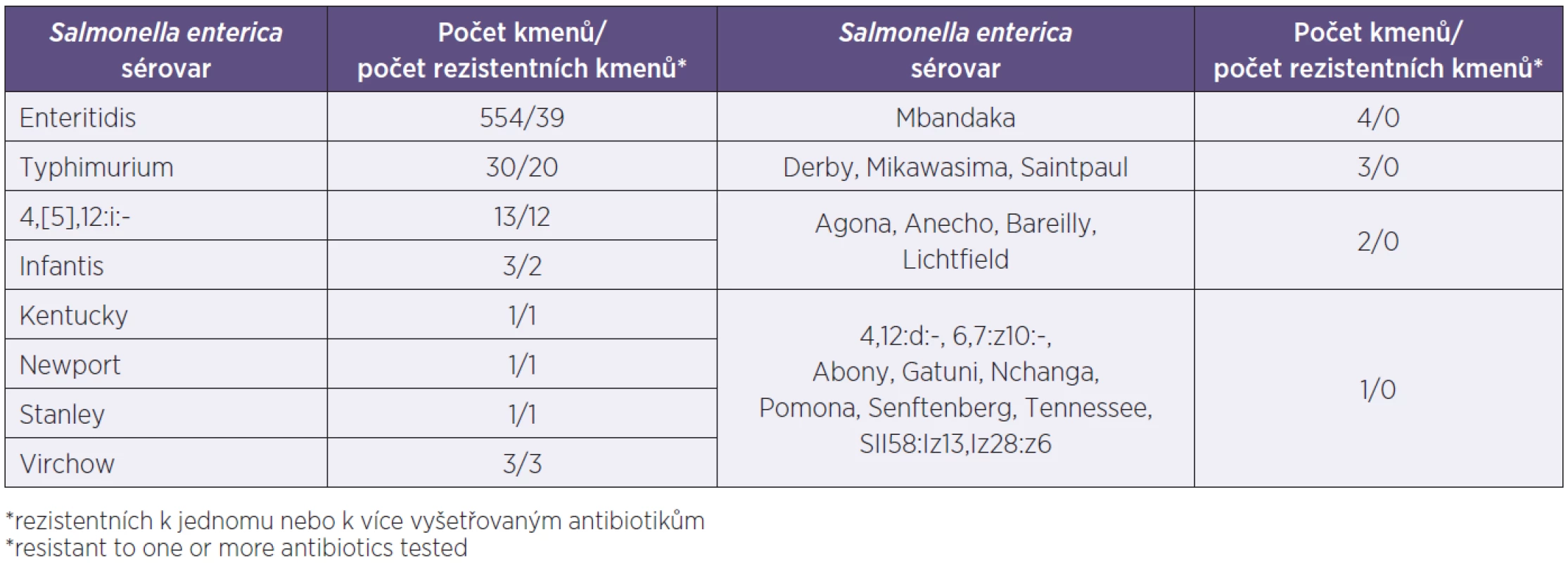
Table 2. Rozmezí minimálních inhibičních koncentrací (MIC) antibiotik, MIC<sub>50</sub> a MIC<sub>90</sub>, klinické breakpointy antibiotik pro <i>Enterobacteriaceae</i> [14] a frekvence rezistence k jednotlivým antibiotikům (%) v souboru 637 salmonel Table 2. Antibiotic minimum inhibitory concentration (MIC) ranges, MIC<sub>50</sub> and MIC<sub>90</sub>, clinical breakpoints for antibiotics in <i>Enterobacteriaceae</i> [14] and rates of resistance to different antibiotics (%) among 637 </i>Salmonella</i> isolates ![Rozmezí minimálních inhibičních koncentrací (MIC) antibiotik, MIC<sub>50</sub> a MIC<sub>90</sub>, klinické breakpointy antibiotik pro <i>Enterobacteriaceae</i> [14] a frekvence rezistence k jednotlivým antibiotikům (%) v souboru 637 salmonel
Table 2. Antibiotic minimum inhibitory concentration (MIC) ranges, MIC<sub>50</sub> and MIC<sub>90</sub>, clinical breakpoints for antibiotics in <i>Enterobacteriaceae</i> [14] and rates of resistance to different antibiotics (%) among 637 </i>Salmonella</i> isolates](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/0d5e46ea4a76c26392b6aa306c8d0676.png)
Table 3. Vzory rezistence u sérovarů <i>Salmonella enterica</i>* Table 3. Resistance patterns in <i>Salmonella enterica</i> serovars* 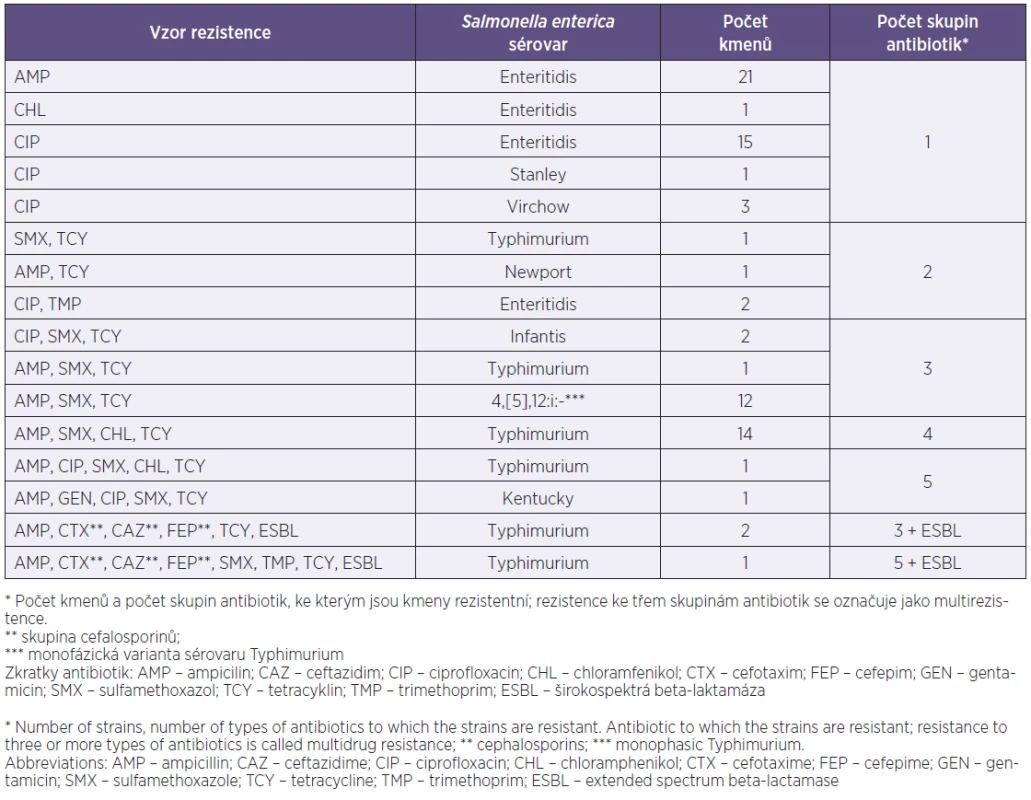
DISKUSE
Pro hodnocení výsledků je soubor 637 kmenů salmonel dostatečně reprezentativní, neboť představuje 67 % případů salmonelóz uvedených v databázi EPIDAT v měsíci červnu 2012 [17]. Počet izolátů z krve byl v našem souboru konsekutivních izolátů nízký (0,8 %), v podobných souborech kmenů se uvádí prevalence izolátů salmonel z krve zhruba 5 % [3], respektive 5,9 % [18].
Nejpočetnější v Evropě [1] i v USA [18] jsou sérovary Enteritidis a Typhimurium. Také v našich souborech kmenů z let 2000 [11] a 2012 byly tyto dva sérovary zastoupeny nečastěji. Sérovar Choleraesuis, který patří mezi nejvirulentnějšího původce invazivních infekcí [3], nebyl v našem souboru přítomen, všechny kmeny z krve patřily k sérovaru Enteritidis.
K vyšetření citlivosti k antibiotikům bylo použito stanovení hodnot minimálních inhibičních koncentrací (MIC). Výsledky získané touto metodou spolehlivě prokazují rezistentní fenotypy salmonel, neboť vysoce korelují s průkazem příslušných genů rezistence [19]. V našem souboru bylo 87,9 % kmenů plně citlivých ke všem vyšetřovaným antibiotikům. Podíl plně citlivých kmenů se ve světě liší, například v souboru téměř 20 000 humánních izolátů salmonel v USA bylo plně citlivých 70,3 % kmenů, a značné rozdíly jsou i v souborech humánních i veterinárních kmenů mezi jednotlivými evropskými zeměmi [1]. Rozdíly vyplývají z odlišností v množství a spektru antibiotik používaných v různých zemích pro humánní a veterinární účely. Pro stanovení pozice jednotlivých antibiotik v dané zemi je proto nezbytné používat vlastní data.
Ciprofloxacin patří mezi léky volby salmonelových infekcí. Klinický breakpoint ciprofloxacinu pro citlivé kmeny Salmonella spp. (≤ 0,063 mg/l) je téměř 8krát nižší, než pro ostatní Enterobacteriaceae (≤ 0,5 mg/l). Klinické důkazy totiž potvrzují špatnou odpověď na ciprofloxacin u celkových infekcí způsobených kmeny salmonel i s nízkým stupněm fluorochinolonové rezistence (MIC 0,063–0,25 mg/l) [14]. V roce 2000 bylo rezistentních k ciprofloxacinu 0,78 % kmenů [11], a v roce 2012 (tato studie) jejich počet několikanásobně vzrostl (3,8 % kmenů), převážně se jednalo o kmeny s monorezistencí.
Za pozornost stojí výskyt tří kmenů sérovaru Typhimurium, rezistentních v důsledku produkce širokospektré betalaktamázy (ESBL) k cefalosporinům 3. a 4. generace cefotaximu a ceftazidimu, respektive cefepimu, a multirezistentních k dalším antibiotikům. V roce 2000 byly prokázány dva kmeny sérovaru Enteritidis a Typhimurium (z celkového počtu 2441 salmonel) rezistentní k cefalosporinům 3. generace, které ESBL neprodukovaly [11]. První výskyt dvou kmenů sérovaru Enteritidis produkujících ESBL u nás byl zaznamenán v roce 2003 [20] a stejně jako u kmenů z roku 2012 byly tyto kmeny v epidemiologické souvislosti, multirezistentní, avšak s rozdílnou rezistencí k jednotlivým antibiotikům. Tyto kmeny budou podrobněji analyzovány.
Podíl kmenů nejpočetnějšího sérovaru Enteritidis, rezistentních k jednomu nebo k více antibiotikům byl jen 7%. U sérovaru Typhimurium a jeho monofázické varianty převládala multirezistence u dvou třetin, respektive u všech kmenů. Tyto sérovary se Evropou šíří pandemicky a v posledních 10 letech se jejich prevalence markantně zvyšuje u salmonel z humánních infekcí i v mase prasat, která jsou pravděpodobným zdrojem infekce [21]. Kromě charakteristické rezistence ke starším antibiotikům lze u těchto sérovarů za zvlášť závažný pokládat výskyt rezistence k cefalosporinům a karbapenemům u kmenů z potravinových zvířat [1, 9, 10], neboť tato antibiotika jsou nepostradatelnými léky invazivních salmonelových infekcí u lidí. Strategie kontroly zahrnuje zlepšení hygieny a příslušných zdravotnických opatření, přípravu a pečlivé dodržování návodů pro uvážlivé používání antibiotik a zavedení příslušných bezpečnostních opatření ke snížení vzniku a šíření salmonel rezistentních k antibiotikům [21].
Do redakce došlo dne 5. 2. 2013.
Adresa pro korespondenci:
RNDr. Pavla Urbášková, CSc.
Státní zdravotní ústav
Šrobárova 48
100 42 Praha 10
e-mail: purbaskova@szu.cz
Sources
1. European Food Safety Authority and European Centre for Disease Prevention and Control The European Union Summary Report on antimicrobial resistance in zoonotic and indicator bacteria from humans, animals and food in the European Union in 2010. EFSA Journal, 2012, 10, 3, p. 2598. [233 pp.] doi:10.2903/j.efsa.2012.2598. Dostupné na www: www.efsa.europa.eu/efsajournal.
2. Miller, S. I., Pegues D. A. Salmonella species, including Salmonella typhi. In: Principles & Practice of Infect. Dis., Mandell, G., Douglas, G. & Bennett, J. (eds), Chapter 223, 7th ed. Churchill--Livingstone, 2009.
3. Jones, T. F., Ingram, L. A., Cieslak, P. R., Vugia, D. J., Tobin-D’Angelo, M. et al. Salmonellosis outcomes differ substantially by serotype. J. Infect. Dis., 2008, 198, p. 109–114.
4. Morales, A. S., Fragoso de Araújo, J., de Moura Gomes, T. V., Costa, A.T. R., Rodrigue D. P. et al. Colistin resistance in Escherichia coli and Salmonella enterica strains isolated from swine in Brazil. Scientific World J., 2012, p. 109795. doi: 10.1100/2012/109795.
5. Sun, S., Negrea, A., Rhen, M., Andersson, D. I. Genetic analysis of colistin resistance in Salmonella enterica serovar Typhimurium. Antimicrob. Agents Chemother., 2009, 53, 6, p. 2298–2305.
6. Ricci, V., Piddock, L. Ciprofloxacin selects for multidrug resistance in Salmonella enterica serovar Typhimurium mediated by at least two different pathways. J. Antimicrob. Chemother., 2009, 63, 5, p. 909–916.
7. Angulo, F. J., Johnson, K. R., Tauxe, R. V., Cohen, M. L. Origins and consequences of antimicrobial-resistant nontyphoidal Salmonella: Implications for the use of fluoroquinolones in food animals. Microbial. Drug Resist., 2000, 6, 1, p. 77–83.
8. Veldman, K., Cavaco, L. M., Meviusl, D., Battisti, A., Franco, A. et al. International collaborative study on the occurrence of plasmid-mediated quinolone resistance in Salmonella enterica and Escherichia coli isolated from animals, humans, food and the environment in 13 European countries. J. Antimicrob. Chemother., 2011, 66, 6, p. 1278–1286.
9. Dolejska, M., Villa, L., Hasman, H., Hansen, L., Caratolli, A. Characterization of IncN plasmids carrying blaCTX-M-1 and qnr genes in Escherichia coli and Salmonella from animals, the environment and humans. J. Antimicrob. Chemother., 2013, 68, 2, p. 333–339.
10. Fischer, J., Rodriquez, I., Schmoger, S., Friese, A., Roesler, U. et al. Salmonella enterica subsp. enterica producing VIM-1 carbapenemase isolated from livestock farms. J. Antimicrob. Chemother., 2013, 68, 2, p. 478–480.
11. Urbášková, P., Dědičová D., Žemličková H., Wünschová M., Jakubů V., Karpíšková R., Petráš P. a pracovníci 85 mikrobiologických laboratoří ČR Stav citlivosti k antibiotikům u Salmonella spp. v České republice. Zprávy CEM, 2001, 10, 2, p. 70–73.
12. Grimont, P. A. D., Weil, F. X. Antigenic formulae of the Salmonella serovars. WHO Colaborating Centre for reference and research on Salmonella, 9th ed., 2007.
13. Urbášková, P. Rezistence bakterií k antibiotikům. Vybrané metody. Trios 1998.
14. The European Committee on Antimicrobial Susceptibility Testing. Breakpoint tables for interpretation of MICs and zone diameters. Version 3.0, 2013. Dostupné na www: http://www.eucast.org/
15. Clinical and Laboratory Standards Institute Performance standards for antimicrobial susceptibility testing; twenty two informational supplement. CLSI Document M100-S22. Clinical and Laboratory Standards Institute, USA, Pa, 2012.
16. Hrabák, J., Žemličková, H., Bergerová, T., Urbášková, P. Interpretace výsledků vyšetření citlivosti enterobakterií u producentů širokospektrých ß-laktamáz (ESBL), ß-laktamáz AmpC a karbapenemáz. Zprávy CEM, 2010, 19, 6–7, p. 194–196.
17. Výskyt vybraných hlášených infekcí v České republice. Zprávy CEM, 2012, 21, 6–7, p. 220.
18. Crump, J. A., Medalla, F. M., Joyce, K. W., Krueger, A. L., Hoekstra, R. M. et al. Antimicrobial resistance among invasive nontyphoidal Salmonella enterica isolates in the United States: National antimicrobial resistence monitoring system, 1996 to 2007. Antimicrob. Agents Chemother., 2011, 55, 3, p. 1148–1154.
19. Anjum, M. F., Choudhary, S., Morrison, V., Snow, L. C., Mafura, M. et al. Identifying antimicrobial resistance genes of human clinical relevance within Salmonella isolated from food animals in Great Britain. J. Antimicrob. Chemother., 2011, 66, p. 229–550.
20. Urbášková, P., Macková, B. První dva humánní izoláty Salmonella Enteritidis produkující ESBL v ČR. Zprávy CEM, 2003, 12, 8, p. 335–336.
21. Hopkins, K. L., Kirchner, M., Guerra, B., Granier, S. A., Lucarelli, C., Porrero, M. C., Jakubczak, A., Threlfall, E. J., Mevius, D. J. Multiresistant Salmonella enterica serovar 4,[5],12:i: in Europe: a new pandemic strain? Euro Surveill., 2010, 15, 22, p. 19580. Dostupné na www: http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=19580
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2013 Issue 2-
All articles in this issue
- Antibiotická rezistence u netyfových sérovarů Salmonella spp. v České republice
- Nová metoda a schéma typizace Streptococcus pneumoniae
- Epidemické případy salmonelóz v České republice v roce 2012
- Intravenózní a subkutánní imunoglobulinová terapie
- Prevalenční odhad problémových uživatelů drog v ČR v letech 2006 a 2007 metodou zpětného záchytu
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Intravenózní a subkutánní imunoglobulinová terapie
- Antibiotická rezistence u netyfových sérovarů Salmonella spp. v České republice
- Nová metoda a schéma typizace Streptococcus pneumoniae
- Prevalenční odhad problémových uživatelů drog v ČR v letech 2006 a 2007 metodou zpětného záchytu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

