-
Medical journals
- Career
Porovnání produkce vybraných faktorů virulence Pseudomonas aeruginosa izolovaných z katétrů
Authors: Olejníčková Kateřina; Holá Veronika
Authors‘ workplace: Mikrobiologický ústav LF a FN u sv. Anny v Brně
Published in: Epidemiol. Mikrobiol. Imunol. 61, 2012, č. 1-2, s. 21-28
Overview
Zkvalitňování lékařské péče s sebou nese vyšší počet invazivních výkonů a také vyšší počet náročnými operacemi oslabených pacientů náchylných k nozokomiálním infekcím. Pseudomonas aeruginosa je jedním z nejčastěji izolovaných nozokomiálních druhů, přičemž léčba pseudomonádových infekcí je často problematická, zdlouhavá a infekce jsou často recidivující. S procesem patogeneze pseudomonádových infekcí je spojena řada faktorů virulence.
V rámci překládané studie bylo vyšetřeno 93 katétrových izolátů Pseudomonas aeruginosa na tvorbu biofilmu, pohyblivost a sekreci vybraných extracelulárních látek. Vysoké procento kmenů byla schopno produkovat hemolyziny, LasB elastázu a pyoverdiny (> 70 %). Submerzní biofilm tvořilo 80 % kmenů, aerovaný biofilm byl přítomen u 90 % izolátů, přičemž byla prokázána pozitivní korelace mezi tvorbou submerzního a aerovaného biofilmu (p = 0,00583; γ = 0,551). Všechny kmeny byly pohyblivé swarming motilitou, 95 % kmenů vykazovalo swimming motilitu a 75 % twitching motilitu. Ze sledovaných faktorů virulence byla mezi kmeny nízká pouze sekrece pyocyaninu a pyochelinu (< 25 %).
Pozitivní korelace byla prokázána u produkce některých extracelulárních látek (mezi produkcí pyochelinu a pyocyaninu, pyocyaninu a LasB elastázy, LasB elastázy a hemolyzinů), mezi produkcí submerzního a aerovaného biofilmu a také mezi produkcí aerovaného biofilmu a pigmentů (pyoverdinu i pyocyaninu). Naopak negativní korelaci vykazovaly vztahy mezi produkcí submerzního i aerovaného biofilmu a LasB elastázy a submerzního biofilmu a pigmentů (pyoverdinu i pyocyaninu). Všechny korelace jsou významné na hladině p = 0,05 a vykazují korelaci γ > 0,50.Klíčová slova:
Pseudomonas aeruginosa – faktory virulence – biofilm – motilita – LasB elastáza – hemolyziny.ÚVOD
Nozokomiální infekce představují závažný problém současné lékařské péče. Připočteme-li k tomu i zvyšující se množství pacientů s oslabenou imunitou, je logické, že se surveillance nozokomiálních patogenů dostává do popředí zájmu klinických mikrobiologů. Pseudomonas aeruginosa patří k nejčastěji izolovaným nozokomiálním druhům. Pseudomonády jsou známé ubikvitním výskytem a rozsáhlou přirozenou i získanou rezistencí k antimikrobní terapii [1].
Kromě pacientů s cystickou fibrózou (CF) ohrožují pseudomonádové infekce především pacienty s oslabenou imunitou, osoby po těžkých chirurgických výkonech či katetrizované pacienty [1]. P. aeruginosa je třetím nejčastějším původcem nozokomiálních močových infekcí u katertizovaných pacientů [2] a zavedení katétru (venózního i močového) patří mezi rizikové faktory pro rozvoj infekcí krevního řečiště [3].
P. aeruginosa je pouze oportunní patogen, přesto může mít nákaza fatální následky. Patogeneze infekcí způsobených P. aeruginosa je složitý proces, do něhož je zapojeno mnoho faktorů virulence [4]. Produkce jednotlivých faktorů virulence se mezi kmeny výrazně liší a záleží na charakteru i míře exprese těchto faktorů, stejně jako na stavu imunitního systému pacienta, zda dojde k propuknutí infekce.
Mezi nejvýznamnější faktory virulence pseudomonád patří tvorba biofilmu, jež se výraznou měrou podílí na selhávání terapeutických zásahů a rozšiřování nozokomiálních kmenů [5]. V posledních letech se zájem vědců upíná i k tzv. aerovanému biofilmu, tedy blance, kterou tvoří některé bakterie na rozhranní kapaliny a vzduchu [6–8]. Role aerovaného biofilmu pro patogenitu P. aeruginosa nebyla zatím objasněna. Proteolytické enzymy pomáhají bakterii překonat obranné mechanismy hostitele – štěpí komponenty pojivové tkáně či modifikují imunitní odpověď organismu [1, 9]. Hemolyziny destabilizují buněčnou membránu a tím vnitřní prostředí buňky, z něhož následně čerpá mikrob živiny [10]. Solubilní pigmenty – pyoverdiny, pyochelin a pyocyanin – se účastní vychytávání iontů železa a fosfátů z okolí buňky [1]. Organely pohybu umožňují bakterii pronikat z vnějšího prostředí do hostitelských tkání a šířit se do preferovaných míst. Jejich úloha byla prokázána i při vzniku močových infekcí u katetrizovaných pacientů [11] a důležitou roli hrají i při tvorbě biofilmu [5]. Pohyb P. aeruginosa je zprostředkován bičíkem (nezbytný pro swimming motilitu – plavání v tekutém prostředí) a pili typu IV (umožňují twitching motilitu – skákavý pohyb na rozhranní dvou pevných fází). Pro poslední typ pohybu – swarming motilitu – jsou potřeba oba typy organel [12].
V předkládané práci jsme se zaměřily na porovnání tvorby vybraných faktorů virulence u klinických izolátů P. aeruginosa a sledování vztahů mezi těmito faktory. U izolátů byly vyšetřeny následující faktory virulence: tvorba biofilmu – submerzního a aerovaného; pohyblivost kmene (swimming, twitching a swarming motilita) a sekrece extracelulárních látek (LasB elastáza, hemolyziny, pigmenty).
MATERIÁL A METODY
Použité mikroorganismy
Celkem bylo v rámci studie zpracováno 94 kmenů rodu Pseudomonas izolovaných z katétrových infekcí pacientů Fakultní nemocnice u sv. Anny v Brně v letech 2008–2010. Izolované kmeny byly na základě typického růstu na Endově agaru, krevním agaru a Mueller-Hinton agaru předběžně určeny jako Pseudomonas aeruginosa. Identifikace byla konfirmována biochemicky (OXItest a NefermTEST, Lachema, CZ) u 93 izolovaných kmenů. Kmeny byly uchovávány v glycerolsérovém bujonu v hlubokomrazícím boxu při teplotě 73 °C a pro vlastní testování byla vždy použita čerstvá 24hodinová kultura.
Průkaz tvorby biofilmu
Tvorba submerzního biofilmu byla testována modifikovanou Christensenovou metodou v mikrotitrační destičce [13]. Do jednotlivých důlků bylo napipetováno 180 μl mozkosrdcové infuze (BHI) se 4 % glukózy a 20 μl bakteriální suspenze v BHI se 4 % glukózy o zákalu 1 podle McFarlandovy stupnice. Destičky byly kultivovány 24 hodin při teplotě 37 °C, poté třikrát propláchnuty vodou a fixovány sušením. Biofilm adherovaný na stěnách důlků byl obarven krystalovou violetí, barvivo bylo rozpuštěno v etanolu a kvantifikováno spektrofotometricky při 595 nm. Všechny kmeny byly testovány ve třech opakováních.
Aerovaný biofilm byl testován v polystyrenových zkumavkách. Médium a kultivační podmínky byly shodné s metodikou pro testování submerzního biofilmu [13]. Do zkumavky bylo napipetováno 1,8 ml média a 200 μl mikrobiální suspenze o zákalu 1 podle McFarlandovy stupnice. Po kultivaci byla u všech kmenů odečtena přítomnost blanky na povrchu média a zhodnocen její charakter (tab. 1). Aerovaný biofilm byl následně kvantifikován. Vzhledem k náročnosti zpracování byla tvorba aerovaného biofilmu kvantifikována pouze u části kmenů. Blanka byla opatrným pohybem zkumavky přichycena ke stěně, zkumavka byla třikrát propláchnuta vodou a blanka byla fixována sušením (obr. 1). Po obarvení krystalovou violetí bylo odstraněno barvivo ze submerzního biofilmu a byl odečten aerovaný biofilm. Kmeny byly testovány ve třech opakováních.
Table 1. Charakteristika jednotlivých kategorií aerovaného biofilmu a počty kmenů, které vytvářely daný typ biofilmu Table 1. Characteristics of Aerated Biofilm and Nos. of biofilm producing strains by biofilm type 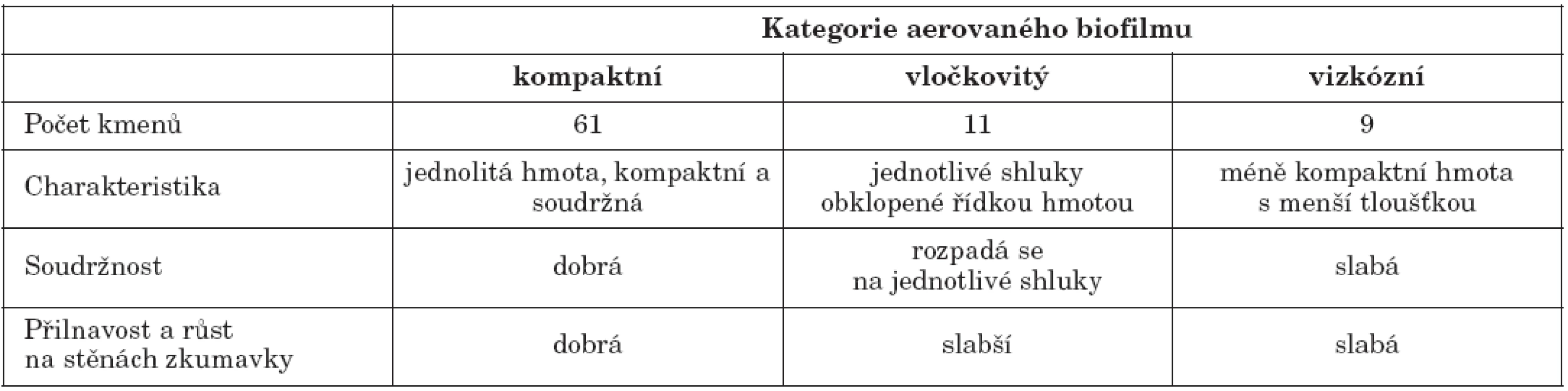
Image 1. Kvantifikace aerovaného biofilmu A, B – producenti aerovaného biofilmu, C – kmen neprodukující aerovaný biofilm Fig. 1. Biofilm quantification: A, B – formation of aerated biofilm, C – no formation of aerated biofilm 
Průkaz pohyblivosti kmene
Ke kvantifikaci jednotlivých typů pohybu byly použity miskové testy s médiem o různém obsahu agaru. Jednotlivé typy pohybu jsou znázorněny na obrázku 2.
Pro test na swimming motilitu bylo využito Luria-Bertani médium (LB) s 0,3 % agaru [14]. Inokulace byla prováděna kolmým vpichem dovnitř čerstvě připraveného média. Kultivace probíhala 24 hodin při 37 °C. Výsledek testu byl hodnocen jako průměr vzniklé zóny, který byl následně přepočítám na plochu kruhu. Zóny vzniklé po kultivaci jsou zobrazeny na obrázcích 2 A, B.
K testování twitching motility byly použity plotny s čerstvým LB médiem s 1 % agaru [15]. Kultura byla inokulována kolmým vpichem na dno misky, kde se buňky pohybovaly na rozhraní pevných fází. Plotny byly inkubovány 16 hodin při 37 °C a následně 72 hodin při pokojové teplotě. Po kultivaci byl agar vyklopen a otisk na dně misky fixován sušením. Pro snazší hodnocení byl otisk obarven krystalovou violetí (obr. 2 C, D). K odečtu twitching motility byl použit software ImageJ [16].
Image 2. Test na swimming (A, B), twitching (C, D) a swarming (E, F) motilitu Fig. 2. Swimming (A, B), twitching (C, D), and swarming (E, F) motility assays 
Swarming motilita byla testována na médiu obsahujícím živný bujon, 5 g/l glukózy a 0,5 % agaru [17]. Zóna pohybu byla změřena po 48hodinové kultivaci při 37 °C (obr. 2 E, F). K odečtu swarming motility byl použit software ImageJ [16].
Jako nepohyblivé byly u všech testů pohyblivosti hodnoceny kmeny, které spíše než zónu růstu vytvořily pouze kolonii s plochou menší než 20 mm2.
Produkce extracelulárních látek
Hemolyziny
Buňky byly kultivovány 18 hodin v LB médiu, 1 ml buněk o denzitě 3 podle McFarlandovy stupnice byl smíchán s 50 μl roztoku propraných erytrocytů. Směs byla inkubována při 37 °C po dobu tří hodin. Nezlyzované erytrocyty a zbytky buněk byly odstraněny centrifugací a optická denzita supernatantu byla změřena při 545 nm. Aktivita hemolyzinů je úměrná množství hemoglobinu uvolněného z erytrocytů po kultivaci s bakteriální suspenzí [18]. Jako hemolyziny produkující kmeny byly vyhodnoceny izoláty, jejichž OD545 supernatantu byla vyšší než průměrná OD545 negativních kontrol.
LasB elastáza
Produkce LasB elastázy byla sledována pomocí elastinového testu s kongo červení [19]. Denzita buněk rostoucích 18 hodin v LB médiu byla upravena na 3 podle McFarlandovy stupnice. 700 μl suspenze bylo smícháno s 250 μl roztoku kongo červeně konjugované s elastinem v Tris pufru s CaCl2. Buňky byly inkubovány při 37 °C po dobu 17 hodin. Elastáza rozložila konjugát a množství uvolněné kongo červeně bylo změřeno spektrofotometricky (OD 492 nm). Jako LasB elastázu-produkující byly vyhodnoceny izoláty, jejichž OD492 byla vyšší než průměr OD492 negativních kontrol.
Produkce pigmentů
Tvorba sideroforů byla detekována kultivací kmenů na speciálních půdách. Pseudomonádový agar P (King A agar) pro detekci pyocyaninu, pyochelinu a pyorubinu je jednoduché médium chudé na fosfáty. Pseudomonádový agar F (King B agar) je médium s dostatkem fosfátů vhodné pro detekci pyoverdinů [20]. Kmeny byly očkovány bakteriologickou kličkou a kultivovány 24 hodin při 37 °C. Produkce pigmentů se projevila změnou barvy média v okolí kolonií. Sekrece pyocyaninu byla konfirmována změnou barvy po acidifikaci 1 M kyselinou chlorovodíkovou [21].
Statistické vyhodnocení
Data byla vyhodnocena za použití programu Statistica for Windows 9.1 [22] pomocí korelačního koeficientu gama a párového t-testu. Hladina významnosti všech korelačních testů byla stanovena jako p = 0,05. Za významné byly považovány korelační koeficienty s p < 0,05 a korelací vyšší než 50 % (tj. γ > 0,50).
VÝSLEDKY A DISKUSE
Pseudomonas aeruginosa je obávaným nozokomiálním patogenem. Přestože zdravým jedincům není kolonizace nebezpečná, pro oslabený organismus může infekce způsobená Pseudomonas aeruginosa skončit fatálně. Díky přirozené i získané rezistenci (nejen k antibiotikům ale i k mnoha dezinfekčním látkám) je velmi obtížné tyto bakterie v nemocničním prostředí eradikovat. Schopnost mikroba perzistovat v podobě biofilmu pak dále komplikuje léčbu a způsobuje chronicitu pseudomonádových infekcí.
Při rozvoji pseudomonádových infekcí hraje přítomnost jednotlivých faktorů virulence zásadní roli. Produkované faktory virulence se uplatňují při kolonizaci nativních i inertních povrchů, pomáhají pseudomonádám překonat obranné mechanismy hostitele a přežít v prostředí makroorganismu. Katétrové infekce močových cest se podílejí až 40 % na celkovém počtu nozokomiálních infekcí [2]. Povrch katétru představuje vhodné prostředí pro adhezi bakterií i pro vytvoření biofilmu. Díky překlenutí některých obranných mechanismů hostilele se katétr stává přímou spojnicí do vnitřního prostředí organismu.
Všechny faktory virulence v rámci studie byly testovány fenotypovými metodami. Přestože jsou k průkazu některých faktorů virulence k dispozici i metody molekulárně-biologické, přítomnost genetické informace v genomu bakterie nemusí nutně znamenat expresi daného faktoru virulence. Vztahem mezi přítomností genu a fenotypovým projevem se zabývali např. Růžička et al. [23]. Z jejich výsledků vyplývá, že ica operon – nezbytný pro tvorbu biofilmu u stafylokoků – se fenotypově projevuje pouze u 70–85 % kmenů, nicméně genetické metody jsou pro svou rychlost a jednoduchou interpretaci vhodným nástrojem pro detekci kmenů s potenciálně vysokou virulencí. Produkce jednotlivých faktorů virulence rovněž není neměnná, podle některých studií ji lze ovlivnit mimo jiné temperovanými fágy – kultura obsahující fága Pf4 vykazovala vyšší počet tzv. SCVs (small colony variants), jež jsou spojeny s vyšší virulencí [24], fág FIZ15 zase podpořil adhezi k epiteliím [25]. Produkce sledovaných faktorů virulence u vyšetřovaných kmenů je shrnuta v grafu 1.
Graph 1. Porovnání produkce jednotlivých faktorů virulence Graph 1. Comparison of production of virulence factors 
Tvorba biofilmu
Tvorba biofilmu v mikrotitrační destičce byla hodnocena podle metodiky Stepanoviće et al. [13]. Jako silní producenti biofilmu bylo vyhodnoceno 25 kmenů (26,9 %), 30 kmenů (32,3 %) bylo středně silnými producenty a 23 kmenů (24,7 %) slabými producenty biofilmu. U 15 kmenů (16,1 %) nebyla produkce biofilmu v mikrotitrační destičce prokázána. Mezi tvorbou submerzního biofilmu v mikrotitrační destičce a v polystyrenových zkumavkách nebyl prokázán statisticky významný rozdíl (p = 0,56; t = 0,879).
Biofilm na rozhraní kapaliny a vzduchu tvořilo 81 testovaných kmenů (87,1 %), přičemž 13 kmenů (14,0 %) tvořilo silnou vrstvu aerovaného biofilmu. Pouze u 12 kmenů (12,9 %) nebyla blanka na rozhraní fází patrná. Kmeny produkující aerovaný biofilm byly podle kritérií definovaných v publikaci Koza et al. [7] rozděleny do 3 skupin, jejichž charakteristika je uvedena v tabulce 1. Nejčastěji (65,6 %) kmeny tvořily kompaktní typ aerovaného biofilmu – robustní homogenní hmotu s dobrou soudržností. Kompaktní a vločkovitý typ aerovaného biofilmu je zobrazen na obrázku 3. U 58 kmenů tvořících aerovaný biofilm bylo množství biofilmu kvantifikováno spektrofotometricky – 86,2 % kmenů bylo silnými producenty, 10,3 % středně silnými producenty a pouze 3,4 % kmenů bylo vyhodnoceno jako slabí producenti aerovaného biofilmu. V předchozích studiích byla tvorba aerovaného biofilmu sledována především u přírodních kmenů P. aeruginosa, např. Ude et al. [26] ji detekovali v případě 76 % půdních izolátů. Autoři bohužel množství aerovaného biofilmu nijak nekvantifikovali.
Image 3. Aerovaný biofilm A – kompaktní typ, B – vločkovitý typ Fig. 3. Formation of aerated biofilm A – compact biofilm, B – floccular biofilm 
Ve zkoumaném souboru bylo zjištěno více producentů aerovaného než submerzního biofilmu (87,1%, respektive 83,9 %). Rovněž většina kmenů (90 %), které byly vyhodnoceny jako biofilm-negativní při testování submerzního biofilmu, byla schopna vytvářet aerovaný biofilm. Pouze dva kmeny netvořily žádný typ biofilmu. Mezi tvorbou submerzního a aerovaného biofilmu byla prokázána pozitivní korelace (p = 0,00583; γ = 0,551). Z kmenů, u kterých byla tvorba aerovaného biofilmu kvantifikována, bylo téměř 90 % izolátů vyhodnoceno jako silní producenti. Výše uvedená data naznačují, že standardní metoda detekce tvorby biofilmu v mikrotitrační destičce nepostihuje všechny varianty biofilmu. To je však dáno spíše omezenými možnostmi zpracování aerovaného biofilmu v mikrotitrační destičce než tím, že by se v mikrotitrační destičce aerovaný biofilm netvořil. Jeho přítomnost jsme během experimentů opakovaně zaznamenaly. Častější produkce aerovaného biofilmu oproti biofilmu submerznímu může být dána faktem, že P. aeruginosa je aerobní organismus. V případě infekcí močových a venózních katétrů však podmínky více odpovídají podmínkám při testování submerzního biofilmu, a proto v těchto případech stanovení submerzního biofilmu poskytuje lepší informaci o schopnosti mikroba tvořit klinicky významný biofilm.
Pohyblivost kmenů
Motilita kmene je přímo úměrná velikosti zóny růstu na speciálním médiu. Výsledky jednotlivých testů pohyblivosti jsou uvedeny na obrázku 4.
Image 4. Porovnání jednotlivých typů motility Fig. 4. Comparison of motility types 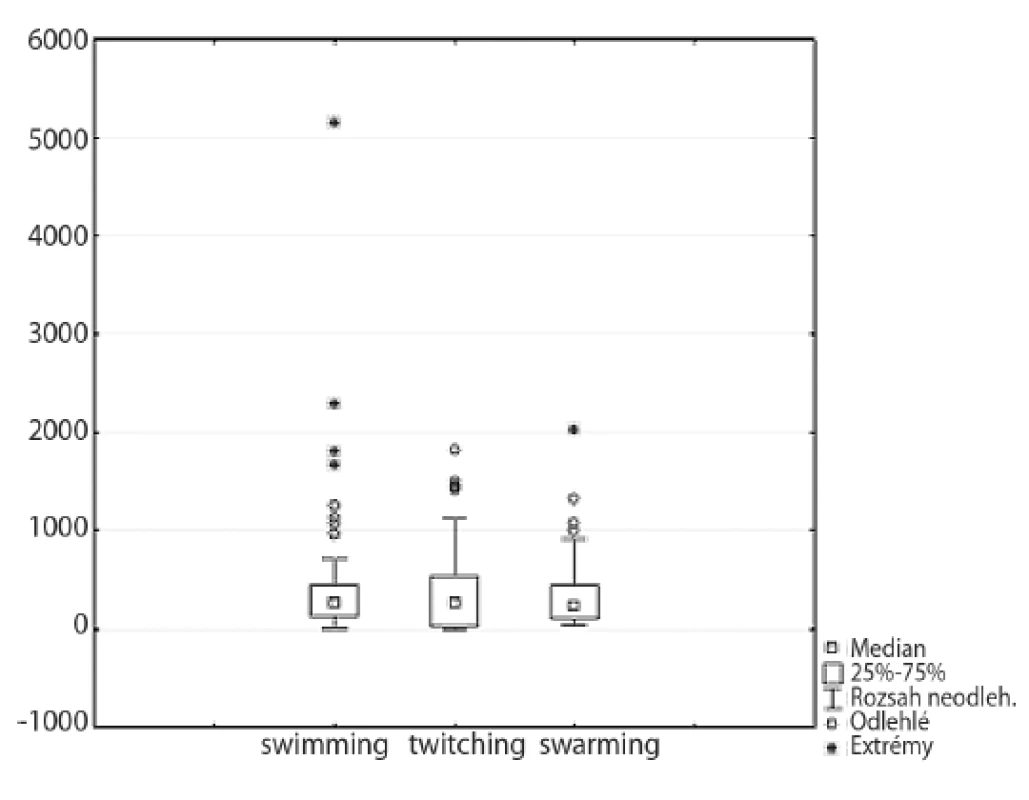
Téměř všechny kmeny vykazovaly swimming motilitu, po inkubaci tvořily izoláty pravidelné kruhové zóny. Plocha největší zóny byla 5150,4 mm2 (kmen médiem přeplaval prakticky celou misku), nejmenší zóna měřila 28,2 mm2. Čtyři kmeny (4,3 %) byly hodnoceny jako nepohyblivé (zóna < 20 mm2).
Při twitching a swarming motilitě vznikaly převážně nepravidelné útvary. Při testovaní twitching motility byla necelá čtvrtina kmenů (celkem 22 – 23,7 %) nepohyblivá (zóna < 20 mm2). Nejvíce pohyblivý kmen twitching motilitou vytvořil zónu o velikosti 1817,5 mm2, nejméně pohyblivý kmen vytvořil zónu pouhých 24,1 mm2.
Pomocí swarming motility byly pohyblivé všechny kmeny. Velikost vzniklých zón se pohybovala v rozmezí 32,1–2022,9 mm2.
Mezi zkoumanými kmeny nebyl detekován žádný zcela nepohyblivý izolát. 69 kmenů bylo pohyblivých všemi testovanými typy motility. Dva kmeny vykazovaly pouze swarming motilitu. 22 kmenů bylo schopno se pohybovat pomocí dvou typů pohybů. Pouze kombinaci swarming a swimming motility vykazovalo 20 kmenů, 2 kmeny byly pohyblivé jen pomocí swarming a twitching motility. Kombinaci pouze swimming a twitching motility nevykazoval žádný kmen.
Pohyblivost katétrových izolátů sledovaných v této studii je vyšší než detekovali Deligianni et al. [17] a Leone et al. [27] u kmenů izolovaných z plic pacientů s CF. Shodně u obou autorů swimming a swarming motilitu vykazovala polovina kmenů, twitching motilitu dokonce Deligianni et al. [17] zjistili pouze u třetiny izolátů. Již dříve však byl prokázán pokles pohyblivosti, stejně jako jiných faktorů virulence, u chronicky kolonizovaných pacientů s CF [28]. Také v rámci naší studie bylo nejméně izolatů pohyblivých pomocí twitching motility, přesto byl tento pohyb zaznamenán u 76 % kmenů. Celkově byl počet pohyblivých kmenů dvakrát vyšší než ve výše uvedených studiích. U katétrových infekcí je schopnost pohybu pro klinické izoláty velmi výhodná, protože umožňuje snadnější a rychlejší kolonizaci katétru, odkud se pak mohou šířit do vnitřního prostředí makroorganismu. Vliv především swarming motility na kolonizaci katétrů a následně močového traktu byl popsán u rodu Proteus [29]. Taktéž všechny naše izoláty byly schopné swarming motility, a tudíž pohybu v lumen katétru. Mezi sledovanými typy pohybu nebyla zjištěna žádná korelace.
Sekretované látky
V testovaném souboru kmenů 87 (93,6 %) tvořilo hemolyziny, 82 (88,2 %) LasB elastázu, 72 (77,4 %) pyoverdin, 21 (22,6 %) pyocyanin a 8 (8,6 %) pyochelin.
Vysoké procento kmenů produkujících výše zmíněné faktory virulence koresponduje s pozorováním ostatních autorů, kteří detekovali u většiny izolátů z močových infekcí tvorbu hemolyzinů, proteáz a sideroforů [30, 31]. Studie Mittala et al. [30] také naznačuje, že hemolytické vlastnosti kmene mohou hrát významnou roli při kolonizaci močového ústrojí. Produkce LasB elastázy je typická nejen pro kmeny z močových infekcí, ale i pro izoláty z jiných oblastí. Degradace elastinu, jakožto jedné ze základních složek pojivové tkáně, může být jedním z rozhodujících faktorů pro rozvoj infekce bez ohledu na její lokalizaci [4]. Pozitivní korelace byla detekována mezi produkcí některých extracelulárních látek – LasB elastázou a hemolyziny (p = 0,0061; γ = 0,561), LasB elastázou a pyocyaninem (p = 0,0027; γ = 0,520) a mezi produkcí pigmentů, tj. pyocheliny a pyocyaninem (p << 0,0001; γ = 0,866).
Korelace mezi tvorbou biofilmu a ostatními faktory virulence
Negativní korelace byla pozorována mezi produkcí submerzního i aerovaného biofilmu a produkcí LasB elastázy (p = 0,00757; γ = 0,518; respektive p = 0,0007; γ = 0,652). Negativní korelace byla prokázána také mezi produkcí submerzního biofilmu a pigmenty – pyocyaninem i pyochelinem (p << 0,0001; γ = 0,528; resp. p = 0,0092; γ = 0,560). K podobným výsledkům dospěli i Yadav et al. [32], kteří pozorovali v biofilmu pokles produkce většiny extracelulárních látek, jako jsou hemolyziny, LasB elastáza, pyochelin.
Pozitivní korelace byla naopak prokázána mezi produkcí aerovaného biofilmu a pigmentů – pyoverdinu i pyocyaninu (p << 0,0001; γ = 0,914; resp. p = 0,0011; γ = 0,6). Pro aerovaný biofilm a produkci pigmentů tedy platí opačný vztah než pro biofilm submerzní. Tvorba biofilmu stejně jako sekrece sideroforů (především pyoverdinu) je řízena systémem quorum sensing. U P. aeruginosa a P. putida je známo, že tzv. pseudomonádový chinolonový signál (2-heptyl-3-hydroxy-4-chinolon) pozitivně ovlivňuje produkci sideroforů, přičemž tvorba submerzního biofilmu je za těchto podmínek potlačena [33]. Vztah mezi produkcí aerovaného biofilmu a sideroforů zatím nebyl detailněji zkoumán.
ZÁVĚR
V souladu s výsledky předchozích studií [30, 31 a další] byla produkce sledovaných faktorů virulence u izolátů z močových katétrů vysoká. Prakticky všechny kmeny byly pohyblivé a tvořily biofilm (aerovaný a/nebo submerzní), 90 % kmenů sekretovalo jednotlivé exoenzymy. Vysoké procento kmenů tvořilo také pyoverdin – siderofor vychytávající esenciální ionty železa z prostředí.
Motilita a schopnost tvořit biofilm jsou důležité faktory pro vytvoření mikrobiálního ložiska, např. v lumen katétru. Extracelulární látky napomáhají degradaci tkání a rozvoji infekce. Přesné vztahy mezi produkcí jednotlivých faktorů virulence však nejsou dosud zcela objasněny.
V rámci této studie byla pozitivní korelace prokázána mezi produkcí některých extracelulárních látek a také mezi produkcí submerzního a aerovaného biofilmu. Naopak tvorba obou typů biofilmu negativně korelovala s produkcí LasB elastázy. Sekrece pigmentů vykazovala negativní korelaci se schopností kmene tvořit submerzní biofilm a pozitivní korelaci s produkcí aerovaného biofilmu. Všechny prokázané korelace byly významné na hladině p = 0,05 a vykazovaly korelaci vyšší než 50% (γ > 0,50).
Práce je součástí dlouhodobějšího výzkumu dané problematiky. Na fenotypové metody detekce faktorů virulence navazuje genotypizace kmenů pomocí RAPD (random amplification of polymorphic DNA) a PFGE (pulse field gradient electrophoresis), která umožní získat přehled o epidemiologii izolátů v rámci několika zdravotnických zařízení v Brně. Porozumění vztahům mezi jednotlivými faktory virulence je nezbytné pro pochopení patogeneze onemocnění způsobených Pseudomonas aeruginosa. Tyto znalosti mohou vést ke zlepšení a zefektivnění léčby pseudomonádových infekcí, zejména těch, které jsou spojené s tvorbou biofilmu. Adekvátní terapeutické zásahy by potom mohly vést ke snížení počtu pseudomonádových infekcí a tím i k úspoře nákladů s těmito infekcemi spojenými.
Poděkování: Práce byla podpořena z grantového projektu IGA MZ ČR NS-9678.
Do redakce došlo dne 1. 11. 2011.
Kontaktní adresa:
Ing. Veronika Holá, Ph.D.
MÚ LF a FN u sv. Anny
Pekařská 53
656 91 Brno
e-mail: veronika.hola@fnusa.cz
Sources
1. Palleroni, N. J. Genus I. Pseudomonas. In Garrity, G. M., Brenner, D. J., Krieg, N. R., Staley J. T. [eds.] Bergey’s Manual of Systematic Bacteriology. Volume 2. New York: Springer Verlag, 2005, s. 323–379.
2. Mittal, R., Aggarwal, S., Sharma, S., Chhibber, S. et al. Urinary tract infections caused by Pseudomonas aeruginosa: a minireview. J. Infect. Public. Health, 2009, roč. 2, s. 101–111.
3. Trautner, B. W., Darouiche, R. O. Catheter-associated infections: pathogenesis affects prevention. Arch. Intern. Med., 2004, roč. 164, s. 842–850.
4. Stehling, E. G., Silveira, W. D., Leite, S. Study of biological characteristics of Pseudomonas aeruginosa strains isolated from patients with cystic fibrosis and from patients with extra-pulmonary infections. Braz. J. Infect. Dis., 2008, roč. 12, s. 86–88.
5. Mah, T. F., O’Toole, G. A. Mechanisms of biofilm resistance to antimicrobial agents. Trends Microbiol., 2001, roč. 9, s. 34–39.
6. Kaplan, J. B., Mulks, M. H. Biofilm formation is prevalent among field isolates of Actinobacillus pleuropneumoniae. Vet. Microbiol., 2005, roč. 108, s. 89–94.
7. Koza, A., Hallett, P. D., Moon, C. D., Spiers, A. J. Characterization of a novel air-liquid interface biofilm of Pseudomonas fluorescens SBW25. Microbiology, 2009, roč. 155, s. 1397–1406.
8. Spiers, A. J., Rainey, P. B. The Pseudomonas aeruginosa SBW25 Wrinkly Spreader biofilm requires attachment factor, cellulose fibre and LPS interactions to maintain strength and integrity. Microbiology, 2005, roč. 151, s. 2829–2839.
9. Van Delden, C., Iglewski, B. H. Cell-to-cell signaling and Pseudomonas aeruginosa infections. Emerg. Infect. Dis., 1998, roč. 4, s. 551–560.
10. Lee, V. T., Smith, R. S., Tümmler, B., Lory, S. Activities of Pseudomonas aeruginosa effectors secreted by the Type III secretion system in vitro and during infection. Infect. Immun., 2005, roč. 73, s. 1695–1705.
11. Nickel, J. C., Grant, S. K., Costerton, J. W. Catheter-associated bacteriuria. An experimental study. Urology, 1985, roč. 26, s. 369–375.
12. O’Toole, G. A., Kolter, R. Flagellar and twitching motility are necessary for Pseudomonas aeruginosa biofilm development. Mol. Microbiol., 1998, roč. 30, s. 295–304.
13. Stepanović, S., Vuković, D., Holá, V., Di Bonaventura, G. et al. Quantification of biofilm in microtiter plates: overview of testing conditions and practical recommendations for assessment of biofilm production by staphylococci. APMIS, 2007, roč. 115, s. 891–899.
14. Déziel, E., Comeau, Y., Villemur, R. Initiation of biofilm formation by Pseudomonas aeruginosa 57RP correlates with emergence of hyperpiliated and highly adherent phenotypic variants deficient in swimming, swarming, and twitching motilities. J. Bacteriol., 2001, roč. 183, s. 1195–1204.
15. Zolfaghar, I., Evans, D. J., Fleiszig, S. M. Twitching motility contributes to the role of pili in corneal infection caused by Pseudomonas aeruginosa. Infect. Immun., 2003, roč. 71, s. 5389–5393.
16. Rasband, W. ImageJ. version 1.43q, 2010, Bethesda, Maryland, USA; National Institutes of Health.
17. Deligianni, E., Pattison, S., Berrar, D., Ternan, N.G. et al. Pseudomonas aeruginosa cystic fibrosis isolates of similar RAPD genotype exhibit diversity in biofilm forming ability in vitro. BMC Microbiol., 2010, 10 : 38.
18. Rampioni, G., Schuster, M., Greenberg, E. P., Zennaro, E. et al. Contribution of the RsaL global regulator to Pseudomonas aeruginosa virulence and biofilm formation. FEMS Microbiol. Lett., 2009, roč. 301, s. 210–217.
19. Hamood, A. N., Griswold, J., Colmer, J. Characterization of elastase-deficient clinical isolates of Pseudomonas aeruginosa. Infect. Immun., 1996, roč. 64, s. 3154–3160.
20. Fonseca, A. P., Correia, P., Extremina, C. I., Sousa, J. C. et al. Molecular epidemiology of Pseudomonas aeruginosa clinical isolates from Portuguese Central Hospital. Folia Microbiol., 2008, roč. 53, s. 540–546.
21. Bachofen, R., Siegrist, J. Microbiology manual. 3rd ed., St. Louis: Sigma-Aldrich Corporation, 2008, 553 s.
22. StatSoft, Inc.: STATISTICA (data analysis software system), version 9.1., 2010, www.statsoft.com.
23. Růžička, F., Holá, V., Votava, M., Tejkalová, R. et al. Biofilm detection and the clinical significance of Staphylococcus epidermidis isolates. Folia Microbiol. Praha, 2004, roč. 49, s. 596–600.
24. Webb, J. S., Lau, M., Kjelleberg, S. Bacteriophage and phenotypic variation in Pseudomonas aeruginosa biofilm development. J. Bacteriol., 2004, roč. 186, s. 8066–8073.
25. Vaca, S., Arce, J., Oliver, G., Arenas, D. et al. FIZ15 bacteriophage increases the adhesion of Pseudomonas aeruginosa to human buccal epithelial cells. Rev. Lat. Am. Microbiol., 1989, roč. 31, s. 1–5.
26. Ude, S., Arnold, D. L., Moon, C. D., Timms-Wilson, T. et al. Biofilm formation and cellulose expression among diverse environmental Pseudomonas isolates. Environ. Microbiol., 2006, roč. 8, s. 1997–2011.
27. Leone, I., Chirillo, M. G., Raso, T., Zucca, M. et al. Phenotypic and genotypic characterization of Pseudomonas aeruginosa from cystic fibrosis patients. Eur. J. Clin. Microbiol. Infect. Dis., 2008, roč. 27, s. 1093–1099.
28. Mahenthiralingam, E., Campbell, M. E., Speert, D. P. Nonmotility and phagocytic resistance of Pseudomonas aeruginosa isolates from chronically colonised patients with cystic fibrosis. Infect. Immun., 1994, roč. 62, s. 569–605.
29. Stickler, D., Hughes, G. Ability of Proteus mirabilis to swarm over urethral catheters. Eur. J. Clin. Microbiol. Infect. Dis., 1999, roč. 18, s. 206–208.
30. Mittal, R., Khandwaha, R. K., Gupta, V., Mittal, P. K. et al. Phenotypic characters of urinary isolates of Pseudomonas aeruginosa & their association with mouse renal colonization. Indian J. Med. Res., 2006, roč. 123, s. 67–72.
31. Woods, D. E, Schaffer, M. S., Rabin, H. R., Campbell, G. D. et al. Phenotypic comparison of Pseudomonas aeruginosa strains isolated from a variety of clinical sites. J. Clin. Microbiol., 1986, roč. 24, s. 260–264.
32. Yadav, V., Harjai, K., Kaur, R., Joshi, K. et al. Urovirulence of Pseudomonas aeruginosa: planktonic cells vs. biofilm cells. Folia Microbiol., 2004, 49, s. 465–470.
33. Fernández-PiĖar, R., Cámara, M., Dubern, J. F., Ramos, J. L. et al. The Pseudomonas aeruginosa quinolone quorum sensing signal alters the multicellular behaviour of Pseudomonas putida KT2440. Res. Microbiol., 2011, roč. 162, s. 773–781.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2012 Issue 1-2-
All articles in this issue
- Epidemie virové hepatitidy E v České republice?
- Porovnání produkce vybraných faktorů virulence Pseudomonas aeruginosa izolovaných z katétrů
-
30 let od popsání prvních případů AIDS – historie a současnost
Část I. - Mikroneutralizace v diagnostice chřipkové infekce
- Lymská borelióza – epidemiologická analýza výskytu v severnom regióne Slovenska
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue-
30 let od popsání prvních případů AIDS – historie a současnost
Část I. - Epidemie virové hepatitidy E v České republice?
- Porovnání produkce vybraných faktorů virulence Pseudomonas aeruginosa izolovaných z katétrů
- Lymská borelióza – epidemiologická analýza výskytu v severnom regióne Slovenska
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

