-
Medical journals
- Career
Testikulární aneuploidie spermií mužů s transverzální lézí míšní
Authors: Jiří Heráček 1,2,3; Vladimír Sobotka 1,2,4; Miluše Vozdová 5; Jiří Rubeš 5; Michael Urban 1,2,3; Robert Grill 1,2
Authors‘ workplace: Univerzita Karlova v Praze, 3. lékařská fakulta, Urologická klinika 1; Fakultní nemocnice Královské Vinohrady, Urologická klinika 2; Androgeos, Praha 3; Pronatal, Praha 4; Výzkumný ústav veterinárního lékařství, v. v. i., Brno 5
Published in: Ces Urol 2013; 17(1): 36-41
Category: Original article
Overview
Cíl:
Stanovit pomocí fluorescenční in situ hybridizace frekvenci výskytu numerických abnormalit chromozomů X, Y, 13, 15, 16, 18, 21 a 22 u spermií mužů s transverzální lézí míšní. Výsledky porovnat s frekvencí výskytu aneuploidií u kontrolní skupiny zdravých dobrovolníků s normospermií.Metoda:
Do studie jsme od roku 2010 do roku 2011 zařadili jedenáct (věk 21–41 roků, průměr ± SEM: 36,2 ± 11,9) mužů s anejakulací po transverzální lézi míšní. Mikrochirurgickou metodou jsme pacientům odebrali testikulární tkáň se spermiemi, které jsme následně vyšetřili pomocí fluorescenční in situ hybridizace. Výsledky jsme porovnali s kontrolní skupinou 10 (věk 26–58 roků, průměr ± SEM: 37,2 ± 13,1) zdravých dobrovolníků, u kterých analýza ejakulátu odebraného masturbací prokázala normospermii.Výsledky:
U mužů s poraněním míchy jsme ze vzorků testikulárních tkání vyšetřili celkem 2613 spermií. V průměru jsme zjistili 2,95 % spermií disomických a 4,90 % spermií diploidních pro sledované chromozomy. Medián byl 3,54, resp. 1,63, což ukazuje na značnou interindividuální variabilitu ve frekvenci diploidních spermií. U každého zdravého dobrovolníka s normospermií jsme vyšetřili nejméně 5000 spermií. Nalezli jsme 0,62 % spermií disomických a 0,29 % diploidních (medián 1,38, resp. 0,26) pro sledované chromozomy. Frekvence výskytu chromozomálně abnormálních spermií byla u pacientů s poraněním míchy statisticky významně vyšší oproti kontrolní skupině (p < 0,01).Závěr:
Výsledky studie prokázaly vysoký počet spermií s numerickými chromozomálními aberacemi u mužů s transverzální lézí míšní a potvrzují nutnost preimplantační genetické diagnostiky při asistované reprodukci u těchto pacientů.Klíčová slova:
fluorescenční in situ hybridizace, odběr spermií, aneuploidie, transverzální léze míšní.ÚVOD
Každoročně v České republice přibývá okolo 300 pacientů s transverzální lézí míšní (TLM). Více než 60 % těchto úrazů postihuje muže, často ve velmi mladém věku.
Poruchu plodnosti u mužů s TLM způsobují především erektilní a ejakulatorní dysfunkce, poškozená tvorba, dozrávání a transport spermií ve varlatech a nadvarlatech, infekce močopohlavních cest a hormonální změny. Kvalitu spermií ovlivňují opakované infekce močopohlavního traktu, technika vyprazdňování močového měchýře, stagnace spermií v semenných váčcích při anejakulaci, zvýšená teplota v šourku, hormonální změny v ose hypotalamus–hypofýza–varle, protilátky proti spermiím nebo vedlejší účinky trvalé medikace (1).
Řada výše zmíněných vlivů může zhoršit i genetickou kvalitu spermií – ať již narušením integrity chromatinu spermií, nebo poruchami spermatogeneze. Výsledkem mohou být numerické aberace chromozomů tzv. aneuploidie, které můžeme diagnostikovat pomocí metody fluorescenční in situ hybridizace (FISH), a stanovit tak frekvenci výskytu chromozomálně abnormálních spermií (2).
Cílem práce bylo porovnat frekvence výskytu aneuploidií chromozomů ve spermiích v souboru mužů s TLM a u kontrolní skupiny zdravých dobrovolníků.
METODA
Soubor
Do studie jsme od roku 2010 do roku 2011 zařadili jedenáct mužů s anejakulací po TLM, kterým jsme odebrali spermie mikrochirurgickou metodou z varlete v rámci léčby neplodnosti. Tabulka 1 shrnuje základní charakteristiku souboru.
Kontrolní skupinu tvořilo 10 zdravých dobrovolníků (věk 26–58 roků, průměr ± SEM: 37,2 ± 13,1), u kterých analýza ejakulátu odebraného masturbací prokázala normospermii. Ejakulát jsme vyšetřili podle doporučení Světové zdravotnické organizace (3).
Do studie jsme nezařadili pacienty s akutní infekcí, známým endokrinním onemocněním, jaterní poruchou, akutním plicním nebo ledvinovým selháním a anamnézou poranění zevního genitálu.
Pacienti podepsali informovaný souhlas schválený Etickou komisí 3. lékařské fakulty Univerzity Karlovy v Praze.
Chirurgický odběr spermií
Pacienti s TLM podstoupili mikrochirurgický odběr spermií a tkáně varlete v rámci léčby neplodnosti metodou asistované reprodukce. Biologický materiál jsme odebírali metodou M-TESE (microsurgical testicular sperm extraction) podle Schlegela (4). Po získání spermií pro asistovanou reprodukci jsme odebírali biologický materiál pro studii. Z místa, kde jsme nalezli spermie, jsme odebrali vzorek testikulární tkáně o velikosti 5 × 2 × 1 mm.
Cytogenetické vyšetření spermií
Tkáň varlete jsme bezprostředně po odběru otiskli na střední část podložního sklíčka na terčík o průměru 10 mm. Sklíčko jsme nechali zaschnout při pokojové teplotě a po přemístění do boxu s odvlhčovačem jsme ho při teplotě do –15 oC skladovali do zpracování metodou FISH. DNA spermií jsme dekondenzovali a denaturovali inkubací v 1 M NaOH. FISH jsme provedli ve dvou krocích, nejprve se sondou MultiVysionTM PB specifickou pro chromozomy 13, 16, 18, 21 a 22 (Vysis-Abbott, Abbott Park, IL, USA). Po vyhodnocení první části FISH následovala druhá část se sondami pro chromozomy X, Y a 15 (Vysis-Abbott). Fluorescenčním mikroskopem (BX60, Olympus, Japonsko) vybaveným potřebnými fluorescenčními filtry, fázovým kontrastem a automatickým stolkem pro záznam souřadnic jsme vyšetřili všechny morfologicky dobře definované nepřekrývající se spermie s bičíkem. Použili jsme hodnotící kritéria podle Rubeše et al. (5). Spermii jsme hodnotili jako disomickou, pokud obsahovala dva fluorescenční signály pro některý s vyšetřovaných chromozomů stejné velikosti oddělené mezerou nejméně o velikosti jednoho signálu (obr. 1). Polohu každé hodnocené spermie jsme zaznamenali v počítači. Spermie jsme znovu vyhledali a vyhodnotili pro zbývající tři chromozomy po druhém kole FISH. Diploidní spermie měly zdvojené signály pro všechny chromozómy.
Image 1. Fluorescenční in situ hybridizace na spermiích: signály pro chromozomy 21 (zelený), 18 (modrý), X (růžový), 13 (červený) a Y (žlutý) Fig. 1. Fluorescence in situ hybridization in sperms: signals for chromosomes 21 (green), 18 (blue), X (pink), 13 (red) and Y (yellow) 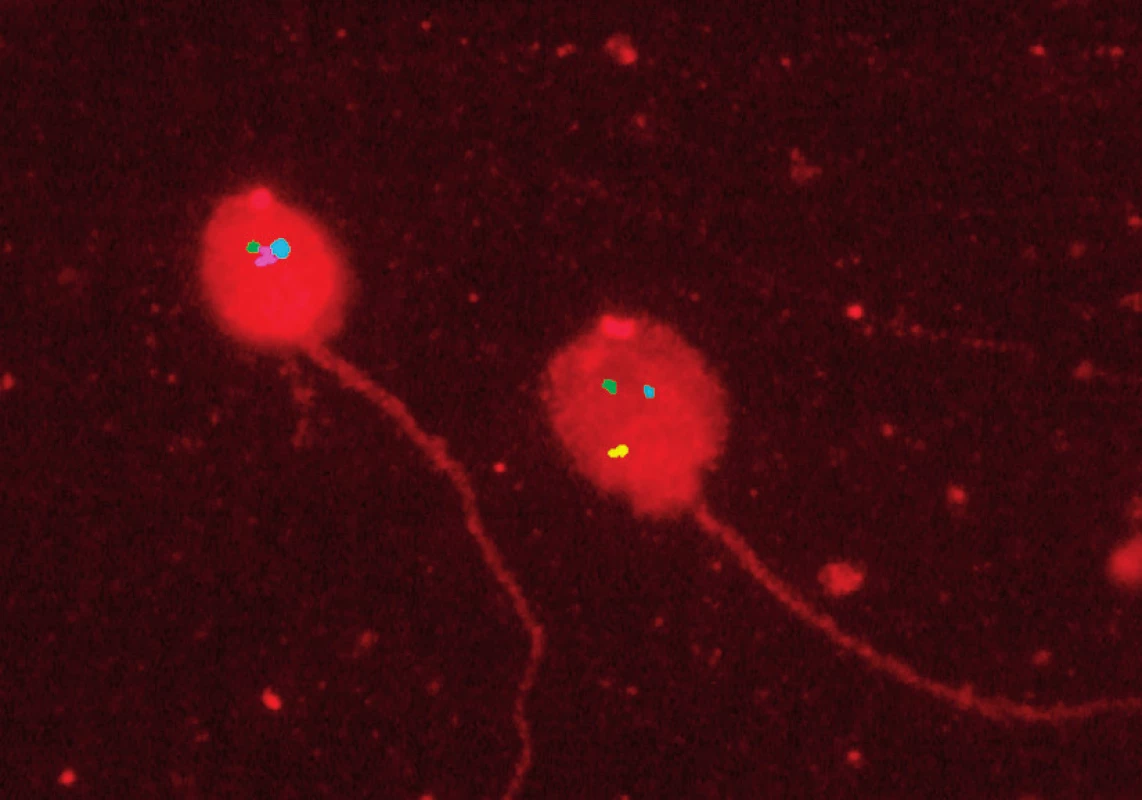
Statistický rozbor
Demografická a klinická data pacientů jsme zpracovali metodami popisné statistiky. Pro statistickou analýzu jsme použili neparametrický Mannův-Whitneyův test, který jsme vyhodnotili na 5% hladině významnosti s využitím softwaru SPSS, verze 18 pro Windows (SPSS, Chicago, IL, USA). Při zpracování článku jsme se řídili současnými mezinárodními doporučeními pro publikaci výsledků observačních studií (6).
Table 1. Základní charakteristika souboru Table 1. Baseline characteristic of the set 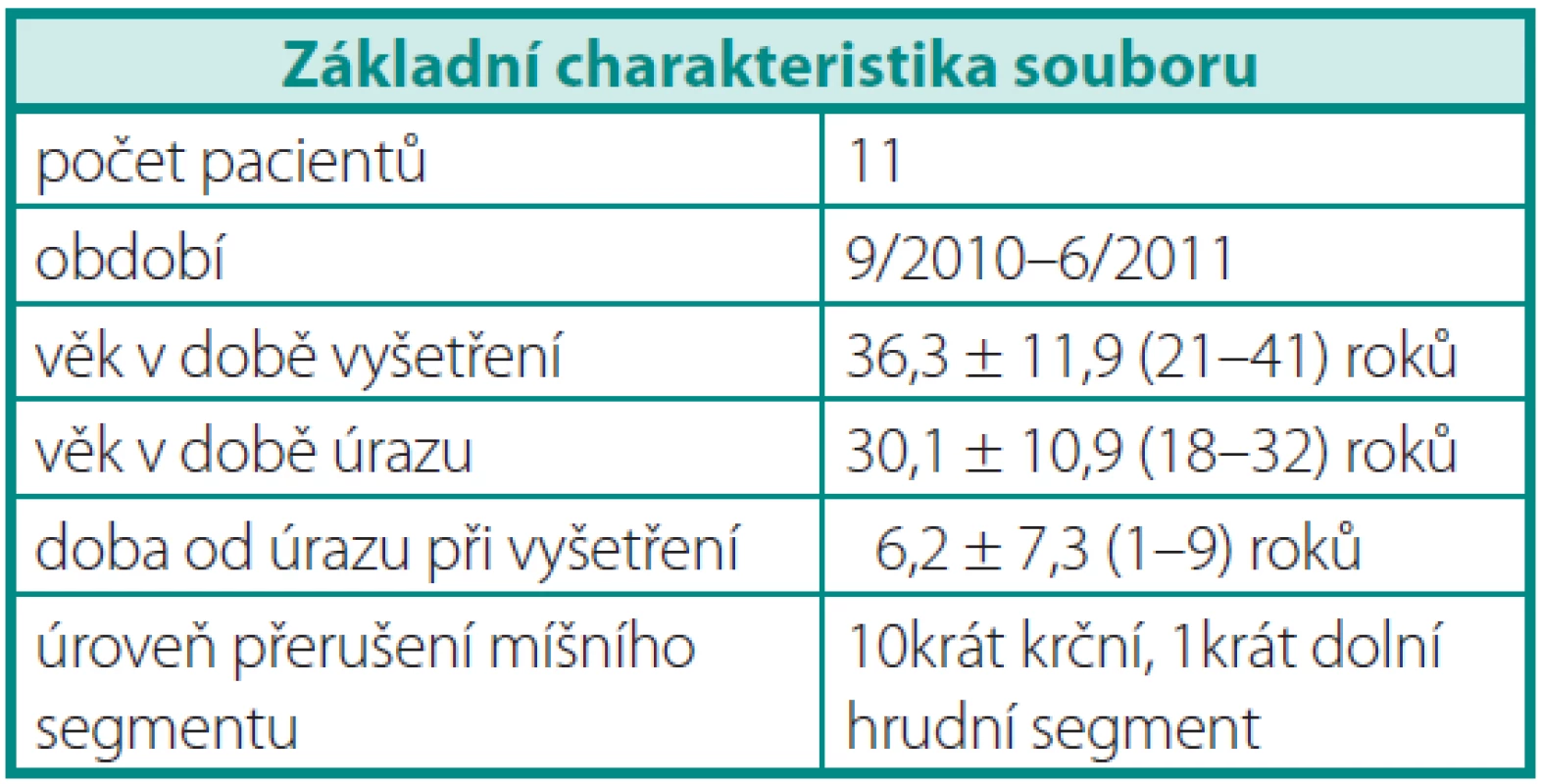
VÝSLEDKY
Všechny muže jsme vyšetřili nejméně 2 roky po TLM, průměrná doba od TLM do doby našeho vyšetření byla 6,2 ± 7,3 roku. Průměrný věk pacientů v době TLM byl 30,1 ± 10,9 roku, průměrný věk pacientů v době našeho vyšetření byl 36,3 ± 11,9 roku.
U mužů s TLM jsme ze vzorků testikulárních tkání vyšetřili celkem 2613 spermií. Z tohoto počtu byla 2,95 % spermií disomických (medián 3,54) a 4,90 % spermií diploidních (medián 1,63) pro sledované chromozomy. U zdravých dobrovolníků jsme zjistili 0,62 % spermií disomických (medián 0,54) a 0,29 % diploidních (medián 0,26) pro sledované chromozomy (tab. 2). Frekvence výskytu chromozomálně abnormálních spermií byla u pacientů s TLM statisticky signifikantně vyšší oproti kontrolní skupině (p < 0,01). Zaznamenali jsme značnou interindividuální variabilitu ve frekvenci spermií s chromozomálními poruchami v rozsahu 1,85–29,41 %. Na této variabilitě se významně podílí frekvence diploidních spermií (tab. 2).
Table 2. Frekvence aneuploidií u mužů s transverzální lézí míšní a u kontrol Table 2. Aneuploidy frequency in men with transversal spinal lesion and in controls 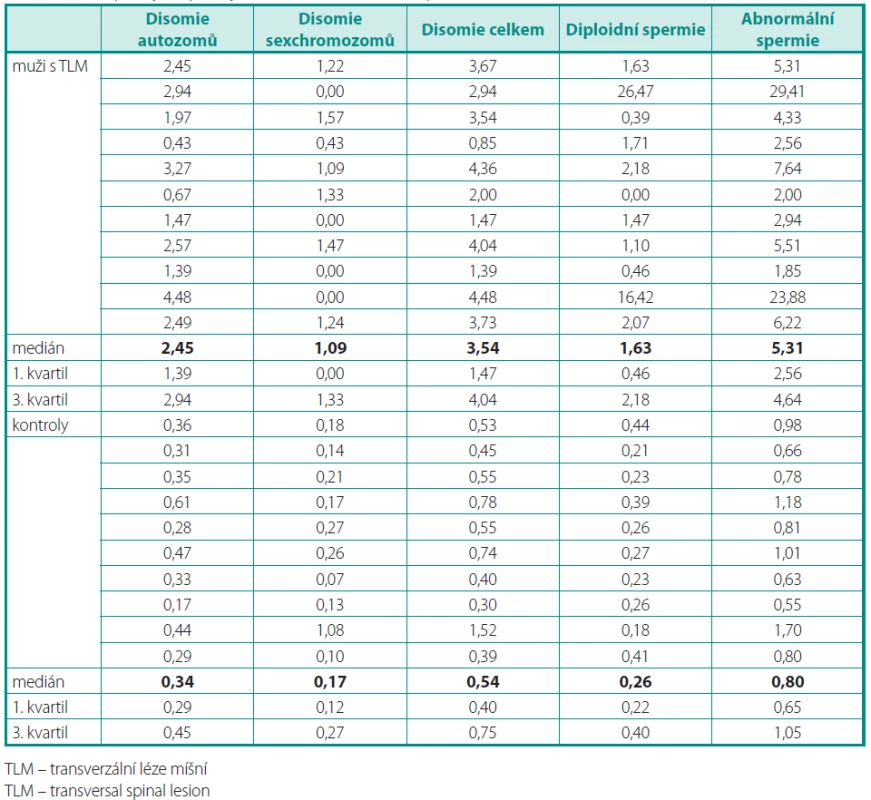
DISKUSE
Po zavedení intracytoplazmatické injekce spermie (ICSI) a M-TESE do klinické praxe vyvstala otázka genetické kvality spermií používaných pro asistovanou reprodukci. Vyšší frekvence výskytu numerických aberací často nacházíme v ejakulátu mužů s abnormálním spermiogramem, u nositelů vrozených chromozomálních poruch a ve spermiích získaných metodou M-TESE (7, 8). Zvýšené frekvence výskytu cytogeneticky abnormálních spermií byly zjištěny také u mužů s neobstrukční azoospermií (9–11). Příčinou je pravděpodobně komplexní narušení meiotických a spermatogenetických procesů. Meiotické poruchy jako defekty párování homologních chromozomů a redukce rekombinace mohou být příčinou vzniku aneuploidních gamet a při rozeznání kontrolními mechanismy buněčného cyklu mohou zastavit maturaci a vést k oligo - až azoospermii (10). U neplodných párů s abnormálními výsledky vyšetření spermií metodou FISH byl zjištěn snížený počet otěhotnění a úspěšných implantací embrya a zvýšený počet potratů při asistované reprodukci (11, 12). Zvýšené frekvence aneuploidií byly dokonce zjištěny i v testikulárních spermiích získaných od mužů po vazektomii (11). Tyto nálezy upozorňují na zvýšené riziko vzniku aneuploidních embryí při využití testikulárních spermií pro ICSI.
V současné době známe základní hladiny disomií pro jednotlivé chromozomy, které se při striktních kritériích hodnocení pohybují v rozmezí 0,03–0,47 % (2, 5). V tomto intervalu se pohybuje také frekvence výskytu aneuploidií pro jednotlivé chromozomy u naší kontrolní skupiny. Naši pacienti po TLM mají statisticky významně vyšší frekvenci výskytu aneuploidií, a to 5,8krát pro autozomy a 2,9krát pro sex chromozomy. Zvláště závažný je podstatně vyšší počet diploidních spermií (17krát), což nasvědčuje závažnému narušení spermiogeneze, zejména u dvou mužů z vyšetřované skupiny. Specifická situace mužů s TLM přispívá k vyšší frekvenci výskytu aneuploidií ve spermiích, vyšší než u obdobné skupiny pacientů bez TLM, kteří podstoupili M-TESE a které Vozdová et al. vyšetřovali stejnou metodikou (8). V této studii měli muži frekvenci disomií chromozomů 6krát vyšší oproti kontrolní skupině, zatímco u námi prezentované skupiny je zvýšení 8,7krát. V odborném tisku nalezneme velmi málo údajů, se kterými můžeme porovnat výsledky naší práce. Qiu et al. vyšetřili spermie odebrané penilní vibrační stimulací od 18 mužů s TLM a zjistili 2,4krát vyšší frekvenci aneuploidií pro vyšetřované autozomy (13, 18 a 21) oproti kontrolní skupině 16 pacientů s psychogenní anejakulací bez TLM (13). Výsledky naší studie, které prokázaly podstatně vyšší frekvenci výskytu aneuploidií u spermií, mohla ovlivnit skutečnost, že jsme sledovali větší počet autozomů. Naopak se shodujeme ve vyšší frekvenci u sex chromozomů, kterou Qiu et al. nalezli 2,2krát vyšší u mužů s TLM oproti kontrolní skupině pacientů. Autoři této studie bohužel nesledovali diploidní spermie.
Výsledky cytogenetického vyšetření spermií mohou sloužit jako prognostický ukazatel výsledku IVF-ICSI (14), což je patrné na interindividuální variabilitě ve frekvenci aneuploidií ve spermiích i z výsledků naší skupiny pacientů s TLM.
ZÁVĚRY
Výsledky naší studie potvrzují důležitost genetického vyšetření spermií u mužů s TLM před asistovanou reprodukcí.
Mechanismy, které ovlivňují vlastnosti spermií mužů s TLM, jsou stále nejasné, proto bude nutné realizovat další studie, které vyhodnotí vliv nervového systému na tvorbu, pohyb a vývoj spermií i na složení biochemických látek v semenné tekutině. Výzkum je třeba zaměřit na změny spermatogeneze a vlastnosti spermií při akutním poranění míchy, v průběhu spinálního šoku a v chronické fázi poranění míchy.
Vysoký výskyt sexuálních dysfunkcí u mužů s TLM poukazuje na potřebu aktivního mezioborového přístupu k této problematice, nejlépe ve specializovaných centrech.
Došlo: 18. 10. 2012.
Přijato: 11. 12. 2012.
Kontaktní adresa
doc. MUDr. Jiří Heráček, Ph.D., MBA
Urologická klinika 3. LF UK
Ruská 87, 100 00 Praha 10
e-mail: jiri.heracek@lf3.cuni.cz
Práce vznikla za podpory grantu IGA MZ č. NS9967 a výzkumného záměru MZE 0002716202.
Projekt byl schválen Etickou komisí 3. lékařské fakulty Univerzity Karlovy v Praze.
Střet zájmů: žádný.
Sources
1. Brackett NL, Lynne CM, Ibrahim E, Ohl DA, Sønksen J. Treatment of infertility in men with spinal cord injury. Nat Rev Urol 2010; 7(3): 162–172.
2. Templado C, Vidal F, Estop A. Aneuploidy in human spermatozoa. Cytogenet Genome Res 2011; 133(2–4): 91–99.
3. World Health Organisation. WHO Laboratory Manual for the Examination and Processing of Human Semen, 5th ed. Geneva: World Health Organization 2010.
4. Schlegel PN. Testicular sperm extraction: microdissection improves sperm yield with minimal tissue excision. Hum Reprod 1999; 14(1): 131–135.
5. Rubes J, Vozdova M, Oracova E, Perreault SD. Individual variation in the frequency of sperm aneuploidy in humans. Cytogenet Genome Res 2005; 111(3–4): 229–236.
6. von Elm E, Altman DG, Egger M, Pocock SJ, Gøtzsche PC, Vandenbroucke JP. The Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) statement: guidelines for reporting observational studies. J Clin Epidemiol 2008; 61(4): 344–349.
7. Calogero AE, Burrello N, De Palma A, Barone N, D‘Agata R, Vicari E. Sperm aneuploidy in infertile men. Reprod Biomed Online 2003; 6(3): 310–317.
8. Vozdova M, Heracek J, Sobotka V, Rubes J. Testicular sperm aneuploidy in non-obstructive azoospermic patients. Hum Reprod 2012; 27(7): 2233–2239.
9. Gianaroli L, Magli MC, Cavallini G, Crippa A, Nadalini M, Bernardini L, et al. Frequency of aneuploidy in sperm from patients with extremely severe male factor infertility. Hum Reprod 2005; 20(8): 2140–2152.
10. Ferguson KA, Wong EC, Chow V, Nigro M, Ma S. Abnormal meiotic recombination in infertile men and its association with sperm aneuploidy. Hum Mol Genet 2007; 16(23): 2870–2879.
11. Rodrigo L, Rubio C, Peinado V, Villamón R, Al-Asmar N, Remohí J, et al. Testicular sperm from patients with obstructive and nonobstructive azoospermia: aneuploidy risk and reproductive prognosis using testicular sperm from fertile donors as control samples. Fertil Steril 2011; 95(3): 1005–1012.
12. Burrello N, Vicari E, Shin P, Agarwal A, De Palma A, Grazioso C, et al. Lower sperm aneuploidy frequency is associated with high pregnancy rates in ICSI programmes. Hum Reprod 2003; 18(7): 1371–1376.
13. Qiu Y, Wang LG, Zhang LH, Li J, Zhang AD, Zhang MH. Sperm chromosomal aneuploidy and DNA integrity of infertile men with anejaculation. J Assist Reprod Genet 2012; 29(2): 185–194.
14. Nicopoullos J, Gilling-Smith C, Almeida PA, Homa S, Nice L, Tempest H, et al. The role of sperm aneuploidy as a predictor of the success of intracytoplasmic sperm injection? Hum Reprod 2008; 23(2): 240–250.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2013 Issue 1-
All articles in this issue
- Role urologa u kastračně rezistentního karcinomu prostaty v České republice
- Diagnostika onemocnění nadledvin – nejvýznamnější klinické syndromy, biochemický průkaz a úloha zobrazovacích metod
- Cizí tělesa zavedená do urogenitálního traktu za účelem sexuální stimulace
- Testikulární aneuploidie spermií mužů s transverzální lézí míšní
- Vyšetření sentinelové uzliny u karcinomu prostaty – mapování primární lymfatické drenáže a zhodnocení přínosu pro staging onemocnění
- Život ohrožující krvácení do dutiny břišní na podkladě spontánní ruptury angio-myolipomu
- Morcelace ledviny po laparoskopické nefrektomii
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diagnostika onemocnění nadledvin – nejvýznamnější klinické syndromy, biochemický průkaz a úloha zobrazovacích metod
- Cizí tělesa zavedená do urogenitálního traktu za účelem sexuální stimulace
- Život ohrožující krvácení do dutiny břišní na podkladě spontánní ruptury angio-myolipomu
- Morcelace ledviny po laparoskopické nefrektomii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

