-
Medical journals
- Career
Testovanie potenciálne probiotických laktobacilov pre použitie vo výživových doplnkoch
Authors: Andrea Bilková; František Bilka; Hana Kiňová Sepová; Andrea Balážová
Published in: Čes. slov. Farm., 2013; 62, 40-45
Category: Original Articles
Overview
Niektoré kmene laktobacilov sú vďaka svojim probiotickým vlastnostiam využívané v potravinárstve a vo výživových doplnkoch. Na našom pracovisku je testovaných 8 kmeňov laktobacilov, pochádzajúcich zo žalúdočných slizníc jahňaťa a kozľaťa, na potenciálne využitie v probiotických prípravkoch pre humánnu, a/alebo veterinárnu medicínu. Sanguinarín je majoritným alkaloidom in vitro kultúr rastlín čeľade Papaveraceae. Vďaka svojmu antimikróbnemu, antimykotickému, antiplakovému a protizápalovému účinku našiel uplatnenie v stomatologických prípravkoch. Spolu s ďalšími alkaloidmi je obsiahnutý aj v prípravku na zvýšenie apetítu hospodárskych zvierat. V tejto práci sme sa zamerali na sledovanie antibakteriálneho vplyvu sanguinarínu, vyizolovaného zo suspenzných kultúr maku siateho, na vybrané kmene laktobacilov. Z nami testovaných laktobacilov bol voči sanguinarínu najmenej citlivý L. reuteri KO5 s MIC 0,6 mg.ml-1. Nasledovali L. murinus C, L. mucosae D a L. plantarum KG4, zhodne s MIC 0,3 mg.ml-1. V prípade použitia kombinácie dvoch a viacerých kmeňov mikroorganizmov v jednom prípravku je potrebné poznať ich vzájomnú schopnosť ovplyvňovať svoj rast a prežívanie. Na testovanie vzájomného vplyvu laktobacilov bola použitá prúžková metóda na agarových platniach. Zo získaných výsledkov vyplýva, že pre použitie v kombinovaných prípravkoch sú najvhodnejšie kmene L. reuteri E, L. plantarum KG1 a L. reuteri KO4m.
Kľúčové slová:
Lactobacillus spp. • probiotiká • výživové doplnky • sanguinarínÚvod
Probiotické mikroorganizmy majú vysoko pravdepodobne pozitívny účinok na zdravie ľudí a zvierat1–6). Medzi nimi majú dominantné postavenie kmene patriace k rodu Lactobacillus. Okrem priaznivého účinku napr. na zloženie gastrointestinálnej mikrobioty, možnosti ovplyvnenia niektorých ochorení gastrointestinálneho traktu a schopnosti modulovať imunitnú odpoveď makroorganizmu sa ukazuje ich možné využitie pri prevencii vzniku zubného kazu. Napríklad Nikawa et al.7) pozorovali, že konzumácia jogurtu s obsahom L. reuteri ATCC 55730 mala signifikantný vplyv na inhibíciu rastu Streptococcus mutans v ústnej dutine sledovaných osôb. Rovnako denný príjem probiotických baktérií (L. reuteri ATCC 55730/ATCC PTA 5289) obsiahnutých v žuvačkách významne redukoval množstvo Streptococcus mutans v slinách mladistvých8). Za tento efekt zodpovedajú pravdepodobne rôzne látky s antimikróbnym účinkom, ktoré produkujú niektoré kmene laktobacilov, napr. organické kyseliny (mliečna, propiónová, octová), peroxid vodíka, CO2, bakteriocíny (antimikróbne pôsobiace peptidy alebo proteíny), reuterín, reutericyklín a i.5, 9, 10).
Producentmi sekundárneho metabolitu sanguinarínu sú najmä rastliny čeľade Papaveraceae, napr. makovec srdcovitý (Macleaya cordata Willd. R. Br.), slncovka kalifornská (Eschscholtzia californica Cham.), lastovičník väčší (Chelidonium majus L.), krvavček kanadský (Sanguinaria canadensis L.) a mak siaty (Papaver somniferum L.). Východzou aminokyselinou v biosyntéze tohto benzo[c]fenantridínového alkaloidu je tyrozín a v súčasnosti sú už známe a aspoň čiastočne charakterizované všetky enzýmy, zúčastňujúce sa tvorby sanguinarínu11). Vo vodnom prostredí je sanguinarín v rovnováhe medzi formou kvartérneho katiónu a formou 6-hydroxy-5,6-dihydroderivátu (tzv. pseudobáza, alebo alkanolamín)12). Sanguinarín vykazuje veľmi široké spektrum biologických účinkov, ktorých detailný prehľad je spracovaný v publikácii Zdařilovej a kol.13). Kombinácia antimikróbneho, antimykotického, antiplakového a protizápalového účinku14) je výhodná hlavne pre stomatologickú aplikáciu v liečbe a prevencii zápalových ochorení parodontu15). U sanguinarínu bola zaznamenaná bakteriostatická a baktericídna aktivita voči Gram pozitívnym (G+) a Gram negatívnym (G–) baktériám a tiež aktivita voči plesniam a kvasinkám. Existujú štúdie o jeho inhibičných účinkoch na Mycobacterium spp.16), Helicobacter pylori17) a Trypanosoma brucei18). Navarro a Delgado19) zistili aj inhibičnú aktivitu dihydrosanguinarínu voči Staphylococcus aureus, Streptococcus faecalis a Candida albicans.
V predkladanej práci sme sa zamerali na sledovanie antibakteriálneho vplyvu sanguinarínu, vyizolovaného zo suspenzných kultúr maku siateho, na vybrané kmene laktobacilov. Tieto kmene sú testované ako potenciálni kandidáti pre využitie v probiotických prípravkoch pre humánnu, a/alebo veterinárnu medicínu6, 20). Zároveň sme sledovali schopnosť testovaných laktobacilov ovplyvňovať vzájomne svoj rast a prežívanie. Získané výsledky bude možné využiť pri príprave vhodnej zmesi dvoch alebo viacerých kmeňov do kombinovaných probiotických prípravkov. Takéto kombinované prípravky laktobacilov a prípadne sanguinarínu by mohli nájsť nové uplatnenie v ústnej hygiene, prípadne ako doplnky výživy pre veterinárne použitie.
Pokusná časť
Izolácia sanguinarínu
V experimente sme použili sanguinarín, ktorý sme vyizolovali zo suspenzných kultúr maku siateho (cv. Gerlach) v rámci experimentov, popísaných v práci Balažovej a kol.21).
Pôvod a kultivácia baktérii
Inhibičný účinok izolovaného sanguinarínu a schopnosť laktobacilov ovplyvňovať navzájom svoj rast a prežívanie sme testovali na kmeňoch Lactobacillus reuteri CCM 3625 (Česká sbírka mikroorganismů, Brno, ČR), L. reuteri E, L. reuteri KO4b, L. reuteri KO4m, L. reuteri KO5, L. mucosae D, L. murinus C, L. plantarum KG1 and L. plantarum KG4 (všetky izolované, identifikované a uchovávané na Katedre bunkovej a molekulárnej biológie liečiv FaF UK, Bratislava, SR)22, 23) a Staphylococcus aureus ATCC 6538 (American Type Culture Collection, USA). Laktobacily sme kultivovali v MRS bujóne (de Man, Rogosa, Sharpe; Oxoid, Veľká Británia) za anaeróbnych podmienok pri 37 °C 24 h. S. aureus sme kultivovali v živnom bujóne (Imuna, Šarišské Michaľany, SR) aeróbne pri 37 °C 24 h. Pre ďalšie experimenty sme používali suspenzie baktérií vo fyziologickom roztoku nariedené, ako je to uvedené nižšie.
Stanovenie minimálnej inhibičnej koncentrácie sanguinarínu
Pri stanovení minimálnej inhibičnej koncentrácie (MIC) sanguinarínu sme postupovali podľa metódy Mlynarčíka a kol.24). V krátkosti, do 96-jamkovej mikrotitračnej platničky sme aplikovali 100 μl dvakrát koncentrovaného MRS bujónu pre laktobacily alebo živného bujónu pre S. aureus, pričom následne sme do prvých jamiek troch radov pipetovali po 100 μl zásobného roztoku sanguinarínu (1,2 mg.ml-1) v 50% metanole. Ďalej sme roztok sanguinarínu riedili dvojkovým radom, čím sme získali 24 rôznych koncentrácii testovanej látky v troch paralelných testoch. Posledné dva rady jamiek sme použili ako kontrolu: namiesto roztoku sanguinarínu sme do1. jamky 1. radu aplikovali 50% metanol (vehikulum) a do 1. jamky 2. radu MRS bujón. Následne sme aj obsah týchto jamiek riedili dvojkovým radom. Baktérie sme nariedili vo fyziologickom roztoku na počet 105 CFU.ml-1. Následne sme do všetkých jamiek inokulovali bakteriálne suspenzie v množstve 5 μl/jamka. Takto inokulované baktérie sme inkubovali anaeróbne (laktobacily) alebo aeróbne (S. aureus) 24 h pri 37 °C. MIC sanguinarínu sme stanovovali hodnotením prítomnosti rastu jednotlivých testovaných baktérií, vyočkovaných inokulátorom na MRS agar (laktobacily) alebo krvný agar (S. aureus) po následnej 24 h inkubácii.
Prúžková metóda na agarových platniach
Na hodnotenie schopnosti laktobacilov ovplyvňovať vzájomne svoj rast a prežívanie sme použili prúžkovú metódu na agarových platniach20, 25, 26).
Po kultivácii v MRS bujóne sme kultúry laktobacilov, usadené centrifugáciou (1000 x g.10 min-1) a dvakrát premyté 0,85% roztokom NaCl nariedili v 0,85% roztoku NaCl podľa stupnice McFarlanda na stupeň 3 (denzitometer CrystalSpecTM Becton Dickinson, USA). Cez stred platne (Ø 9,6 cm) s modifikovaným MRS agarom (MRS agar bez citrátu triamónneho a acetátu sodného) sme očkovali producentské kmene laktobacilov v línii v objeme 20 μl a inkubovali po dobu 24 h alebo 48 h v anaeróbnych podmienkach. Následne sme laktobacily usmrtili 2 h inkubáciou v parách chloroformu. Indikačné laktobacily sme očkovali v objeme 10 μl v líniách kolmých na líniu producentských kmeňov laktobacilov a inkubovali 24 h pri 37 °C za anaeróbnych podmienok. Urobili sme aj modifikovaný experiment, pri ktorom sme indikačné kmene laktobacilov naočkovali bezprostredne po naočkovaní producentských kmeňov a následne sme všetky baktérie inkubovali 24 h pri 37 °C za anaeróbnych podmienok. V tomto prípade neboli producentské kmene usmrtené chloroformom (0 h pre-inkubácia).
Po poslednej inkubácii sme merali zónu inhibície rastu indikačných laktobacilov v mm.
Inhibičnú zónu dlhú 0–12 mm sme hodnotili ako slabú inhibíciu, 13–24 mm ako stredne silnú inhibíciu a zónu väčšiu ako 25 mm ako vysokú inhibíciu25, 26).
Testovanie baktericídneho alebo bakteriostatického efektu produktov laktobacilov
Zo zóny, kde bol rast indikačných laktobacilov inhibovaný sme inokulačnou kľučkou odobrali 1 μl vzorky a kultivovali sme ju na modifikovanom MRS agare 48 h pri 37 °C za anaeróbnych podmienok. Následne sme hodnotili prítomnosť alebo neprítomnosť rastu laktobacilov. V prípade, že nebol detegovaný žiadny rast indikačnej baktérie, považovali sme účinok látok vyprodukovaných producentským kmeňom laktobacila za baktericídny voči testovanému indikačnému kmeňu. V prípade, že indikačný laktobacil vyrástol, považovali sme účinok látok, vyprodukovaných producentským kmeňom laktobacila, za bakteriostatický voči testovanému indikačnému kmeňu.
Výsledky a diskusia
Zmes benzo[c]fenantridínovch alkaloidov (okrem sanguinarínu obsahuje najmä chelerytrín) izolovaných z Macleaya cordata je používaná na podporu chuti do jedla napr. u prasiat, hydiny a hovädzieho dobytka v prípravku Sangrovit (Phytobiotics Futterzusatzstoffe GmbH., Nemecko)27–29). Prípravok registrovaný v EÚ podporuje tvorbu slín a činnosť tráviacich žliaz. Pritom sa ukazuje, že sanguinarín nie je v tráviacom trakte metabolizovaný na potenciálne nebezpečný benzo[c]fenantridín, ako sa pôvodne predpokladalo a tiež, že nie je takmer vôbec resorbovaný30).
V súčasnosti WHO zaradila vznikajúcu rezistenciu mikroorganizmov na antibiotiká medzi tri najväčšie hrozby pre ľudské zdravie. Následne Európska komisia vydala nariedenie, ktoré od 1. januára 2006 zakazuje používanie antibiotík ako rastových promótorov v krmivách s výnimkou kokcidiostatík a histomonostatík (EC Regulation 1831/2003). Preto probiotiká so svojím širokým antimikróbnym potenciálom poskytujú sľubnú alternatívu. Ich používanie ako krmivových doplnkov sa ukazuje ako prospešné práve u úžitkových zvierat31). Kombinované prípravky laktobacilov a sanguinarínu (resp. súčasné podávanie výživových doplnkov s ich obsahom) by mohli nájsť uplatnenie v živočíšnej výrobe a vo veterinárnej praxi.
V humánnej medicíne sa zdá prospešné využitie probiotických mikroorganizmov a alkaloidu sanguinarínu v ústnej hygiene. Antimikrobiálny, antiinflamačný a antiplakový účinok sanguinarínu sa využíva vo viacerých stomatologických prípravkoch (zubná pasta a ústna voda Santoin, Walmark, ČR). Ako bolo spomenuté v úvode, laktobacily sa zase ukazujú byť prospešnými v prevencii tvorby zubného kazu. Predpokladaným mechanizmom ich účinku je produkcia antibakteriálnych látok, účinných voči jeho pôvodcom32–35). Zároveň je však nutné spomenúť aj opačný názor – v niektorých publikáciách sa autori prikláňajú k názoru, že laktobacily kolonizujú zubné kazy, iniciované inými baktériami a pre ich schopnosť tvorby organických kyselín sa môžu spolupodieľať na rozširovaní lézií36, 37).
V tejto práci testované laktobacily už boli charakterizované z hľadiska ich imunomodulačných vlastností, schopnosti ovplyvniť rast patogénnych a potenciálne patogénnych mikroorganizmov a produkcie antimikróbne pôsobiacich látok6, 20, 23). V predkladanej práci sme sa preto zamerali na schopnosť týchto laktobacilov, ako potenciálnych probiotických kandidátov, prežívať v prítomnosti rôznych koncentrácií sanguinarínu. Pre porovnanie baktericídneho účinku sanguinarínu voči testovaným laktobacilom sme použili zbierkové kmene L. reuteri CCM 3625 a S. aureus ATCC 6538. Minimálne inhibičné koncentrácie sanguinarínu voči testovaným baktériám sú uvedené v tabuľke 1. Z nami testovaných baktérií bol voči sanguinarínu najmenej citlivý kmeň L. reuteri KO5 s MIC 0,600 mg.ml-1. Nasledovali kmene L. murinus C a L. mucosae D a L. plantarum KG4, u všetkých troch bola MIC 0,300 mg.ml-1. Tieto štyri kmene laktobacilov sa preto javia v porovnaní s kmeňmi L. reuteri E, L. reuteri KO4m, L. reuteri KO4b a L. plantarum KG1 pre použitie v kombinácii so sanguinarínom ako perspektívnejšie. Nami stanovená MIC sanguinarínu pre S. aureus bola 0,15 mg.ml-1. Zaujímavé je, že Navarro a Delgado19) zaznamenali u tohto kmeňa pomerne vysokú citlivosť na dihydrosanguinarín (MIC 0,0093 mg.ml-1), ktorý je redukovaným derivátom sanguinarínu.
Aby si zabezpečili selekčnú výhodu vo svojom environmentálnom prostredí, produkujú mnohé kmene laktobacilov rôzne látky s antimikróbnym účinkom. Tieto látky pôsobia bakteriostaticky alebo baktericídne nielen na rôzne patogénne a potenciálne patogénne mikroorganizmy (napr. Listeria monocytogenes, Staphylococcus aureus, Clostridium botulinum, C. perfringens, Escherichia coli, Streptococcus spp., Candida albicans), ale často sú účinné aj voči iným druhom laktobacilov a dokonca aj voči iným kmeňom rovnakého druhu, ako je sám producent5, 10). Preto sme sa v ďalšej časti práce zamerali na sledovanie schopnosti testovaných laktobacilov ovplyvňovať vzájomne svoj rast a prežívanie. Vzájomná koexistencia dvoch, resp. viacerých probiotických kmeňov v kombinovanom prípravku, môže totiž ovplyvniť účinnosť tohto prípravku. Na testovanie inhibičného potenciálu laktobacilov sme použili prúžkovú metódu na agarových platniach, ktorou sme už v minulosti testovali inhibičný potenciál laktobacilov voči vybraným oportúnnym patogénom20). Tento experiment umožňuje sledovať schopnosť extracelulárnych produktov laktobacilov potláčať rast iných mikroorganizmov.
Z výsledkov vyplýva, že čím bola dlhšia doba pre-inkubácie producentských kmeňov, tým bol silnejší aj ich inhibičný potenciál voči ostatným laktobacilom (tab. 2 a 3). V prípade, že sme producentské a indikačné kmene laktobacilov očkovali na platne bezprostredne po sebe, nepozorovali sme žiadne zóny inhibície rastu ani u jedného z indikačných kmeňov (údaje neuvádzame). Najvyšší inhibičný potenciál z producentských kmeňov sme pozorovali u L. plantarum KG4 po 24 aj 48 h pre-inkubácii. Najnižšiu inhibičnú aktivitu preukázali kmene L. murinus C (po 24 h pre-inkubácii) a L. plantarum KG1 (po 48 h pre-inkubácii). Kmeň L. murinus C po takto dlhej pre-inkubácii neinhiboval rast väčšiny ostatných laktobacilov. 24 h pre-inkubácia pravdepodobne nie je dostatočne dlhá na to, aby táto baktéria vyprodukovala dostatok účinných látok. Slabo inhiboval iba kmene L. mucosae D a L. reuteri E, spolu s ktorými bol izolovaný zo žalúdočnej sliznice jahňaťa. Zaujímavé výsledky sme pozorovali pri L. reuteri E a L. plantarum KG1, ktoré mali proti niektorým kmeňom nižšiu inhibičnú aktivitu po 48 h preinkubácii ako po 24 h. Ako najcitlivejší voči látkam, produkovaným ostatnými laktobacilmi sa ukázal byť L. murinus C. Najmenej citlivé boli L. reuteri KO5 (po 24 h pre-inkubácii producentov) a L. plantarum KG4 (po 48 h pre-inkubácii producentov).
Table 1. Minimálna inhibičná koncentrácia (MIC) sanguinarínu voči testovaným baktériám 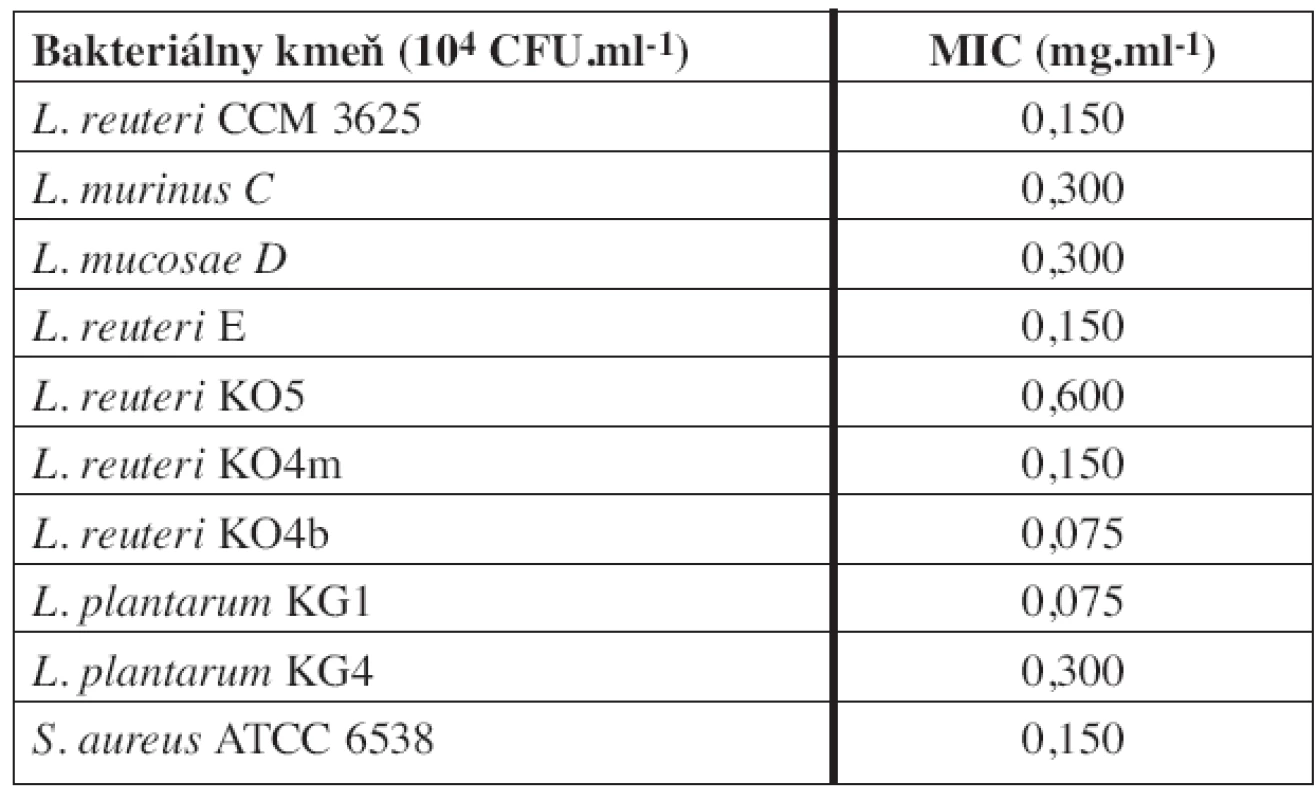
Table 2. Zóny inhibície rastu indikačných kmeňov laktobacilov po 24 h pre-inkubácii producentských kmeňov 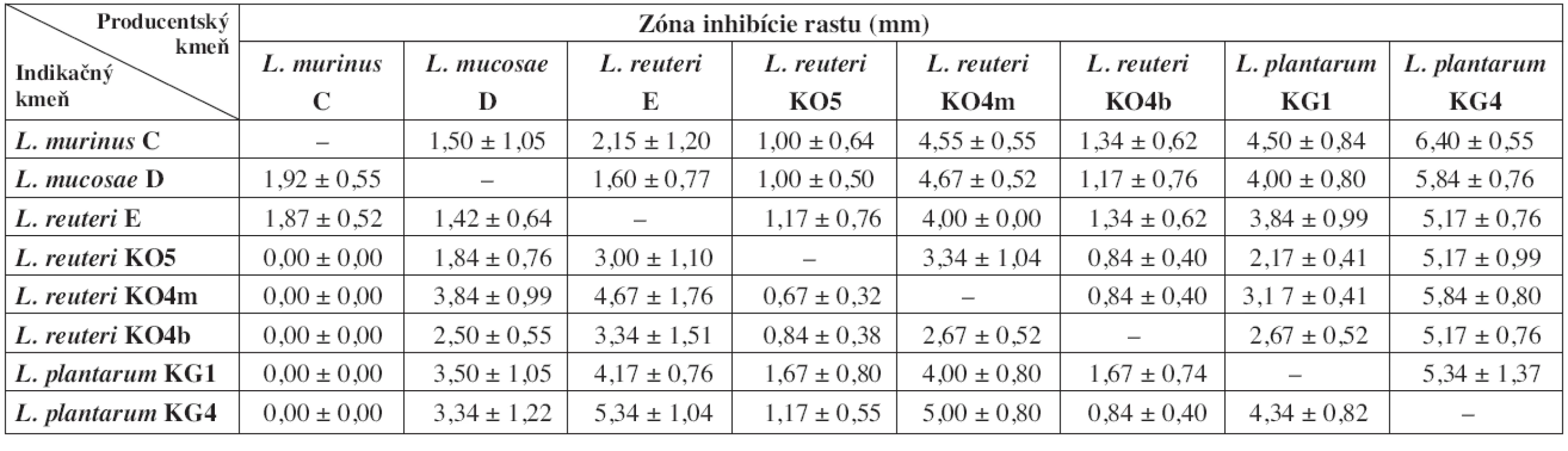
Hodnoty sú aritmetickým priemerom zo šiestich paralelných experimentov ± SD. Table 3. Zóny inhibície rastu indikačných kmeňov laktobacilov po 48 h pre-inkubácii producentských kmeňov 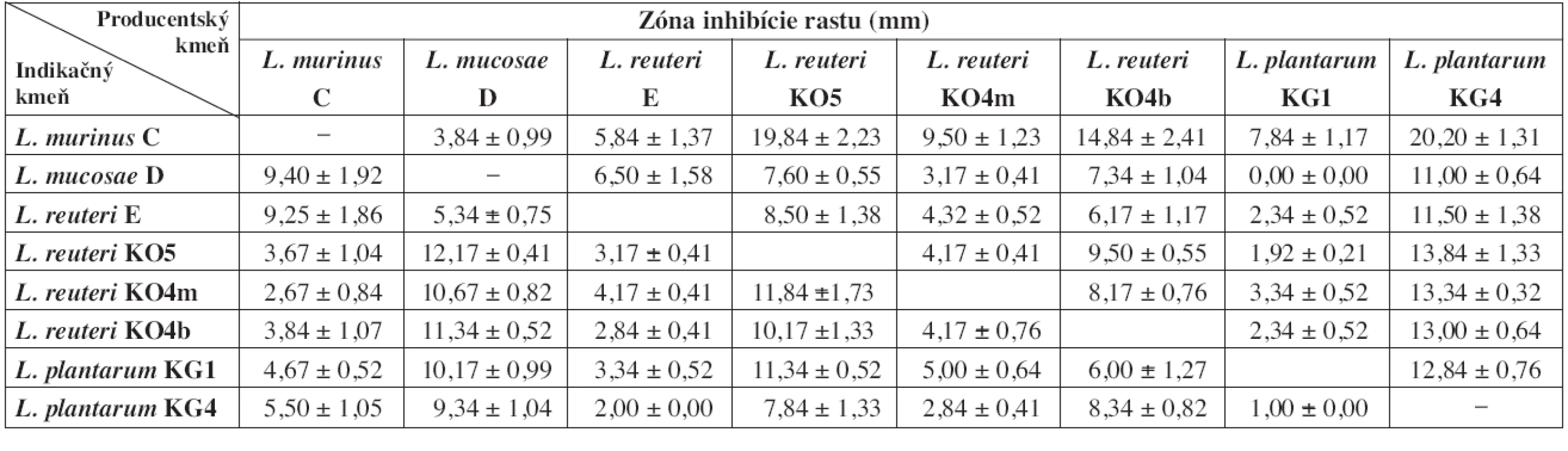
Hodnoty sú aritmetickým priemerom zo šiestich paralelných experimentov ± SD. Antimikróbne látky, produkované laktobacilmi do pevného média mali voči všetkým indikačným kmeňom bakteriostatický a nie baktericídny účinok.
Z hľadiska vzájomného pôsobenia nie sú medzi testovanými laktobacilmi výrazné rozdiely. Po 24 h pre-inkubácii všetky produkčné kmene vykazovali slabú inhibíciu rastu indikačných kmeňov (tab. 2). Po 48 h pre-inkubácii sme stredne silnú inhibíciu voči jednému z indikačných laktobacilov zaznamenali u produkčných kmeňov L. mucosae D, L. reuteri KO5 a L. reuteri KO4b. Jedine L. plantarum KG4 stredne silno inhiboval rast piatich zo siedmich indikačných kmeňov (tab. 3). Silný typ inhibície sme nezaznamenali ani v jednom prípade. Na základe získaných výsledkov za najvhodnejšie pre požitie v kombinovaných prípravkoch považujeme kmene L. reuteri E, L. plantarum KG1 a L. reuteri KO4m. Tieto kmene vykazovali najnižší inhibičný potenciál po 48 h pre-inkubácii a súčasne boli relatívne odolné voči antimikróbnemu účinku ostatných testovaných laktobacilov. Za kmene menej vhodné pre použitie v kombinovaných prípravkoch považujeme L. murinus C a L. plantarum KG4. Prvý pre najnižšiu schopnosť rásť v prítomnosti ostatných testovaných laktobacilov a druhý pre najvyššiu schopnosť inhibovať rast indikačných kmeňov.
Stret záujmov: žiadny.
Došlo 23. listopadu 2012 / Přijato 14. ledna 2013
Mgr. Andrea Bilková, PhD. (✉) • F. Bilka • H. Kiňová Sepová • A. Balažová
Univerzita Komenského v Bratislave, Farmaceutická fakulta, Katedra bunkovej a molekulárnej biológie liečiv
Kalinčiakova 8, 832 32 Bratislava, Slovenská republika
e-mail: bilkova@fpharm.uniba.sk
Sources
1. Coudeyras S., Jugie G., Vermerie M., Forestier Ch. Adhesion of human probiotic Lactobacillus rhamnosus to cervical and vaginal cells and interaction with vaginosis-associated pathogens. Infect. Dis. Obstet. Gynecol. 2008; http://www.hindawi.com/journals/idog/ 2008/549640/ (13.11.2012)
2. Myllyluoma E., Ahonen A. M., Korpela R., Vapaatalo H., Kankuri E. Effects of multispecies probiotic combination on Helicobacter pylori infection in vitro. Clin. Vaccine Immunol. 2008; 15, 1472–1482.
3. Lin P. P., Hsieh Y. M., Tsai Ch. Ch. Antagonistic activity of Lactobacillus acidophilus RY2 isolated from healthy infancy feces on the growth and adhesion characteristics of enteroaggregative Escherichia coli. Anaerobe 2009; 15, 122–126.
4. Sepp E., Stšepetova J., Smidt I., Rätsep M., Kõljalg S., Lõivukene K., Mändar R., Jaanimäe L., Löhr H.I., NatČs O.B., Naaber P. Intestinal lactoflora in Estonian and Norwegian patients with antibiotic associated diarrhea. Anaerobe 2011; 17, 407–409.
5. Bilková A., Kiňová Sepová H., Bilka F., Balažová A. Bakteriocíny produkované baktériami mliečneho kvasenia. Čes. a slov. Farm. 2011; 60, 65–72.
6. Kiňová Sepová H., Dubničková M., Bilková A., Bukovský M., Bezáková L. Identification and biological activity of potential probiotic bacterium isolated from the stomach mucus of breast-fed lamb. Braz. J. Microbiol. 2011; 42, 1188–1196.
7. Nikawa H., Makihira S., Fukushima H., Nishimura H., Ozaki Y., Ishida K., Darmawan S., Hamada T., Hara K., Matsumoto A., Takemoto T., Aimi R. Lactobacillus reuteri in bovine milk fermented decreases the oral carriage of mutans streptococci. Int. J. Food Microbiol. 2004; 95, 219–223.
8. Caglar E., Kavaloglu S. C., Kuscu O. O., Sandalli N., Holgerson P. L., Twetman S. Effect of chewing gums containing xylitol or probiotic bacteria on salivary mutans streptococci and lactobacilli. Clin. Oral Investig. 2007; 11, 425–429.
9. Ouwehand A. C., Vesterlund S. Antimicrobial components from lactic acid bacteria. In: Salminen S., von Wright A., Ouwehand A. C. eds. Lactic Acid Bacteria: Microbiological and functional aspects, 3rd ed. New York: Marcel Dekker, Inc. 2004.
10. Kiňová Sepová H., Bilková A., Bilka F., Bezáková L. Antimikróbne pôsobiace látky produkované baktériami mliečneho kvasenia. Čes. a slov. Farm. 2010; 59, 155–159.
11. Bilková A., Bilka F., Bezáková L. Enzymológia tvorby benzylizochinolínových alkaloidov. Čes. slov. Farm. 2005; 54, 17–22.
12. Dostál J., Slavík J. Novější poznatky o sanguinarinu a příbuzných alkaloidech. Chem. Listy 2000; 94, 15–20.
13. Zdařilová A., Malíková J., Dvořák Z., Ulrichová J., Šimánek V. Kvartérní isochinolinové alkaloidy sanguinarin a chelerythrin. Účinky in vitro a in vivo. Chem. Listy 2006; 100, 30–41.
14. Simeon S., Rios J. L., Villar A. Pharmacological activities of benzophenanthridine and phenanthrene alkaloids. Pharmazie 1989; 44, 593–597.
15. Walterová D., Ulrichová J., Valka I., Vičar J., Vavrečková C., Táborská E., Harkrader R. J., Meyer D. L., Černá H., Šimánek V. Benzo[c]phenanthridine alkaloids sanguinarine and chelerythrine: Biological activities and dental care applications. Acta Univ. Palacky Olomouc Fac. Med. 1995; 139, 7–16.
16. Newton S. M., Lau C., Gurcha S. S., Besra G. S., Wright C. W. The evaluation of fourty-three plant species for in vitro antimicrobial activities. J. Ethnopharmacol. 2002; 79, 57–67.
17. Mahady G. B., Pendland S. L., Stoia A., Chadwick L. R. In vitro susceptibility of Helicobacter pylori to isoquinoline alkaloids from Sanguinaria canadensis and Hydrastis canadensis. Phytother. Res. 2003; 17, 217–221.
18. Merschjohann K., Sporer F., Steverding D., Wink M. In vitro effect of alkaloids on bloodstream forms of Trypanosoma brucei and T. congolense. Planta Med.2001; 67, 623–627.
19. Navarro V., Delgado G. Two antimicrobial alkaloids from Bocconia arborea. J. Ethnopharmacol. 1999; 66, 223–226.
20. Bilková A., Kiňová Sepová H., Bukovský M., Bezáková L. Antibacterial potential of lactobacilli isolated from a lamb. Vet. Med. 2011; 56, 319–324.
21. Balažová A., Blanáriková V., Bilka F., Bilková A., Kiňová Sepová, H. Efekt troch rôznych elicitorov na produkciu sanguinarínu suspenznými kultúrami nízko-morfínovej odrody maku siateho (Papaver somniferum L.). Čes. slov. Farm. 2011; 60, 237–240.
22. Bilková A., Kiňová Sepová H., Bilka F., Bukovský M., Balažová A., Bezáková, L. Identification of newly isolated lactobacilli from the stomach mucus of lamb. Acta Facult. Pharm. Univ. Comenianae 2008; 55, 64–72.
23. Kiňová Sepová H., Bilková A. Isolation and identification of new lactobacilli from goatling stomach and investigation of reuterin production in Lactobacillus reuteri strains. Folia Microbiol 2003; 58, 33–38.
24. Mlynarčík D., Bukovský M., Čupková V., Sirotková L. Praktické cvičenia z mikrobiológia a imunologických prípravkov. Skriptá, FaF UK Bratislava, 1995, 160.
25. Annuk H., Shchepetova J., Kullisaar, T., Songisepp E., Zilmer M., Mikelsaar M. Characterization of intestinal lactobacilli as putative probiotic candidates. J. Appl. Microbiol. 2003; 94, 403–412.
26. Hütt P., Shchepetova J., Lõivukene K., Kullisaar T., Mikelsaar M. Antagonistic activity of probiotic lactobacilli and bifidobacteria against entero - and uropathogens. J. Appl. Microbiol. 2006; 100, 1324–1332.
27. Vieira S. L., Oyarzabal O. A., Freitas D. M., Berres J., Pena J. E. M., Torres C. A. Performance of broilers fed diets supplemented with sanguinarine-like alkaloids and organic acid. J. Appl. Poult. Res. 2008; 17, 128–133.
28. Rawling M. D., Merrifield D. L., Davies S. J. Preliminary assessment of dietary supplementation of Sangrovit on red tilapia (Oreochromis niloticus) growth performance and health. Aquaculture 2009; 294, 118–122.
29. Jurkiewicz J., Gruzauskas R., Zdunczyk Z., Semaskaite A., Jankowski J., Totilas Z., Jarule V., Sasyte V., Zdunczyk P., Raceviciute-Stupeliene A., Svirmickas G. Effect of dietary addition of Macleaya cordata alkaloid extract on growth performance, caecal indices and breast meat fatty acids profile in male broilers. J. Anim. Physiol. Anim. Nutr. 2011; 95, 171–178.
30. Zdařilová A., Vrublová E., Vostalová J., Klejdus B., Stejskal D., Prosková J., Kosina P., Svobodová, A., Večera R., Hrbáč J., Černochová D., Vičar J., Ulrichová J., Šimánek V. Natural feed additive of Macleaya cordata: safety assessment in rats a 90-day feeding experiment. Food Chem Toxicol. 2008; 46, 3721–3726.
31. Nousiainen J., Javanainen P., Setala J., von Wright A. Lactic acid bacteria as animal probiotics. In: Salminen S., Ouwehand A., von Wright A. eds. Lactic acid bacteria: microbial and functional aspects 3rd ed. New York: Marcel Dekker 2004.
32. Caglar E., Sandalli N., Twetman S., Kavaloglu S., Ergeneli S., Selvi S. Effect of yogurt with Bifidobacterium DN-173 010 on salivary mutans streptococci and lactobacilli in young adults. Acta Odontol. Scand. 2005; 63, 317–320.
33. Caglar E., Cildir S. K., Ergeneli S., Sandalli N., Twetman S. Salivary mutans streptococci and lactobacilli levels after ingestion of the probiotic bacterium Lactobacillus reuteri ATCC 55730 by straws or tablets. Acta Odontol. Scand. 2006; 64, 314–318.
34. Tong H., Chen W., Merritt J., Qi F., Shi W., Dong X. Streptococcus oligofermentans inhibits Streptococcus mutans through conversion of lactic acid into inhibitory H2O2: a possible counteroffensive strategy for interspecies competition. Mol. Microbiol. 2007; 63, 872–880.
35. He X., Lux R., Kuramitsu H. K., Anderson M. H., Shi W. Achieving probiotic effects via modulating oral microbial ecology. Adv. Dent. Res. 2009; 21, 53–56.
36. Tanzer J., Livingston J., Thompson A. The microbiology of primary dental caries in human. J. Dent. Educ. 2001; 65, 1028–1037.
37. Švec P., Sedláček I., Žáčková L., Nováková D., Kukletová M. Lactobacillus spp. associated with early childhood caries. Folia Microbiol. 2009; 54, 53–58.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2013 Issue 1-
All articles in this issue
- Testovanie potenciálne probiotických laktobacilov pre použitie vo výživových doplnkoch
- Organizácia a riadenie znárodneného farmaceutického priemyslu so zameraním na Slovensko od roku 1945 do roku 1948
- Orální mukóza a léčba rekurentní aftózní stomatitidy
- Návrh a vývoj systému pro transmukózní přívod diltiazem hydrochloridu
- Enkapsulace a uvolňování diklofenaku sodné soli z halloysitových nanotubulů
- Pediatrické perorální roztoky s propranolol-hydrochloridem pro magistraliter přípravu: formulace a hodnocení stability
- Mukoadhezivní filmy jako perspektivní lékové formy pro orální podání
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pediatrické perorální roztoky s propranolol-hydrochloridem pro magistraliter přípravu: formulace a hodnocení stability
- Orální mukóza a léčba rekurentní aftózní stomatitidy
- Organizácia a riadenie znárodneného farmaceutického priemyslu so zameraním na Slovensko od roku 1945 do roku 1948
- Mukoadhezivní filmy jako perspektivní lékové formy pro orální podání
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

