-
Medical journals
- Career
Analytické a preanalytické aspekty stanovení lehkých řetězců neurofilament v biologických tekutinách
Authors: L. Fialová 1; L. Nosková 1; M. Kalousová 1; T. Zima 1; T. Uher 2; A. Bartoš 3
Authors‘ workplace: Ústav lékařské biochemie a laboratorní, diagnostiky, 1. LF UK a VFN v Praze 1; Centrum pro demyelinizační onemocnění, Neurologická klinika, 1. LF UK a VFN v Praze 2; Neurologická klinika 3. LF UK, Praha 3
Published in: Cesk Slov Neurol N 2022; 85(1): 11-16
Category: Review Article
doi: https://doi.org/10.48095/cccsnn202211Overview
Tento přehled si klade za cíl seznámit klinické a laboratorní pracovníky s nejdůležitějšími preanalytickými a analytickými aspekty stanovení lehkých řetězců neurofilament (NfL) v biologických tekutinách. NfL představují perspektivní nespecifický biomarker poškození neuronů a axonů, k němuž dochází u celé řady neurologických onemocnění. Před zavedením vyšetřování NfL do širší klinické praxe je nutné charakterizovat preanalytické a analytické stránky stanovení, které mohou významným způsobem ovlivnit správnost výsledku analýzy. Při hodnocení koncentrací NfL je zapotřebí brát v úvahu věk pacienta a vliv může mít i body mass index. Výhodou NfL je jejich dlouhodobá stabilita při různých teplotách skladování i odolnost vůči opakovaným cyklům zmrazování a rozmrazování. Koncentrace NfL v klinických studiích se stanovují především imunoanalytickými metodami, které se liší citlivostí. Pro stanovení NfL existuje několik imunoanalytických přístupů vhodných pro spolehlivé vyšetření v mozkomíšním moku (MMM) i v séru/plazmě. Volba optimálního analytického přístupu závisí mimo jiné na koncentracích NfL v biologických tekutinách. Pro stanovení NfL v MMM lze využít metod ELISA, které vykazují dostačující citlivost pro vyšší koncentrace NfL vyskytující se v této biologické tekutině. Postupně zaváděné nové technologie charakterizované výrazně vyšší citlivostí ve srovnání s metodou ELISA umožnily spolehlivé vyšetřování NfL i v séru či plazmě. Podrobněji jsou zmiňovány principy metod postavené na technologii Simoa®, SimplePlexTM a imunomagnetické redukce.
Klíčová slova:
mozkomíšní mok – biomarker – krev – neurofilamenta – preanalytická fáze
Úvod
Neurologům se dostává do rukou slibný biomarker, kterým jsou lehké řetězce neurofilament (NfL). Někteří jejich význam přirovnávají k troponinům v kardiologii [1].
Neurofilamenta v CNS jsou heteropolymery sestavené ze čtyř polypeptidových řetězců, k nimž patří triplet neurofilamentových řetězců (NfL, střední řetězce neurofilament a těžké řetězce neurofilament) a a-internexin. V periferním nervovém systému (PNS) je součástí neurofilament společně s tripletem neurofilamentových řetězců další protein – peripherin. Struktura neurofilamentových řetězců je podobná, ale jednotlivé polypeptidy se liší relativní molekulovou hmotností (Mr) a mírou fosforylace – lehké řetězce mají Mr 70 000, střední řetězce (NfM) 150 000 a těžké řetězce (NfH) 200 000 [2]. Schéma molekuly NfL je znázorněno na obr. 1. NfL tvoří nejhojnější podjednotku v tripletu neurofilamentových řetězců, zastoupení NfL: NfM: NfH v neurofilamentech je přibližně v tomto poměru 5 : 3: 1 [3].
Image 1. Schéma struktury lehkého řetězce neurofilamenta.
Fig. 1. Scheme of the neurofilament light chain structure.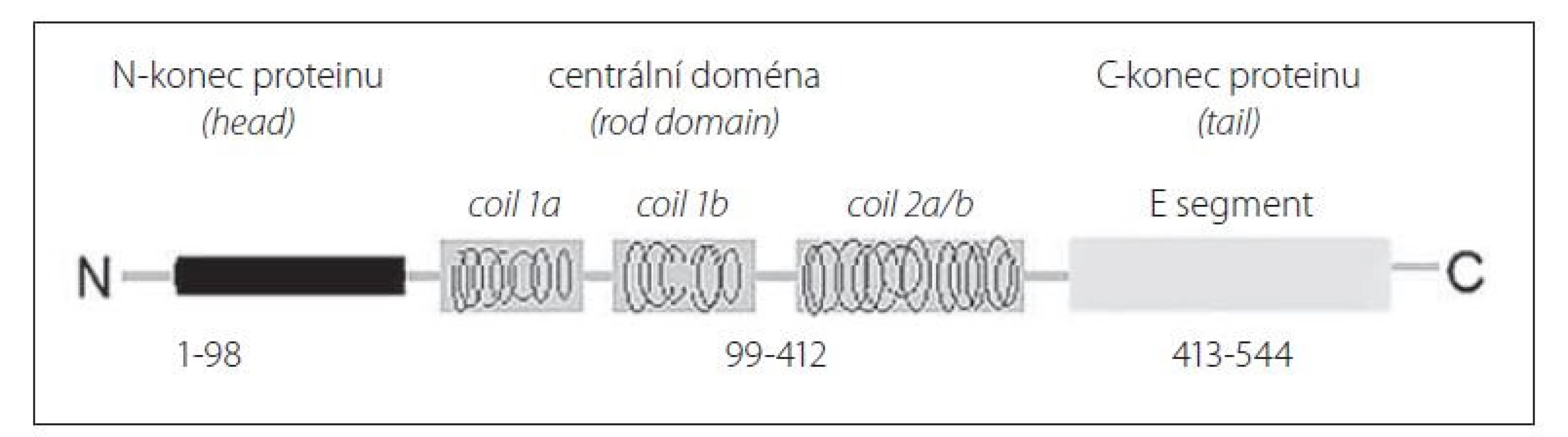
NfL představují nespecifický biomarker odrážející poškození axonů a neuronů, k němuž dochází z různých příčin, ať už se jedná např. o zánět, neurodegeneraci nebo trauma [4–8]. NfL se uvolňují do intersticiální tekutiny a z ní mohou pronikat do mozkomíšního moku (MMM) a také do krve. Při některých patologických stavech v oblasti nervové soustavy se množství NfL přestupujících do různých kompartmentů výrazně zvyšuje [9–11].
Detailnější výzkum NfL jako biomarkeru u neurologických onemocnění umožnili již v roce 1996 Rosengren et al [12], když jako první popsali metodu ELISA (enzyme-linked immunosorbent assay) jako vhodnou ke stanovení NfL. Citlivost metody ELISA však dovoluje správně stanovovat koncentrace NfL pouze v MMM, jehož odběr představuje invazivní výkon. Proto se další vlna zájmu o NfL dostavila až poté, co se začaly úspěšně vyvíjet vysoce citlivé metody na jejich stanovení v krvi [13]. Od té doby se datuje prudký nárůst nových poznatků o NfL využitelných v péči o pacienty se závažným neurologickým onemocněním. Značná pozornost je věnována přínosu stanovení NfL u nemocných s RS [1,5,14–17]. Vysoká hladina NfL predikuje aktivitu nemoci u RS [18–20], naopak nízká hladina je spojená s absencí radiologické aktivity nemoci a mohla by v budoucnosti u některých pacientů doplnit, nebo dokonce nahradit kontrolní zobrazení CNS MR [17]. Povzbudivé výsledky přinášejí i studie zaměřené na využití NfL u dalších neurologických onemocnění spojených se ztrátou nebo poškozením neuronů [6,9,21,22]. Existují studie ukazující přínos NfL při diferenciální diagnostice různých typů demencí, extrapyramidových neurodegenerativních onemocnění nebo také amyotrofické laterální sklerózy [9,10]. Měření hladin NfL může pomoci při predikci vývoje stavu po ischemické CMP, po úrazech mozku nebo po kardiopulmonální resuscitaci [20,22,23].
Před zavedením vyšetřování NfL do širší klinické praxe je nutné charakterizovat preanalytické a analytické stránky jejich stanovení, které mohou významným způsobem ovlivnit správnost výsledku analýzy, a je zapotřebí k nim přihlížet při interpretaci výsledků vyšetření. Tento text si klade za cíl seznámit klinické a laboratorní pracovníky s nejdůležitějšími preanalytickými a analytickými aspekty stanovení NfL v biologických tekutinách.
Koncentrace NfL v jednotlivých biologických tekutinách
Běžnými biologickými tekutinami, v nichž se NfL vyšetřují, jsou MMM, sérum a plazma (tab. 1). Nejvyšších koncentrací dosahují NfL v MMM (cNfL). V porovnání s plazmou či sérem jsou koncentrace cNfL mnohonásobně vyšší. Např. Disanto et al [5] uvedli, že medián koncentrací NfL byl 42x nižší v séru než v MMM.
Table 1. Koncentrace NfL v různých biologických tekutinách u zdravých osob analyzované pomocí souprav Simoa NF-light™ Advantage Kit Quanterix*. 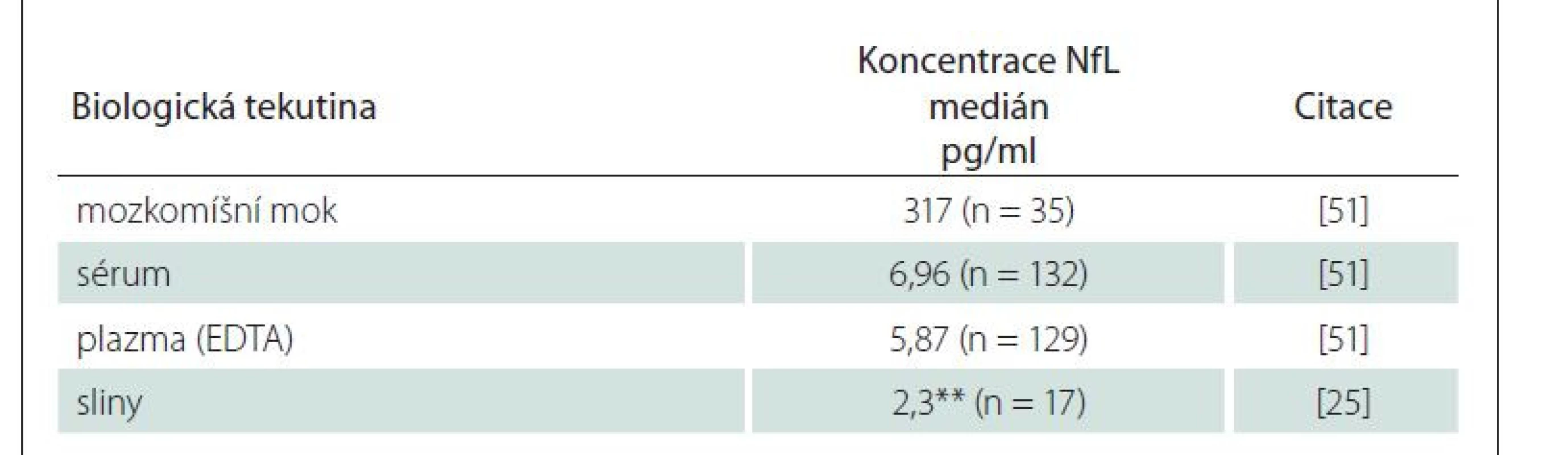
*nejedná se o referenční rozmezí; **hodnota odpovídá průměru
EDTA – kyselina ethylendiamintetraoctová; n – počet; Nfl – neurofilamentaJak vyplynulo z metaanalýzy, mezi koncentracemi cNfL a koncentracemi NfL v séru (sNfL) nebo v plazmě (pNfL) existuje středně silná korelace, která je více vyjádřena u pacientů s onemocněním CNS nebo PNS než u kontrolních skupin. Těsnější vztah byl pozorován ve studiích, které použily pro stanovení NfL citlivějších imunoanalytických metod [24].
NfL byly testovány i ve slinách, které představují velice snadno dostupný biologický materiál [25]. Zatím se ale zdá, že stanovení NfL ve slinách bude mít omezený klinický význam, alespoň pro neurodegenerativní onemocnění.
Biologické faktory ovlivňující koncentrace NfL
Věk
Důležitý faktor, který ovlivňuje koncentrace cNfL i koncentrace NfL v krvi, představuje věk. Pozitivní korelaci mezi věkem a koncentrací cNfL u kontrolních skupin i u řady neurologických onemocnění publikovali v rozsáhlé metaanalýze, na které se podíleli i někteří autoři tohoto článku, Bridel et al [4]. U zdravých osob metaanalýza uvádí nárůst koncentrací cNfL na každý rok věku o 3,3 %.
Vztah mezi věkem a koncentrací NfL vyjádřený u zdravých jedinců i u pacientů je dobře dokumentován i v krvi [5,26]. Pro zdravé kontroly se udává vzestup koncentrací sNfL o 2,2 % na každý rok věku [5]. Podle některých studií není zvyšování koncentrací sNfL s věkem lineární a zrychluje se po dosažení věku 60 let, kdy navýšení může být až dvojnásobné, tj. o 4,3 % [27]. U různých neurologických onemocnění byla také prokazována významná korelace mezi NfL v krvi a věkem [5,19,28].
Pozitivní vztah mezi koncentracemi NfL a věkem je připisován věkem podmíněným změnám v CNS spojeným se ztrátou neuronů, ale přispívat může i výraznější pokles renálních funkcí, zejména u starších osob [29,30]. Proto je nezbytné souvislost mezi věkem a koncentracemi NfL zohledňovat při interpretaci jejich vyšetření.
Pohlaví a rasa
Koncentrace cNfL ve vztahu k pohlaví hodnotili v nedávné metaanalýze Bridel at al [4]. Byly vyšší o 26 % u zdravých mužů a zvýšení u mužů bylo pozorováno i u některých neurologických onemocnění. V EDTA (kyselina ethylendiamintetraoctová) plazmě a séru ale není závislost koncentrací NfL na pohlaví v řadě prací prokazována [5,26,28,29]. Pohlaví se proto při normalizaci koncentrací NfL nebere v úvahu.
Ukazuje se, že etnika mohou mít odlišné koncentrace. V MMM byly koncentrace NfL nižší u kognitivně zdravých Afroameričanů než u osob kavkazské rasy [31]. Naopak v séru byly koncentrace NfL nižší u kavkazské rasy než u jiných ras [30].
Body mass index a objem krve
Dalším faktorem, který ovlivňuje koncentrace NfL v krvi, je index tělesné hmotnosti (body mass index; BMI) a objem krve. Manouchehrinia et al [32] tento vztah analyzovali na velkém souboru kontrol (n = 662) a prokázali významnou negativní korelaci mezi koncentrací pNfL a BMI s poklesem o 0,02 pg/ml na vzestup BMI o jednotku. Vztah mezi koncentracemi p/sNfL a BMI popsaný Manouchehriniou et al u zdravých platil také pro pacienty s RS a mentální anorexií [32–34]. Snížení koncentrace pNfL o 0,15 pg/ml bylo zaznamenáno při zvýšení objemu krve o 1 l u zdravých kontrol. Jiná je pak situace v průběhu fyziologického těhotenství, které je doprovázeno vzestupem koncentrací NfL v krvi [20].
Biologická variabilita
Důležitou vlastností analytu je jeho stabilita u jedince v čase. Intraindividuální kolísání koncentrací sNfL v průběhu dne a mezi dny je minimální (3,1 %), ale interindividuální variabilita je výrazná (35,6 %) [35].
Další biologické vlivy
Kromě výše uvedených vlivů byly popsány i další faktory s dopadem na koncentrace NfL v krvi, jako jsou kouření, systolický krevní tlak, fibrilace síní, onemocnění PNS, užívání neurotoxických léků, které většinou přispívají ke zvýšení koncentrací. Přihlížet je zapotřebí i ke stavu hematoencefalické bariéry [20,24].
Vliv teploty a doby skladování na stabilitu NfL v biologických tekutinách
NfL je stabilním analytem při skladování vzorku při nízkých i vyšších teplotách. Stabilita NfL byla prokázána jak v MMM, tak v séru/plazmě.
Mozkomíšní mok
Koncentrace cNfL ve vzorcích zpracovaných po jedné nebo 24 h po odběru se významně nelišily bez ohledu na teplotu skladování (pokojová teplota, 4 °C). Stabilita koncentrací cNfL je zachována i po dobu 21 dnů při různých teplotách v rozmezí od −20 °C do 37 °C při srovnání s teplotou −80 °C [36].
NfL v MMM jsou odolná vůči opakovanému zmrazování a rozmrazování (−80 °C a pokojová teplota). Byly testovány čtyři cykly bez významných změn v koncentraci cNfL [36].
Sérum, plazma
Koncentrace s/pNfL zůstávají stabilní 7–8 dnů, když jsou uchovávány při pokojové teplotě nebo při 4 °C [37,38]. Stabilita NfL je za situace několikadenního uchování při pokojové teplotě mírně vyšší v séru než v EDTA plazmě [38]. Stabilitu si NfL udržují i při opakovaném zmrazování a rozmrazování. Koncentraci sNfL a EDTA plazmy významně neovlivnil ani 3–5× opakovaný cyklus rozmrazení a zmrazení [37,39].
Další preanalytické vlivy na koncentraci NfL
Mozkomíšní mok
Nízká, tj. 0,05% (odpovídá 2 500 erytrocytů/μl) kontaminace vzorku MMM krví neměla při 1–2hodinovém skladování při pokojové teplotě dopad na změnu koncentrace cNfL, ale větší, 5% kontaminace (odpovídá 250 000 erytrocytů/μl) se již odrazila ve zvýšení koncentrace cNfL až o 66 %. Nižší teplota při 4 °C snižovala míru nárůstu koncentrací cNfL. Podobné ovlivnění koncentrací cNfL se projevilo i při skladování vzorků po delší dobu (4–24 h) [36].
Sérum, plazma
Koncentraci v plazmě může ovlivnit použitý typ odběrové zkumavky s rozdílnými antikoagulačními přísadami. Plazmy s různými antikoagulačními prostředky pro stanovení NfL by neměly být zaměňovány, i když hodnoty koncentrací spolu významně korelují [39]. Podle studie Ashtona et al [39] nejnižší koncentrace pNfL stanovené pomocí Simoa® (single molecule array) (Quanterix, Billerica, MA, USA), na HD-X analyzátoru poskytuje citrátová plazma, následuje plazma s EDTA a nejvyšší koncentrace jsou získávány z plazmy ze zkumavek s heparinem lithným. Koncentrace NfL v citrátové plazmě byly o 20 % nižší než v plazmě EDTA. Podle různých studií jsou koncentrace NfL v séru vyšší asi o 11 % než v EDTA plazmě, ale je mezi nimi vyjádřena signifikantní korelace nebo se neliší [26,39,40]. Při srovnání mezi sérem a plazmou s heparinem lithným nebyl pozorován rozdíl [39].
Pro stanovení s/pNfL je zapotřebí přihlédnout k hemolýze vzorku vzhledem ke skutečnosti, že erytrocyty obsahují některé cytoskeletální struktury, vč. NfL [41]. Pomocí vysoce citlivé metody Simoa® byly v lyzátech z erytrocytů prokázány nízké koncentrace NfL, které korelovaly s koncentracemi NfL v plazmě [42].
Dalším preanalytickým faktorem, který může mít dopad na přesnost stanovení koncentrace NfL v plazmě, je doba, jež uplyne mezi odběrem a centrifugací. I v tomto případě se projevuje dobrá stabilita NfL. Koncentrace NfL v EDTA plazmě, která byla získána standardním způsobem (centrifugací krve během dvou hodin po odběru) signifikantně korelovala s koncentracemi NfL v plazmě získané oddálenou centrifugací krve za různých podmínek (po 48 h stání krve při pokojové teplotě, při 37 °C), i když bylo pozorováno mírné zvýšení [43]. Dobré výsledky přineslo i testování koncentrací NfL v eluátech z krve odebrané ve formě skvrn na speciální kartičky, hodnoty koncentrací NfL získané z těchto tekutin však byly signifikantně nižší [43].
Metody pro stanovení NfL v biologických tekutinách
Koncentrace NfL v klinických studiích se stanovují především imunoanalytickými metodami, které se liší citlivostí. Proto volba optimálního analytického přístupu závisí mimo jiné na koncentracích NfL v biologických tekutinách.
Stanovení NfL v mozkomíšním moku
Pro stanovení cNfL lze využít metod ELISA, které vykazují dostačující citlivost pro vyšší koncentrace NfL vyskytující se v této biologické tekutině. Před dostupností imunoanalytických souprav pro měření NfL v krvi byly koncentrace NfL ve většině klinických studií analyzovány pomocí komerčně dostupné soupravy NF-light® (Neurofilament light) ELISA firmy UmanDiagnostics (Umeå, Švédsko). Tato sendvičová ELISA využívá dvou vysoce specifických monoklonálních protilátek. Jejich reaktivita je namířena proti odlišným epitopům lokalizovaným v centrální tyčovité oblasti (rod domain) molekuly NfL (obr. 1) [44,45].
Stanovení NfL v krvi (plazmě, séru)
Vyšetření v krvi zpočátku bránila nedostatečná citlivost metod ELISA pro stanovení nízkých koncentrací NfL, o čemž jsme se sami přesvědčili [14]. O něco vyšší citlivosti dosahují imunoanalytické metody založené na detekci elektrochemiluminiscenčního signálu, který využívá pro elektrochemiluminiscenční metody (ECL) společnost MESO Scale DiscoveryTM (Rockville, MD, USA) [37]. Nově jsou dostupné i citlivější ELISA soupravy pro stanovení NfL v séru, s nimiž ale zatím nemáme zkušenosti. Postupně zaváděné nové technologie charakterizované výrazně vyšší citlivostí umožnily spolehlivé vyšetřování NfL i v séru či plazmě, ale při vhodném ředění jimi lze samozřejmě stanovovat i koncentrace v MMM [13].
Vysoce citlivé metody jsou postavené na technologii Simoa®, SimplePlexTM (ProteinSimple, San Jose, CA, USA) a IMR (immunomagnetic reduction) [46,47]. Principy uvedených imunoanalytických technik se liší.
Vysoce citlivé imunoanalytické metody pro stanovení NfL
Simoa®
Simoa®, o níž se hovoří také jako o digitální ELISE, využívá základních principů ELISY, jejichž modifikací je dosaženo schopnosti detekovat koncentrace proteinů v jednotkách fg–pg/ml [13,48–50].
V průběhu stanovení NfL metodou Simoa® se na paramagnetických částicích, které jsou označeny specifickými anti-NfL protilátkami, vytvoří sendvičový imunokomplex. Jeho součástí je protilátka na částici, dále NfL ze vzorku, popř. standardu a druhá anti-NfL protilátka, k níž se prostřednictvím vazby biotin-streptavidin připojí enzym β-galaktosidáza. Po vytvoření sendvičového komplexu se jednotlivé paramagnetické částice s roztokem fluorogenního substrátu rozdělí do pole obsahujícího několik set tisíc mikrojamek. Poté se v každé jamce detekuje fluorescence vzniklá rozkladem substrátu prostřednictvím β-galaktosidázy přítomné v imunokomplexu. Fluorescenční signál je dále vyhodnocován pomocí softwaru, který je součástí analyzátoru [13,49,50]. Soupravy Simoa® využívají stejné protilátky, jako jsou ty v soupravách ELISA UmanDiagnostics [51].
Metoda stanovení NfL na principu Simoa® je v současnosti považována za referenční metodu pro stanovení NfL v séru či plazmě [46]. Kromě vysoké citlivosti a nízké spotřeby vzorku patří k jejím výhodám i široký rozsah měřitelných koncentrací umožňující stanovení NfL v MMM a v séru či plazmě, a to dokonce i u osob bez onemocnění CNS i PNS [51]. Další výhodou technologie Simoa® je dostupnost komerčních souprav, které lze zpracovávat na několika typech analyzátorů firmy Quanterix (Billerica, MA, USA). Pro každý z analyzátorů jsou vyvinuty speciální soupravy a k dispozici jsou i takové, v nichž lze NfL analyzovat společně s dalšími proteiny ve formě multiplexu. Koncentrace pNfL stanovené samostatně vysoce korelovaly s výsledky NfL měřených jako součást multiplexu [52]. Souprava Simoa NF-light® Advantage Kit je určena pro stanovení NfL v séru, plazmě a MMM [51]. Jako kalibrátor využívá rekombinantní lidský NfL, který nahradil v minulosti používaný kalibrátor hovězího původu. Starší výsledky získané prostřednictvím hovězího kalibrátoru lze přepočítat pomocí poměru 5 : 1 (koncentrace NfL určená pomocí hovězího kalibrátoru = 5× koncentrace určená pomocí rekombinantního lidského kalibrátoru).
SimplePlex
Další citlivou imunoanalytickou metodou vhodnou pro stanovení nízkých koncentrací NfL v krvi je technika založená na nové automatizované platformě SimplePlexTM [46]. Imunochemická reakce probíhá v kanálcích, z nichž v každém jsou zabudovány tři skleněné komůrky (nanoreaktory) umožňující provedení analýzy každého vzorku v triplikátu. Na vnitřním povrchu komůrek je navázána specifická protilátka, která zachytí antigen obsažený ve vzorku. K detekci vzniklého imunokomplexu slouží další protilátka označená fluorescenčním barvivem. Analýza je plně automatizovaná pomocí analyzátoru ELLATM, jenž měří fluorescenční signál [53]. Platforma SimplePlexTM je schopna i multiplexových analýz pro stanovení několika biomarkerů současně. Zcela nedávno byla publikována studie srovnávající koncentrace sNfL stanovené technologiemi SimplePlexTM ELLATM a Simoa® [46]. Srovnání ukázalo silnou korelaci mimo jiné i díky tomu, že obě metody používají stejné anti-NfL protilátky. Na rozdíl od protilátek byl v obou soupravách odlišný standard, což se odrazilo v rozdílných absolutních koncentracích sNfL. Vzhledem k linearitě vztahu je možný přepočet koncentrací získaných oběma metodami pomocí korekčního faktoru.
Imunomagnetická redukce
Pro nízké koncentrace NfL byla vypracována i metoda na bázi imunomagnetické redukce (IMR), jejíž vývoj je spojen se společností MagQu Co. Ltd. (Taiwan) / MagQu LLC (USA) [47,54]. IMR je založena na měření poklesu magnetického signálu, ke kterému dochází po vytvoření imunokomplexu na povrchu magnetických nanokuliček. Tyto nanokuličky vyrobené z Fe3O4 mají na povrchu navázané specifické protilátky. V magnetickém poli střídavého proudu kuličky oscilují. Po navázání antigenu na kuličku prostřednictvím specifické protilátky se kuličky zvětšují a některé shlukují, což má za následek snížení rychlosti jejich oscilace. Tato změna rychlosti oscilace je úměrná množství vázaného analytu a lze ji přímo změřit. Signál IMR je analyzován velice citlivým magnetometrem. Na rozdíl od výše uváděných imunoanalytických metod je zapotřebí pouze jedné protilátky a provedení metody nevyžaduje promývací kroky.
Metoda IMR pro měření NfL nevyužívá anti-NfL protilátky UmanDiagnostics, nýbrž anti-NfL protilátky Santa Cruz Biotechnology, Inc. Standard má povahu rekombinantního lidského NfL. Předklinické testování metody pro vyšetřování NfL pomocí IMR ukázalo, že test se vyznačuje mimořádnou citlivostí a vysokou specifičností [47].
Základní údaje týkající se různých technologií pro stanovení NfL jsou shrnuty v tab. 2.
Table 2. Základní údaje týkající se souprav pro stanovení NfL v biologických tekutinách. 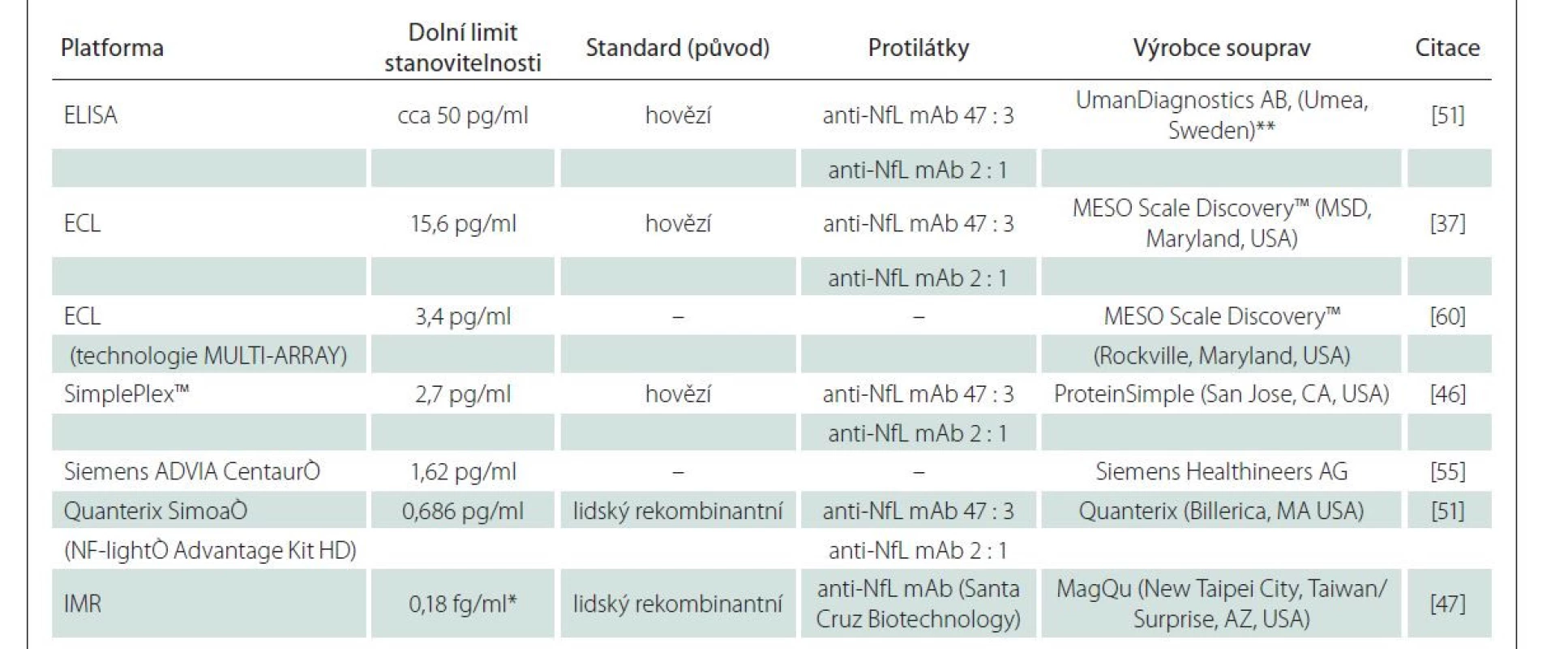
*limit detekce; **od konce roku 2021 je od stejného výrobce k dispozici i souprava ELISA pro stanovení NfL v séru s dolním limitem stanovitelnosti 0,8 pg/ml
ECL – electrochemiluminescence; ELISA – enzyme-linked immunosorbent assay; IMR – immunomagnetic reduction; mAb – monoklonální protilátky; Nfl – neurofilamentaPerspektivy v analytice
Další krok v analytice NfL představuje adaptace vysoce citlivé metody pro rutinní imunoanalytickou platformu Siemens – ADVIA Centaur® a Atellica® (Siemens, Mnichov, Německo) [55]. Nová imunoanalýza vykazuje vysokou korelaci s metodou Simoa® (NfL-light® Advantage Kit, Quanterix) [55].
Jedním z trendů v biochemické diagnostice jsou multiplexové analýzy. Pro neurologické biomarkery jsou ve formě až kvadruplexu vč. NfL k dispozici od společnosti Quanterix. Nový analytický přístup volí Olink Proteomics (Uppsala, Švédsko). Využívá technologie PEA (Proximity Extension Assay) spojující princip imunochemické reakce s polymerázovou řetězovou reakcí [56]. Uvedená technologie umožňuje vytváření multiplexů pro stanovení vysokého počtu analytů, mezi nimiž jsou zařazena i NfL, které jsou součástí panelu Olink® Target 96 Neuro Exploratory.
Závěr
NfL představují perspektivní nespecifický biomarker poškození neuronů a axonů, k němuž dochází u celé řady neurologických onemocnění. Pro stanovení NfL existuje několik imunoanalytických přístupů vhodných pro spolehlivé vyšetření v MMM i v séru/plazmě. Postupně jsou studovány preanalytické a analytické vlivy, které mají dopad na výsledek stanovené koncentrace NfL. Při hodnocení koncentrací je zapotřebí brát v úvahu věk pacienta a BMI. Výhodou NfL je jejich dlouhodobá stabilita při různých teplotách i odolnost vůči opakovaným cyklům zmrazování a rozmrazování. Je zřejmé, že se postupně rozšiřuje nabídka nových technologických přístupů, které se zdají být perspektivními pro vyšetřování i velmi nízkých koncentrací NfL. I v ČR existují pracoviště, která provádějí stanovení NfL v krvi, zatím na výzkumné bázi. V této souvislosti se naléhavým problémem stává standardizace stanovení NfL, zahrnující výběr referenční analytické metody a přípravu certifikovaného referenčního materiálu. Při zavedení vyšetřování NfL do klinické praxe bude také nutné zajistit systém externí kontroly kvality, jako je tomu u jiných analytů. Bude zajímavé sledovat, jaké místo zaujmou sérové koncentrace NfL v diagnostice neurologických onemocnění vedle zobrazovacích metod mozku, vyšetření MMM a kognitivních testů [57–59].
Grantová podpora
Práce byla podpořena výzkumnými záměry RVO VFN 64165, Cooperatio Laboratory Diagnostics and Neuroscience Charles University, BBMRI-CZ LM2018125, OP VVV CZ.02.1.01/0.0/0.0/18_046/0015959, grantem FV40032, CleverAge Biota v programu Trio, AZV grantem NV-18 - 08-00062 a projektem SVV 260 523.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem práce nemají žádný konflikt zájmů a projektem SVV 260 523.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Lenka Fialová, CSc.
Ústav lékařské biochemie
a laboratorní diagnostiky
1. LF UK a VFN v Praze
Kateřinská 32
121 08 Praha
e-mail: lfial@lf1.cuni.cz
Přijato k recenzi: 26. 10. 2021
Přijato do tisku: 20. 1. 2022
Sources
1. Thebault S, Booth RA, Freedman MS. Blood neurofilament light chain: the neurologist‘s troponin? Biomedicines 2020; 8 (11): 523. doi: 10.3390/biomedicines8110 523.
2. Yuan A, Rao MV, Veeranna et al. Neurofilaments and neurofilament proteins in health and disease. Cold Spring Harb Perspect Biol 2017; 9 (4): a018309. doi: 10.1101/cshperspect.a018309.
3. Lobsiger CS, Cleveland DW. Neurofilaments: organization and function in neurons. In: Squire LR (eds). Encyclopedia of neuroscience. Amsterdam: Elsevier 2009 : 433–436. doi: 10.1016/B978-008045046-9.00728-2.
4. Bridel C, van Wieringen WN, Zetterberg H et al. Diag - nostic value of cerebrospinal fluid neurofilament light protein in neurology: a systematic review and meta-analysis. JAMA Neurol 2019; 76 (9): 1035–1048. doi: 10.1001/jamaneurol.2019.1534.
5. Disanto G, Barro C, Benkert P et al. Serum neurofilament light: a biomarker of neuronal damage in multiple sclerosis. Ann Neurol 2017; 81 (6): 857–870. doi: 10.1002/ana.24954.
6. Fialová L. Neurofilamenta u traumatického poškození mozku – současné znalosti. Klin Biochem Metab 2018; 26 (2): 68–75.
7. Piťha J. Biomarkery roztroušené sklerózy – současné možnosti a perspektivy. Cesk Slov Neurol N 2015; 78/111 (3): 269–273.
8. Kusnierova P, Zeman D, Hradilek P et al. Neurofilament levels in patients with neurological diseases: a comparison of neurofilament light and heavy chain levels. J Clin Lab Anal 2019; 33 (7): e22948. doi: 10.1002/jcla.22948.
9. Khalil M, Teunissen CE, Otto M et al. Neurofilaments as biomarkers in neurological disorders. Nat Rev Neurol 2018; 14 (10): 577–589. doi: 10.1038/s41582-018-0058-z.
10. Gaetani L, Blennow K, Calabresi P et al. Neurofilament light chain as a biomarker in neurological disorders. J Neurol Neurosurg Psychiatry 2019; 90 (8): 870–881. doi: 10.1136/jnnp-2018-320106.
11. Andersson E, Janelidze S, Lampinen B et al. Blood and cerebrospinal fluid neurofilament light differentially detect neurodegeneration in early Alzheimer‘s disease. Neurobiol Aging 2020; 95 : 143–153. doi: 10.1016/j.neurobiolaging.2020.07.018.
12. Rosengren LE, Karlsson JE, Karlsson JO et al. Patients with amyotrophic lateral sclerosis and other neurodegenerative diseases have increased levels of neurofilament protein in CSF. J Neurochem 1996; 67 (5): 2013–2018. doi: 10.1046/j.1471-4159.1996.67052013.x.
13. Kuhle J, Barro C, Andreasson U et al. Comparison of three analytical platforms for quantification of the neurofilament light chain in blood samples: ELISA, electrochemiluminescence immunoassay and Simoa. Clin Chem Lab Med 2016; 54 (10): 1655–1661. doi: 10.1515/cclm-2015-1195.
14. Fialova L, Bartos A, Svarcova J et al. Serum and cerebrospinal fluid light neurofilaments and antibodies against them in clinically isolated syndrome and multiple sclerosis. J Neuroimmunol 2013; 262 (1–2): 113–120. doi: 10.1016/j.jneuroim.2013.06.010.
15. Srpova B, Uher T, Hrnciarova T et al. Serum neurofilament light chain reflects inflammation-driven neurodegeneration and predicts delayed brain volume loss in early stage of multiple sclerosis. Mult Scler 2021; 27 (1): 52–60. doi: 10.1177/1352458519901272.
16. Fialova L. Neurofilaments in multiple sclerosis. Multiple Sclerosis News 2019; 5 (1): 6–12.
17. Uher T, Schaedelin S, Srpova B et al. Monitoring of radiologic disease activity by serum neurofilaments in MS. Neurol Neuroimmunol Neuroinflamm 2020; 7 (4): e714. doi: 10.1212/nxi.0000000000000714.
18. Uher T, Kubala Havrdova E, Benkert P et al. Measurement of neurofilaments improves stratification of future disease activity in early multiple sclerosis. Mult Scler 2021; 27 (13): 2001–2013. doi: 10.1177/13524585211047977.
19. Barro C, Benkert P, Disanto G et al. Serum neurofilament as a predictor of disease worsening and brain and spinal cord atrophy in multiple sclerosis. Brain 2018; 141 (8): 2382–2391. doi: 10.1093/brain/awy154.
20. Barro C, Chitnis T, Weiner HL. Blood neurofilament light: a critical review of its application to neurologic disease. Ann Clin Transl Neurol 2020; 7 (12): 2508–2523. doi: 10.1002/acn3.51234.
21. Fialova L, Bartos A, Svarcova J. Neurofilaments and tau proteins in cerebrospinal fluid and serum in dementias and neuroinflammation. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2017; 161 (3): 286–295. doi: 10.5507/bp.2017.038.
22. Shahim P, Politis A, van der Merwe A et al. Neurofilament light as a biomarker in traumatic brain injury. Neurology 2020; 95 (6): e610–e622. doi: 10.1212/wnl.0000000 000009983.
23. Moseby-Knappe M, Mattsson N, Nielsen N et al. Serum neurofilament light chain for prognosis of outcome after cardiac arrest. JAMA Neurol 2019; 76 (1): 64–71. doi: 10.1001/jamaneurol.2018.3223.
24. Alagaratnam J, von Widekind S, De Francesco D et al. Correlation between CSF and blood neurofilament light chain protein: a systematic review and meta-analysis. BMJ Neurol Open 2021; 3 (1): e000143. doi: 10.1136/bmjno-2021-000143.
25. Gleerup HS, Sanna F, Hogh P et al. Saliva neurofilament light chain is not a diagnostic biomarker for neurodegeneration in a mixed memory clinic population. Front Aging Neurosci 2021; 13 : 659898. doi: 10.3389/fnagi.2021.659898.
26. Hviid CVB, Knudsen CS, Parkner T. Reference interval and preanalytical properties of serum neurofilament light chain in Scandinavian adults. Scand J Clin Lab Invest 2020; 80 (4): 291–295. doi: 10.1080/00365513.2020.1730434.
27. Khalil M, Pirpamer L, Hofer E et al. Serum neurofilament light levels in normal aging and their association with morphologic brain changes. Nat Commun 2020; 11 (1): 812. doi: 10.1038/s41467-020-14612-6.
28. Mattsson N, Andreasson U, Zetterberg H et al. Association of plasma neurofilament light with neurodegeneration in patients with Alzheimer disease. JAMA Neurol 2017; 74 (5): 557–566. doi: 10.1001/jamaneurol.2016.6 117.
29. Akamine S, Marutani N, Kanayama D et al. Renal function is associated with blood neurofilament light chain level in older adults. Sci Rep 2020; 10 (1): 20350. doi: 10.1038/s41598-020-76990-7.
30. Korley FK, Goldstick J, Mastali M et al. Serum NfL (Neurofilament Light Chain) levels and incident stroke in adults with diabetes mellitus. Stroke 2019; 50 (7): 1669–1675. doi: 10.1161/STROKEAHA.119.024941.
31. Howell JC, Watts KD, Parker MW et al. Race modifies the relationship between cognition and Alzheimer‘s disease cerebrospinal fluid biomarkers. Alzheimers Res Ther 2017; 9 (1): 88. doi: 10.1186/s13195-017-0315-1.
32. Manouchehrinia A, Piehl F, Hillert J et al. Confounding effect of blood volume and body mass index on blood neurofilament light chain levels. Ann Clin Transl Neurol 2020; 7 (1): 139–143. doi: 10.1002/acn3.50972.
33. Wentz E, Dobrescu SR, Dinkler L et al. Thirty years after anorexia nervosa onset, serum neurofilament light chain protein concentration indicates neuronal injury. Eur Child Adolesc Psychiatry 2021; 30 (12): 1907–1915. doi: 10.1007/s00787-020-01657-7.
34. Nilsson IAK, Millischer V, Karrenbauer VD et al. Plasma neurofilament light chain concentration is increased in anorexia nervosa. Transl Psychiatry 2019; 9 (1): 180. doi: 10.1038/s41398-019-0518-2.
35. Hviid CVB, Madsen AT, Winther-Larsen A. Biological variation of serum neurofilament light chain. Clin Chem Lab Med 2021 [ahead of print]. doi: 10.1515/ cclm-2020-1276.
36. Koel-Simmelink MJ, Vennegoor A, Killestein J et al. The impact of pre-analytical variables on the stability of neurofilament proteins in CSF, determined by a novel validated SinglePlex Luminex assay and ELISA. J Immunol Methods 2014; 402 (1–2): 43–49. doi: 10.1016/ j.jim.2013.11.008.
37. Gaiottino J, Norgren N, Dobson R et al. Increased neurofilament light chain blood levels in neurodegenerative neurological diseases. PLoS One 2013; 8 (9): e75091. doi: 10.1371/journal.pone.0075091.
38. Altmann P, Ponleitner M, Rommer PS et al. Seven day pre-analytical stability of serum and plasma neurofilament light chain. Sci Rep 2021; 11 (1): 11034. doi: 10.1038/s41598-021-90639-z.
39. Ashton NJ, Suarez-Calvet M, Karikari TK et al. Effects of pre-analytical procedures on blood biomarkers for Alzheimer‘s pathophysiology, glial activation, and neurodegeneration. Alzheimers Dement (Amst) 2021; 13 (1): e12168. doi: 10.1002/dad2.12168.
40. O‘Connell GC, Alder ML, Webel AR et al. Neuro biomarker levels measured with high-sensitivity digital ELISA differ between serum and plasma. Bioanalysis 2019; 11 (22): 2087–2094. doi: 10.4155/bio-2019-0213.
41. Terasawa K, Taguchi T, Momota R et al. Intermediate filaments of endoskeleton within human erythrocytes. Blood 2007; 110 (11): 1734. doi: 10.1182/blood.V110.11.1734.1734.
42. Lombardi V, Carassiti D, Giovannoni G et al. The potential of neurofilaments analysis using dry-blood and plasma spots. Sci Rep 2020; 10 (1): 97. doi: 10.1038/s41598-019-54310-y.
43. Simren J, Ashton NJ, Blennow K et al. Blood neurofilament light in remote settings: alternative protocols to support sample collection in challenging pre-analytical conditions. Alzheimers Dement (Amst) 2021; 13 (1): e12145. doi: 10.1002/dad2.12145.
44. Norgren N, Rosengren L, Stigbrand T. Elevated neurofilament levels in neurological diseases. Brain Res 2003; 987 (1): 25–31. doi: 10.1016/s0006-8993 (03) 03 219-0.
45. Norgren N, Karlsson JE, Rosengren L et al. Monoclonal antibodies selective for low molecular weight neurofilaments. Hybrid Hybridomics 2002; 21 (1): 53–59. doi: 10.1089/15368590252917647.
46. Gauthier A, Viel S, Perret M et al. Comparison of Simoa and Ella to assess serum neurofilament-light chain in multiple sclerosis. Ann Clin Transl Neurol 2021; 8 (5): 1141–1150. doi: 10.1002/acn3.51355.
47. Liu HC, Lin WC, Chiu MJ et al. Development of an assay of plasma neurofilament light chain utilizing immunomagnetic reduction tec hnology. PLoS One 2020; 15 (6): e0234519. doi: 10.1371/journal.pone.0234519.
48. Fialova L, Zima T, Bartos A. Přehled imunoanalytických metod ke stanovení tripletu biomarkerů Alzheimerovy nemoci v mozkomíšním moku a v krvi. Chemické listy 2020; 114 (8): 537−544.
49. Cohen L, Walt DR. Single-molecule arrays for protein and nucleic acid analysis. Annu Rev Anal Chem (Palo Alto Calif) 2017; 10 (1): 345–363. doi: 10.1146/annurev-anchem-061516-045340.
50. Lue LF, Guerra A, Walker DG. Amyloid beta and tau as Alzheimer’s disease blood biomarkers: promise from new technologies. Neurol Ther 2017; 6 (Suppl 1): 25–36. doi: 10.1007/s40120-017-0074-8.
51. Hendricks R, Baker D, Brumm J et al. Establishment of neurofilament light chain Simoa assay in cerebrospinal fluid and blood. Bioanalysis 2019; 11 (15): 1405–1418. doi: 10.4155/bio-2019-0163.
52. Korley FK, Yue JK, Wilson DH et al. Performance evaluation of a multiplex assay for simultaneous detection of four clinically relevant traumatic brain injury biomarkers. J Neurotrauma 2018; 36 (1): 182–187. doi: 10.1089/neu.2017.5623.
53. Dysinger M, Marusov G, Fraser S. Quantitative analysis of four protein biomarkers: an automated microfluidic cartridge-based method and its comparison to colorimetric ELISA. J Immunol Methods 2017; 451 : 1–10. doi: 10.1016/j.jim.2017.08.009.
54. Yang CC, Yang SY, Chen HH et al. Effect of molecule-particle binding on the reduction in the mixed-frequency alternating current magnetic susceptibility of magnetic bio-reagents. J Appl Phys 2012; 112 (2): 024704. doi: 10.1063/1.4739735.
55. Plavina T, Rudick RA, Calabresi PA et al. Development of a sensitive serum neurofilament light assay on Siemens routine immunoassay platforms. Multiple Sclerosis J 2019; 25 (2 Suppl): 278. doi: 10.1177/1352458519868 078.
56. Lundberg M, Eriksson A, Tran B et al. Homogeneous antibody-based proximity extension assays provide sensitive and specific detection of low-abundant proteins in human blood. Nucleic Acids Res 2011; 39 (15): e102. doi: 10.1093/nar/gkr424.
57. Šilhán D, Ibrahim I, Tintěra J et al. Parietální atrofie na magnetické rezonanci mozku u Alzheimerovy nemoci s pozdním začátkem. Cesk Slov Neurol N 2019; 82 (1): 91–95. doi: 10.14735/amcsnn201991.
58. Bartoš A, Polanská H. Správná a chybná pojmenování obrázků pro náročnější test písemného Pojmenování obrázků a jejich vybavení (dveřní POBAV). Cesk Slov Neurol N 2021; 84/117 (2): 151–163. doi: 10.48095/cccsnn202115.
59. Bartoš A, Čechová L, Švarcová J et al. Likvorový triplet (tau proteiny a beta-amyloid) v diagnostice Alzheimerovy-Fischerovy nemoci. Cesk Slov Neurol N 2012; 75/108 (5): 587–594.
60. Stengelin M, Bathala P, Wohlstadter JN. Sensitive serum/plasma neurofilament light immunoassay. Alzheimers Dement 2019; 15 (7): P1346–P1347. doi: 10.1016/j.jalz.2019.06.3846.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2022 Issue 1-
All articles in this issue
- Editorial
- Poděkování recenzentům
- Analytické a preanalytické aspekty stanovení lehkých řetězců neurofilament v biologických tekutinách
- Komentář k článku autorů Fialová et al Analytické a preanalytické aspekty stanovení lehkých řetězců neurofilament v biologických tekutinách
- Spontánní intrakraniální hypotenze
- Novinky v liečbe hlbokou mozgovou stimuláciou pri neurologických ochoreniach
- Poruchy čichu po transnazálních endoskopických operacích adenomu hypofýzy
- Česká verze nástroje Mini-BESTest a doporučení pro jeho klinické použití
- Validace české jazykové verze dotazníků DN4 a PainDetect pro diagnostiku neuropatické bolesti
- Sakrální deaferentace a implantace sakrálního neurostimulátoru u pacienta s transverzální míšní lézí
- Vícečetná tumoriformní ložiska mozku jako první projev demyelinizačního onemocnění
- Cerebrální hyperperfuzní syndrom – vzácná komplikace revaskularizačního výkonu
- Dilatace skalpu podkožními expandéry před sekundární počítačově modelovanou kranioplastikou z porózního polyethylenu
- Zemřel doc. MUDr. Vilibald Vladyka, CSc.
- Zemřela doc. MUDr. Miluše Havlová, CSc.
- Odešel prim. MUDr. Hanuš Baš, CSc.
- Prof. MUDr. Zdeněk Kadaňka, CSc., osmdesátiletý
- Výsledky chirurgické terapie meralgia paresthetica 15 pacientů
- Test-retest hodnocení spolehlivosti čichového testu (Odorized Markers Test)
- Vliv fluoxetinu na obnovu funkční nezávislosti u pacientů po akutní ischemické cévní mozkové příhodě a prognostické faktory
- Lokalizovaná neurofibromatóza typu 1 v mozaice
- Anémie z nedostatku železa vykazující progresivní retinální, kochleární a cerebrální trombózu
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vícečetná tumoriformní ložiska mozku jako první projev demyelinizačního onemocnění
- Spontánní intrakraniální hypotenze
- Novinky v liečbe hlbokou mozgovou stimuláciou pri neurologických ochoreniach
- Analytické a preanalytické aspekty stanovení lehkých řetězců neurofilament v biologických tekutinách
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

