-
Medical journals
- Career
Syndrom progresivní ataxie a palatálního tremoru u pacienta s mírnou idiopatickou bilaterální hypertrofií olivárního jádra
Authors: P. Hemerková 1; H. Matulová 1; J. Jandura 2
Authors‘ workplace: Neurologická klinika LF UK a FN Hradec Králové 1; Radiologická klinika LF UK a FN Hradec Králové 2
Published in: Cesk Slov Neurol N 2021; 84(5): 496-498
Category: Letters to Editor
doi: https://doi.org/10.48095/cccsnn2021496Vážená redakce,
párové dolní olivární jádro se nachází v horní části prodloužené míchy, laterálně od pyramidových drah. Přijímá jak motorické, tak senzorické podněty, které se zde integrují a olivocerebelární dráhou jsou pak přenášeny do mozečkového kortexu. Jádro je zapojeno do tzv. Guillain-Mollaretova trojúhelníku. Tento okruh, známý též jako trojúhelník myoklonický, propojuje kontralaterální nucleus dentatus a ipsilaterální malobuněčnou část nucleus ruber a ipsilatelární olivu inferior. Tvoří tedy zpětnovazebný okruh mozkového kmene a mozečkových jader, který moduluje míšní motorickou aktivitu (obr. 1) [1].
Image 1. MR mozku, T2 vážená sekvence koronálně – znázornění Guillain-Molaretova trojúhelníku.
Horní vrchol vyznačuje levostranný nucleus ruber, dolní vrchol odpovídá poloze ipsilaterálního dolního olivárního jádra, třetí vrchol kontralaterálně ukazuje místo pravostranného nucleus dentatus.
Fig. 1. Brain MRI, T2 weighted coronal sequence – depiction of the Guillain-Molaret triangle.
The upper peak indicates the left-sided nucleus ruber, the lower peak corresponds to the position of the ipsilateral inferior olivary nucleus, and the third peak contralaterally indicates the location of the right-sided nucleus dentatus.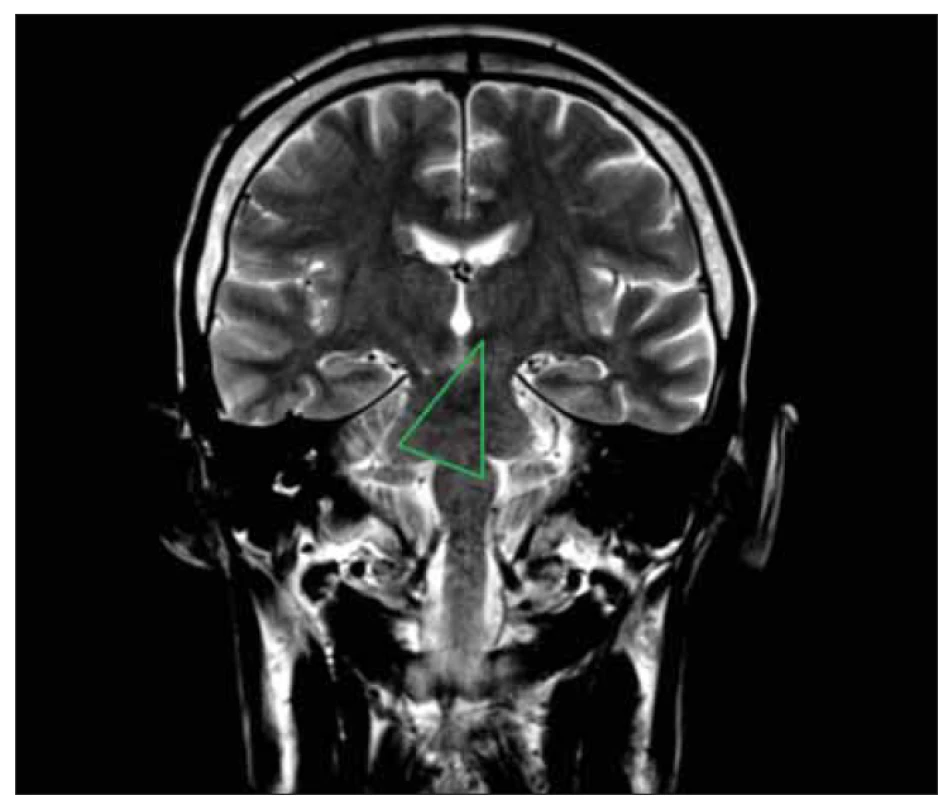
Olivární jádro může podléhat degeneraci. Existují dva základní druhy této degenerace. Buďto se jedná o primární neurodegenerativní proces neznámé příčiny a bilaterální degenerace jádra je součástí vzácného syndromu progresivní ataxie a palatálního tremoru (PAPT), nebo se degenerace rozvine sekundárně po škodlivém inzultu, jakým může být např. hemoragie, ischemie či demyelinizace postihující struktury myoklonického trojúhelníku. V druhém případě se může jednat o hypertrofii olivy pouze unilaterální. Podstatné je, že v obou případech dochází k desinhibici (a tedy aktivaci) olivárního jádra, k jeho hypertrofii a rytmickým spontánním výbojům. Hovoříme o tzv. hypertrofické degeneraci olivy (HOD) [2].
Hlavním klinickým projevem HOD je palatální tremor (PT) postihující měkké patro, ale i uvulu, larynx a pharynx, nebo okulopalatální tremor (OPT), tedy PT spojený s pendulárním nystagmem.
Jedenapadesátiletý, dosud zdravý montážní dělník s nevýznamnou rodinnou anamnézou se dostavil k neurologickému vyšetření pro řadu potíží. Během posledního roku si začal všímat nejistoty při chůzi s tendencí k vrávorání a pádům, okolí ho podezíralo z podnapilosti. Přitom stačilo třeba vést vodítko se psem, aby se znovu cítil při chůzi jistý. Trápily ho také nechtěné mimovolní pohyby, vlivem kterých např. jednou udeřil kolemjdoucího. On sám se každou chvíli o něco uhodil, celkově úplně ztratil odhad vzdálenosti v prostoru. Ve volném čase rád hrál v kapele na kytaru, ale poslední rok začal špatně slyšet. Také se objevily mírné potíže s polykáním, občas se zalykal při příjmu tekutin a tuhých soust.
V neurostatu byl nápadný především palatální myoklonus. Byly přítomny mírná posturální instabilita, stoj o široké bázi. Chůze lehce vrávoravá, kroky nebyly zcela stejné délky. Na končetinách lehká dystaxe. Řeč byla mírně dysartrická.
Na MR mozku se zobrazil stranově symetrický zvýšený signál na T2 vážené sekvenci v oblasti dolního olivárního jádra a jeho mírná bilaterální hypertrofie. Jinak byly struktury Guillain-Mollaretova trojúhelníku bez patologického nálezu a radiologický nález byl tedy hodnocen jako idiopatická bilaterální hypertrofická degenerace olivárního jádra (obr. 2).
Image 2. MR mozku, T2 vážená sekvence axiálně – mírná symetrická hypertrofie dolních olivární jader, která jsou bilaterálně s patologicky zvýšeným signálem.
Dif. dg. – další příčiny vysokého T2 váženého signálu ve ventrální části prodloužené míchy:
• demyelinizace v souvislosti s roztroušenou sklerózou;
• tumor (astrocytom, metastáza, lymfom);
• léze postihující kortikospinální dráhu (Walleriánská degenerace, adrenoleukodystrofie, amyotrofická laterální skleróza);
• infarkt v povodí vertebrobazilární perforující tepny – většina medulárních infarktů nastává v povodí arteria posterior inferior cerebelli a postihuje posterolaterální část prodloužené míchy (např. při disekci vertebrální tepny). Alternativně, medulární infarkty mohou být spojeny s okluzí perforující větví přední míšní tepny nebo vertebrálních tepen a mají paramediální lokalizaci;
• infekční/zánětlivý proces (tuberkulóza, sarkoidóza, HIV/AIDS, rhombencephalitis) [10].
Fig. 2. Brain MRI, T2 weighted axial sequence – imaging at the level of the inferior olivary nuclei, which are bilateral with pathologically increased signal and mild symmetric hypertrophy.
Dif. dg. – other causes of high T2 weighted signal in the ventral part of the medulla oblongata:
• demyelination in the context of multiple sclerosis;
• tumor (astrocytoma, metastasis, lymphoma);
• lesions affecting the corticospinal tract (Wallerian degeneration, adrenoleukodystrophy, amyotrophic lateral sclerosis);
• infarction in the territory of the vertebrobasilar perforating artery – most of the medullary infarctions occur in the posterior inferior cerebellar artery territory and affect the posterolateral part of the medulla oblongata (for example, in vertebral artery dissection). Alternatively, medullary infarctions may be associated with the occlusion of perforating branches of the anterior spinal artery or vertebral arteries and are located in the paramedian region;
• infectious/inflammatory process – tuberculosis, sarcoidosis, HIV/AIDS, rhombencephalitis.![MR mozku, T2 vážená sekvence axiálně – mírná symetrická hypertrofie dolních
olivární jader, která jsou bilaterálně s patologicky zvýšeným signálem.<br>
Dif. dg. – další příčiny vysokého T2 váženého signálu ve ventrální části prodloužené míchy:<br>
• demyelinizace v souvislosti s roztroušenou sklerózou;<br>
• tumor (astrocytom, metastáza, lymfom);<br>
• léze postihující kortikospinální dráhu (Walleriánská degenerace, adrenoleukodystrofie,
amyotrofická laterální skleróza);<br>
• infarkt v povodí vertebrobazilární perforující tepny – většina medulárních infarktů nastává
v povodí arteria posterior inferior cerebelli a postihuje posterolaterální část prodloužené
míchy (např. při disekci vertebrální tepny). Alternativně, medulární infarkty mohou být spojeny
s okluzí perforující větví přední míšní tepny nebo vertebrálních tepen a mají paramediální
lokalizaci;<br>
• infekční/zánětlivý proces (tuberkulóza, sarkoidóza, HIV/AIDS, rhombencephalitis) [10].<br>
Fig. 2. Brain MRI, T2 weighted axial sequence – imaging at the level of the inferior olivary
nuclei, which are bilateral with pathologically increased signal and mild symmetric
hypertrophy.<br>
Dif. dg. – other causes of high T2 weighted signal in the ventral part of the medulla
oblongata:<br>
• demyelination in the context of multiple sclerosis;<br>
• tumor (astrocytoma, metastasis, lymphoma);<br>
• lesions affecting the corticospinal tract (Wallerian degeneration, adrenoleukodystrophy,
amyotrophic lateral sclerosis);<br>
• infarction in the territory of the vertebrobasilar perforating artery – most of the medullary
infarctions occur in the posterior inferior cerebellar artery territory and affect the posterolateral
part of the medulla oblongata (for example, in vertebral artery dissection). Alternatively,
medullary infarctions may be associated with the occlusion of perforating branches of
the anterior spinal artery or vertebral arteries and are located in the paramedian region;<br>
• infectious/inflammatory process – tuberculosis, sarcoidosis, HIV/AIDS, rhombencephalitis.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/cb686182255c725ff769abb0f8b3e399.png)
Vyšetření na ORL potvrdilo oboustrannou percepční nedoslýchavost. Při vyšetření polykacího aktu nebyla zachycena porucha polykání, ale mimovolní stahy svalů hrtanu a hltanu, které jistě mohou být příčinou nepříjemných pocitů u pacienta při polykání.
Doplnili jsme EEG pro úvahu o fokálních motorických epileptických paroxysmech jako příčině náhlých trhavých pohybů (které jdou ale etiologicky nejspíše na vrub ataxii), záznam byl bez epileptiformní aktivity. EMG neprokázala polyneuropatii dolních končetin, která by se mohla podílet na nestabilitě stoje a chůze nemocného.
Syndrom progresivní cerebelární ataxie a palatálního tremoru spojený s přítomností HOD byl popsán poprvé již v roce 1985 americkými neurology Sperligem a Hermannem, kteří symptomy bezúspěšně zkoušeli ovlivnit tri (hexy) phenidylem s antimuskarinovým účinkem (původně registrován jako antiparkinsonikum) a L-5 hydroxytryptophanem [3].
Samuel et al poté rozlišili sporadickou a familiární formu nemoci a publikovali práci popisující syndrom u 28 nemocných. Žádný z nich neměl strukturální lézi v kmeni, u některých byla přítomna atrofie mozečku [4].
U sporadické formy nemoci se kromě ataxie mohou vyskytnout i poruchy okulomotoriky, jako jsou pohledem evokovaný nystagmus, záškubový vertikální nystagmus nebo hypermetrické sakády. V práci Samuela et al byla u dvou pacientů z 28 přítomna internukleární oftalmoplegie. PT patřící do základní charakteristiky syndromu byl přítomen u všech. Pacienti si tedy mohou stěžovat na poruchu zraku charakteru rozmazaného vidění při rychlých pohybech hlavou. Zároveň byla u sporadické formy poměrně často přítomna ztráta sluchu. Žádné další specifické neurologické příznaky nejsou popisovány [4].
Klinický obraz familiární formy syndromu PAPT může být mnohem různorodější. Ne vždy je na MR přítomna hypertrofie olivárního jádra. Mezi nejčastější příčiny familiární formy PAPT patří výskyt v rámci Alexandrovy choroby, spinocerebelární ataxie typu 20 a mutace POLG.
Alexandrova choroba patří do skupiny leukodystrofií, tedy nemocí spojených s primární poruchou myelinu a buněk myelin tvořících. Onemocnění je podmíněno mutací v genu GFAP, kódující kyselý gliální fibrilární protein (GFAP), který je důležitou stavební strukturou astrocytů. Rozlišuje se forma infantilní, juvenilní a adultní. Do klinického obrazu patří bulbární/pseudobulbární syndrom, spasticita, demence, ale často také právě cerebelární ataxie, palatální tremor, nystagmus a jiné abnormální oční pohyby [5].
Pro SCA20 jsou typické začátek dysartrií, pomalá progresivní ataxie, palatální tremor a familiární výskyt s autosomálně dominantní dědičností. Kromě toho mohou být přítomny abnormní oční pohyby typu hypermetrických horizontálních sakád, v menšině případů se objeví i lehká šlachookosticová hyperreflexie a posturální tremor. Na MR kromě cerebelární atrofie může, ale nemusí být přítomen zvýšený T2 važený signál v oblasti olivárního jádra [6].
Gen POLG kóduje mitochondriální DNA polymerázu zodpovědnou za replikaci mitochondriálního genomu. Mutace POLG jsou nejčastější příčinou genetických mitochondriálních chorob a spektrum jejich klinických projevů je velmi široké. Patří sem choroby s počátkem v raném dětském věku – Alpers-Huttenlocherův syndrom, autosomálně recesivní (a dominantní) progresivní externí oftalmoplegie, dětská myocerebrohepatopatie a skupina tzv. chorob MEMSA spojených s myoklonickou epilepsií, myopatií a senzorickou ataxií [7].
V rámci diferenciální diagnózy je nutné rovněž myslet na progresivní supranukleární paralýzu, u které byla HOD popsána [8], stejně jako u nemocného s familiární formou Creutzfeld-Jakobovy nemoci [9]. V úvahu by připadala i cerebelární forma multisystémové atrofie. Z léčitelných vzácných příčin PAPT by měla být vyloučena glutenová senzitivita.
U našeho pacienta je základním rysem onemocnění palatální tremor a progredující ataxie. Na MR mozku jsou patrné abnormální změny intenzity a mírná hypertrofie obou olivárních jader, bez dalšího patologického nálezu. Klinický i radiologický nález tedy odpovídají neurodegenerativnímu syndromu PAPT. Navíc je přítomna i nedoslýchavost, která bývá u této jednotky často popisována, naopak chybí porucha očních pohybů. Na výsledek genetického vyšetření mutace POLG a panelu SCA nemocný čeká. V medikaci lze vyzkoušet antikonvulziva či benzodiazepiny, avšak s nejistým efektem. U našeho pacienta nyní zkoušíme malou dávku klonazepamu. Objevují se kazuistiky popisující dobrý efekt botulotoxinu aplikovaného do palatálních svalů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manu script met the ICMJE “uniform requirements” for biomedical papers.MUDr. Pavlína Hemerková
Neurologická klinika
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: pavlina.hemerkova@fnhk.cz
Přijato k recenzi: 22. 8. 2021
Přijato do tisku: 14. 10. 2021
Sources
1. Khoyratty F, Wilson T. The dentato-rubro-olivary tract: clinical dimension of this anatomical pathway. Case Rep Otolaryngol 2013; 2013 : 934386. doi: 10.1155/2013/934386.
2. Tilikete C, Desestret V. Hypertrophic olivary de - generation and palatal or oculopalatal tremor. Front Neurol 2017; 8 : 302. doi: 10.3389/fneur.2017.00302.
3. Sperling MR, Herrmann C Jr. Syndrome of palatal myoclonus and progressive ataxia: two cases with magnetic resonance imaging. Neurology 1985; 35 (8): 1212–1214. doi: 10.1212/wnl.35.8.1212.
4. Samuel M, Torun N, Tuite PJ et al. Progressive ataxia and palatal tremor (PAPT): clinical and MRI assessment with review of palatal tremors. Brain 2004; 127 (Pt 6): 1252–1268. doi: 10.1093/brain/awh137.
5. Kolníková M, Sýkora P. Leukodystrofie – klinické a rádiologické aspekty. Cesk Slov Neurol N 2014; 77/110 (5): 534–552.
6. Storey E, Gardner RJ. Spinocerebellar ataxia type 20. In: Adam MP, Ardinger HH, Pagon RA et al (eds.). GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle 1993–2020.
7. Rahman S, Copeland WC. POLG-related disorders and their neurological manifestations. Nat Rev Neurol 2019; 15 (1): 40–52. doi: 10.1038/s41582-018-0101-0.
8. Hanihara T, Amano N, Takahashi T et al. Hypertrophy of the inferior olivary nucleus in patients with progressive supranuclear palsy. Eur Neurol 1998; 39 (2): 97–102. doi: 10.1159/000007915. PMID: 9520070.
9. Granger A, Agarwal S, Andino A et al. Hypertrophic olivary degeneration and movement disorder in a patient with familial Creutzfeldt-Jakob disease. Cureus 2020; 12 (10): e10854. doi: 10.7759/cureus.10854.
10. Osborn AG, Salzman KL, Katzman G et al. Diagnostic imaging: Brain. 2nd ed. Philadelphia: Lippincott Williams & Wilkins 2009.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2021 Issue 5-
All articles in this issue
- Ofatumumab – nová možnost vysoce účinné terapie relabujících forem roztroušené sklerózy
- Hereditární gelsolinová amyloidóza – klinické projevy a molekulárně genetická příčina
- Ovlivňují iniciální klinické symptomy výsledný stav pacientů s ischemickým iktem a rekanalizační léčbou?
- Analgeticko-myorelaxační infuze v terapii vertebrogenního algického syndromu – technologické a klinické aspekty
- Srovnání vlivu první a druhé vlny pandemie COVID-19 na počty hospitalizovaných pacientů s ischemickou cévní mozkovou příhodou, na jejich diagnostiku, léčbu a prognózu
- První zkušenosti s využitím přímé monitorace sluchového nervu u operací vestibulárního schwannomu v České republice
- Ultrasonograficky navigovaný léčebný obstřik sakroilického kloubu
- Fatická porucha u migrény s aurou – videokazuistika
- Syndrom progresivní ataxie a palatálního tremoru u pacienta s mírnou idiopatickou bilaterální hypertrofií olivárního jádra
- Recenze knihy
- Cenu J. E. Purkyně 2021 obdržel neurochirurg prof. MUDr. Eduard Zvěřina, DrSc., FCMA
- Neuroradiologické charakteristiky a klinické výsledky u pacientů intoxikovaných metanolem
- Zpráva o epikraniální arteriovenózní malformaci
- Okluze velkých mozkových tepen u nemocné se svalovou dystrofií Emery-Dreifuss
- Meningeální forma Rosai-Dorfmanovy choroby
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Analgeticko-myorelaxační infuze v terapii vertebrogenního algického syndromu – technologické a klinické aspekty
- Ofatumumab – nová možnost vysoce účinné terapie relabujících forem roztroušené sklerózy
- Ultrasonograficky navigovaný léčebný obstřik sakroilického kloubu
- Syndrom progresivní ataxie a palatálního tremoru u pacienta s mírnou idiopatickou bilaterální hypertrofií olivárního jádra
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

