-
Medical journals
- Career
Měření vrstvy nervových vláken sítnice u pacientů s Alzheimerovou chorobou
Authors: Z. Kasl 1; Š. Rusňák 1; N. Jirásková 2; P. Rozsíval 2; M. Krčma 3; J. Laczó 4; M. Vyhnálek 4; J. Hort 4
Authors‘ workplace: Oční klinika LF UK a FN Plzeň 1; Oční klinika LF UK a FN Hradec Králové 2; 1. interní klinika LF UK a FN Plzeň 3; Neurologická klinika 2. LF UK a FN v Motole, Praha 4
Published in: Cesk Slov Neurol N 2016; 79/112(4): 424-429
Category: Original Paper
doi: https://doi.org/10.14735/amcsnn2016424Overview
Úvod:
Alzheimerova choroba (ACH) je nejčastější příčina syndromu demence a mírné kognitivní poruchy (MCI). Současné diagnostické metody jsou nákladné, náročné a pro pacienta zatěžující. Proto se hledají alternativní přístupy pro časnou diagnostiku ACH. Jednou z možností může být zhodnocení tloušťky vrstvy nervových vláken sítnice (RNFL).Cíl:
Cílem naší práce bylo stanovit tloušťku RNFL v jednotlivých kvadrantech sítnice cirkulárně kolem terče zrakového nervu u pacientů s ACH a MCI pomocí optické koherenční tomografie (OCT) a porovnat výsledky s kontrolním souborem.Soubor a metodika:
Soubor obsahoval 24 pacientů s ACH, resp. 48 změřených očí a 10 pacientů s MCI, resp. 19 změřených očí. Kontrolní soubor čítal 26 osob, resp. 51 změřených očí. Všichni pacienti podstoupili komplexní oční vyšetření a byla u nich změřena tloušťka RNFL pomocí OCT.Výsledky:
Mezi hodnotami tloušťky RNFL souborů studovaných a kontrolního jsme neprokázali statisticky signifikantní rozdíl.Závěry:
Námi zvolená metodika a získané výsledky potvrzují výhody vyšetření sítnice jako použitelnou, časově přiměřenou a pro pacienta nezatěžující možnost. Výstupy z naší práce přispívají do diskuze o přínosu této metodiky v diagnostice ACH. Je třeba dalších studií, které by analyzovaly přínosnost OCT v diagnostice ACH s výhledem výhodnosti aplikace této metodiky v klinické praxi.Klíčová slova:
Alzheimerova choroba – optická koherenční tomografie – vrstva nervových vláken sítniceÚvod
Alzheimerova choroba (ACH) je progresivní neurodegenerativní onemocnění mozku postihující zejména kognitivní funkce, chování a soběstačnost pacientů.
Jedná se o nejčastější příčinu syndromu demence, kterou v současnosti trpí celosvětově asi 35 mil. osob. Kolem roku 2030 se v souvislosti se stárnutím populace očekává zdvojnásobení a okolo roku 2050 až zečtyřnásobení počtu postižených. Pro diagnózu ACH byla v roce 2011 navržena nová diagnostická kritéria [1].
Podle těchto kritérií se onemocnění může klinicky projevit již v tzv. prodromálním stadiu, které klinicky odpovídá syndromu mírné kognitivní poruchy (Mild Cognitive Impairment; MCI) [2]. Podle nejnovějších poznatků patofyziologické změny mozku předcházejí příznaky demence o 10 – 15 let. Proto byla navržena diagnostická jednotka preklinické ACH [3]. Moderní diagnostické metody, které mají největší senzitivitu a specificitu v časných stadiích ACH, zahrnují průkaz poruchy metabolizmu mozku a změny struktury nervové tkáně. Nejdříve bývá pozitivní vyšetření pozitronovou emisní tomografií (PET) s ligandy zobrazujícími amyloid in vivo, jako je Pitsburgská substance, florbetaben nebo flutematamol. Následně může dojít k poklesu hladiny beta-amyloidu v mozkomíšním moku nebo k poklesu metabolizmu glukózy na PET. O něco později dochází ke zmenšování hipokampu zjistitelnému na magnetické rezonanci (MR). V době prvních klinických příznaků je vhodné doplnit vyšetření neuropsychologické zaměřené zejména na průkaz postižení epizodické paměti a jiné časné kognitivní markery. Všechna výše zmíněná vyšetření jsou finančně nákladná, časově a organizačně náročná a pro pacienty zatěžující. Z tohoto důvodu pokračuje výzkum s hledáním alternativních, levných, snadno proveditelných a pacienty nezatěžujících biomarkerů. Podmínkou je jejich vysoká senzitivita a specificita pro ACH. Výzvou nadále zůstává snaha o co možná nejdřívější stanovení diagnózy. Léčba současná symptomatická nebo budoucí kauzální by měla být zahájena co nejčasněji. Včasné zahájení léčby umožňuje oddálit nejzávažnější stadia onemocnění a prodloužit období soběstačnosti. Limitem v přesnosti zobrazení mozkové tkáně pomocí výše jmenovaných grafických metod je pevná lebka. V oku je díky průhlednosti očních struktur pozorování nervových buněk dobře proveditelné. Embryologickým základem sítnice je výchlipka mozku. Retina obsahující neurony je částí centrálního nervového systému, která je přístupná oftalmologickému vyšetření. Blanksová et al prokázali histologicky ztrátu 25 % neuronů ve vrstvě gangliových buněk centrální sítnice u pacientů s AD ve srovnání s kontrolním souborem [4]. Z výše uvedených faktů pramení myšlenka sledovat některé choroby mozku prostřednictvím lidského oka [5]. U pacientů s ACH byla prokázána ztráta neuronů a potažmo bychom očekávali ztenčení vrstvy nervových vláken sítnice (Retinal Nerve Fiber Layer; RNFL) způsobené úbytkem nervových vláken. Některé studie založené na měření RNFL při ACH přinesly negativní [6,7] a jiné pozitivní nálezy [8 – 13]. Celkově nelze výsledky považovat za konzistentní.
Optická koherenční tomografie (Optical Coherence Tomography; OCT) se standardně v oftalmologii používá k diagnostice chorob sítnice, vitreoretinálního rozhraní a terče zrakového nervu. OCT je ale také diagnostickým nástrojem schopným kvantifikovat v sítnici změny, u kterých předpokládáme souvislost s neurodegenerativními chorobami. Používá se jako pomocná metoda v diagnostice a sledování průběhu roztroušené sklerózy [14,15]. I v případě ACH je hlavní sledovanou strukturou vrstva nervových vláken a vrstva gangliových buněk. Zde je s progresí choroby očekáván rychlejší úbytek těchto vrstev než u zdravé populace. Jde o objektivní měření struktur, které má potenciál ve sledování vývoje onemocnění v čase. OCT byla poprvé použita k zobrazení sítnice v roce 1991 [16]. V podstatě jde o optickou analogii a-skenu ultrasonografie [17], jednorozměrného lineárního způsobu zobrazení ve směru vysílaných ultrazvukových vln, který se běžně používá k měření délky oka od rohovky k sítnici při výpočtu optické mohutnosti čočky. OCT využívá odrazu dostatečně širokého spektra nízkokoherenčního záření delších vlnových délek v rozsahu blízkého infračerveného záření od tkání oka. Starší time domainové OCT (TD-OCT) využívá k detekci dráhového rozdílu záření posun referenčního zrcadla, a tím pádem změny vzdálenosti, kterou putuje referenční paprsek. Novější spectral domain OCT (SD-OCT) pracují s frekvenčně kódovaným signálem. Měřením celého spektra záření současně lze dosáhnou lepší citlivosti a výrazného zrychlení vyšetření [18]. SD-OCT zvyšuje axiální rozlišení 2 – 3krát a skenovací rychlost 60 – 110krát oproti TD-OCT [19]. Nejpokročilejší modely dnes mohou zobrazit detaily sítnice s rozlišením několika mikrometrů. Vyšetřující může struktury pozorovat také ve 3D obraze. Tato diagnostická modalita přinesla obrovský pokrok v oblasti diagnostiky chorob sítnice a umožňuje vidět detaily lidského oka téměř tak, jak tomu bylo dříve možné pouze v histologickém obraze.
Cílem naší práce bylo stanovit tloušťku vrstvy nervových vláken v peripapilární oblasti sítnice u pacientů s ACH a pacientů s MCI a porovnat výsledky s nálezy u kontrolního souboru věkově odpovídající populace bez kognitivního deficitu.
Soubor a metodika
Soubor byl tvořen 24 pacienty s ACH s průměrným věkem 74 let (±8 let), z toho 11 mužů a 13 žen, resp. 48 změřených očí (Mini-Mental State Examination; MMSE 21 ± 3) a 10 pacienty s MCI s průměrným věkem 72 let (±8 let), z toho pět mužů a pět žen, resp. 19 změřených očí (MMSE 28 ± 1).
Pacienti s MCI byli vybráni podle Petersenových kritérií [20] a pacienti s ACH byli diagnostikováni dle NINCDS-ADRDA kritérií [21]. Diagnóza byla podpořena nálezy na MR (byly vyloučeny rozsáhlejší cévní změny nebo strukturální patologie svědčící pro jinou možnou etiologii). MR jako biomarker k hodnocení atrofie nebo jiné metabolické markery využity nebyly. Pacienti s MCI absolvovali vyšetření neuropsychologickou baterií, všichni pacienti pak laboratorní testy [1].
Do skupiny s MCI byli zařazeni pacienti s amnestickou MCI [22]. Skupina měla rovněž vyšetřenou MR, podrobné neuropsychologické vyšetření a část z ní i likvor se stanovením biomarkerů [23]. Všichni pacienti byli vyšetřeni testem MMSE. Pacienti byli pečlivě vybráni a požádáni o spolupráci při vyšetření v Poradně pro poruchy kognitivních funkcí na Neurologické klinice FN v Motole a podepsali informovaný souhlas. Kontrolní soubor obsahoval 26 osob, z toho 12 mužů a 14 žen s průměrným věkem 71 (±7), resp. 51 změřených očí (MMSE 30). Byl tvořen doprovázejícími osobami pacientů s ACH a pacienty vyšetřenými na oční ambulanci FN Plzeň, kteří neměli žádné z vylučujících kritérií. Lichý počet změřených očí v souboru pacientů s MCI a v kontrolním souboru byl v obou případech způsoben nemožností změřit jedno z očí. V obou případech šlo o pacienty s anamnézou poranění jednoho oka. Vyloučeni byli pacienti s kataraktou, léčeným glaukomem nebo podezřením na glaukom, s neuropatií zrakového nervu, ischemickými lézemi sítnice, známkami věkem podmíněné makulární degenerace, anamnézou operace oka vyjma katarakty, se stavem po těžkých poraněních očí v anamnéze, s posttraumatickými nebo dystrofickými lézemi na rohovce, refrakční vadou větší než +3 a – 5 sférických dioptrií a astigmatizmem větším než 2 dioptrie. Vyloučili jsme také pacienty s diabetes mellitus. Pacientům byl vyšetřen na štěrbinové lampě přední segment oka vč. zornicových reakcí. V arteficiální mydriáze navozené aplikací kapek Unitropic (Tropikamid) do spojivkového vaku byla prohlédnuta čočka, sklivec a sítnice. Posléze bylo provedeno měření tloušťky RNFL na OCT.
Tloušťka RNFL byla měřena pomocí spektrální OCT Cirrus firmy Carl Zeiss (Carl Zeiss Meditec, CZM) s max. rozlišením 5 mikrometrů a skenovací rychlostí 27 000 A-skenů/ s standardním skenem o průměru 3,4 mm provedeným cirkulárně kolem terče zrakového nervu v módu RNFL (obr. 1, 2) u pacientů s diagnostikovanou ACH a MCI. Měřena byla průměrná hodnota tloušťky RNFL a hodnoty tloušťky RNFL v jednotlivých peripapilárních kvadrantech sítnice označených jako H – horní, D – dolní, N – nazální, T – temporální.
Image 1. Grafické zobrazení sítnice při měření RNFL pomocí OCT. Fialová kružnice o průměru 3,4 mm na obrázku dole označuje místo meření tloušťky RNFL na sítnici cirkulárně kolem terče zrakového nervu. Fig. 1. Graphical display of the retina during OCT RNFL. The purple circle with a diameter of 3.4 mm on the figure below indicates the location of RNFL thickness measurement on the retina circularly around the optic nerve. 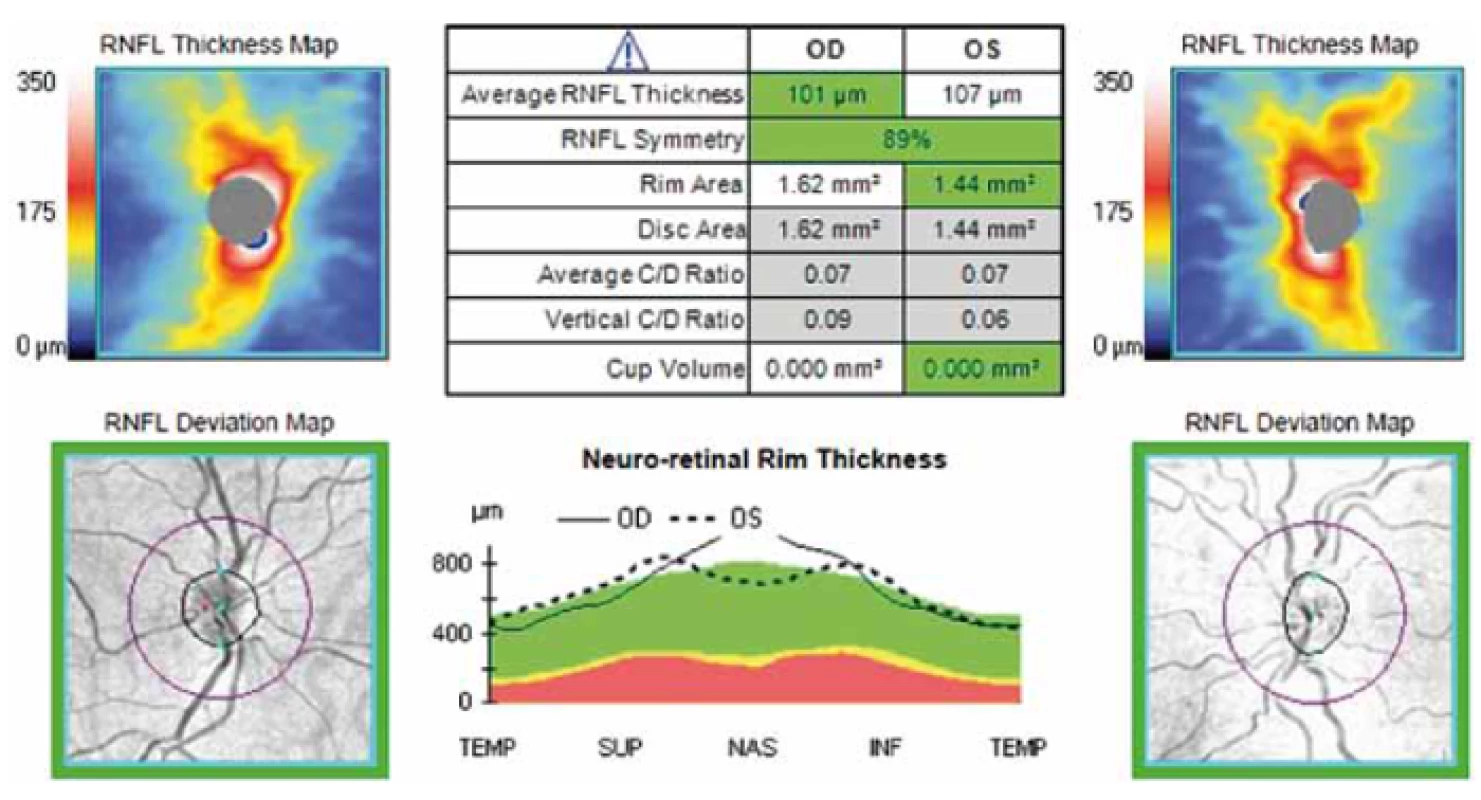
Image 2. Grafické znázornění výsledků měření RNFL v jednotlivých kvadrantech kolem terče zrakového nervu na sítnici. V kruzích na obrázku jsou znázorněny jednotlivé kvadranty (S – horní (v tabulce H), I – dolní (v tabulce D), T – temporální, N – nazální) a číselné hodnoty měření RNFL u jednoho z pacientů. Fig. 2. Graphical representation of measurement results for each quadrant RNFL around the optic nerve in the retina. The circles in the figure show the individual quadrants (S – upper (H in table), I – lower (D in table), T – temporal, N – nasal) and numerical values for RNFL measurement in one of the patients. 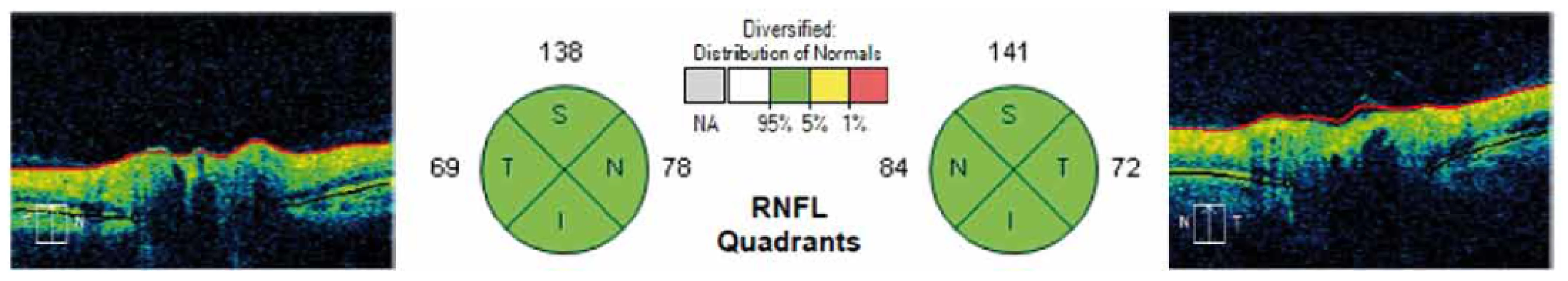
Naměřená data byla hodnocena metodami deskriptivní statistiky. Normalita dat byla ověřena Shapirovým-Wilkovým testem a k porovnání jednotlivých skupin byl použit nepárový t-test, analýza variace (ANOVA) a v případě jiného než normálního rozložení dat ANOVA on Ranks. Všechny testy byly provedeny na 5% hladině významnosti. Ke statistickému zpracování byl použit software SigmaPlot (Systat Software).
Výsledky
Pacienti při vyšetření dobře spolupracovali a rozuměli zadaným pokynům. Vlastní vyšetření na OCT přístroji v závislosti na spolupráci pacienta trvalo jen několik minut a dařilo se provést i u pacientů s demencí při ACH s relativně nízkým MMSE (21 ± 3). Pacienti ho všichni zvládli a během vyšetření po krátké instruktáži zaujali správnou polohu. Tuto polohu s hlavou položenou v opěrce brady na přístroji dobře udrželi během celého procesu skenování. Dobře také fixovali na grafickou značku v přístroji. Dobrá fixace značky je nutná k provedení kvalitních skenů sítnice. Kvalita získaných skenů byla u pacientů s demencí při ACH srovnatelná s kontrolním souborem. Také spolupráce s pacienty byla vzhledem k rychlosti provedení vyšetření velmi dobrá. Vlastní získání skenů na OCT Cirrus trvalo u pacientů s demencí při ACH stejně jako u kontrolního souboru jen několik desítek vteřin. Demonstrovali jsme praktičnost vyšetření u pacientů s demencí s různě pokročilým stadiem, a proto OCT hodnotíme jako pro pacienty nezatěžující a snadno proveditelnou metodu.
Mezi hodnotami tloušťky RNFL studovaných souborů a kontrolním souborem jsme neprokázali statisticky signifikantní rozdíl v žádném peripapilárním kvadrantu sítnice. Výsledky jsou podrobně uvedeny v tab. 1.
Table 1. Naměřené hodnoty tloušťky RNFL v jednotlivých souborech. 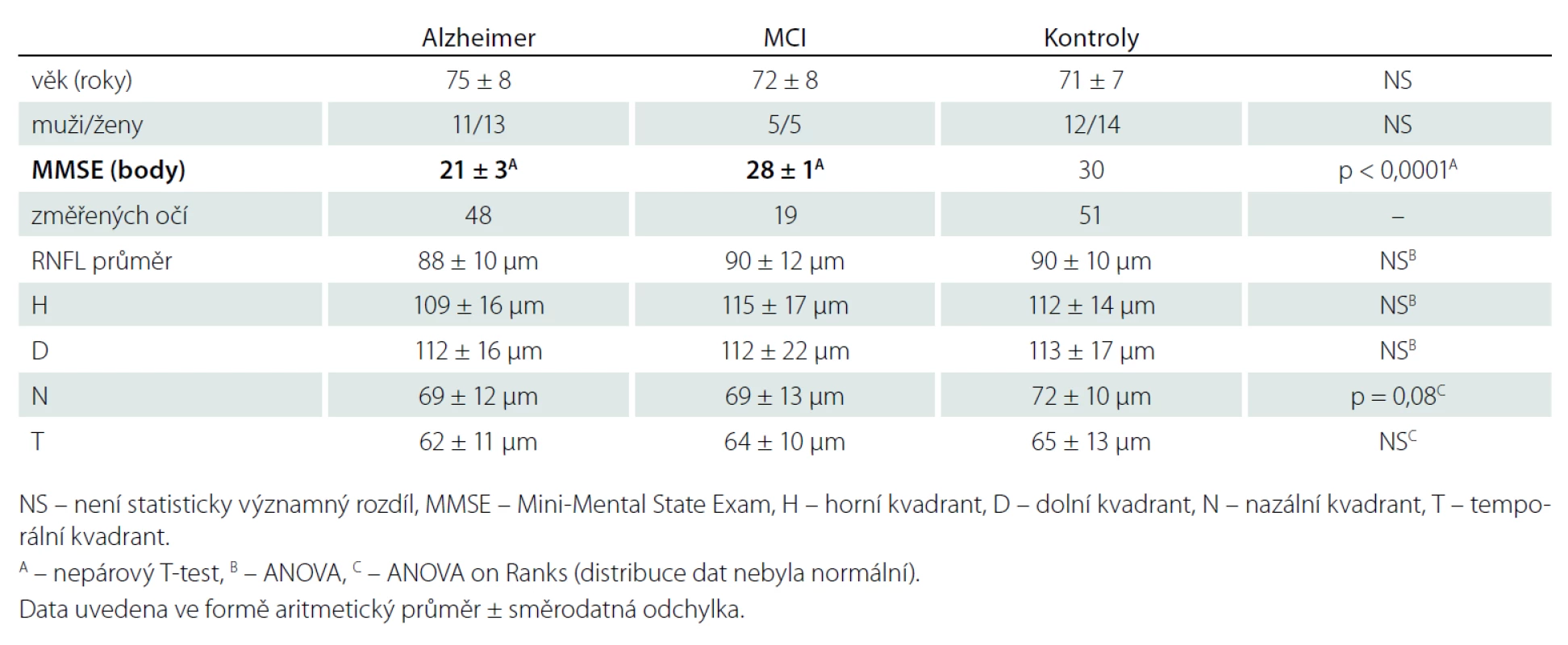
Korelace ztenčení RNFL s věkem byla zjištěna jen u RNFL – H v celém souboru, uvažujeme - li jednotlivé skupiny samostatně, korelace nebyla prokázána (tab. 2). V měřených souborech nebyly zjištěny rozdíly tloušťky RNFL mezi pohlavími (tab. 3).
Table 2. Korelace tloušťky RNFL s věkem (v jednotlivých kvadrantech napříč všemi skupinami). 
Table 3. RNFL dle pohlaví v jednotlivých souborech. 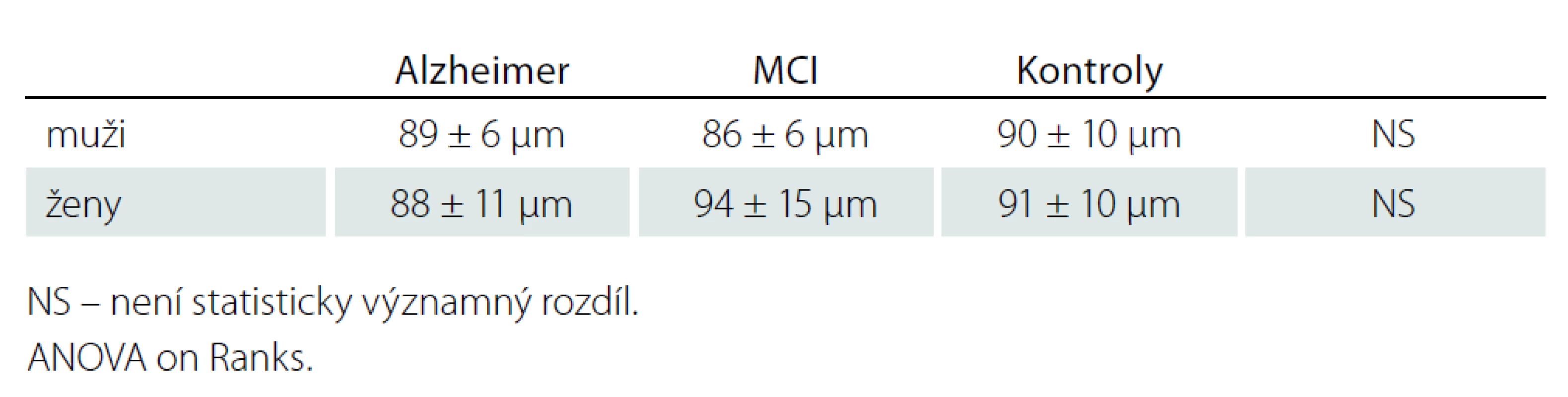
Diskuze
Demonstrovali jsme praktičnost vyšetření u pacientů s různě pokročilým stadiem ACH. Námi naměřené výsledky neprokázaly statisticky signifikantní ztenčení RNFL v žádném peripapilárním kvadrantu sítnice. Naše nálezy jsou tak v souladu se studiemi Gharbiya et al a Kergoata et al [6,7] a zároveň v rozporu se studiemi Gaoa et al, Kirbase et al, Kellera et al, Larisino et al, Berishy et al a Iseriho et al [8 – 13] uvedenými přehledně v tab. 4. Tyto studie se však liší použitou metodikou a definicí souboru. Zásadní rozdíly v uvedených publikacích jsou ve velikosti souborů od 9 do 40, resp. kontrolních souborů od 8 do 40 jedinců. Autoři také použili různé typy vyšetřovacích přístrojů. Mezi OCT použitými ve studiích převládalo dnes již překonané OCT time domainového typu, které pracuje pomaleji a není tak přesné jako spektrální OCT. Kergoat et al používali k měření RNFL laserovou skenovací polarimetrii [7].
Table 4. Výsledky jednotlivých prací, které měřily RNFL u ACH. 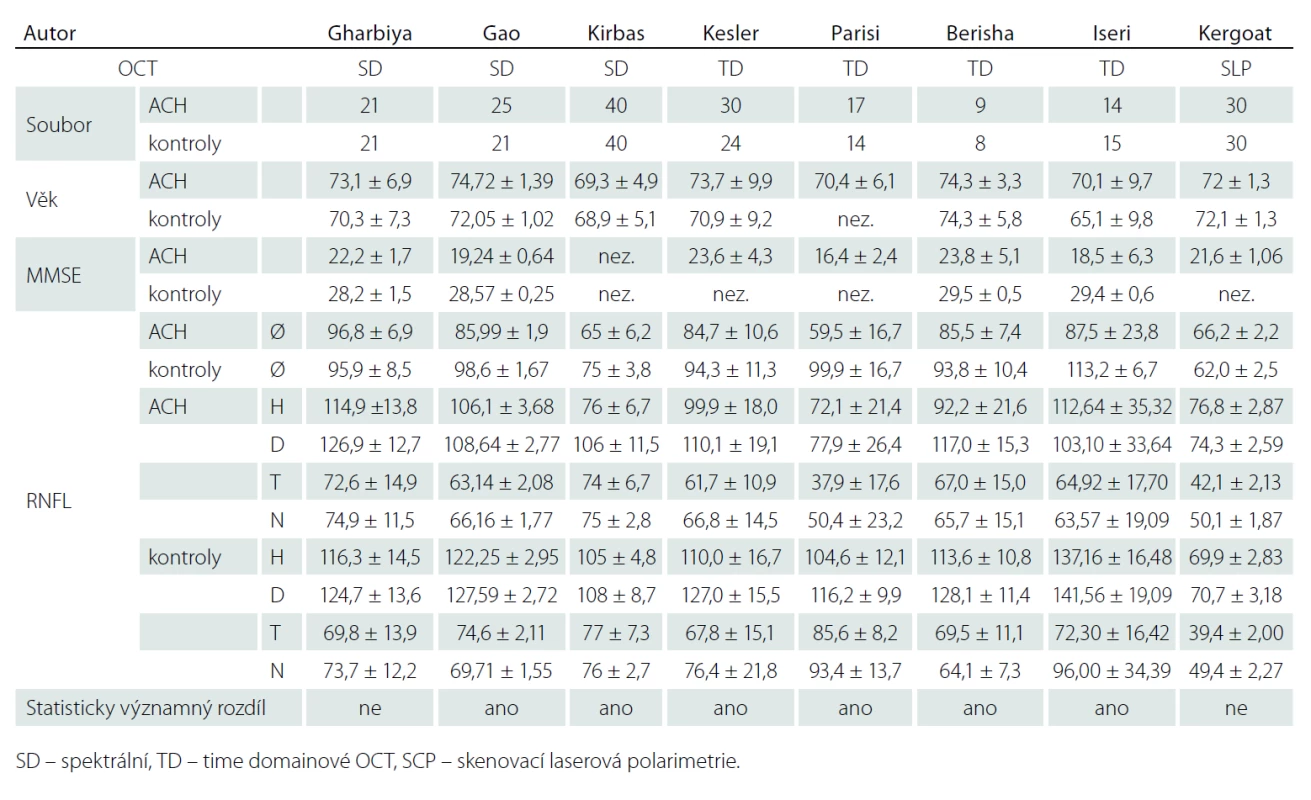
Zásadním faktorem, který je třeba zohlednit v hodnocení výsledků, je možnost výskytu počátečního neodhaleného stadia ACH mezi jedinci kontrolního souboru. Podle nových diagnostických kritérií [1 – 3] je chápána ACH jako kontinuum od preklinického, přes prodromální až po stadium demence. Akumulace beta-amyloidu v mozku a další změny předcházejí rozvoji prvních klinických příznaků až o 10 – 15 let. Je třeba diskutovat o možnosti, že kontrolní soubor pacientů v této, ale i v ostatních citovaných pracích mohl obsahovat pacienty s preklinickou ACH, jejichž sítnice už mohla být postižena. Možnost, že kontrolní soubor obsahoval jak opravdu zdravé, tak i preklinicky postižené, nebo dokonce prodromálním stadiem postižené jedince, by teoreticky vysvětlovala heterogenitu výsledků, jejich absolutní hodnoty a zejména pak i nález v této práci. Heterogenitu výsledků mohla také ovlivnit skutečnost, že u pacientů se syndromem demence nebo MCI nelze vyloučit, že někteří jedinci neměli v mozku alzheimerskou patologii přítomnu, neboť nebyly provedeny metabolické biomarkery.
Sdělení o ztenčení vrstvy RNFL a funkčních poruchách sítnice u pacientů s ACH předchází práce Hintona et al, kteří jako první prokázali u pacientů s ACH v histopatologickém nálezu ztrátu gangliových buněk v sítnici a degeneraci optického nervu [24]. Tyto histologické výsledky nebyly dále potvrzeny ve sdělení Curcia et al [25].
Podnětem k další diskuzi jsou nehomogenní číselné hodnoty výsledků jednotlivých sdělení. V některých pracích je průměrná naměřená hodnota vrstvy nervových vláken u pacientů s ACH vyšší než hodnota tloušťky vrstvy nervových vláken u kontrolního souboru jiné publikace. Rozptyl naměřených hodnot v jednotlivých publikacích je zásadní. Tento fenomén lze jistě částečně vysvětlit nejen nestejnoměrností studovaných souborů s různě vyvinutou ACH (MMSE v rozmezí od 16,4 do 23,8) (tab. 4), ale také použitím různých typů měřicích přístrojů. Absolutní hodnoty naměřené různými modely OCT se mohou značně lišit a nejsou tak mezi jednotlivými pracemi konzistentní [26,27]. Cirrus firmy Carl Zeiss patří společně se Spectralis firmy Heidelberg mezi přístroje, které měří spíše nižší hodnoty oproti vyšším hodnotám měřenými jinými OCT [26,28]. V práci Kirbase jsou průměrné hodnoty tloušťky RNFL nižší než nejnižší naměřená hodnota v jednotlivých kvadrantech. To upozorňuje na možné chyby při zpracování dat.
V Parisiho sdělení je u pacientů s ACH zmiňováno signifikantní snížení RNFL ve všech kvadrantech, což ostatní práce nepotvrdily [11]. V měření Paqueta byl prokázán pokles průměrné tloušťky RNFL peripapilárně proti kontrolnímu souboru. Byl zjištěn statisticky významný rozdíl mezi měřeními u pacientů s MCI a mírnou formou ACH oproti pacientům s pokročilou formou ACH [29]. Kesler et al upozorňují na signifikantní ztenčení RNFL u pacientů s ACH i MCI pouze v dolním kvadrantu, zatímco ztenčení v horním kvadrantu změřil pouze u pacientů s ACH, nikoliv u pacientů s MCI [10]. V jedné z posledních publikovaných prací na toto téma uvádí Kromer et al ztenčení RNFL pouze v horním nazálním peripapilárním sektoru sítnice [30]. Ve sdělení Gharbiya et al, kde byla použita spektrální OCT, nebylo ztenčení RNFL u pacientů s ACH naměřeno v žádném peripapilárním kvadrantu. Kergoat, který používal k měření laserovou skenovací polarimetrii, žádný rozdíl mezi RNFL pacientů s ACH a kontrolním souborem nenaměřil [6]. Je třeba upozornit na značnou nejednotnost výsledků publikací zabývajících se touto problematikou s nutností ověření těchto tezí na větším souboru pacientů. V běžné praxi zatím lze považovat měření RNFL za doplňující vyšetření s možným potenciálem informovat o event. neurodegenerativním onemocnění. OCT se stalo bezpochyby zásadním pomocníkem v práci oftalmologů a neurologů některých subspecializací. Některé morfologické změny na sítnici jsou dnes díky OCT snadno měřitelné in vivo. Měření vrstvy nervových vláken je jednou z možností využití tohoto přístroje u chorob, kde lze s rozvojem choroby očekávat ztenčení této vrstvy. Musíme ale stále myslet na další možné důvody ztenčení vrstvy nervových vláken. Nejde pouze o glaukom, diabetickou retinopatii či věkem podmíněnou makulární degeneraci. Mohou se vyskytnout jiné proběhlé či probíhající choroby sítnice a zrakového nervu, které vrstvu RNFL souběžně ovlivňují. Již byly sledovány soubory pacientů trpící migrénami, Parkinsonovou chorobou nebo schizofrenií [31 – 33]. I u nich byl prokázán úbytek RNFL. Tento fakt je třeba zohlednit. Zásadní je také individualita tloušťky RNFL mezi jednotlivci [34]. Úbytek této vrstvy je pak také spojen s přibývajícím věkem. S narůstajícím věkem není úbytek RNFL konstantní [28]. Dále je třeba si uvědomit, že výsledky jednotlivých prací jsou výstupy z několika typů OCT od různých výrobců. Liší se nejenom typy, ale i generace použitých přístrojů a srovnatelnost výsledků je proto velmi omezená. Doposud neexistují jednotné standardy absolutních hodnot pro měření struktur sítnice pomocí OCT. Některé hodnoty vznikají uměle na základě empirických představ, jako např. stanovení průměrné hodnoty tloušťky vrstvy nervových vláken u atrofie terče zrakového nervu, která byla v publikaci Pula et al stanovena na 75 mikrometrů [35]. Ohledně absolutních čísel při stanovení tloušťky a objemu jednotlivých struktur sítnice musíme také uvést, že měříme-li jednotlivé struktury pomocí dalších přístrojů, které mají podobnou funkci, ale měří je na jiném principu, můžeme dosáhnout značně odlišných číselných hodnot. Mezi takové přístroje se řadí skenovací laserová polarimetrie (SLP) [36].
Závěr
V naší práci jsme prokázali, že OCT je vzhledem k nenáročnosti vyšetření a minimální zátěži pro pacienta praktickou diagnostickou metodou. U pacientů s ACH a MCI jsme nepotvrdili statisticky signifikantně ztenčenou tloušťku RNFL v žádném kvadrantu sítnice kolem terče zrakového nervu. I přes nejednotné výsledky měření peripapilární RNFL ve výše citovaných pracích jsme přesvědčeni o tom, že sítnice je zásadním a slibným místem pro další výzkum neurodegenerativních chorob. Rozdíl nebyl zjištěn, avšak přístupnost a dobrá proveditelnost vyšetření sítnice přináší možnost vyšetřovat v blízké budoucnosti pomocí lepších přístrojů, na lépe definovaných populacích pacientů. Konkrétní výsledky naší práce za námi popsaných podmínek však vhodnost vyšetření v rutinní klinické praxi neprokázaly.
Přínosem v dalším poznání bude také sledování jiných lokalit sítnice k ověření souvislostí očního nálezu s onemocněním mozku. Je třeba realizovat další jak průřezové, tak longitudinální studie s použitím OCT, které by se zaměřily zejména na limity a podrobné definování použitých pacientských souborů.
Přijato k recenzi: 9. 11. 2015
Přijato do tisku: 28. 1. 2016
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
as. MUDr. Zdeněk Kasl
Oční klinika
LF UK a FN Plzeň
alej Svobody 80
323 00 Plzeň
e-mail: zdenekkasl@volny.cz
Sources
1. McKhann GM, Knopman DS, Cherkow H, et al. The diagnosis of dementia due to Alzheimer‘s disease: recommendations from the National Institute on Aging-Alzheimer‘s Association workgroups on diagnostic guidelines for Alzheimer‘s disease. Alzheimers Dement 2011;7(3):263 – 9. doi: 10.1016/ j.jalz.2011.03. 005.
2. Albert MS. Changes in cognition. Neurobiol Aging 2011;32(Suppl 1):58 – 63. doi: 10.1016/ j.neurobiolaging. 2011.09.010.
3. Sperling RA, Aisen PS, Beckett LA, et al. Toward defining the preclinical stages of Alzheimer‘s disease: recommendations from the National Institute on Aging-Alzheimer‘s Association workgroups on diagnostic guidelines for Alzheimer‘s disease. Alzheimers Dement 2011;7(3):280 – 92. doi: 10.1016/ j.jalz.2011.03. 003.
4. Blanks JC, Torigoe Y, Hinton DR, et al. Retinal pathology in Alzheimer‘s disease. I. Ganglion cell loss in foveal/ parafoveal retina. Neurobiol Aging 1996;17(3):377 – 84.
5. Guo L, Duggan J, Cordeiro MF. Alzheimer‘s disease and retinal neurodegeneration. Curr Alzheimer Res 2010;7(1):3 – 14.
6. Gharbiya M, Trebbastoni A, Parisi F, et al. Choroidal thinning as a new finding in Alzheimer‘s disease: evidence from enhanced depth imaging spectral domain optical coherence tomography. Alzheimers Dis 2014;40(4):907 – 17. doi: 10.3233/ JAD-132039.
7. Kergoat H, Kergoat MJ, Justino L, et al. An evaluation of the retinal nerve fiber layer thickness by scanning laser polarimetry in individuals with dementia of the Alzheimer type. Acta Ophthalmol Scand 2001;79(2): 187 – 91.
8. Gao L, Liu Y, Li X, et al. Abnormal retinal nerve fiber layer thickness and macula lutea in patients with mild cognitive impairment and Alzheimer‘s disease. Arch Gerontol Geriatr 2015;60(1):162 – 7. doi: 10.1016/ j.archger. 2014.10.011.
9. Kirbas S, Turkyilmaz K, Anlar O, et al. Retinal nerve fiber layer thickness in patients with Alzheimer disease. J Neuroophthalmol 2013;33(1):58 – 61. doi: 10.1097/ WNO.0b013e318267fd5f.
10. Kesler A, Vakhapova V, Korczyn AD, et al. Retinal thickness in patients with mild cognitive impairment and Alzheimer‘s disease. Clin Neurol Neurosurg 2011;113(7):523 – 6. doi: 10.1016/ j.clineuro.2011.02.014.
11. Parisi V, Restuccia R, Fattapposta F, et al. Morphological and functional retinal impairment in Alzheimer‘s disease patients. Clin Neurophysiol 2001;112(10):1860 – 7.
12. Berisha F, Feke GT, Trempe CL, et al. Retinal abnormalities in early Alzheimer‘s disease. Invest Ophthalmol Vis Sci 2007;48(5):2285 – 9.
13. Iseri PK, Altinaş O, Tokay T, et al. Relationship between cognitive impairment and retinal morphological and visual functional abnormalities in Alzheimer disease. J Neuroophthalmol 2006;26(1):18 – 24.
14. Fernandes DB, Raza AS, Noqueira RG, et al. Evaluation of inner retinal layers in patients with multiple sclerosis or neuromyelitis optica using optical coherence tomography.Ophtalmology 2013;120(2):387 – 94. doi: 10.1016/j. ophtha.2012.07.066.
15. Oberwarenbrock S, Schipling S, Ringelstein M, et al. Retinal damage in multiple sclerosis disease subtypes measured by high resolution optical coherence tomography. Mult Scler Int 2012;2012 : 530305. doi: 10.1155/ 2012/ 530305.
16. Yanni SE, Wang J, Cheng CHS, et al. Normative reference ranges for the retinal nerve fiber layer, macula and retinal layer thickness in children. Am J Ophthalmol 2013;155(2):354 – 60. doi: 10.1016/ j.ajo.2012.08.010.
17. Výborný P, Fučík M, Rozsíval P. Glaukom. In: Kuchynka P et al. Oční lékařství. Praha: Grada Publishing 2007 : 555 – 607.
18. Kousal B. Fyzikální podstata OCT vyšetření. In: Němec P, Lofflerová V, Kousal B, eds. Optická koherenční tomografie. Klinický atlas sítnicových patologií. Praha: Mladá fronta 2015 : 13 – 6.
19. Schuman JS. Spectral domain optical coherence tomography for glaucoma (an AOS thesis). Trans Am Ophthalmol Soc 2008;106 : 426 – 58.
20. Petersen RC. Mild cognitive impairment as a diagnostic entity. J Intern Med 2004;256(3):183 – 94.
21. McKhann G, Drachman D, Folstein M, et al. Clinical diagnosis
of Alzheimer‘s disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer‘ s Disease. Neurology 1984;34(7):939 – 44.
22. Winblad B, Palmer K, Kivipelto M, et al. Mild cognitive impairment – beyond controversies towards a consensus: report of the International Working Group on Mild Cognitive Impairment. J Intern Med 2004;256(3): 240 – 6.
23. Hort J, Glosova L, Vyhnalek M, et al. Tau protein a beta amyloid v likvoru u Alzheimerovy choroby. Cesk Slov Neurol N 2007;70/ 103(1):30 – 6.
24. Hinton DR, Sadun AA, Blanks JC, et al. Optic-nerve degeneration in Alzheimer‘s disease. N Engl J Med 1986;315(8):485 – 7.
25. Curcio CA, Drucker DN. Retinal ganglion cells in Alzheimer‘s disease and aging. Ann Neurol 1993;33(3):248 – 57.
26. Pakravan M, Pakbin M, Aghazadehamiri M, et al. Peripapillary retinal nerve fiber layer thickness measurement by 2 different spectral domain optical coherence tomography machines. Eur J Ophthalmol 2013;23(3):289 – 95. doi: 10.5301/ ejo.5000167.
27. Pierro L, Gagliardi M, Iuliano L, et al. Retinal nerve fiber layer thickness reproducibility using seven different OCT instruments. Invest Ophthalmol Vis Sci 2012;53(9):5912 – 20. doi: 10.1167/ iovs.11-8644.
28. Kierman DF, Hariprasad SM. Normative Databases in SD-OCT: a status report a comprehensive look at the evolution of OCT software design and database development. [online]. Available from URL: http://www.retinalphysician.com/ articleviewer.aspx?articleID=104438.
29. Paquet C, Boissonnot M, Roger F, et al. Abnormal retinal thickness in patients with mild cognitive impairment and Alzheimer‘s disease. Neurosci Lett 2007;420(2):97 – 9.
30. Kromer R, Serbecic N, Hausner L, et al. Detection of retinal nerve fiber layer defects in Alzheimer‘s disease using SD-OCT. Front Psychiatry 2014;5 : 22. doi: 10.3389/ fpsyt.2014.00022.
31. Kirbas S, Tufekci A, Turkyilmaz K, et al. Evaluation of the retinal changes in patients with chronic migraine. Acta Neurol Belg 2013;113(2):167 – 72. doi: 10.1007/ s13760-012-0150-x.
32. Bodis-Wollner I. Foveal vision is impaired in Parkinson‘ s disease. Parkinsonism Relat Disord 2013;19(1):1 – 14. doi: 10.1016/ j.parkreldis.2012.07.012.
33. Chu EM, Kolappan M, Barnes TR, et al. A window into the brain: an in vivo study of the retina in schizophrenia using optical coherence tomography. Psychiatry Res 2012;203(1):89 – 94. doi: 10.1016/ j.pscychresns.2011.08.011.
34. Hong SW, Ahn MD, Kang SH, et al. Analysis of peripapillary retinal nerve fiber distribution in normal young adults. Invest Ophthalmol Vis Sci 2010;51(7):3515 – 23. doi: 10.1167/ iovs.09-4888.
35. Pula JH, Kattah JC, Wang H, et al. Ability of a neuro-ophthalmologist to estimate retinal nerve fiber layer thickness. Clin Ophthalmol 2012;6 : 1477 – 81. doi: 10.2147/ OPTH.S34573.
36. Schallenberg M, Dekowski D, Kremmer S, et al. Comparison of Spectralis-OCT, GDxVCC and GDxECC in assessing retinal nerve fiber layer (RNFL) in glaucomatous patients. Graefes Arch Clin Exp Ophthalmol 2013;251(5):1343 – 53. doi: 10.1007/ s00417-012-2219-x.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2016 Issue 4-
All articles in this issue
- Epileptochirurgická léčba zlepšuje kvalitu života – výsledky dotazníkové studie
- Morfologické zmeny nervus medianus u pacientov s novodiagnostikovanou, neliečenou, autoimunitne podmienenou hypotyreózou
- Principy operací páteřních sutkovitých nádorů nervové pochvy
- Tubulopapilární adenom žlučníku – náhodný nález u tříletého chlapce s později diagnostikovanou metachromatickou leukodystrofií – kazuistika
- Měření vrstvy nervových vláken sítnice u pacientů s Alzheimerovou chorobou
- Neurorehabilitace senzomotorických funkcí po poranění míchy
- Genetické a epigenetické faktory podmiňující vznik a prognózu mozkových gliomů – souhrn současných poznatků
- Tři časy Testu kreslení hodin hodnocené BaJa skórováním u časné Alzheimerovy nemoci
- Kresba jízdního kola – validizační studie pro syndrom demence
- Přední ischemická optická neuropatie a okluze větve retinální tepny po transkatétrové okluzi foramen ovale – kazuistika
-
Introduction to the Conference
Different Approaches in Neurorehabilitation and their Impact on Clinical Improvements of Neurological Patients
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Neurorehabilitace senzomotorických funkcí po poranění míchy
- Tři časy Testu kreslení hodin hodnocené BaJa skórováním u časné Alzheimerovy nemoci
- Genetické a epigenetické faktory podmiňující vznik a prognózu mozkových gliomů – souhrn současných poznatků
- Měření vrstvy nervových vláken sítnice u pacientů s Alzheimerovou chorobou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

