-
Medical journals
- Career
Morfologické zmeny nervus medianus u pacientov s novodiagnostikovanou, neliečenou, autoimunitne podmienenou hypotyreózou
Authors: D. Holováčová; M. Kužma; Z. Killinger; J. Payer
Authors‘ workplace: V. interná klinika LF UK a UN Bratislava
Published in: Cesk Slov Neurol N 2016; 79/112(4): 440-444
Category: Short Communication
doi: https://doi.org/10.14735/amcsnn2016440Overview
Cieľ:
Monitorovanie ultrasonograficky hodnotiteľných zmien nervus medianus v úrovni priečneho rezu karpálneho tunela u pacientov s hypotyreózou.Materiál a metódy:
Prierezová kontrolovaná štúdia, v ktorej sme u pacientov s novodiagnostikovanou primárnou hypotyreózou vyšetrili plochu priečneho rezu nervus medianus v mieste jeho vstupu do karpálneho tunela (Cross Sectional Area; CSA). Hodnoty sme porovnali s kontrolnou skupinou zdravých jedincov. Rozdiel bol štatisticky vyhodnotený nepárovým t-testom.Výsledky:
Zaradených bolo 44 pacientov (ø vek 52,8 rokov, 14 mužov/30 žien, ø BMI 24,542 kg/m2, ø TSH (tyreotropín) 22,815 mIU/l, fT4 11,756 pmol/l). Kontrolná skupina pozostávala zo 44 jedincov (ø vek 52,57 rokov, 14 mužov/30 žien, ø BMI 24,52 kg/m2, ø TSH 2,31 mIU/l, ø fT4 16,397 pmol/l). CSA bolo signifikantne väčšie u pacientov (ø 0,098 cm2) v porovnaní s kontrolami (ø 0,072 cm2, p < 0,001). U dvoch pacientov bolo zvýšenie hodnoty CSA (> 0,11 cm2) sprevádzané symptomatológiou syndrómu karpálneho tunela.Záver:
Ultrasonografické nálezy u pacientov s primárnou hypotyreózou dokumentovali prítomnosť subklinického a klinického syndrómu karpálneho tunela. Ak je potvrdená prítomnosť syndrómu karpálneho tunela, je vhodné vyšetriť hladiny tyreoidálnych hormónov na vylúčenie možnej hypotyreózy. Meranie priečneho prierezu n. medianus pomocou ultrazvuku s vysokým rozlíšením by mohlo byť považované za alternatívnu modalitu pre včasný záchyt tejto neuropatie u pacientov s hypotyreózou.Kľúčové slová:
syndróm karpálneho tunela – hypotyreóza – ultrazvukÚvod
Tyreoidálne hormóny sú zapojené do mnohých funkcií centrálneho i periférneho nervového systému dôsledkom čoho môžu byť rôzne neurologické symptómy [1]. Chronická autoimunitná tyreoiditída (AIT), nazývaná tiež Hashimotova tyreoiditída, je po ústupe endemickej strumy najčastejšou tyreopatiou a najčastejším zápalom štítnej žľazy nielen u nás, ale aj v ostatných krajinách s normalizovaným príjmom jódu. Diagnózu primárnej hypotyreózy potvrdzuje zvýšenie sérovej hladiny hypofyzárneho tyreostimulačného hormónu (TSH) a zníženie sérovej hladiny voľného tyroxínu (fT4), ktorá začína klesať neskôr v porovnaní so vzostupom TSH [2]. U pacientov s hypotyreózou možno pozorovať dve hlavné formy dysfunkcie periférneho nervového systému. Najčastejšou formou mononeuropatie je syndróm karpálneho tunela (SKT), menej častý je výskyt senzitívnej a motorickej axonálnej polyneuropatie [3]. SKT je najznámejší a najrozšírenejší úžinový syndróm, ktorý je charakterizovaný stlačením n. medianus v oblasti karpálneho tunela. Klinický obraz SKT je dostatočne známy a pozostáva z rôznych kombinácií pozitívnych a negatívnych motorických, senzitívnych a autonómnych príznakov podmienených léziou n. medianus v karpálnom tuneli [4]. Prevalencia SKT u pacientov s hypotyreózou sa odhaduje na 23–43,7 % [3,5–11].
Patogenéza vzniku neuropatie u pacientov s hypotyreózou nie je úplne objasnená. Na mechanizme vzniku neuropatie pri hypotyreóze sa môže podieľať infiltrácia mukopolysacharidov alebo mucinóznych depozitov do peri - a epineuria s kompresiou nervu. Ďalším mechanizmom, ktorý vedie k poruche vedenia vzruchu, sú zmeny na úrovni plazmatických membrán neurónov v dôsledku zníženia hladín hormónov štítnej žľazy. Pri hypotyreóze dochádza aj k zmenám rovnováhy tekutín a periférnemu opuchu tkaniva, čo môže viesť k rozvoju SKT [1]. Zmeny sú reverzibilné a po začatí substitučnej terapie dochádza k zreteľnému ústupu neuropatických symptómov [1,9,10,12].
Cieľom tejto štúdie bolo pomocou ultrazvuku s vysokým rozlíšením zaznamenať hodnoty plochy n. medianus v priečnom reze (Cross Sectional Area; CSA) u pacientov s novodiagnostikovanou, neliečenou, primárnou hypotyreózou a výsledky porovnať so zdravými probandmi. Korelovať hladiny tyreoidálnych hormónov (TSH, fT4) a autoprotilátok proti tkanivu štítnej žľazy s ultrasonografickým nálezom. Porovnať ultrasonografické zmeny v oblasti n. medianus s klinickými prejavmi.
Súbor pacientov a metodika
Súbor tvorilo 44 pacientov s novodiagnostikovanou, neliečenou, autoimunitne podmienenou hypotyreózou (tab. 1), ktorí boli porovnávaní so 44 zdravými probandmi. Pacienti boli vyšetrení a následne sledovaní na endokrinologickej ambulancii V. internej kliniky Lekárskej fakulty UK a UN Bratislava.
Table 1. Základné charakteristiky štúdijnej skupiny s novodiagnostikovanou, neliečenou autoimunitne podmienenou hypotyreózou. 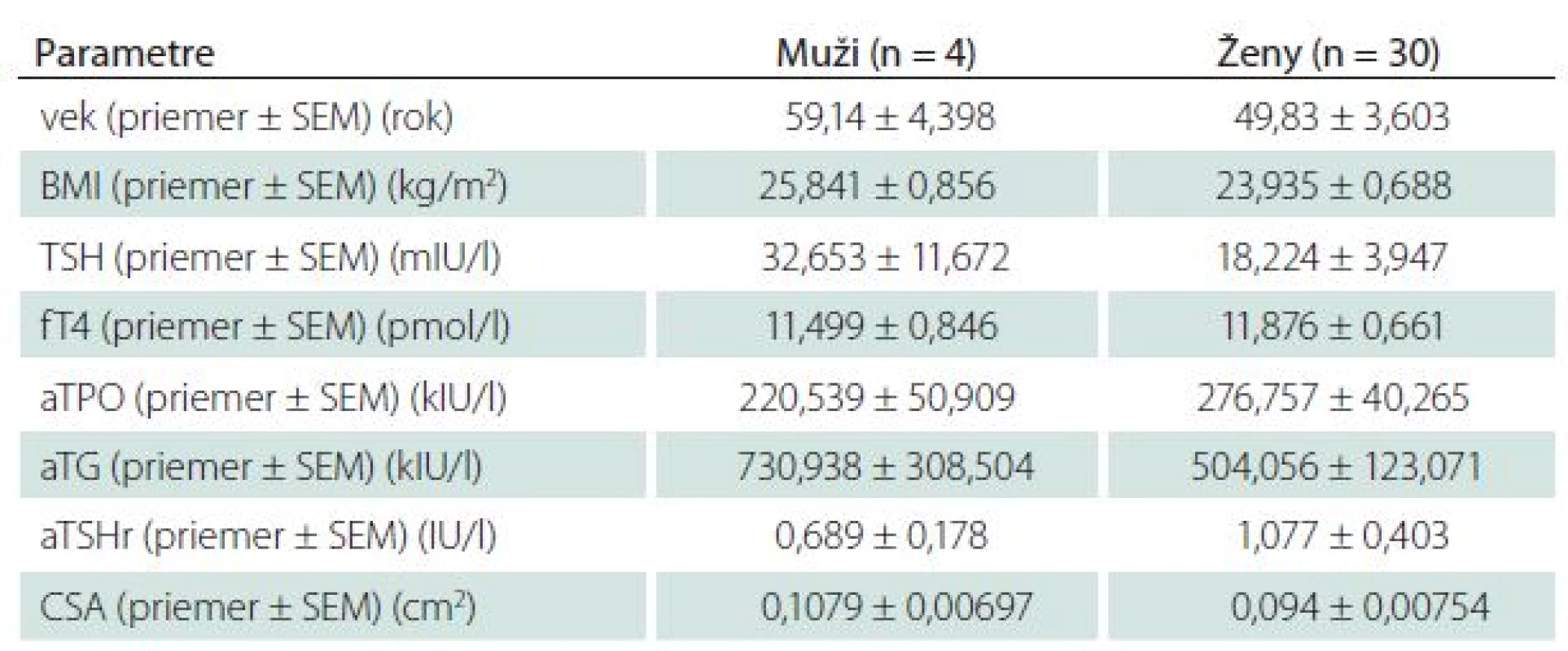
Kritéria pre zaradenie do štúdie boli:
- Novodiagnostikovaná, neliečená, autoimunitne podmienená hypotyreóza definovaná sérovými hladinami fT4 < 11,5 pmol/l a TSH > 4,78 mIU/l, aTG > 60 kIU/l a/ alebo aTPO > 60 kIU/l, aTSHr > 1,75 IU/l.
- Pacienti s pridruženými ochoreniami, ktoré by mohli byť príčinou inej neuropatie (metabolické ochorenia, iné endokrinopatie, paraneoplastické, zápalové, systémové ochorenia, ochorenia pečene a obličiek), ako i gravidné ženy, ženy užívajúce hormonálnu antikoncepciu a obézni (Body Mass Index; BMI nad 30 kg/m2) boli zo súboru vylúčení.
- Posúdením pracovnej anamnézy sme eliminovali podiel funkčného zaťaženia na zmenách n. medianus v oblasti karpálneho tunela.
Hodnotili sme subjektívne príznaky udávané pacientmi (nočné parestézie, denné kľudové a námahové (ponámahové) parestézie, bolesti zápästia, dlane a prstov, stuhnutosť prstov, zníženie obratnosti prstov), atrofiu tenaru, provokačné manévre (Tinelov test, Phalenov flekčný test). Zaznamenaná bola doba trvania subjektívnych príznakov odhadnutá v mesiacoch pred diagnostikou hypotyreózy. Sledovali sme základné antropometrické parametre – hmotnosť, výšku, BMI. Výsledky sme porovnali s kontrolnou skupinou zdravých probandov na základe pohlavia, veku a BMI. Pri vstupnom vyšetrení sme realizovali laboratórne vyšetrenia, vrátane sérových koncentrácii kreatinínu, elektrolytov, kreatínkinázy, kyseliny listovej a vitaminu B12, ktoré boli v medziach normy. Všetci pacienti a zdraví probandi podstúpili ultrasonografické vyšetrenie za účelom merania CSA n. medianus pri vstupe do karpálneho tunela.
Autori vyhlasujú, že štúdia na ľudských subjektoch popísaná v manuskripte bola vykonaná v súlade s etickými štandardmi príslušnej komisie (inštitucionálnej a národnej) zodpovednej za vykonávanie klinických štúdií a Helsinskou deklaráciou z roku 1975, revidovanou v roku 2000.
Laboratórne parametre
Funkcia štítnej žľazy bola hodnotená meraním koncentrácií: hormón stimulujúci štítnu žľazu (TSH, ADVIA Centaur a ADVIA Centaur XP; Tarrytown, NY, v pevnej fáze, monoklonálna protilátka značená pomocou chemoimunoluminiscencie (CLIA) s variáciou medzi testami variability CV 3 – 55 % CV 5 – 51 %), voľný tyroxín (fT4, ADVIA Centaur a ADVIA Centaur XP, Tarrytown, NY, v pevnej fáze, polyklonálna protilátka značená pomocou CLIA s variáciou medzi testami variability CV 3,44–4,16 %), protilátka proti tyreoidálnej peroxidáze (aTPO, Elecsys a cobas e analyzátor, Bazilej; Švajčiarsko, pomocou elektrochemiluminiscencie (ECLIA), s variáciou medzi testami variability CV 5,6–8,9 %) a protilátka proti tyreoglobulínu (aTG, Elecsys a cobas e analyzátor, Bazilej; Švajčiarsko, pomocou ECLIA s variáciou medzi testami variability CV vo výške 5,8–6,0 %).
Štatistické metódy
Štatistická analýza bola vykonaná pomocou štatistického softvéru IBM SPSS Statistics 19. Kategoriálne dáta sú vyjadrené ako priemer ± smerodajná odchýlka priemeru (SDs). Štatistická významnosť rozdielov medzi skupinami bola testovaná pomocou nepároveho t-testu. Na vyhodnotenie korelácie medzi TSH, fT4, autoprotilátkami proti tkanivu štítnej žľazy a CSA n. medianus sme využili Pearsonov korelačný koeficient.
Ultrasonografia
Všetci pacienti a kontroly podstúpili ultrasonografické vyšetrenie karpálneho tunela pomocou ultrazvuku GE Logiq-e s lineárnou sondou o frekvencii 12 MHz. Merania boli uskutočnené jedným pracovníkom. Vyšetrovaná bola nedominantná končatina pacienta. Pacienti počas vyšetrenia sedeli oproti vyšetrujúcemu s predlaktím položeným na podložke a dlaňou smerujúcou nahor v neutrálnej polohe. N. medianus sme vyšetrili v transverzálnej rovine v mieste vstupu do karpálneho tunela, ktorý je definovaný proximálne okrajom flexor retinaculum, a medzi tuberculum os scaphoideum a os pisiforme. V pozdĺžnom smere sme si potvrdili správne určenie n. medianus. N. medianus bol pozorovaný ako oválna alebo elipsoidná, hypoechogénne retikulárna oblasť s hyperechogenním okrajom. Plochu n. medianus v priečnom reze sme merali priamou metódou za použitia tzv. metódy trasovania. Každé meranie bolo vykonané trikrát, pričom výsledná hodnota bola spriemerovaná.
Provokačné manévre
Poklepom neurologického kladivka na ligamentum carpi transversum v mieste nad karpálnym tunelom sme u pacientov realizovali Tinelov test. Test je pozitívny, ak vyvolá parestézie alebo bolesť vyžarujúcu distálne pozdĺž priebehu nervu. Pri Phalenovom manévri pacienti vykonali palmárnu flexiu v zápästí obidvoch rúk po dobu 30 – 60 s. Test sa považuje za pozitívny, ak sa v priebehu 60 s takéhoto držania rúk objaví parestézia alebo necitlivosť na I.–III. prste.
Výsledky
V skupine pacientov bolo 30 žien (68,2 %) a 14 mužov (31,8 %) s novodiagnostikovanou, neliečenou, autoimunitne podmienenou hypotyreózou. Priemerné hodnoty TSH boli 22,815 ± 4,617 mIU/l a fT4 11,756 ± 0,519 pmol/l. Kontrolná skupina pozostávala zo 44 zdravých jedincov, priemerné hodnoty TSH boli 2,313 ± 0,153 mIU/ l a fT4 16,397 ± 0,359 pmol/l. Táto skupina zahŕňala 30 žien a 14 mužov. Priemerný vek pacientov bol 52,8 ± 2,875 rokov a kontroly bol 52,57 ± 2,873 rokov. Štatisticky významný rozdiel medzi skupinami, pokiaľ ide o antropometrické parametre, vek a pohlavie sme nezaznamenali. Muži v porovnaní so ženami boli starší v priemere o 10 rokov a mali vyššie hodnoty BMI 25,84 ± 0,856 kg/m2 ako ženy BMI 23,93 ± 0,688 kg/m2. Rozdiel medzi pohlaviami nebol štatisticky významný. Hodnoty CSA n. medianus u pacientov s novodiagnostikovanou, neliečenou, autoimunitne podmienenou hypotyreózou (0,098 ± 0,00564 cm2) vykazovali významný rozdiel v porovnaní s kontrolnou skupinou (0,072 ± 0,00168 cm2) (p < 0,001) (tab. 2, graf 1). Štatisticky významnú pozitívnu koreláciu medzi sérovými hodnotami TSH, autoprotilátkami proti tkanivu štítnej žľazy a CSA n. medianus sme nezaznamenali. Nepreukázali sme signifikantnú negatívnu koreláciu medzi CSA n. medianus a fT4, hoci trend negatívnej závislosti medzi sledovanými parametrami bol prítomný (tab. 3). Celková svalová slabosť a únava boli zaznamenané u 37 % pacientov, tieto obtiaže boli najčastejším dôvodom pre konzultáciu u endokrinológa (graf 2). Distálne parestézie (nočné alebo denné pokojové/ námahové parestézie), bolesti zápästia, stuhnutosť prstov udávali štyria pacienti (9 %), pričom dvaja z nich mali hodnoty CSA n. medianus vyššie ako 0,1 cm2. Dĺžka trvania príznakov bola v priemere 4,5 mesiaca pred diagnostikou primárnej hypotyreózy. Provokačné manévre (Tinelov príznak a Phalenov manéver) boli u všetkých pacientov negatívne. Ostatné príznaky typické pre SKT ako pocit slabosti v rukách, stratu citlivosti, stratu schopnosti udržať menšie predmety sme u pacientov nezaznamenali. V kontrolnej skupine neboli zaznamenané žiadne obtiaže.
Table 2. Porovnanie štúdijnej skupiny pacientov s novodiagnostikovanou neliečenou hypotyreózou a kontroly pomocou nepárového t-testu. 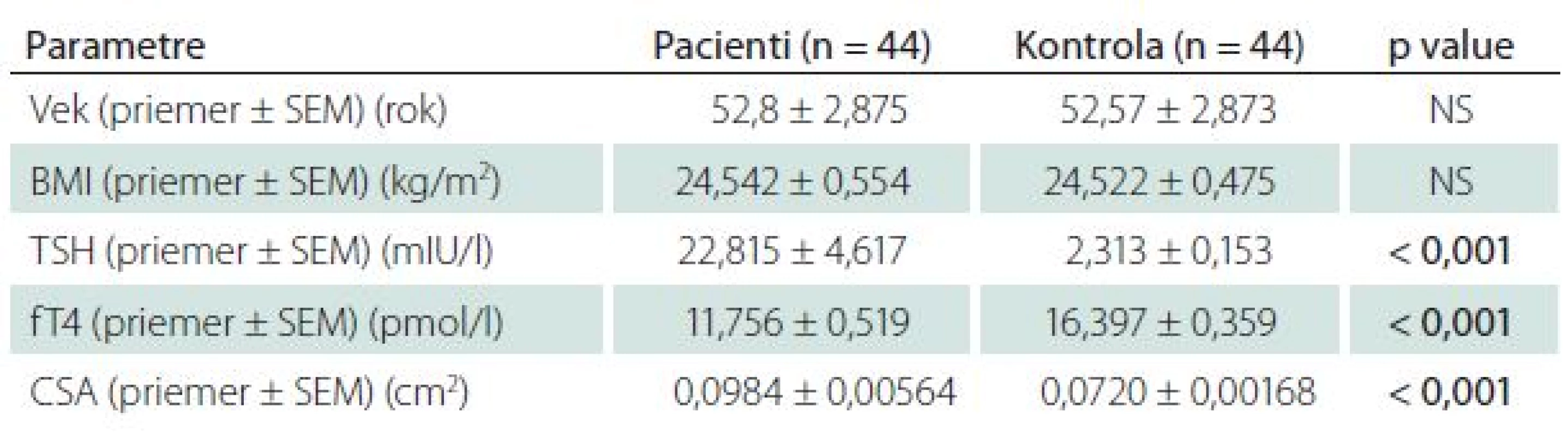
Table 3. Korelačná analýza vzťahu medzi aktivitou TSH, fT4, antityreoidálnych protilátok a hodnotou CSA n. medianus. 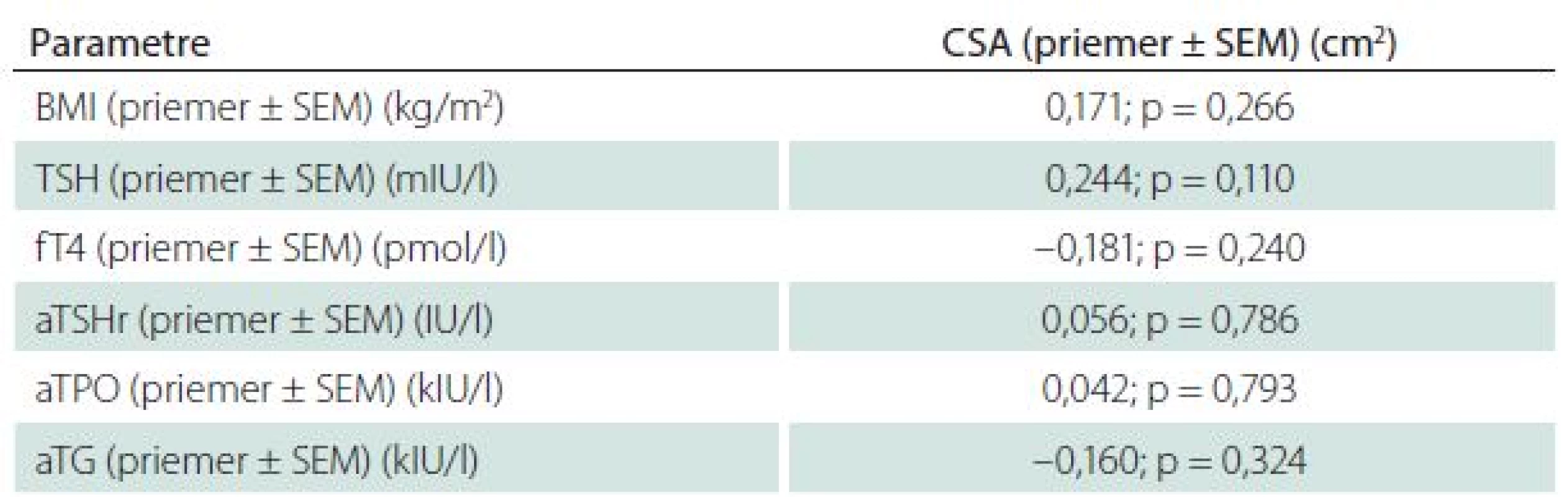
Graph 1. Porovnanie CSA n. medianus medzi pacientmi s novodiagnostikovanou, neliečenou, autoimunitne podmienenou hypotyreózou a kontrolnou skupinou. 
Graph 2. Výskyt klinických prejavov u pacientov s novodiagnostikovanou, autoimunitne podmienenou hypotyreózou. 
Diskusia
Poruchy funkcie štítnej žľazy ovplyvňujú funkciu i štruktúru viacerých orgánov v ľudskom tele [13]. Neuropatie zriedka predstavujú samostatné nozologické jednotky. Zväčša sprevádzajú ochorenia iných orgánov a orgánových systémov [14]. Hypotyreóza je zvyčajne dôležitým rizikovým faktorom periférnej, kompresívnej neuropatie [15]. Patogenéza vzniku SKT nie je celkom objasnená. Na mechanizme vzniku tejto neuropatie u hypotyreózy sa môže podieľať infiltrácia mukopolysacharidov alebo mucinóznych depozitov do peri - a epineuria v kombinácii s hypotyreózou indukovanou demyelinizáciou. Predošlé výskumy preukázali, že mucinózne depozity v periférnych nervoch by mohli mechanicky narušiť metabolickú výmenu živín a katabolických produktov z neurónu a do neho, následkom čoho je kompresívna neuropatia. Niektoré štúdie zistili morfologický dôkaz primárnej axonálnej degenerácie. Ten by mohol byť vysvetlený prítomným deficitom energie pri hypotyreóze, čo vedie k zníženiu oxidácie a k zníženej degradácii depozitov glykogénu. Hypotyreóza spôsobuje spomalenie metabolizmu, čo vedie k poruchám rovnováhy tekutín a následne opuchom tkanív, ktoré môžu vyvíjať tlak na periférne nervy. Hormonálne a metabolické zmeny u hypotyreózy sú zodpovedné za včasné neurologické zmeny, ktoré sa môžu objaviť pred diagnostikou ochorenia štítnej žľazy [1,11,12,16].
Viaceré štúdie dospeli k záveru, že funkčné vyšetrenie štítnej žľazy je u pacientov so SKT potrebné, i keď vzťah medzi ochoreniami nebol preukázaný [17]. Britská spoločnosť chirurgie ruky (The British society for surgery of the hand) radí skríningové vyšetrenie hypotyreózy a diabetes mellitus u pacientov so SKT pred navrhovaným operačným riešením. V retrospektívnej štúdii Vashishtha et al zistili u troch zo 63 pacientov so SKT výskyt novodiagnostikovanej primárnej hypotyreózy [18]. Neuropatia môže byť prvým a hlavným nálezom najmä v prípadoch novodiagnostikovanej hypotyreózy [5,19]. Tieto výsledky sú v súlade s názorom, že SKT môže byť spôsobený dysfunkciou štítnej žľazy, i keď vzťah medzi ochoreniami je doposiaľ málo objasnený. Skríning napomáha pri diagnostike nových prípadov hypotyreózy u tejto vybranej skupiny. Náklady na diagnostiku a následnú liečbu nových prípadov hypotyreózy sú nižšie v porovnaní s operačným zákrokom.
SKT je zvyčajne diagnostikovaný pomocou klinického a fyzikálneho vyšetrenia a elektroneurografických kondukčných štúdií, ktoré sa používajú na potvrdenie prítomnosti mononeuropatie n. medianus. Medzi klinické prejavy syndrómu karpálneho tunela patria tŕpnutie, pocit pálenia a slabosti v oblasti inervovanej n. medianus [20]. Symptómy sú sedemkrát častejšie u žien ako u mužov [21]. Počas posledných 20 rokov bola neuromuskulárna ultrasonografia s vysokým rozlíšením zavedená ako doplnková metóda pre diagnózu rôznych nervových a svalových ochorení [22]. Elektrodiagnostické vyšetrenia majú svoje obmedzenia; sú nepohodlné a nie sú schopné posúdiť anatómiu n. medianus a štrukturálne zmeny jeho okolia [23]. Ultrasonografia je považovaná za neinvazívnu, ľahko reprodukovateľnú, bezbolestnú, cenovo výhodnú, dostupnú a veľmi prínosnú diagnostickú metódu [24], ktorá zlatému štandardu diagnostiky – elektromyografii – prináša cenné informácie o kontinuite nervu, jeho echoštruktúre, priebehu a vzťahu k okolitým štruktúram. Okrem toho pomocou ultrazvuku môžeme určiť príčinu mononeuropatie n. medianus a štrukturálne anomálie (cysty, tumory, cievy, kalózne útvary), ktoré by nebolo možné detekovať samotnými elektrodiagnostickými vyšetreniami [23,25]. Ako základný diagnostický ukazovateľ kompresívnej neuropatie n. medianus v oblasti karpálneho tunela sa javí jeho veľkosť, resp. prierez. Hodnota CSA n. medianus ≥ 10,0 mm2 na úrovni os pisiforme je najviac používaným diagnostickým kritériom SKT so senzitivitou vyššou ako 97,9 % [25].
V našej štúdii sme sa zamerali na pacientov s novozistenou, neliečenou, primárnou hypotyreózou. V porovnaní s inými štúdiami sme v našom súbore podrobne spracovali charakteristiku základného ochorenia, prísne stanovili indikačné kritéria a skupinu zdravých probandov. Pacienti s hypotyreózou mali signifikantne vyššie hladiny TSH a nižšie hladiny fT4 v porovnaní s kontrolnou skupinou. Všetci pacienti a zdraví probandi podstúpili ultrasonografické vyšetrenie za účelom merania CSA n. medianus na úrovni os pisiforme s priemernou hodnotou 9,875 mm2 v porovnaní s kontrolnou skupinou 7,2 mm2. Namerané hodnoty CSA n. medianus boli veľmi blízke výsledkom získaným v štúdiách [26–29]. Je dobre známe, že zmeny v BMI môžu ovplyvniť integritu nervu. Werner et al preukázali, že u obéznych jedincov (BMI > 29), je 2,5krát väčšia pravdepodobnosť výskytu klinických prejavov SKT v porovnaní so štíhlymi (BMI < 20). Korelácia medzi CSA n. medianus a BMI môže existovať [30]. V našej práci sme nezaznamenali žiadny významný rozdiel v BMI pacientov v porovnaní s kontrolnou skupinou, takže výsledky nemôžu byť ovplyvnené týmto faktorom. Zaznamenali sme vyššie hodnoty CSA n. medianus u mužov (10,25 ± 0,4 mm2) v porovnaní so ženami (9,73 ± 0,5 mm2). Tento výsledok je podobný výsledku získaného Klauserom et al, ktorí preukázali, že hodnoty CSA n. medianus boli vyššie u mužov ako u žien v priemere o 2,2 mm2 [31]. V čase diagnostiky autoimunitnej hypotyreózy udávali štyria pacienti distálne parestézie v distribučnej oblasti n. medianus. Klinicky významné zvýšenie CSA n. medianus > 0,11 cm2 sme zaznamenali u dvoch pacientov. Štatisticky významnú pozitívnu koreláciu medzi sérovými hodnotami TSH, autoprotilátkami proti tkanivu štítnej žľazy a CSA n. medianus sme nezaznamenali. Taktiež sme nepreukázali signifikantnú negatívnu koreláciu medzi CSA n. medianus a fT4, hoci trend negatívnej závislosti medzi sledovanými parametrami bol prítomný.
Záver
U novodiagnostikovaných pacientov s autoimunitnou hypotyreózou sme pomocou ultrasonografie preukázali výskyt morfologických zmien n. medianus charakteristických pre syndróm karpálneho tunela v porovnaní so zdravými. Tieto zmeny boli prítomné aj u asymptomatických pacientov s hypotyreózou, preto meranie plochy n. medianus na priečnom reze pomocou ultrasonografie s vysokým rozlíšením by mohlo byť považované za alternatívnu modalitu pre včasný záchyt tejto neuropatie u pacientov s hypotyreózou.
Zoznam použitých skratiek
BMI – Body Mass Index
SKT – syndróm karpálneho tunela
CSA – Cross Sectional Area (plocha priečneho rezu)
AIT – autoimunitná tyreoiditída
TSH – tyreotropín
fT4 – voľná frakcia tyroxínu
aTPO – protilátky proti tyreoperoxidáze
aTG – protilátky proti tyreoglobulínu
aTSHr – protilátky proti TSH receptoromAutoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Dana Holováčová
V. interná klinika
LF UK a UN Bratislava
Ružinovská 6
826 06 Bratislava
e-mail: danaholovacova@gmail.com
Prijato k recenzii: 20. 10. 2015
Prijato do tlače: 27. 1. 2016
Sources
1. Kasem AA, Fathy SM, Shahin DA, et al. Carpal tunnel syndrome in hypothyroid patients: the effect of hormone replacement therapy. AJIM 2014;2(3):54 – 8.
2. Holováčová D, Čierny D, Brázdilová K, et al. Muskuloskeletálne zmeny pri hypotyreóze. Rheumatologia 2013;4 : 185 – 9.
3. Eslamian F, Bahrami A, Aghamohammadzadeh N, et al. Electrophysiologic changes in patients with untreated primary hypothyroidism. J Clin Neurophysiol 2011;28(3):323 – 8. doi: 10.1097/ WNP.0b013e31821c30d9.
4. Kurča E. Syndróm karpálneho tunela. Cesk Slov Neurol N 2009;72/ 105(6):499 – 510.
5. Duyff RF, Van den Bosch J, Laman DM, et al. Neuromuscular findings in thyroid dysfunction: a prospective clinical and electrodiagnostic study. J Neurol Neurosurg Psychiatry 2000;68(6):750 – 5.
6. Cruz MW, Tendrich M, Vaisman M, et al. Electroneuromyography and neuromuscular finndings in 16 primary hypothyroidism patients. Arq Neuropsiquiatr 1996;54(1):12 – 8.
7. EL-Salem K, Ammari F. Neurophysiological changes in neurologically asymptomatic hypothyroid patients: a prospective cohort study. J Clin Neurophysiol 2006;23(6):568 – 72.
8. Somay G, Oflazoglu B, Us O, et al. Neuromuscular status of thyroid diseases, a prospective clinical and electrodiagnostic study. Electromyogr Clin Neurophysiol 2007;47(2):67 – 78.
9. Kececi H, Degirmenci Y. Hormone replacement therapy in hypothyroidism and nerve conduction study. J Clin Neurophysiol 2006;36(2):79 – 83.
10. Palumbo CF, Szabo RM, Olmsted SL. The effects of hypothyroidism and thyroid replacement on the development of carpal tunnel syndrome. J Hand Surg Am 2000;25(4):734 – 9.
11. Ajeena IM. Prevalence of neuromuscular abnormalities in newly diagnosed patients with thyroid dysfunction. AJRC 2013;1 : 79 – 88.
12. Fathy SM, Shahin DA, Kasem AA. The effect of hormone replacement therapy in hypothyroid patients with carpal tunnel syndrome. AAMJ 2010;8(3):156 – 70.
13. Mazanec R, Nedelka T, Bojar M. Neuromuskulární poruchy u tyreopatie. Neurol Praxi 2012;13(1):22 – 5.
14. Kučera P. Problematika neuropatie v klinickej praxi. Neurológia 2010;5(2):55 – 9.
15. Oktayoglu P, Nas K, Kilinç F, et al. Assessment of the Presence of carpal tunnel syndrome in patients with diabetes mellitus, hypothyroidism and acromegaly. J Clin Diagn Res 2015;9(6):14 – 8. doi: 10.7860/ JCDR/ 2015/ 13149.6101.
16. Drobný M. Prehľad poškodení perifernej nervovej sústavy. Via Practica 2007;4(10): 442 – 9.
17. Dijk MA, Reitsma JB, Fischer JC, et al. Indications for requesting laboratory tests for concurrent diseases in patients with carpal tunnel syndrome: a systematic review. Clinical Chemistry 2003;9 : 1437 – 44.
18. Vashishtha M, Varghese B, Mosley F, et al. Screening for thyroid dysfunction and diabetes in patients with carpal tunnel syndrome. Surgeon 2014; pii: S1479-666X(14)00144-9. doi: 10.1016/ j.surge.2014.11.003.
19. Sabina Y, Noorzadah B, Shelina B. Motor neuropathy in hypothyroidism: clinical and electrophysiological findings. BSMMU J 2008;1(1):15 – 8.
20. Kurča E, Kučera P. Syndróm karpálneho tunela – patogenéza, diagnostika a liečba. Neurol Praxi 2004;5(2):24 – 8.
21. Kim HS, Joo SH, Han ZA, et al. The nerve/ tunnel index: a new diagnostic standard for carpal tunnel syndrome using sonography: a pilot study. J Ultrasound Med 2012;31(1):23 – 9.
22. Cartwright MS, Hobson-Webb LD, Boon AJ, et al. Evidence-based guideline: neuromuscular ultrasound for the diagnosis of carpal tunnel syndrome. Muscle Nerve 2012;46(2):287 – 93. doi: 10.1002/ mus.23389.
23. Bíla M. Sonografie u syndromu karpálního tunelu. Acta Chir Orthop Traumatol Cech 2013;80(5):356 – 9.
24. Kurca E, Nosal V, Grofik M, et al. Single parameter wrist ultrasonography as a first-line screening examination in suspected carpal tunnel syndrome patients. Bratisl Lek Listy 2008;109(4):177 – 9.
25. McDonagh C, Alexander M, Kane D. The role of ultrasound in the diagnosis and management of carpal tunnel syndrome: a new paradigm. Rheumatology 2015;54(1):9 – 19. doi: 10.1093/ rheumatology/ keu275.
26. El Miedany YE, Aty SA, Ashour S. Ultrasonography versus nerve conduction study in patients with carpal tunnel syndrome: substantive or complementary tests? Rheumatology 2004;43 : 887 – 95.
27. Chan KY, George J, Goh KJ, et al. Ultrasonography in the evaluation of carpal tunnel syndrome: diagnostic criteria and comparison with nerve conduction studies. Neurology Asia 2011;16(1):57 – 64.
28. Wang LY, Leong CHP, Huang YCH, et al. Best diagnostic criterion in high-resolution ultrasonography for carpal tunnel syndrome. Chang Gung Med J 2008;31(5):469 – 76.
29. Wong SM, Griffith JF, Hul AC, et al. Carpal tunnel syndrome: diagnostic usefulness of sonography. Radiology 2004;232(1):93 – 9.
30. Werner RA, Albers JW, Franzblau A et al. The relationship between body mass index and the diagnosis of carpal tunnel syndrome. Muscle Nerve 1994;17(6):632 – 6.
31. Klauser AS, Halpern EJ, Zordo T, et al. Carpal tunnel syndrome assessment with US: value of additional cross-sectional area measurements of the median nerve in patients versus healthy volunteers. Radiology 2009;250(1):171 – 7. doi: 10.1148/ radiol.2501080397.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2016 Issue 4-
All articles in this issue
- Epileptochirurgická léčba zlepšuje kvalitu života – výsledky dotazníkové studie
- Morfologické zmeny nervus medianus u pacientov s novodiagnostikovanou, neliečenou, autoimunitne podmienenou hypotyreózou
- Principy operací páteřních sutkovitých nádorů nervové pochvy
- Tubulopapilární adenom žlučníku – náhodný nález u tříletého chlapce s později diagnostikovanou metachromatickou leukodystrofií – kazuistika
- Měření vrstvy nervových vláken sítnice u pacientů s Alzheimerovou chorobou
- Neurorehabilitace senzomotorických funkcí po poranění míchy
- Genetické a epigenetické faktory podmiňující vznik a prognózu mozkových gliomů – souhrn současných poznatků
- Tři časy Testu kreslení hodin hodnocené BaJa skórováním u časné Alzheimerovy nemoci
- Kresba jízdního kola – validizační studie pro syndrom demence
- Přední ischemická optická neuropatie a okluze větve retinální tepny po transkatétrové okluzi foramen ovale – kazuistika
-
Introduction to the Conference
Different Approaches in Neurorehabilitation and their Impact on Clinical Improvements of Neurological Patients
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Neurorehabilitace senzomotorických funkcí po poranění míchy
- Tři časy Testu kreslení hodin hodnocené BaJa skórováním u časné Alzheimerovy nemoci
- Genetické a epigenetické faktory podmiňující vznik a prognózu mozkových gliomů – souhrn současných poznatků
- Měření vrstvy nervových vláken sítnice u pacientů s Alzheimerovou chorobou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

