-
Medical journals
- Career
Volumetrické vyhodnocení efektu následné onkologické léčby při inoperabilní progresi či reziduu nízkostupňového gliomu
Authors: R. Bartoš 1,2; F. Třebický 3; A. Malucelli 1,2; A. Hejčl 1,2; J. Zárubová 4; D. Hořínek 1,2; R. Peter 2; M. Sameš 1
Authors‘ workplace: Neurochirugická klinika Masarykovy nemocnice, Ústí nad Labem 1; Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně 2; Ústav radiační onkologie, Nemocnice Na Bulovce, Praha 3; Neurologické oddělení, Thomayerova nemocnice, Praha 4
Published in: Cesk Slov Neurol N 2014; 77/110(2): 216-222
Category: Short Communication
Overview
Cíl:
Vyhodnocení klinické a objemové odpovědi nízkostupňového gliomu na konkomitantní a adjuvantní chemoradioterapii.Soubor a metodika:
Popisujeme soubor sedmi pacientů (pět žen a dva muži) po operaci nízkostupňového gliomu s potvrzenou progresí či inoperabilním reziduem nádoru. Objemová regrese nádoru byla vyhodnocena metodou manuální počítačové volumetrie.Výsledky:
V našem pilotním souboru jsme pomocí volumetrické kvantifikace pozorovali průměrnou 90% (73 až 100%) redukci objemu nádoru v T1 vážených obrazech a 73% (41 až 100%) redukci objemu nádoru v T2 vážených obrazech. U tří pacientů došlo po onkologické léčbě k vymizení epileptických záchvatů, u jednoho pacienta zůstaly jacksonské senzitivní epileptické paroxyzmy beze změny.Závěr:
Kombinovaná onkologická léčba u pacientů s inoperabilním nízkostupňovým gliomem WHO grade II indikovaná přes známky nízké proliferační aktivity může vést u signifikantní části pacientů k významné objemové regresi nádoru.Klíčová slova:
nízkostupňový gliom – chemoterapie – radioterapie – temozolomid – počítačová volumetrieÚvod
Kromě prokázaného pozitivního přínosu resekce je význam adjuvantní onkologické léčby u nízkostupňového gliomu WHO grade II stále kontroverzní.
V naší pilotní studii hodnotíme grafický vývoj komplexně onkologicky léčených pacientů po operaci nízkostupňového gliomu s projevy objemové progrese bez známek grafického up ‑ gradingu v průběhu dispenzarizace, kteří podstoupili onkologickou léčbu – radioterapii a chemoterapii.
Materiál a metodika
Soubor
Náš sledovaný soubor tvoří sedm pacientů, pět žen a dva muži, ve věkovém rozmezí 32 až 47 let (průměr 40 let). U všech byl základní typ tumoru určen histologickým vyšetřením po resekci tumoru se snahou o radikalitu (tab. 1).
Hlavní vstupní kritérium byla nepřítomnost známek up ‑ grade gliomu – absence enhancující složky nádoru a výsledek poměru cholinu a N ‑ acetylaspartátu (Cho/ NAA) v tumoru verifikovaný MR spektroskopií, event. PET.
U šesti pacientů se jednalo o objemovou progresi nádoru, která nemohla být z důvodu elokvence řešena další resekcí, u jedné pacientky byla léčba zahájena ihned po operaci pro signifikantní reziduum nádoru difuzně infiltrující primární motorickou kůru.
Léčba
Onkologická léčba spočívala v:
1. Radioterapii
Pacient byl uložen ve standardní supinační poloze s fixací hlavy trojbodovou maskou (Orfit©), bylo provedeno grafické zobrazení skeletu hlavy a mozku na CT přístroji Siemens Somatom s aplikací kontrastní látky v 3mm intervalu CT řezů od vertexu hlavy po skelet obratlů C4/ 5. Do grafického CT zobrazení nekontrastní fáze byla fúzována diagnostická zobrazení T1 a T2 váženými obrazy MR na plánovacím systému Eclips Varian. Do grafického zobrazení byly definovány rizikové orgány (OAR – mozkový kmen, chiazma a optické nervy) a oblasti zájmu: nádorové ložisko (GTV), klinický objem (CTV), plánovaný objem pro iniciální dávku (PTV1 – dávka kumulativní 46 – 50 Gy v referenční izodóze 90 – 95 %) a plánovaný objem pro dávku doplňovací (PTV2 – dávka 10 – 14 Gy v referenční izodóze 92 – 95 % po dokončení fáze léčby pro objem PTV1). Definitivní radiační dávka pro nádorové ložisko (GTV) se v našem souboru pohybovala mezi Dmax 62,9 a 66,5 Gy.
2. Chemoterapii
- a) Potenciační léčba při radioterapii – temozolomid (Temodal®, event. generiky) v dávce 75 mg/ m2 p.o. podání po celou dobu léčby, včetně víkendů (7krát týdně), chemoterapie byla zahájena první den radioterapie v podání 30 min před snídaní na lačno v kombinaci se setrony a ukončena posledním dnem radioterapie.
- b) Systémová adjuvantní léčba – temozolomid v dávce 200 mg/ m2 p.o. D1 – 5 v intervalu 28 dnů, celkem šest cyklů. První cyklus chemoterapie byl zahájen za 30 – 31 dnů od ukončení chemoradioterapie dle klinického stavu pacientů.
Vyšší radiační dávka (Dmax 62,9 – 66,5 Gy) byla indikována specialistou (F. T.), a to z důvodů rizika malignizace nádoru u inoperabilní objemově progredující léze po konvenční radioterapii dávkou 50 – 54 Gy. Dle našeho názoru gliomy potenciálně bez kodelece 1p19q, exprese p53, bez mutace IDH a metylace MGMT budou více směřovat k biologické akceleraci proliferace. V budoucnu se hodláme soustředit na indikaci intenzity onkologické léčby právě na základě výsledku onkocytogenetického vyšetření. Chemoradioterapie a adjuvantní chemoterapie je dle našeho protokolu prováděna s cílem likvidace a stabilizace kmenů buněk, které by při pouhé chemoterapii nastoupily biologickou selekci k chemorezistenci (paralela s malobuněčným plicním karcinomem).
U všech pacientů byl léčebný protokol schválen etickými komisemi obou klinických pracovišť.
V průběhu aplikace chemoradioterapie byli pacienti sledováni hematologicky v intervalu sedmi dnů a dále byly vyhodnocovány biochemické funkce při zahájení a ukončení léčby. U systémové léčby byla hematologická toxicita sledována v intervalu 14 dnů a biochemické parametry po 3. a 6. cyklu. Profylaktické použití antibiotik nebylo u žádného z pacientů indikováno.
Volumetrické hodnocení efektu léčby
Jako metodu objemového výpočtu výsledku léčby jsme použili objemovou analýzu manuální konturací T1 hypointenzity a T2 hyperintenzity vstupního stavu nádoru a snímků s 6 - až 29měsíčním odstupem po ukončení onkologické léčby. Pro stanovení objemu nádoru jsme použili software StealthDTI (Medtronic, Minneapolis, USA), pro analýzu byly využity axiální T1 a T2 vážené obrazy s vysokým rozlišením vhodné pro použití v módu multiplanar reconstruction (MPR). Pro náběr těchto obrazů byl použit přístroj Symphony 1.5T (Siemens, Erlangen, Německo).
Autoři prohlašují, že studie na lidských subjektech popsaná v manuskriptu byla provedena v souladu s etickými standardy etické komise Masarykovy nemocnice odpovědné za provádění klinických studií a Helsinskou deklarací z roku 1974, revidovanou v roce 2000.
Výsledky
Volumetrické hodnocení efektu léčby
Výsledky jsou uvedeny v tab. 2.
Table 2. Volumetrické hodnocení efektu léčby – výsledky. 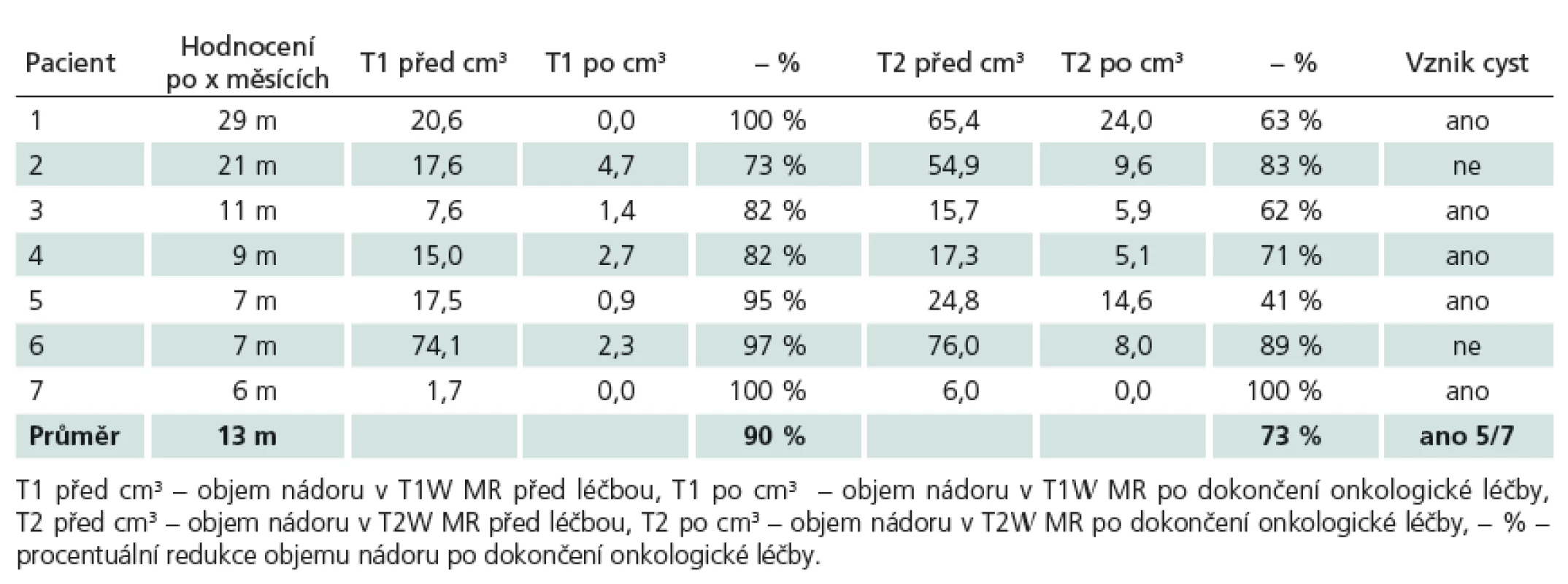
Epileptologické výsledky léčby
U tří pacientů došlo po onkologické léčbě k vymizení epileptických záchvatů, u jednoho pacienta zůstaly jacksonské senzitivní epileptické paroxyzmy beze změny a tři pacienti byli i vstupně bez záchvatů.
Nežádoucí účinky
V průběhu radioterapie byly zaznamenány standardní kožní projevy (epilace), u dvou pacientů došlo k přechodnému zpomalení psychomotorického tempa. U žádného pacienta v průběhu radioterapie neproběhl epileptický záchvat.
V průběhu potenciační fáze chemoterapie nebyly pozorovány alergické projevy, gastrointestinální toxicita byla plně sanována setrony (Zofran Zydis 8 mg), v jednom případě byla potenciace zastavena pro projevy hematotoxicity (leukopenie a trombopenie).
Pacientka 7 systémovou adjuvantní léčbu odmítla a je dále sledována. U pacientky 4 došlo v průběhu systémové léčby k projevům dřeňového útlumu s nutností snížení dávky na 150 mg/ m2, její další průběh byl nekomplikovaný. U pacienta 6 byla léčba komplikována pneumonií bez projevů hematologické toxicity.
Diskuze
V českém onkologickém písemnictví toto téma již kazuisticky zpracovali Třebický et al [1], v našem sdělení rozšiřujeme soubor pacientů a zejména odpověď kvantifikujeme pomocí manuální počítačové volumetrie.
Všechny nám dostupné práce používají modifikovaná Macdonaldova kritéria kvantifikace odpovědi nádoru na léčbu [2]. Ta spočívají v měření dvou či tří na sebe kolmých rozměrů nádoru a výpočtu průměrného rozměru nádoru (MTD, Mean Tumor Diameter). Jako kompletní odpověď je hodnocena úplná regrese nádoru ve T2 či flair vážené MR, jako částečná odpověď > 50% regrese, jako méně významná „minor“ odpověď 25 až 50% regrese nádoru, jako progrese > 25% nárůst průměrné velikosti tumoru a stabilní nález zahrnující všechny eventuality mimo výše definované.
Image 1. Výrazná regrese (D) (83% v T2) LGG u 45leté pacientky (pacientka 2) po parciální resekci (A, B, C) fibrilárního astrocytomu (reziduum v oblasti precentrálního gyru) za 21 měsíců po kombinované onkologické léčbě. Taktéž došlo k ústupu původně refrakterních epileptických záchvatů. 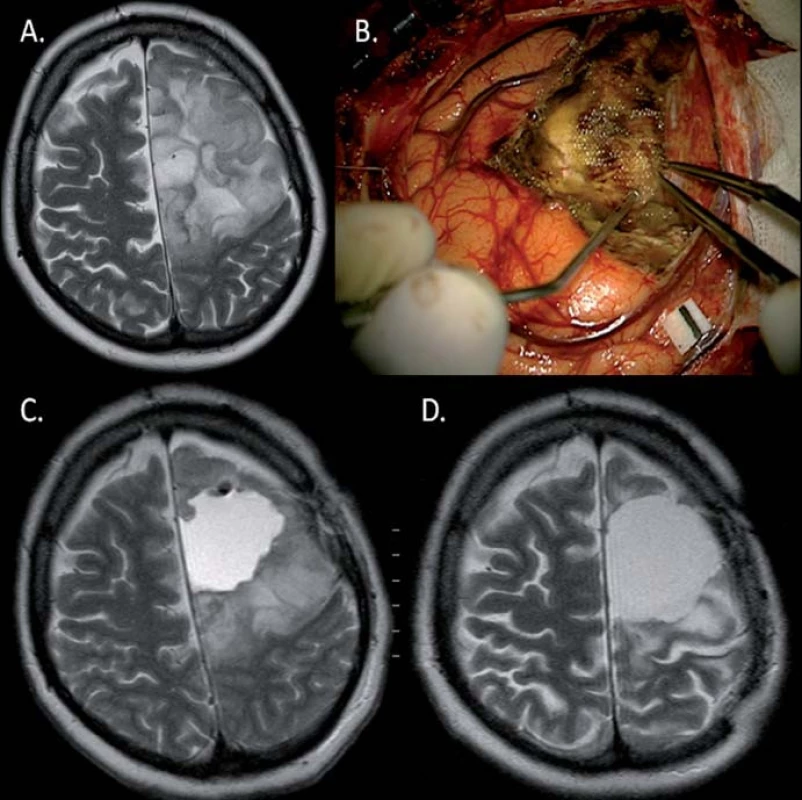
Naše práce na rozdíl od níže citovaných hodnotí efekt léčby přesnější volumetrickou metodou v kubických centimetrech, její větší přesnost oproti měření průměrů nádoru jsme prokázali v naší předchozí práci o inzulárních gliomech [3]. Rádi bychom v českém a slovenském neurochirurgickém prostředí upozornili na doposud opomíjenou metodu léčby progredujících či neresekabilních nízkostupňových gliomů WHO grade II (LGG). V našich podmínkách převažuje jako metoda volby observace a vyčkávání známek malignizace nádoru či izolovaná radioterapie bez potenciační a adjuvantní chemoterapie temozolomidem. Nutno však doplnit, že o následné onkologické léčbě uvažujeme až po objektivním vyloučení dalšího resekčního výkonu.
V našem malém volumetricky hodnoceném souboru jsme zaznamenali v T2 vážené MR jednu kompletní odpověď (14 %), v pěti případech (71%) částečnou odpověď a v jednom případě „minor“ odpověď (14 %). V 71 % došlo ke vzniku drobných intratumorálních cyst, nezjistili jsme lineární závislost mezi dobou od započetí onkologické léčby a objemovou odpovědí.
Velice zajímavý je článek francouzských autorů [4], jenž hodnotí vývoj LGG před používáním temozolomidu v léčbě a během ní – na velkém souboru 107 pacientů. Autoři si všímají přirozeného vývoje LGG a stanovují průměrný přírůstek střední velikosti nádoru (MTD) 4,76 mm/ rok, růst závisí na stavu 1p19q kodelece; pokud je tato přítomna, růst je pomalejší (3,4 mm/ rok), naopak nepřítomnost 1p19q kodelece je prognosticky nepříznivý znak s průměrnou rychlostí nárůstu MTD o 5,9 mm/ rok.
Po léčbě temozolomidem došlo v citovaném souboru během celkové doby sledování u 20 pacientů (18,6 %) k částečné odpovědi, u 45 pacientů (42 %) k málo významné „minor“ odpovědi, u 35 pacientů (32,7 %) zůstal nádor stabilní a u sedmi pacientů (6,5 %) došlo k jeho progresi. K častější objektivní odpovědi docházelo u pacientů s 1p19q kodelecí (73 vs 50 %). U 98 ze 107 pacientů (92 %) došlo alespoň k dočasné odpovědi, u 77 z nich bezprostředně po podání léčby a u 21 opožděně v mediánu 116 dní (48 – 206). Došlo k průměrnému zmenšení MTD o 9,2 mm/ rok ( – 0,5 až – 39,1 mm/ rok).
Ale 36 pacientů navzdory kontinuálnímu podávání temozolomidu zaznamenalo po střední době 367 dní (98 – 756) opětovný růst nádoru, riziko opětovného růstu bylo signifikantně větší při nepřítomnosti kodelece 1p19q (60,6 vs 16,6 %) nebo při detekovatelnosti p53 (70,5 vs 25 %). Získaná chemorezistence se tedy vyvíjí daleko častěji a rychleji u pacientů, kteří exprimují p53 a nenesou 1p19q kodeleci.
Zajímavou otázku v sobě nese přerušení léčby. Většina nádorů začne poté růst znovu, v 59 % vzniká riziko opětovného růstu po střední době sledování 200 dní (60 – 630). Ideální je dle autorů tedy hodnocení efektu léčby za kontinuálního volumetrického sledování a její přerušení eventuálně až po obrácení růstové křivky, ke kterému ve většině případů dochází.
Další možností kvantifikace je měření nádoru pouze ve dvou na sebe kolmých rovinách na transverzálním řezu o největším rozměru nádoru ve flair sekvenci tak, jak to činí ve svém menším souboru Brada et al [5]. V souboru 30 pacientů s fibrilárními astrocytomy, oligodendrogliomy a smíšenými gliomy zaznamenali parciální odpověď u tří pacientů, „minor“ odpověď u 14 pacientů, stabilní onemocnění u 11 pacientů a progresi u jednoho. Tříletý Progression Free Survival (PFS)byl 66 % a přežití bylo v tomto období 82 %. Autoři vyzdvihují pozitivum klinic-kého dopadu – kompenzaci epileptických záchvatů; 15 pacientů z 28 s epilepsií (54 %) zaznamenalo redukci frekvence záchvatů a šest z nich bylo zcela bez záchvatů. V našem malém souboru jsme pozorovali tento příznivý klinický efekt léčby u tří ze čtyř pacientů s epileptickými záchvaty.
Další francouzská práce, jež rovněž vyzdvihuje příznivý klinický dopad pro pacienty s oligodendrogliomy a oligoastrocytomy, hodnotí 60 pacientů [6]. Ke klinickému zlepšení došlo v 51 % (u 30 pacientů) s refrakterní epilepsií, včetně 12 pacientů z 36 radiologicky stabilních. K objektivní radiologické odpovědi došlo v 31 % (17 % částečná a 14 % „minor“), onemocnění bylo u 61 % pacientů graficky stabilní a v 8 % nádor progredoval. Důležité je hodnocení střední doby do maximální odpovědi – ta byla 12 měsíců v rozmezí od 5 do 20.
Image 2. U 32leté pacientky (pacientka 4) s inoperabilní progresí (A) tři roky po téměř úplné (92%) resekci oligoastrocytomu WHO II v pravé inzule došlo po onkologické léčbě k významné regresi T1 hypointenzity (82%) (B). Pacientka je neurologicky intaktní a bez epileptických záchvatů. 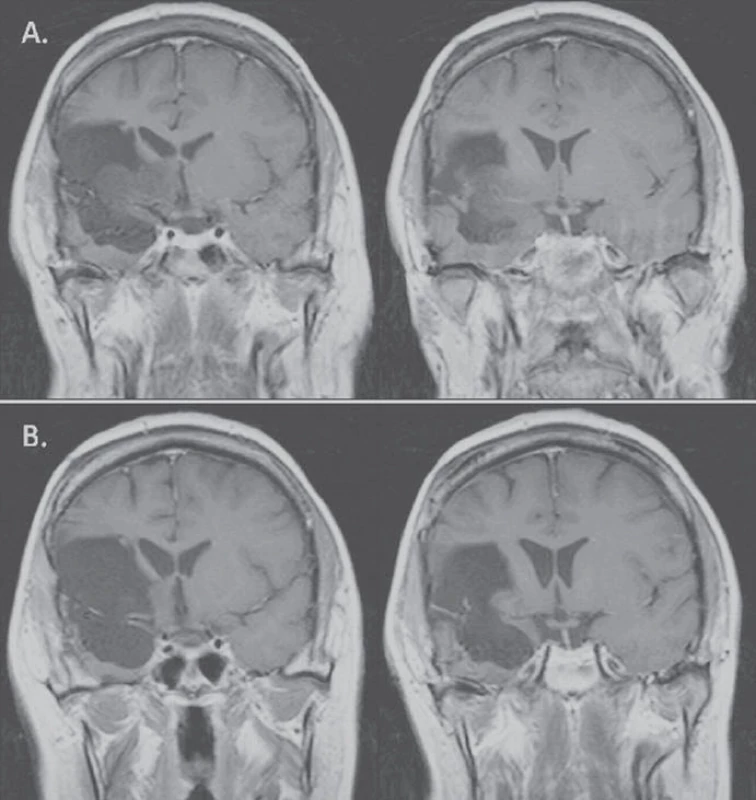
Výše uvedená práce byla definitivně publikována po rozšíření na 149 pacientů, tedy se jedná o početně nejsilnější soubor pacientů [7]. Temozolomid byl podáván v konvenčním dávkování, střední počet cyklů čítal 14. Celkem 77 pacientů (53 %) zaznamenalo objektivní odpověď, u 22 (15 %) byla částečná, u 55 pacientů (38 %) se jednalo o „minor“ odpověď, u 55 pacientů (37 %) se onemocnění stabilizovalo a u 14 pacientů (10 %) došlo k progresi. Střední čas do maximální odpovědi trval shodně s pilotní prací 12 měsíců (3 – 30). Genotypizace byla provedena u 86 pacientů, kodelece 1p19q byla přítomna u 42 % a byla spojena s vyšší četností (72 vs 46 %) a delší dobou odpovědi, delším PFS a dobou přežití. Trend příznivého působení na kompenzaci epileptických záchvatů trval, k > 50% snížení četnosti epileptických záchvatů došlo u 87 pacientů (58 %).
Opačný výsledek stran vlivu onkogenetických faktorů na efekt léčby měla kooperativní holandská studie zahrnující 58 pacientů [8]. Zkoumala však efekt temozolomidu při progresi po radioterapii a vysoké procento pacientů mělo enhancující lézi. Hodnotila přítomnost mutací v IDH1, IDH2, TP53 genech, metylaci promotoru MGMT, trizomii 7. chromozomu a kodeleci 1p19q. Objektivní radiologická odpověď nastala v 54 %. Nebyla však zjištěna vazba výše uvedených genetických faktorů na PFS či celkové přežití po léčbě temozolomidem. Autoři uvádějí, že mutace promotoru MGMT a IDH1 mají vliv na dobu přežití od doby diagnózy, nikoliv na výsledek po léčbě temozolomidem při progresi.
Některé studie hodnotí význam intenzifikovaného denního podávání temozolomidu oproti standardnímu 5dennímu cyklu [9,10]. Primárním účelem pilotní práce [9] čítající 25 pacientů bylo určení toxicity léčby. Intenzifikované dávkování (75 mg/ m2/ den při podávání ve dnech 1 – 21 z 28denního cyklu) by mělo mít oproti standardnímu dávkování (200 mg/ m2/ den při podávání ve dnech 1 – 5 z 28denního cyklu) výhodu větší kumulativní expozice léku a deplece hladiny O6 - alkylguanine DNA alkyltransferázy, a tím by mělo překonávat intrinsickou chemorezistenci. Nejčastějšími vedlejšími nežádoucími účinky byly únava (76 %), lymfocytopenie (72 – 48 %, vysokého stupně), zácpa (56 %) a nauzea (52 %). Vysokostupňové toxicity (jiné než lymfocytopenie) zahrnovaly sekundární malignitu – difuzní velkobuněčný B lymfom, pruritus, hyponatremii, neutropenii, leukocytopenii a kognitivní pokles, každá z nich nastala v jednom případě. Lymfocytopenie nejčastěji vznikala po 6. cyklu podávání temozolomidu. Výhodou temozolomidu oproti PCV (prokarbazin‑lomustin‑vinkristin) je absence kumulativní toxicity, jež umožňuje dlouhodobé podávání.
Image 3. Regrese (B) (89% v T2) LGG u 33letého pacienta (pacient 6) s původně výraznou progresí (A) smíšeného oligoastrocytomu 32 měsíců po awake resekci s lokalizací řečových center bezprostředně posteriorně od původní postresekční dutiny. Po onkologické léčbě nedošlo ke zhoršení řeči, naopak došlo k ústupu epileptických záchvatů. 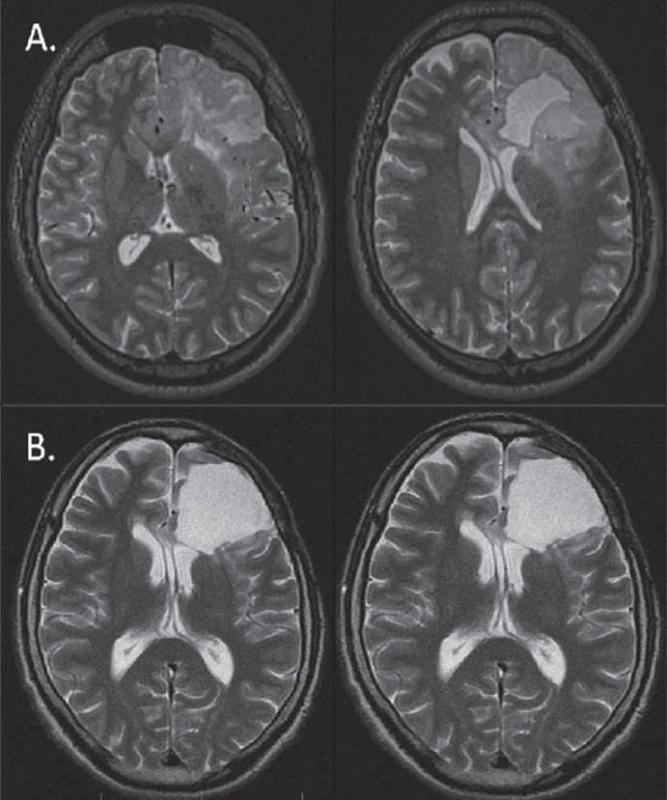
V další klinické studii, čítající 30 pacientů [10] nastala objektivní odpověď v 30 %, kontrola onemocnění v 86 %, PFS jeden, resp. dva roky byl 73 % a 43 %. Výsledky se tedy podobaly konvenčnímu dávkování, ke snížení frekvence epileptických záchvatů došlo u 62 % symptomatických pacientů. V této práci kodelece 1p19q nekorelovala s PFS ani s dobou přežití, což však autoři vysvětlují možnou vyšší citlivostí intenzifikovaného režimu chemoterapie i na 1p19q intaktní tumory.
V naší práci jsme zaznamenali v jednom případě kompletní odpověď v T1 i T2 vážené MR. To je v rešerši literatury spíše výjimka. Práce, která taktéž popisuje kompletní odpověď, hodnotí léčbu progredujících LGG u 46 pacientů [11], bias však představuje zařazení pěti pilocytických astrocytomů a dětských pacientů, navíc v 70 % se jednalo o enhancující léze, tedy potenciálně gliomy vyššího grade. Kompletní odpověď nastala u čtyř pacientů, objektivní odpověď nastala v 61 %, u 35 % pacientů zůstalo onemocnění stabilní, 6 a 12měsíční PFS byla 98 %, resp. 76 %. V našem souboru se jednalo ve všech případech o neenhancující léze, v případě kompletní odpovědi o velice drobné reziduum 6 cm3 inzulárního gliomu (obr. 4).
Image 4. U pacientky 45leté pacientky (pacientka 7) s progredujícím nevelkým reziduem (C, D) (původně 4 cm3) fibrilárního astrocytomu WHO II v pravé inzule (A, B) došlo po radioterapii s chemopotenciací k úplné regresi T1 hypoa T2 hyperintenzity (E, F). Pacientka je neurologicky intaktní a bez epileptických záchvatů. 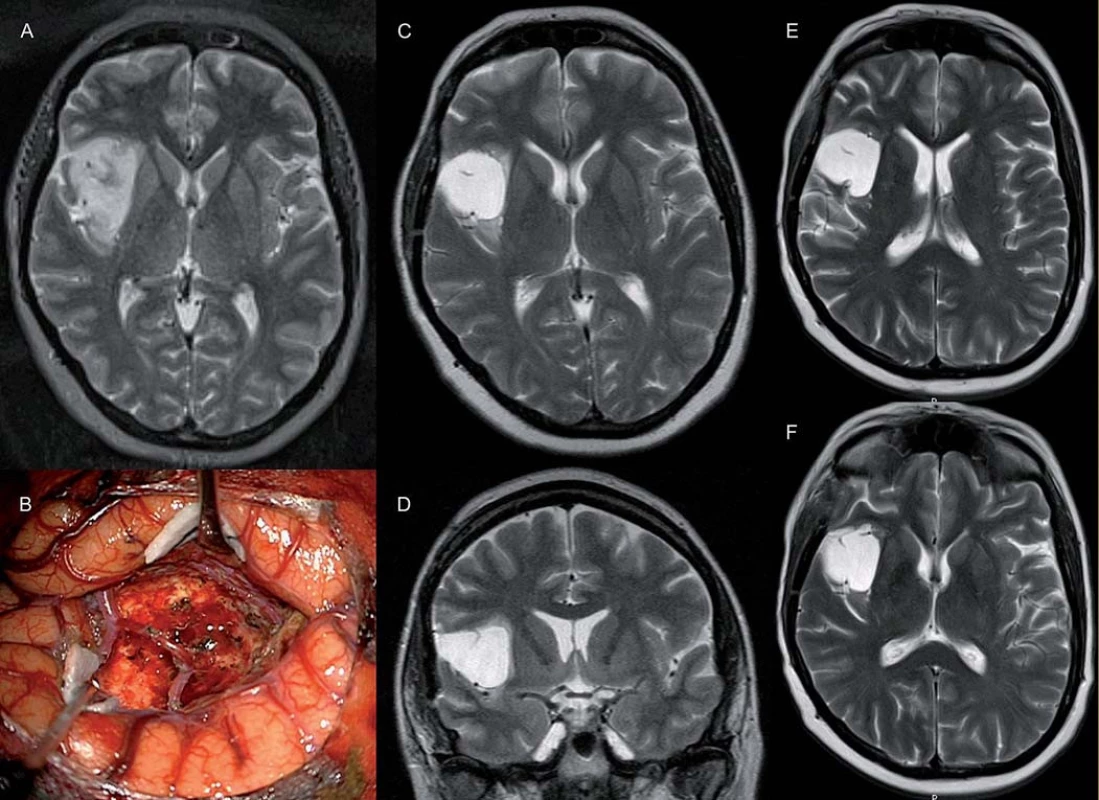
Závěr
Kombinovaná onkologická léčba u pacientů s neresekovatelným nízkostupňovým gliomem WHO grade II indikovaná přes známky nízké proliferační aktivity může vést u signifikantní části pacientů k významné objemové regresi nádoru. Příznivý je taktéž antiepileptogenní potenciál objemové redukce nádoru. Léčba by měla být volumetricky kvantifikována a k jejímu přerušení by měl onkolog přistoupit až po obrácení růstové křivky nádoru.
V našem pilotním souboru jsme po chemoradioterapii s aplikací vyšší radiační dávky (Dmax 62,9 – 66,5 Gy) pomocí volumetrické kvantifikace pozorovali průměrnou 90% (73 až 100%) redukci objemu nádoru v T1 vážených obrazech a 73% (41 až 100%) redukci objemu nádoru v T2 vážených obrazech. U pěti ze sedmi pacientů taktéž došlo po léčbě ke vzniku drobných (cca 5mm) intratumorálních cyst. Všechny vedlejší nežádoucí účinky byly předpokládatelné, vážnější korigovatelné a neohrozily celkový stav pacienta.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 11. 4. 2013
Přijato do tisku: 5. 11. 2013
MUDr. Robert Bartoš Ph.D.
Neurochirurgie
Masarykova nemocnice
Sociální péče 12A
400 11 Ústí nad Labem
e-mail: robert.bartos@kzcr.eu
Sources
1. Třebický F, Kubeš J, Bartoš R, Malucelli A, Sameš M et al. Léčba nízkostupňového gliomu supratentoriální oblasti mozku po neurochirurgické subtotální resekci s projevy objemového up ‑ gradingu. Klin Onkol 2012; 25(4): 294 – 298.
2. Macdonald DR, Cascino TL, Schold SC jr, Cairncross JG.Response criteria for phase II studies of supratentorial malignant glioma. J Clin Oncol 1990; 8(7): 1277 – 1280.
3. Bartoš R, Sameš M, Zolal A, Radovnický T, Hejčl A, Vachata P et al. Resekce insulárních gliomů – volumetrické hodnocení radikality. Cesk Slov Neurol N 2009; 72/ 105(6): 534 – 541.
4. Ricard D, Kaloshi G, Amiel ‑ Benouaich A, Lejeune, Marie Y, Mandonnet E et al. Dynamic history of low ‑ grade gliomas before and after temozolomide treatment. Ann Neurol 2007; 61(5): 484 – 490.
5. Brada M, Viviers L, Abson C, Hines F, Britton J,Ashley S et al. Phase II study of primary temozolomide chemotherapy in patients with WHO grade II gliomas. Ann Oncol 2003; 14(12): 1715 – 1721.
6. Hoang ‑ Xuan K, Capelle L, Kujas M, Taillibert S, Duffau H, Lejeune J et al. Temozolomide as initial treatment for adults with low ‑ grade oligodendrogliomas or oligoastrocytomas and correlation with chromosome 1p deletions. J Clin Oncol 2004; 22(15): 3133 – 3137.
7. Kaloshi G, Benouaich ‑ Amiel A, Diakite F, Taillibert S,Lejeune J, Laigle ‑ Donadey F et al. Temozolomide for low ‑ grade gliomas: predictive impact of 1p/ 19q loss on response and outcome. Neurology 2007; 68(21); 1831 – 1836.
8. Taal W, Dubbink HJ, Zonnenberg CB, Zonnenberg BA, Postma TJ et al. First‑line temozolomide chemotherapy in progressive low ‑ grade astrocytomas after radiotherapy: molecular characteristics in relation to response. Neuro Oncol 2011; 13(2): 235 – 241.
9. Pouratian N, Gasco J, Sherman JH, Shaffrey ME, Schiff D. Toxicity and efficacy of protracted low dose temozolomide for the treatment of low grade gliomas. J Neurooncol 2007; 82(3): 281 – 288.
10. Tosoni A, Franceschi E, Ermani M, Bertorelle R, Bonaldi L, Blatt V et al. Temozolomide three weeks on and one week off as first line therapy for patients with recurrent or progressive low grade gliomas. J Neurooncol 2008; 89(2): 179 – 185.
11. Pace A, Vidiri A, Galiè E, Carosi M, Telera S, Cianciulli AM et al. Temozolomide chemotherapy for progressive low ‑ grade glioma: clinical benefits and radiological response. Ann Oncol 2003; 14(12): 1722 – 1726.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2014 Issue 2-
All articles in this issue
- Autonomní dysreflexie – závažná komplikace u pacientů po poranění míchy
- Ortostatická hypotenze jako autonomní dysregulační porucha po poranění krční míchy
- Porovnanie validity diagnostických kritérií sclerosis multiplex 2005 vs 2010 s aspektom včasnej diagnostiky
- Vývoj neurologického a funkčního obrazu po poranění míchy
- Vztah mezi parametry transkraniální dopplerometrie a tkáňovou oxymetrií u pacientů s těžkým subarachnoidálním krvácením
- Posuzování gramatičnosti v Brocově afázii – příklad dvou pacientů
- Normativní hodnoty parametrů vedení pro nervus ulnaris a nervus medianus měřené standardizovaným způsobem
- Volumetrické vyhodnocení efektu následné onkologické léčby při inoperabilní progresi či reziduu nízkostupňového gliomu
- Ovlivnění funkce sluchové dráhy u pacientů s vestibulárním schwannomem léčených Leksellovým gama nožem
- REaDY – český registr svalových dystrofií
- Intoxikace metanolem v obraze magnetické rezonance – kazuistiky
- Krční epidurální absces – dvě kazuistiky
- Syndrom Dravetové: těžká myoklonická epilepsie v časném dětství – kazuistiky
- Nemalinová myopatie asociovaná s monoklonální gamapatií – kazuistika
- Neuromodulace
- Alkoholový odvykací stav a delirium – od patofyziologie k léčbě
- Cerebrální vazospazmy po subarachnoidálním krvácení – možnosti diagnostiky, monitorace a léčby
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Autonomní dysreflexie – závažná komplikace u pacientů po poranění míchy
- Syndrom Dravetové: těžká myoklonická epilepsie v časném dětství – kazuistiky
- Normativní hodnoty parametrů vedení pro nervus ulnaris a nervus medianus měřené standardizovaným způsobem
- Neuromodulace
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career