-
Medical journals
- Career
Souběžný výskyt mutace v genu ZNF9 (myotonická dystrofie typu 2) a v genu CLCN1 (myotonia congenita) v jedné rodině – kazuistika
Authors: O. Parmová 1,2; S. Voháňka 1,2; L. Fajkusová 2,3; K. Stehlíková 3
Authors‘ workplace: Neurologická klinika LF MU a FN Brno 1; CEITEC – Středoevropský technologický institut, MU, Brno 2; Centrum molekulární biologie a genové terapie IHOK, FN Brno 3
Published in: Cesk Slov Neurol N 2013; 76/109(5): 648-651
Category: Case Report
Overview
Myotonie je zpomalená relaxace kosterního svalstva po volní kontrakci. Je spojena s poruchou chloridových a méně často i natriových kanálů ve svalové membráně. Porucha chloridových kanálů je způsobena primárně mutací v genu pro kosterní svalový chloridový kanál (CLCN1) nebo je sekundární jako v případě myotonické dystrofie, kdy je způsobena posttranskripčním ovlivněním syntézy chloridových kanálů akumulovanou ribonukleovou kyselinou obsahující expandované triplety či tetraplety mutovaného genu. U nemocných s kongenitální myotonií dominuje porušená svalová relaxace, která je provází od dětství. Myotonie je klinicky velmi zřetelná, mírní se cvičením (warm ‑ up fenomén). Oproti tomu u myotonických dystrofií je dominantní svalová slabost a systémové příznaky, myotonie většinou není v popředí. Na rozdíl od velikosti expanze (myotonická dystrofie typ 1) neexistují důkazy, že homozygotní stav u myotonických dystrofií vede k horšímu klinickému průběhu či časnějšímu začátku onemocnění. Uvádíme ojedinělou kazuistiku pacientky, která má od 33 let potíže s dekontrakcí. V objektivním neurologickém nálezu je lehká slabost svalstva pletence pánevního, ale výrazná intenční myotonie, přítomnost myotonie perkusní a pozitivní warm ‑ up fenomén. Molekulárněgenetickým vyšetřením byla potvrzena myotonická dystrofie typu 2 s expanzí na obou alelách genu ZNF9, zároveň byl homozygotní stav podpořen vyšetřením předků a jejich příbuzných. Současně je pacientka nositelkou semidominantní mutace v genu CLCN1, kterou získala od své matky, nositelky heterozygotní mutace v genu ZNF9. Homozygotní stav u expanzivních autozomálně dominantních genových mutací (myotonická dystrofie) obecně nevede k těžšímu fenotypu, ten je u pacientky způsoben patrně současnou mutací v chloridovém kanálu.
Klíčová slova:
myotonie – myotonická dystrofie – kongenitální myotonie – molekulární genetikaPoužité zkratky
CLCN1 gen pro kosterní svalový chloridový iontový kanál 1 (ClC1)
DMPK proteinkináza pro myotonickou dystrofii
MCB kongenitální myotonie, Beckerův typ
MCT kongenitální myotonie, Thomsenův typ
MD myotonická dystrofie
PCR polymerázová řetězová reakce
RNA ribonukleová kyselina
SB Southern Blot
ZNF9 protein s motivem zinkových prstů 9
Úvod
Myotonie je zvýšená excitabilita svalových vláken charakterizovaná zpomalenou relaxací kosterního svalstva po volní kontrakci. Je spojena s poruchou chloridových a méně často i natriových napětím řízených kanálů ve svalové membráně. Porucha chloridových kanálů je primárně způsobena mutací v genu pro chloridový kanál (CLCN1) nebo je sekundární jako v případě myotonické dystrofie, kdy je způsobena posttranskripčním ovlivněním syntézy chloridových kanálů akumulovanou RNA obsahující abnormální triplety či tetraplety genu DPMK, resp. ZNF9. Myotonia congenita je způsobena mutací v genu pro chloridový kanál (CLCN1), který je lokalizován na dlouhém raménku 7. chromozomu (7q35). Podle typu dědičnosti se tradičně rozděluje na Thomsenovu (dominantní) a Beckerovu (recesivní) variantu. CLCN1 mutace jsou rozesety po celém genu a nevykazují žádné zvláštní umístění pro mutace vedoucí k MCB nebo MCT [1]. Většina mutací vede k výskytu autozomálně recesivní formy, existují však mutace, které jsou spojené s oběma typy dědičnosti – tzv. semidominantní [2]. Molekulární mechanizmus tohoto komplexního chování zůstává nejasný, může jít o variabilní penetranci, neúplnou dominanci, rozdílnou alelickou expresi a nižší klinickou expresi u žen [1]. U nemocných s kongenitální myotonií dominuje porušená svalová relaxace, která je provází od dětství. Myotonie je klinicky velmi zřetelná, objevuje se po první kontrakci po odpočinku a mírní se opakováním pohybu (warm ‑ up fenomén). U pacientů s recesivní formou je tíže myotonie větší s občasným výskytem svalové slabosti, která se taktéž projevuje po období klidu. Muskulatura je u pacientů často hypertrofická.
Myotonická dystrofie má autozomálně dominantní typ dědičnosti. Molekulárněgenetickým vyšetřením se u myotonické dystrofie typu 1 (MD1) prokazuje CTG trinukleotidová expanze v genu DMPK na 19. chromozomu, u myotonické dystrofie typu 2 (MD2) se prokazuje CCTG tetranukleotidová expanze v genu ZNF9 na chromozomu 3. U myotonických dystrofií je prominentní svalová slabost a systémové příznaky (katarakta, poruchy srdečního rytmu a kardiomyopatie, endokrinní poruchy aj.). Myotonie většinou není v popředí klinického obrazu nemoci. U MD1 tíže fenotypu do určité míry koreluje s velikosti CTG expanze, u MD2 tato závislost chybí. Také neexistují důkazy, že homozygotní stav u myotonických dystrofií vede k horšímu klinickému průběhu či časnějšímu začátku [3].
Kazuistika
Uvádíme ojedinělou kazuistiku pacientky a její rodiny, u které byl zjištěn současný výskyt myotonické dystrofie a kongenitální myotonie. Pacientka ve věku 41 let má od 33 let potíže s dekontrakcí. V objektivním neurologickém nálezu je lehká slabost svalstva pletence pánevního, která se objevila před dvěma lety. Pacientka má však výraznou intenční myotonii a myotonii perkusní, je také pozitivní warm ‑ up fenomén. Molekulárněgenetickým vyšetřením Repeat ‑ Primed PCR (RP PCR) a Souther Blot (SB) byla potvrzena MD2 s expanzí na obou alelách postiženého genu. Vyšetřené hladiny kreatinkinázy (5,6 µkat/ l) a myoglobinu (110,7 µg/ l) jsou zvýšené. Na EMG vyšetření byly nalezeny myotonické výboje. Na MR mozku je přítomno hypersignální ložisko v bílé hmotě (obr. 1). Strukturální a signálové změny především v bílé hmotě mozku se typicky vyskytují u pacientů s myotonickou dystrofii, ale jsou samy o sobě nespecifické. Kardiologické vyšetření neprokázalo poruchy srdečního rytmu či kardiomyopatii. Taktéž oční vyšetření bylo bez průkazu katarakty. Z důvodu přítomnosti výrazné poruchy dekontrakce byla provedena i analýza genu CLCN1 (PCR ‑ sekvenace exonů a přilehlých intronových oblastí). Molekulárněgenetickým vyšetřením bylo potvrzeno, že pacientka je zároveň nositelkou semidominantní mutace c.2680C>T, p.(Arg894*) ve 23. exonu genu CLCN1. Tuto mutaci získala od své matky. Homozygotní stav mutace v genu ZNF9 byl podpořen vyšetřením rodinných příslušníků. Rodokmen rodiny zobrazuje přenos mutací těchto chorob v rodině (obr. 2). Matka pacientky je nositelkou heterozygotní mutace v genu ZNF9, má klinické projevy odpovídající MD2 (kořenovou slabost svalstva pletence pánevního od 38 let věku, intenční myotonii a kataraktu od 55 let), myotonické výboje v jehlové EMG a zvýšenou hladinu kreatinkinázy v séru. Vyšetření otce nebylo možné, jelikož zemřel v mladém věku a byl zpopelněn. Abychom potvrdili homozygotní expanzi genu ZNF9 u pacientky, provedli jsme vyšetření jeho sourozenců a nalezli mutaci v genu ZNF9 u jedné z jeho sester, která je ale ve věku 70 let kompletně asymptomatická. Taktéž jsme vyšetřili sourozence pacientky. U její sestry nebyla zjištěna mutace v genu ZNF9 ani v genu CLCN1. Její dva bratři doposud vyšetřeni nebyli. V genetickém vyšetřování jsme pokračovali i u dětí pacientky. Obě dcery jsou presymptomatickými nositelkami heterozygotní mutace v genu ZNF9, mladší dcera je však zároveň i nositelkou mutace pro kongenitální myotonii.
Image 1. MR mozku – hypersignální ložisko velikosti 10 mm v bílé hmotě supratentoriálně na úrovní centrum semiovale vlevo v T2 obraze. 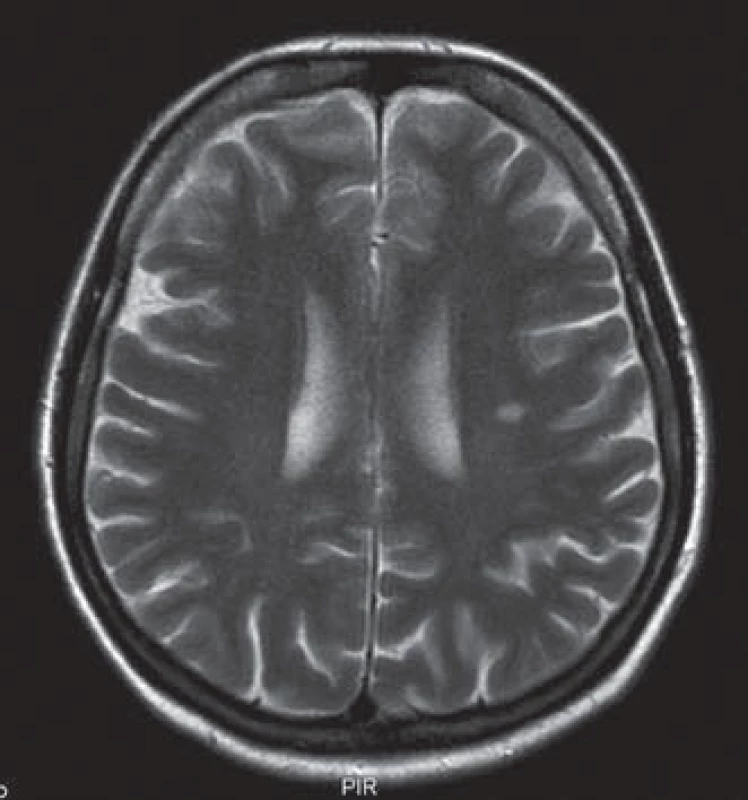
Image 2. Rodokmen rodiny zobrazuje přenos mutací obou chorob ve třech generacích. Probandka označena šipkou. Čísla uvádějí věk vyšetřovaných. Vyšetřen gen CLCN1 a ZNF9. 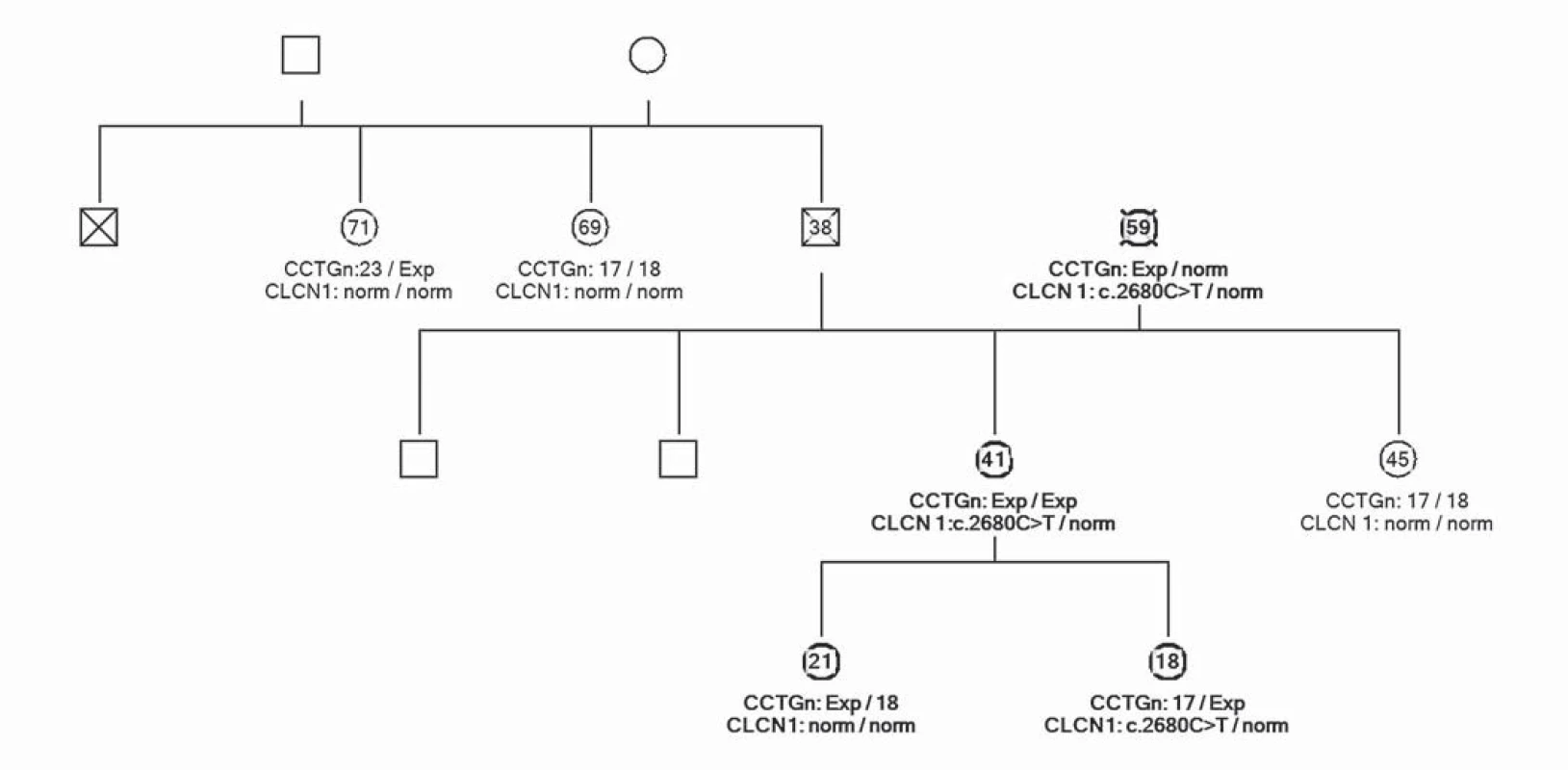
Diskuze
Myotonická dystrofie je považována za autozomálně dominantní chorobu bez rozdílu ve fenotypu mezi heterozygotním a homozygotním stavem. Homozygotní stav je velmi vzácný a byl doposud popsán jen u několika pacientů [4]. Na rozdíl od MD1, kde tíže fenotypu do určité míry koreluje s velikosti CTG expanze, tato či jiné závislosti u MD2 chybí. V literatuře byla popsána rodina s výskytem myotonické dystrofie typu 2, kde u třech sourozenců byla zjištěna homozygotní mutace [3]. I když jeden ze sourozenců byl vážněji klinicky postižen, klinický průběh symptomů všech tří homozygotů byl v rozmezí klinického průběhu heterozygotů. Ani velikost expanze a jiná vyšetření neprokázaly žádné rozdíly mezi heterozygotním a homozygotním stavem. Homozygotní stav se může dokonce klinicky projevit pouze výskytem katarakty jako jediného symptomu nemoci [5]. Homozygotní stav u expanzivních autozomálně dominantních genových mutací (MD1, MD2) nemění fenotyp nemoci ve srovnání s heterozygotním stavem. Lze tedy říci, že u pacientky výskyt mutace na obou alelách genu pro myotonickou dystrofii nevede k těžšímu fenotypu. Ten je způsoben patrně současnou mutací v chloridovém kanálu, pro co svědčí dominantní myotonické projevy.
Výskyt kongenitální myotonie je popisován různě od 1 : 10 000 až 1 : 100 000. Doposud je identifikováno okolo 200 mutací v genu CLCN1 a toto číslo se neustále zvyšuje, což dokládá vysoký stupeň alelické heterogenity spojené s touto chorobou [6]. U pacientky byla zjištěna mutace p.(Arg894*). Tato mutace patří k jedné z nejčastějších mutací v genu CLCN1 v české populaci [7] a může mít autozomálně dominantní nebo recesivní charakter. U pacientky výskyt semidominantní mutace v genu CLCN1 pravděpodobně přispěl, jak bylo uvedeno, k výraznějšímu klinickému postižení.
Současný výskyt mutace v genu ZNF9 a v genu CLCN1 je ojedinělý, ale možný případ [8]. Tento stav byl například popsán u jedné rodiny, kde koexistence obou mutací zvýšila závažnost myotonie u některých členů rodiny [9]. Zároveň to přispělo k výrazné variabilitě v myotonickém fenotypu sledované rodiny. V jiném případě nosiči mutace chloridového kanálu měli kromě větší myotonie i výraznější svalové bolesti [10]. V uvedené kazuistice je myotonie u pacientky taktéž výraznější než u ostatních členů rodiny. Také je zajímavý fenotyp sestry otce pacientky, kterou jsme vyšetřovali v rámci ověření homozygotního stavu pacientky při nemožnosti vyšetřit otce. Vzhledem k věku 72 let jde zatím o dlouhodobě kompletně asymptomatickou nosičku mutace v genu ZNF9 s normální nejen svalovou silou a nepřítomností katarakty a myotonie, ale i s normální hodnotou CK a normálním EMG nálezem.
Závěr
Uvedli jsme kazuistiku pacientky s klinicky výraznou intenční myotonií, u níž jsme molekulárněgenetickým vyšetřením zjistili koexistenci mutací v genu pro myotonickou dystrofii 2 a v genu pro kongenitální myotonii.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Olesja Parmová
Neurologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: olesja.parmova@fnbrno.cz
Přijato k recenzi: 24. 4. 2013
Přijato do tisku: 31. 5. 2013
Sources
1. Clinical and genetic investigations of patients with myotonia congenita in Northern Norway [on-line]. Available from URL: munin.uit.no/ bitstream/ handle/ 10037/ 3993/ thesis.pdf?sequence=2.
2. Dunø M, Colding ‑ Jørgensen E, Grunnet M, Jespersen T, Vissing J, Schwartz M. Difference in allelic expression of the CLCN1 gene and the possible influence on the myotonia congenita phenotype. Eur J Hum Genet 2004; 12(9): 738 – 743.
3. Schoser BG, Kress W, Walter MC, Halliger ‑ Keller B,Lochmüller H, Ricker K. Homozygosity for CCTG mutation in myotonic dystrophy type 2. Brain 2004; 127(8): 1868 – 1877.
4. Cerghet M, Tapos D, Serajee FJ, Mahbubul Huq AH. Homozygous myotonic dystrophy with craniosynostosis. J Child Neurol 2008; 23(8): 930 – 933.
5. Martorell L, Illa I, Rosell J, Benitez J, Sedano MJ, Baiget M. Homozygous myotonic dystrophy: clinical and molecular studies of three unrelated cases. J Med Genet 1996; 33(9): 783 – 785.
6. The human gene mutation database [on-line]. Available from URL: www.hgmd.cf.ac.uk/ ac/ gene.php?gene=CLCN1.
7. Sedlackova J, Vohanka S, Hermanova M, Vondracek P, Fajkusova L. Analysis of the CLCN1 gene in Czech patients with myotonia congenita. Neuromuscul Disord 2009; 19 : 645.
8. Neuromuscular disease center [on-line]. Available from URL: neuromuscular.wustl.edu/ mother/ activity.html.
9. Sun C, Van Ghelue M, Tranebjærg L, Thyssen F, Nilssen Ø, Torbergsen T. Myotonia congenita and myotonic dystrophy in the same family: coexistence of a CLCN1 mutation and expansion in the CNBP (ZNF9) gene. Clin Genet 2011; 80(6): 574 – 580.
10. Ursu SF, Alekov A, Mao NH, Jurkat ‑ Rott K. ClC1chloride channel in myotonic dystrophy type 2 and ClC1 splicing in vitro. Acta Myol 2012; 31(2): 144 – 153.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2013 Issue 5-
All articles in this issue
- Wilsonova nemoc
- Nová antikoagulancia v prevenci kardioembolických iktů u pacientů s nevalvulární fibrilací síní
- Kanabis ve vývoji a homeostáze nervového systému
- Homocysteín a sclerosis multiplex
- Kvantifikace postižení u pacientů s lumbální spinální stenózou
- Multiformní glioblastom – přehled nových poznatků o patogenezi, biomarkerech a perspektivách léčby
- Současné možnosti využití magnetické rezonance v diagnostice normotenzního hydrocefalu
- Neurologické komplikace dengue – možné nebezpečí pro střední Evropu
- Přesnost farmakogenetických algoritmů pro výpočet denní dávky warfarinu
- Interrater variabilita v hodnocení míry atrofie hipokampů pomocí Scheltensovy škály
- Porovnání peroperační radiační expozice při otevřené a miniinvazivní transpedikulární fixaci hrudní a bederní páteře
- Test 3F Dysartrický profil – normativní hodnoty řeči v češtině
- Operační léčba syndromu supinátorového kanálu
- Strategie diagnostiky, terapie a dispenzarizace pacientů s hemangioblastomy v CNS z pohledu neurochirurga
- Synkopy, hluchota a slepota u karcinomu prsu – kazuistika
- Gitelmanův syndrom provázený manifestní tetanií – kazuistika
- Konzumace marihuany jako rizikový faktor ischemické cévní mozkové příhody – kazuistika
- Tumoriformní varianta roztroušené sklerózy – dvě kazuistiky
- Souběžný výskyt mutace v genu ZNF9 (myotonická dystrofie typu 2) a v genu CLCN1 (myotonia congenita) v jedné rodině – kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Wilsonova nemoc
- Multiformní glioblastom – přehled nových poznatků o patogenezi, biomarkerech a perspektivách léčby
- Tumoriformní varianta roztroušené sklerózy – dvě kazuistiky
- Test 3F Dysartrický profil – normativní hodnoty řeči v češtině
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

