-
Medical journals
- Career
Derivace moči po radikální cystektomii
: J. Jarabák; R. Zachoval; V. Vik
: Urologické oddělení Thomayerovy nemocnice, přednosta: Doc. MUDr. R. Zachoval, Ph. D.
: Rozhl. Chir., 2014, roč. 93, č. 1, s. 46-52.
: Various Specialization
Práce je určena k postgraduálnímu vzdělávání lékařů.
Úvod:
Odstranění močového měchýře, jako součást léčby nádorového, ale i nenádorového onemocnění, je vždy spojeno s nutností zajistit derivaci moči. Cílem práce je shrnutí jednotlivých možností derivace moči po cystektomii, jejich výhody, nevýhody a dlouhodobé výsledky.Metody:
Přehledový článek shrnující relevantní literaturu a vlastní zkušenosti autorského kolektivu.Závěr:
Práce porovnává výhody a rizika jednotlivých variant derivace moči po radikální cystektomii.Klíčová slova:
radikální cystektomie – derivace moči – konduit podle BrickeraÚvod
V současné době jsme svědky velkého rozmachu rekonstrukční urologie. Snaha o funkční náhradu močového měchýře však je v urologii patrná již více než sto let. Můžeme být právem hrdí, že mezi průkopníky derivace moči patří český chirurg Karel Maydl, který jako první v roce 1892 implantoval terčík trigona extrofického močového měchýře do sigmatu. Operace derivující moč jsou v současné době indikovány nejen u pacientů s lokálně pokročilým onkologickým onemocněním močového měchýře nebo jiných pánevních orgánů, ale stále častěji i u pacientů s konzervativně nezvládnutelnými chronickými benigními stavy (např. neurogenní dysfunkce dolních močových cest, intersticiální cystitida, tuberkulóza močového měchýře a další) a také s kongenitálními vadami dolních močových cest. Přes veškeré dosavadní úsilí neexistuje jednoznačná shoda na optimální variantě chirurgického postupu.
Odstranění močového měchýře, bez ohledu na příčinu, je vždy spojeno s nutností provedení močové derivace. Pod pojmem derivace moči se rozumí zajištění pasáže a odvodu moči jinou cestou než pomocí vlastního močového měchýře. Je snahou, aby zvolený typ derivace moči co nejvíce fyziologicky nahradil původní jímací a evakuační funkci dolních močových cest, a to bez negativního vlivu na funkci ledvin. V posledních dekádách byla vyvinuta a do praxe uvedena řada způsobů, ideální metoda však stále neexistuje. Výběr vhodného typu operace závisí na faktorech nemocného (věk, pohlaví, komorbidity) i jeho onemocnění. Při rozhodování o typu derivace je také nutné zohlednit přání pacienta s cílem dosažení co nejvyšší kvality života po operaci. Navíc také není možné aplikovat jediný způsob derivace univerzálně pro všechny nemocné. Logicky tak vznikají vysoké nároky na operační tým, který musí byt schopen podle aktuálního nálezu vyhodnotit situaci a popřípadě naplánovaný typ derivace změnit.
Metodika
1. Historie
Urologické operace patří mezi nejstarší v dějinách medicíny. Nejdéle známou operací je cirkumcize. Již civilizace označovaná jako nilská znala operační vynětí močových kamenů z močového měchýře [1]. První pokus o propojení uropoetického aparátu se střevním segmentem byl datován a publikován v roce 1852 a je spojen se jménem sira Johna Simona. V Londýně operoval třináctiletého chlapce s extrofií močového měchýře, kterému cíleně vytvořil píštěl mezi terminálními úseky močovodů a rektem, která měla zabezpečit odtok moči do střevního segmentu. Pacient bohužel do roka zemřel na kalkulózní pyelonefritidu [2,3]. Komplikace, především refluxní pyelonefritidy, vedly k rozvoji dalších technik napojení uropoetického traktu do segmentu střeva. Éru příspěvků českých chirurgů do této problematiky započal v roce 1892 Karel Maydl. V Praze implantoval u pacienta s extrofií měchýře terčík trigona do sigmatu, přičemž tak využil přirozený antirefluxní mechanismus močovodů [4]. Z českých chirurgů je dále nutno zmínit Karla Pavlíka. Před více než 100 lety provedl v Praze první cystektomii u ženy. Derivaci moči zajistil implantací močovodů do pochvy. Pacientka přežívala dalších 16 let [5]. Koncept ortotopické neoveziky poprvé představili Tizzoni a Foggi v roce 1888 po provedení izoperistaltické náhrady s využitím ilea u psa [6]. V roce 1913 provedl první ortotopickou rekonstrukci na lidském subjektu Lemoine [7]. Do 50. let minulého století byla nejpoužívanější derivační metodou ureterosigmoideostomie, kterou do praxe zavedl Coffey [8,9]. Hodnocení dlouhodobých výsledků však přineslo velké zklamání. Byly popsány závažné infekční i metabolické komplikace této derivace, postihující až 80 % operovaných [10,11]. Hlavní příčinou komplikací byla nedokonalá technika implantace močovodů, která umožňovala reflux infikovaného střevního obsahu. Časté byly také striktury v místě anastomózy. To vedlo ke změnám na horních cestách močových s postupným zhoršováním až ztrátou renálních funkcí.
V roce 1950 byla popsaná Brickerem na svou dobu nepochybně převratná derivační technika – ureteroileostomie, která je v řadě center používána jako metoda volby dodnes [12]. Dalším milníkem v rozvoji derivací byl nepochybně kontinentní sférický ileální rezervoár, který vyvinul a v roce 1975 publikoval Nils Kock, známý též jako „Kock-pouch“ [13]. V 80. letech 20. století se objevila éra nízkotlakých (resp. detubulizovaných) rezervoárů. Střevo v tubulární formě se při derivaci moči prakticky přestalo používat [14]. Výhodu detubulizace objevil v roce 1959 Goodwin díky své „cup-patch“ technice augmentace močového měchýře [15]. Z prací autorů využívajících pro substituci močového měchýře detubulizovaný segment se ukázalo, že optimální náhrady je dosaženo, je-li vytvořen rezervoár sférického tvaru. Hlavní výhodou detubulizovaného segmentu je dostatečná kapacita při nízkém intravezikálním tlaku. Obecným principem, který je aplikovatelný na každý rezervoár, je LaPlaceův zákon, podle kterého je intravezikální/intraluminální tlak nepřímo úměrný průměru neoveziky. Tedy čím větší je průměr neoveziky, tím menší je tlak. A právě nízký intravezikální tlak je základním předpokladem kontinence a ochrany horních močových cest. Samotné detubulizace zvoleného střevního segmentu je dosaženo protnutím jeho celé stěny na antimezenteriální (event. antimezokolické) straně. Důležité je protětí cirkulárních a spirálovitých svalových snopců, čímž se dosáhne přerušení peristaltických stahů. Rekonfigurací střeva je vytvořen rezervoár s peristaltickými a antiperistaltickými vlnami, které proti sobě interagují. Nedochází tak k náhlým zvýšením intravezikálního tlaku. Vždy je ale nutno dbát, aby nedošlo k přetočení nebo zaškrcení cévní stopky mezenteria, s následným rizikem ischemie a nekrózy použitého segmentu. Pro vytvoření rezervoáru bylo v literatuře popsáno použití snad všech částí zažívacího traktu od žaludku po rektum. Všechny části zažívacího traktu jsou i nadále v klinické praxi používány s jedinou výjimkou, kterou je jejunum. Jeho použití vedlo k vážným metabolickým komplikacím (hyponatremie, hyperchloremie, metabolická acidóza), pro které bylo opuštěno.
2. Klasifikace a typy derivace moči
Derivačních metod bylo popsáno a do praxe uvedeno velké množství. Jednotlivé typy je možné klasifikovat podle různých kritérií. Z časového hlediska dělíme derivace na dočasné a trvalé. Podle kontinence na inkontinentní (vyžadují nutnost použití jímacích pomůcek) a kontinentní. Dalším možným kritériem je dělení podle lokalizace vyústění: zevní ústí na povrchu těla (např. ureteroileoanastomóza), vnitřní – do dutého orgánu (např. ureterosigmoideostomie). Kontinentní derivace dělíme podle typu a umístění neoveziky na ortotopické (kontinence neoveziky je zajištěna svěračem ponechané uretry), heterotopické (neovezika s kutánním kontinentním stomatem) a na derivace využívající anální svěrač. Podle využití/nevyužití segmentu zažívacího traktu popisujeme derivace přímé (bez využití segmentu zažívacího traktu – např. kutánní ureterostomie) a nepřímé (využívající segment zažívacího traktu – např. všechny ureteroenterostomie).
Podle klasifikace Mezinárodní společnosti pro kontinenci (ICS) dělíme kontinentní derivace podle místa vyústění rezervoáru na anální kontinentní derivace (rezervoáry kontrolované anální svěračem), kutánní heterotopické kontinentní derivace (rezervoáry, které jsou uloženy v dutině břišní a jsou vyprazdňovány katetrizací přes kožní stoma) a na ortotopické náhrady močového měchýře (rezervoáry uložené v místě původního močového měchýře, které jsou anastomozovány s uretrou a využívají ke kontinenci přirozený uzavírací mechanismus svěrače uretry)[16].
2.1. Inkontinentní derivace
Kožní ureterostomie – poměrně jednoduchá metoda, bez nutnosti manipulace se střevem. Vhodná v situaci vyžadující drenáž pouze jedné ledviny, použitelná je ale i při oboustranné derivaci. Výhodou je rychlost, jednoduchost, a tedy i malá operační zátěž. Odpadají také rizika, vyplývající z exkluze ileální kličky (ischemie, poruchy hojení anastomózy). Nevýhodou jsou časté dlouhodobé komplikace: vznik striktur v oblasti stomie, uroinfekce a tvorba litiázy. Vzhledem k vysoké frekvenci pozdních komplikací je používána výjimečně, nejčastěji jako forma paliativní derivace u polymorbidních pacientů s krátkou předpokládanou délkou dožití.
Ureteroileostomie – podle svého autora označovaná také jako derivace Brickerova [12]. Je nejčastěji používanou formou inkontinentní derivace moči po odstranění měchýře. Pro transport moči po cystektomii se používá exkludovaný, asi 15 cm dlouhý segment terminálního ilea, do jehož orálního konce jsou implantovány oba uretery. Aborální konec kličky tenkého střeva je vyveden navenek, identicky jako terminální ileostomie. Bricker původně implantoval oba močovody jednotlivě end to side (Obr. 1, 2). V dnešní době se používá modifikovaný způsob popsaný Wallacem ve dvou variantách. V případě typu Wallace I jsou konce obou močovodů sešity do společné ploténky izoperistalticky, u typu Wallace II jsou šity proti sobě, antiperistalticky (Obr. 3). V obou případech je pak ploténka našita na orální konec z pasáže exkludované kličky ilea. Výhodou této derivace je její jednoduchost a menší množství metabolických komplikací. Nevýhodou je nutnost nosit jímací pomůcky. Mezi dlouhodobé komplikace patří problémy se stomií (intestinoureterální striktury, parastomální hernie, únik moče při netěsnosti stomických pomůcek apod.) a rizika poškození horních močových cest (hydronefróza, pyelonefritidy a litiáza) [17].
1. Ureteroileostomie podle Brickera – exkluze kličky ilea z pasáže Převzato z: Droller JM. Surgical management of urologic disease an anatomic approach. St.Loius, Mosby – Yaer Book, Inc. 1992:1149. Fig. 1 Ureteroileostomy according to Bricker – ileal loop, excluded from the intestinal pasage According to: Droller JM. Surgical management of urologic disease: an anatomic approach. St.Loius, Mosby-Year Book, Inc. 1992:1149. 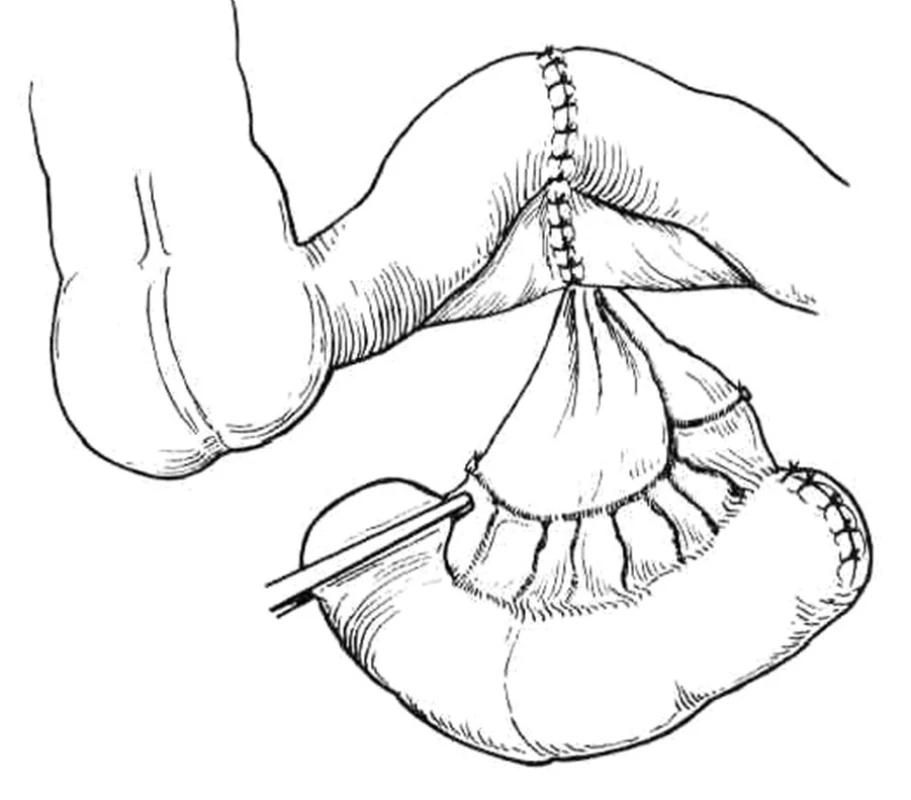
2. Ureteroileostomie podle Brickera – end to side uretero-ileo anastomoza Převzato z: Droller JM. Surgical management of urologic disease an anatomic approach. St.Loius, Mosby – Yaer Book, Inc. 1992: 1150. Fig. 2: Ureteroileostomy according to Bricker – end-to-side uretero-ileal anastomosis According to: Droller JM. Surgical management of urologic disease: an anatomic approach. St.Loius, Mosby-Year Book, Inc. 1992:1150. 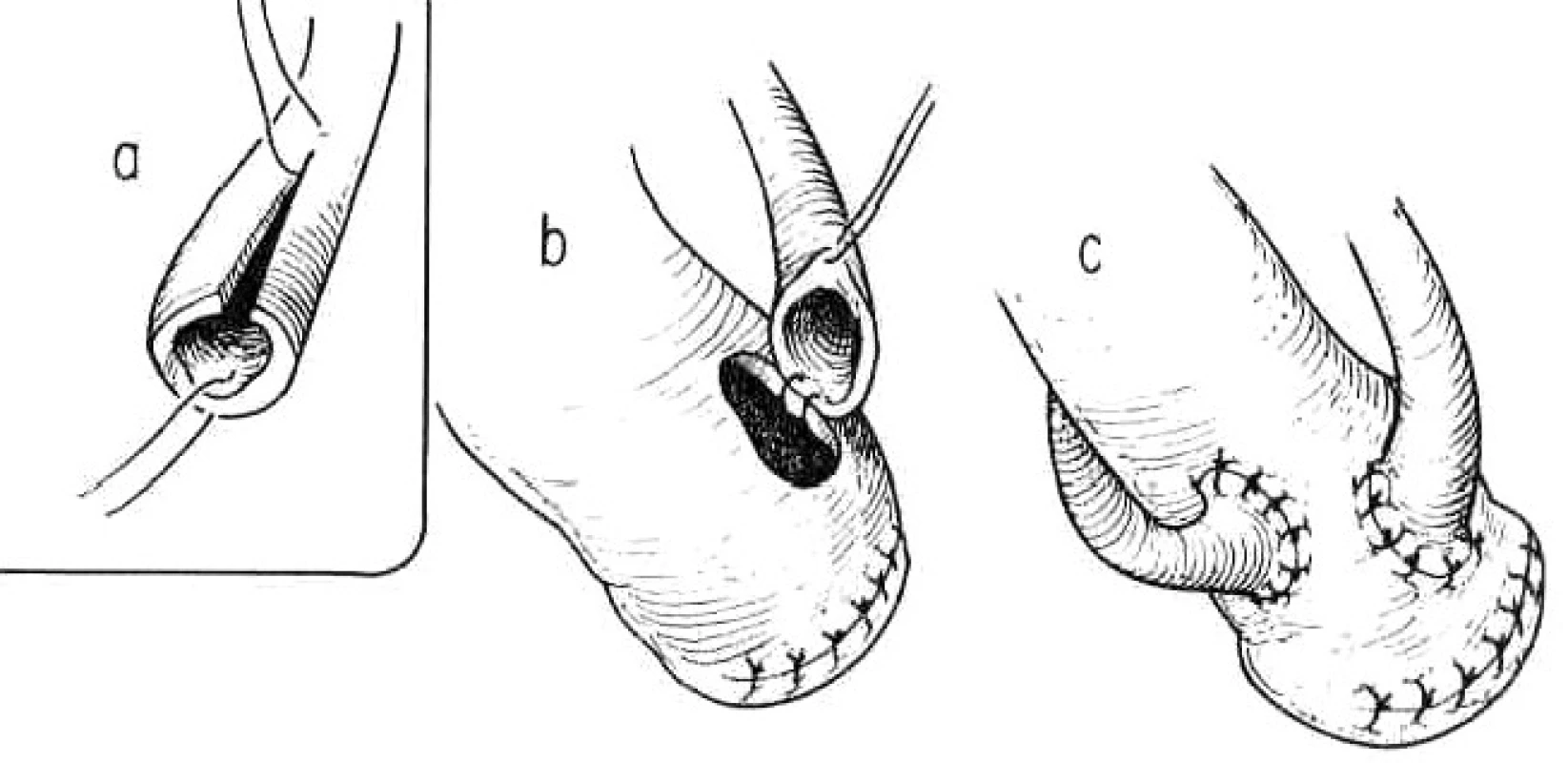
3. Ureteroileostomie podle Brickera s uretero-ileo anastomózou podle Wallace II. převzato z: Dvořáček j, Babjuk M, et al. Onkourologie. Praha, Galén 2005:184. Fig. 3: Ureteroileostomy according to Bricker with ureteroileal anastomosis according toWallace II According to: Dvořáček J, Babjuk M, et al. Onkourologie. Praha, Galén 2005:184. 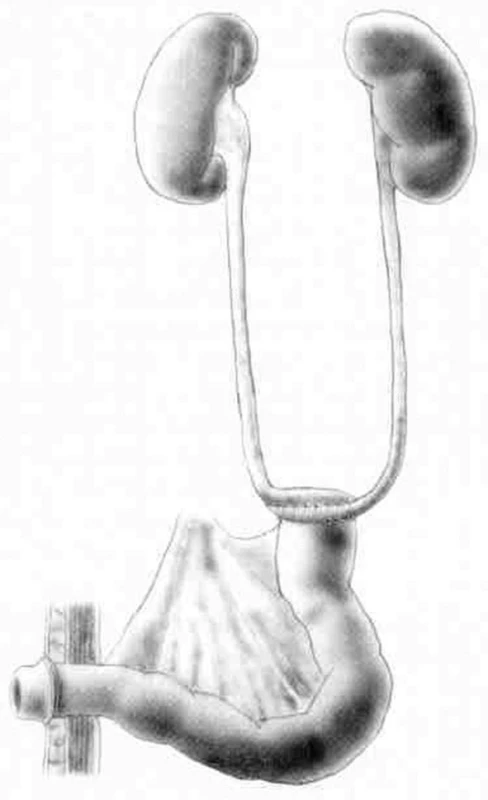
Jejunální konduit – popsán byl v roce 1935 Seiffertem. Vzhledem k závažným metabolickým komplikacím (tzv. syndrom jejunálního konduitu – hyponatremie, hyperchloremie, těžká acidoza) se v současné době v praxi nepoužívá [18,19].
Konduity s využitím segmentu tlustého střeva – využívají se zejména u pacientů po radioterapii v oblasti malé pánve, kde záření poničilo kličky tenkého střeva a terminální části ureterů. Pro vytvoření konduitu se používá exkludovaná klička transverza nebo sigmatu, širšího využití v praxi však nezaznamenaly.
2.2. Rezervoáry s kontinentním kutánním stomatem – jedná se o nitrotělní, vysokokapacitní, nízkotlaké a cévkovatelné rezervoáry. Kutánní stoma slouží k zabezpečení kontinence a vyprazdňování neoveziky intermitentní katetrizací. Modelování rezervoáru je založeno na exkluzi, detubulizaci a rekonfiguraci zvoleného střevního segmentu do sférického tvaru s implantací ureterů. Jako střevní úsek se obvykle používá preterminální ileum nebo ileocekální oblast v délce cca 50–75 cm podle zvoleného typu kontinentního kutánního stomatu. Stoma lze vytvořit z apendixu nebo z tubulizované části tenkého střeva a umísťuje se do pupku nebo do oblasti podbřišku.
Heterotopické neoveziky můžeme dělit podle techniky zvoleného stomatu a kontinence:
Neoveziky s cévkovatelným stomatem na principu intususcepce – „Kock pouch“. První široce rozšířený heterotopický rezervoár, původně vytvořený Nielsem Kockem jako řešení pro nemocné s terminální ileostomií. Až posléze byl použit pro derivaci moči po cystektomii. Je tvořen exkludovanou kličkou preterminálního ilea v délce 60–70 cm. Střední část v délce cca 40 cm se detubulizuje do rezervoáru tvaru U. Nedetubulizovaný orální a aborální konec exkludované kličky o délce 12–15 cm slouží k vytvoření intususcepčních chlopní: orální jako prevence reflexu do horních močových cest, aborální k zajištění kontinence [13]. Na podobném principu je založen také tzv. „Mainz pouch I“, který využívá ileocekální oblast. Do sférického tvaru se detubulizuje cékum a preterminální ileum, kontinence je zajištěná tvorbou intususcepční chlopně na nedetubulizovaném ileu, které je fixované k Bauhinské chlopni. Orální konec ilea se vyšívá zevně na břišní stěnu [14,20].
Neoveziky s cévkovatelným ventilem na principu zúženého a antiperistalticky uloženého střevního segmentu – tzv. „Indiana pouch“. Rezervoár je vytvořen z detubulizovaného céka a ascendens, stoma je tvořeno z plikovaného a antiperistalticky uloženého terminálního ilea [21]. Další možnou variantou je „Florida pouch“ nebo obdobný „Miami pouch“. Při tvorbě ventilu se podélně resekuje terminální ileum. Oba podtypy pouchů se liší jen modelováním neoveziky [22,23].
Neoveziky využívající ventil z apendixu a jejich modifikace – jedná se v podstatě o heterotopickou neoveziku „Mainz pouch I“. Její kontinence a evakuace je však zabezpečovaná stomatem z apendixu, podle tzv. „Mitrofanoffova principu“. Podstatou je zanoření apendixu do tunelu vzniklého podélnou incizí serózy a lamina muscularis céka v taenia libera [24]. Může být rovněž použit „Montiho princip“ – stoma vytvořené „arteficiálním“ apendixem. Ten je vytvořen transverzální tubulizací z 2–2,5 cm dlouhého exkludovaného segmentu ilea [25].
Princip intususcepčního ventilu je v současné době používán minimálně. Důvodem je hlavně náročná operační technika a vysoké riziko komplikací (píštěle, litiáza, detususcepce chlopně). V současné době je proto za nejvhodnější a nejbezpečnější techniku při tvorbě kontinentního stomatu u heterotopických náhrad močového měchýře považováno použití apendixu a jeho variant. Po operaci je nutné pravidelně vyplachovat neoveziku malým množstvím sterilního fyziologického roztoku (50–70 ml), aby se odloučil hlen tvořený sliznicí střeva. Rezervoár v průběhu několika měsíců postupně zvětší svůj objem. V ideálním případě pak je nutnost katetrizace jen každých asi 6 hodin.
2.3 Kontinentní derivace moči kontrolované análním sfinkterem – využívají k jímání moči rektum a sigma, zachování kontinence je dosaženo díky funkci análního svěrače. Do skupiny těchto derivací patří klasická ureterosigmoideostomie. Do poloviny minulého století velmi populární metoda, v současnosti však již používána není. Důvodem je malá kapacita nedetubulizovaného rektosigmatu a hlavně četné komplikace (pyelonefritidy, poškození renálních funkcí, poruchy acidobazické rovnováhy a závažné změny v elektrolytovém hospodářství). Poznatky při tvorbě vnitrotělních rezervoárů přinesly koncem minulého století několik technik, umožňujících zvětšení objemu rektosigmatu detubulizací. V praxi je využíván „Mainz pouch II“. Jeho princip spočívá v detubulizaci a rekonfiguraci rektosigmatu s cílem zvýšení jeho kapacity. Močovody jsou implantovány do rezervoáru antirefluxně [26]. Metoda je relativně jednoduchá a je vhodnou alternativou zejména u starších pacientů. Nevýhodou je skutečnost, že dlouhodobé působení moči na střevní sliznici zvyšuje riziko vzniku adenokarcinomu zažívacího traktu. Tento typ derivace obvykle také vyhovuje více ženám, které jsou oproti mužům zvyklé močit vsedě.
2.4. Ortotopické rezervoáry (kontinentní náhrady močového měchýře) – jedná se o náhradu močového měchýře v pravém slova smyslu. Neovezika vytvořená z detubulizovaného střevního segmentu je anastomozována na močovou trubici se zachovaným a funkčním svěračem. Na tvorbu neoveziky se mohou použít různé střevní segmenty, v současné době je nejpoužívanějším úsekem preterminální ileum, v menší míře ileocekální oblast nebo colon sigmoideum. Nově vytvořený rezervoár má v ideálním případě tvar koule. Střevo se modeluje do tvarů písmen M, W nebo U. Močovody se podle zvolené úpravy střevního segmentu implantují antirefluxně nebo přímo, bez antirefluxního principu.
V současné době jsou nejpoužívanější typy rezervoárů tyto:
neovezika dle Hautmanna – provádí se detubulizací 60–70 cm exkludované kličky preterminálního ilea a její konfigurací do tvaru písmene M nebo W. Uretery se napojují přímo na oba konce nedetubulizovaného střeva exkludované kličky. Otvor pro anastomózu s uretrou se tvoří v nejspodnějším konci neoveziky [27,28], neovezika dle Studera – používá se 60 cm exkludované kličky preterminálního ilea. Detubulizuje se pouze aborálních 40–44 cm ve tvaru písmene U, zbytek je ponechán v tubulizované formě jako aferentní klička, na jejíž orální konce se přímo anastomozují močovody [29].
Ortotopické neoveziky se původně prováděly pouze u mužů. V současné době je tato indikace rozšířená i u žen. Zachování distálních 2/3 močové trubice umožňuje dosažení vysokého stupně kontinence. Bezprostředně po operaci má rezervoár malou kapacitu. Při správném režimu však postupně objem neoveziky dosahuje až 500 ml. Pacienti močí pomocí břišního lisu, mají slabší proud moči, někdy k dosažení plného vyprázdnění musejí provádět autokatetrizaci. Zhruba 85–90 % pacientů dosahuje denní kontinence bez vložky, nebo s jednou vložkou, noční inkontinence se pohybuje mezi 20–30 % [1].
Derivačním výkonem je dnes možné nahradit téměř všechny funkce močového měchýře a močových cest – transportní, jímací i evakuační. Vzhledem ke specifickým vlastnostem vrstev svaloviny močového měchýře se však nikdy nejedná o rovnocennou náhradu. Ani současné poznatky tkáňového inženýrství neumožňují vytvoření plnohodnotné náhrady. Nejčastěji využívanou variantou rekonstrukce pro svou jednoduchost a standardizovanou techniku tak zůstává na většině pracovišť konstrukce konduitu podle Brickera. Operační nález a přípravu kličky ilea exkludované z pasáže ukazuje Obr. 4. Dalším krokem je zavedení ureterálních splintů oboustranně, ideálně do úrovně ledvinných pánviček a vytvoření společné lišty na protnutých koncích obou ureterů (Obr. 5). Dokončení ureteroileoanastomózy ukazuje Obr. 6.
4. Operační nález: klička ilea exkludovaná z pasáže, ileoileální anastomóza end-end Fig. 4: Surgical finding: loop of the ileum, excluded from the passage, ileo-ileo anastomosis end-to-end 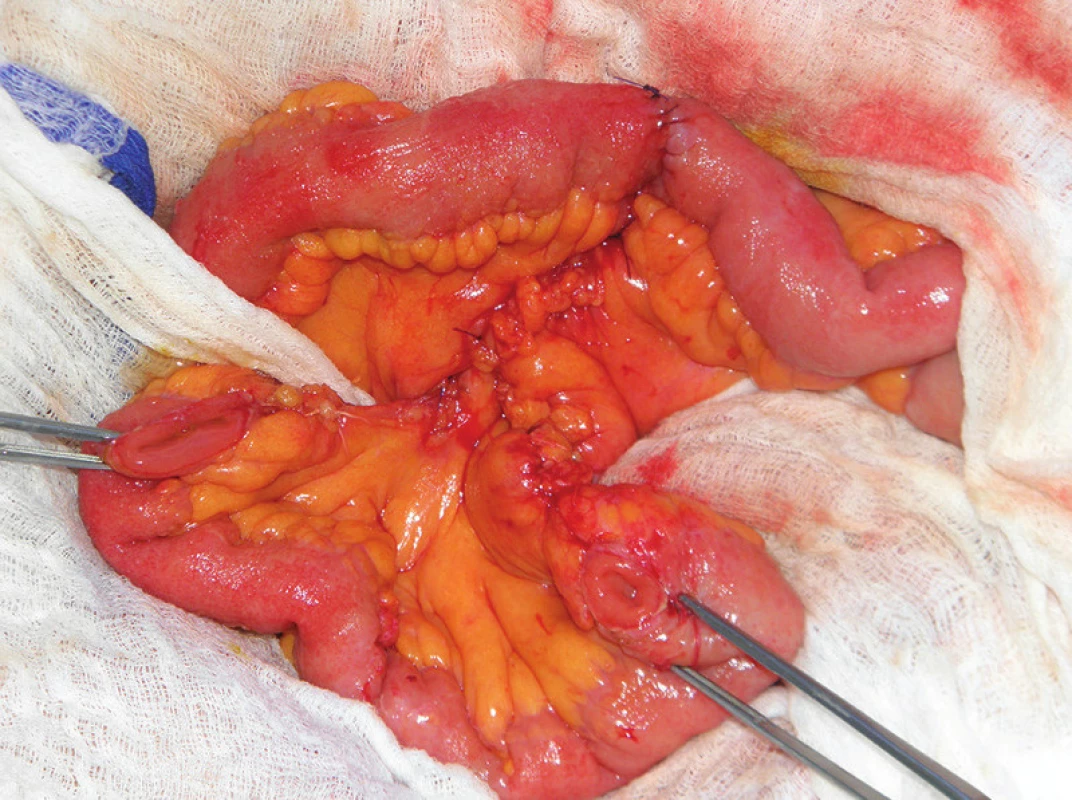
5. Operační nález: příprava společné lišty obou ureterů před ureteroileoanastomózou – do obou ureterů jsou zavedeny splinty Fig. 5: Surgical finding: preparation of the common urethral plate before constructing ureteroileoanastomosis – splints were inserted into both ureters 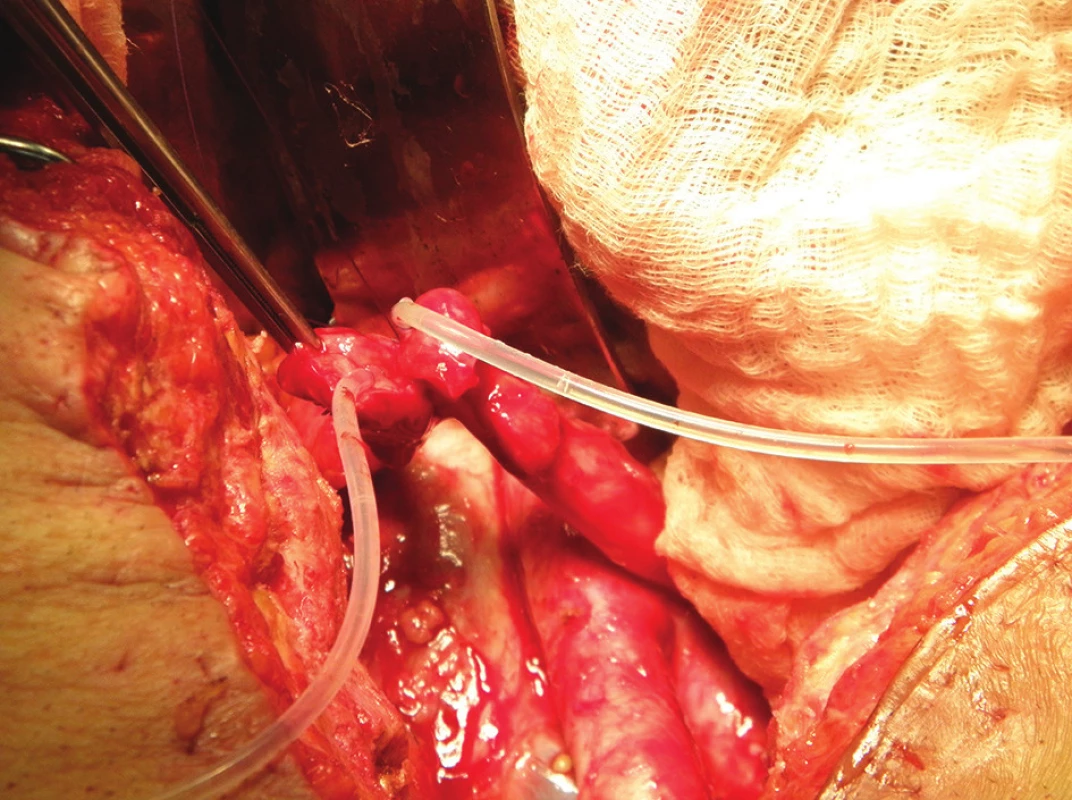
6. Operační nález: dokončená ureteroileoanastomóza (bílá šipka) Fig. 6: Surgical finding: finished ureteroileoanastomosis (white arrow) 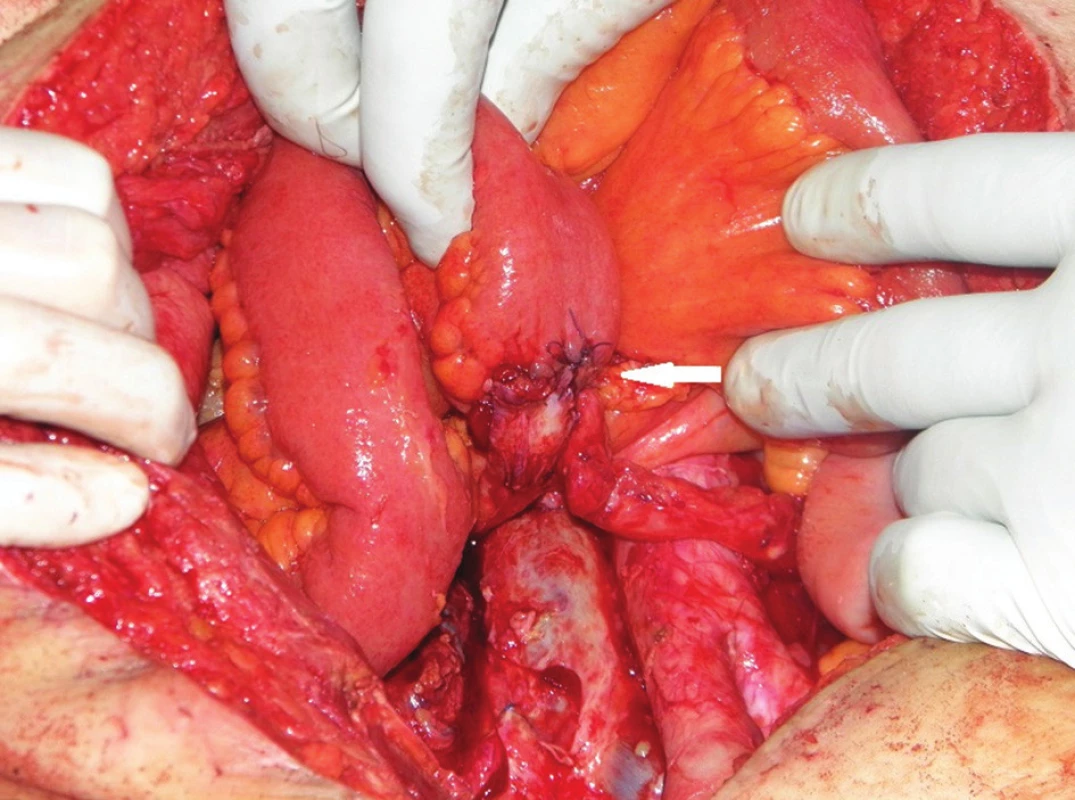
3. Komplikace derivačních výkonů
Komplikace spojené s operacemi, které zajišťují derivaci moči, je možné hodnotit podle obecné klasifikace chirurgických komplikací dle Clavien-Dindo, podle společného jmenovatele komplikace nebo podle doby jejich vzniku. Mezi obecné řadíme krvácení, poruchy funkce ledvin s oligo - až anurií, plicní embolizaci, žilní trombózu a komplikace infekční. Specifické komplikace pak vyplývají z porušení kontinuity zažívacího traktu. Patří sem pooperační poruchy pasáže a hojení enter-enteroanastomózy, ischemie exkludované kličky (torze nebo špatná příprava cévního zásobení kličky), urinózní sekrece v důsledku dehiscence ureteroileoanastomózy nebo jiné části sutury rezervoáru. Jako další je nutné uvést komplikace spojené s vyprazdňováním rezervoáru (inkontinence, striktury). U heterotopických náhrad uvádí většina autorů kontinenci okolo 90 %. Inkontinence je nejčastěji způsobená selháním sfinkterového mechanismu na podkladě ischemických či fibrózních změn. Jediným řešením pak většinou bývá chirurgická korekce. Pacienti s ortotopickou náhradou močového měchýře dosahují dříve denní než noční kontinence. Dosažení optimální úrovně kontinence obvykle trvá 6–12 měsíců, zejména po zvýšení kapacity rezervoáru na 450–550 ml a zlepšení compliance stěny neoveziky. Míra denní kontinence se po substituci neoveziky pohybuje v rozmezí 87–98 %, míra noční kontinence v rozmezí 72–95 % (30). Striktura kožního stomatu (resp. katetrizačního konduitu) se vyskytuje u 15–30 % pacientů, řešením jsou dilatace nebo opět chirurgická korekce. Co se týká frekvence časných pooperačních komplikací, udává většina pracovišť hodnoty okolo 16 % [1].
Nejčastěji používanou tkání pro vytvoření nového rezervoáru moči je střevní segment. Ten však má samozřejmě jiné vlastnosti anatomické i funkční než močový měchýř. Především se jedná o naprosto odlišné funkce resorpční a sekreční, což vede k metabolickým změnám. Metabolické důsledky náhrady měchýře závisí na typu a délce užitého střevního segmentu. Čím větší je plocha střeva a čím proximálnější segment je použit, tím jsou metabolické změny závažnější. Použití žaludku má za následek hypochloremickou metabolickou alkalózu, využití jejuna vede k hyponatremii a hyperkalemii. Při použití aborálnějších úseků střeva můžeme pozorovat hyperchloremickou metabolickou acidózu. Nejčastější komplikací intestinálních derivací obecně je metabolická acidóza. Její příčinou je hlavně reabsorpce chloridu amonného (NH4Cl), v menší míře pak sekrece bikarbonátů. Schopnost kompenzovat rozvíjející se acidózu závisí na stavu renálních funkcí, při nedostatečnosti ledvin se acidóza prohlubuje. Ke korekci metabolické acidózy používáme perorální bikarbonáty, k zajištění optimálních podmínek kompenzace je důležitý dostatečný příjem tekutin. Dlouhodobý posun acidobazické rovnováhy vede v organismu k depleci kalcia na podkladě mobilizace HCO3 z kostí a jejich následné demineralizaci. Resekce ilea zhoršuje také resorpci vitaminu D, což má známé negativní důsledky na kostní metabolismus.
Jinou skupinu očekávaných komplikací představují změny v souvislosti se zkrácením segmentu zažívacího traktu, které se projeví snížením specifické funkce daného úseku. Pozornost je nutné věnovat situacím, kdy je pro neoveziku použito funkční terminální ileum, resp. ileocékální chlopeň. Tato situace může způsobit malabsorpci žlučových kyselin a tuků se steatoreou, urychlení střevní pasáže, hypovitaminózu a zvýšený sklon k tvorbě cholecystolitiázy a urolitiázy. Deficit vitaminu B12 v důsledků malabsorpce v terminálním ileu vzniká při resekci více než 50 cm terminálního ilea. Manifestuje se často pozdně, po 3–5 letech, kdy dojde k vyčerpání zásob organismu. Deficit vitaminu B12 je většinou subklinický, přesto se s ohledem na délku použitého segmentu střeva doporučuje kontrola hladiny B12 s pěti a víceletým odstupem od provedení náhrady. Při užití segmentu zažívacího traktu je nutné počítat i s reabsorpcí léků, které jsou ledvinami vylučovány v nezměněné podobě. Příkladem mohou být cytostatika – během podávání chemoterapie se proto doporučuje permanentní drenáž neoveziky cévkou.
Z dalších možných komplikací kontinentní derivace moči je nutno zmínit zvýšený výskyt urolitiázy, resp. konkrementů v neovezice. Incidence se podle různých autorů pohybuje okolo 10 %. Příčinou mohou být infekce, nadprodukce hlenu a nedostatečné vyprázdnění pouche v kombinaci s metabolickými změnami. Nadprodukci hlenu a jeho hromadění v neovezice se předchází jeho pravidelnými výplachy fyziologickým roztokem. K mukolýze lze použít rovněž N-acetylcystein. Pozdní komplikací je rozvoj dilatace horních cest močových v důsledku striktury ureteroenterické anastomózy. Může se přechodně řešit zavedením ureterálních stentů nebo založením punkční nefrostomie. Pro trvalou nápravu je obvykle nutná operační revize a provedení reanastomózy. Méně častou příčinou hydronefrózy je stenóza stomie. Další komplikací, na kterou je nutné myslet, je možnost vzniku parastomálních hernií a kýl v jizvě po laparotomii. Velké kýly nejsou jen kosmetickým defektem, mohou také zhoršovat funkčnost zvoleného typu derivace. Jedinou možností v těchto případech je chirurgická korekce.
Trvalý kontakt střevní sliznice s močí je spojen s vyšším rizikem vzniku střevního adenokarcinomu. Odhaduje se, že riziko vzniku sekundární malignity je až 80krát vyšší oproti normální populaci. Tumory se obvykle objevují s latencí 15–25 let, a to nejčastěji v oblasti ureteroenterické anastomózy. U derivací, kde je klička exkludovaná z pasáže, a nedochází tak ke kontaktu moči se stolicí, je riziko vzniku nádorů nižší [31].
Závěr
V posledních letech byla popsána řada nových technik a principů derivačních výkonů po odstranění močového měchýře. Výběr vhodného typu derivace závisí na celkovém stavu pacienta, jeho schopnostech, sociálním postavení i rodinném zázemí. Vzhledem k náročnosti těchto operací a častému výskytu časných i pozdních komplikací je nezbytné pacienty před výkonem plně informovat o všech možných rizicích a úskalích léčby. Ideální derivace moči neexistuje, volba typu operace proto vždy závisí na operačním nálezu, zkušenostech a tradicích konkrétního pracoviště.
MUDr. Jaroslav Jarabák
Urologické oddělení Thomayerovy nemocnice
Vídeňská 800
140 59 Praha 4 – Krč
e-mail: jaroslav.jarabak@ftn.cz
Sources
1. Čermák A, Pacík D, Vít V. Kontinentní a inkontinentní derivace moči, měchýř šetřící postupy. Urol List 2012;10 : 34–43.
2. Jarolím L. Derivace moči po cystektomii. Urol List 2008; 6 : 53–59.
3. Simon J. Ectopia vesicae( absence of the anterior walls of the bladder and pubis abdominal parieties); operation for directing the orifices of the ureters into the rectum; temporary success; subsequent death; autopsy. Lancet 1852;2 : 568–570.
4. Maydl K. Prvé případy radikálního léčení rozštěpeného měchýře. Čas Lék Čes 1894;33 : 337–343.
5. Pawlik K. Exstirpace močového měchýře. Čas Lek Čes 1890;29 : 705–706.
6. Tizzoni G, Foggi A. Die wiederherstellung der harnblase. Centralblatt für chirurgie 1888;15 : 921–924.
7. Lemoine G. Creation d’une vessie nouvellepar un procedure personnel apres cystectomie gorale pour cancer. J Urol Med Chir 1913;4 : 367.
8. Coffey RC. Physiologic implantation of the severed ureter on common bile duct into the intestine. JAMA 1911;56 : 397–403.
9. Coffey RC. Bilateral submucous transplantation of ureters into large intestine by tube technic. JAMA 1929;93 : 1529–1538.
10. Ferrit DO, Odel HM. Elektrolyte pattern of the blood after bilateral ureterosigmoidostomy. JAMA 1950;142 : 634–641.
11. Lapides J. Mechanism of electrolyte imbalance following ureterosigmoid transpantation. Surgery Gynekology and Obstetrics 1951;93 : 691–706.
12. Bricker EM. Bladder substitution after pelvic evisceration. Surg Clin North Am 1950;30 : 1511–1521.
13. Kock NG, Nelson AE, Norlen EL, et al. Urinary diversion via kontinent ileum reservoir. Clinical experience. Scand J Urol Nephrol 1978;49,Suppl:23–31.
14. Thürofff JW, Alken P, Riedmiller H, et al. 100 cases of Mainz-pouch (mixed augmentationęn recum for bladder augmentation and urinary diversion. Word J Urol 1985;11 : 179–184.
15. Goodwin WE, Winter CC, Barker WF. Cup-patch technique of ileocystoplasty for baldder enlargement or partila substitutes. Surg Gynecol Obstet 1959;108 : 240–244.
16. Thüroff JW, Mattiasson A, Andersen JT, et al. The standardization of terminology and assessment of functional characteristics of intestinal urinary reservoirs. Neurourol Urodynam 1996;15 : 499–511.
17. Schmidt J, Madersbacher S, Eberle J, et al. Long term outcome of ileal konduit urinary diversion. Eur Urol 2002;1,Suppl:160.
18. Seifert L. Die darm-siphonblase. Arch Klin Chir 1935;183 : 569–574.
19. Mansson W, Lindstedt E. Elektrolyte disturbances after jejunal condiut urinary diversion. Scan J Urol Nephrol 1978;12 : 17–21.
20. Thüroff JW, Alken P, Riedmiller H, et al. 100 cases of Mainz-pouch. Continuing experience and evolution. J Urol 1988;140 : 283–288.
21. Rolland RG, Mitchell ME, Bihrle R, et al. Indiana continent urinary reservoir. J Urol 1987;137 : 1136–1139.
22. Lockhart JL. Remodeled right colon. An alternative irinary reservoir. J Urol 1987;138 : 730–734.
23. Bejany DE, Politano VA. Stapled and nonstapled tapared distal ileum for construction of a kontinent colonic urinary reservoir. J Urol 1988;140 : 491–494.
24. Riedmiller H, Berger R, Miller S, et al. Continent appendix stoma. A modification of the Mainz pouch technique. J Urol 1990;143 : 1115–1117.
25. Monti PR, Carwalho R, Dutta MA, et al. New techniques for construction of efferent konduit based upon Mitrofanoff principle. Urology 1997;49 : 112–115.
26. Fisch M, Wammack R, Miller SC, et al. The Mainz pouch II (sigma-rectum pouch). J Urol 1993;149 : 258–263.
27. Hautmann RE, Egghart R, Frohneberg D, et al. Die ileum-neoblaze. Urologe 1987;26 : 67–73.
28. Hautmann RE, de Petriconi R, Gottfried HW, et al. The ileal neobladder. Complication and functional results in 363 patients after 11 years of follow-up. J Urol 1999;161 : 422–428.
29. Studer UE, Danuser H, Merz VW, et al. Experience in 100 patients with an ileal low pressure bladder substitute combined with an afferent tubular isoperistaltis segment. J Urol 1995; 154 : 49–56.
30. Thurairaja R, Burkhard FC, Studer UE. Ortotopická neovezika – současný stav. Urol List 2008;6 : 5–12.
31. Babjuk M. Derivace moči u nemocných s nádory močového měchýře. In: Dvořáček J, Babjuk M, et al. Onkourologie 1. vyd. Praha, Galen 2005 : 198.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2014 Issue 1-
All articles in this issue
- Erectile dysfunction as a result of spinal trauma
- Laparoscopic cholecystectomy in children and adolescents
- Intraoperative CT-based spinal navigation: the initial 295 implants experience
-
Is thyroid and parathyroid surgery safe?
Is it suitable for one-day surgery? - Biliary stent as a cause of bowel obstruction
- Pelvic exenteration in the treatment of advanced tumours of the small pelvis
- Total pelvic exenteration – strategy of the surgery
- Urine derivation after radical cystectomy
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Urine derivation after radical cystectomy
-
Is thyroid and parathyroid surgery safe?
Is it suitable for one-day surgery? - Pelvic exenteration in the treatment of advanced tumours of the small pelvis
- Biliary stent as a cause of bowel obstruction
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

