-
Medical journals
- Career
Sekundární prevence ischemické choroby srdeční a chorob periferních tepen kombinací antiagregační a antikoagulační léčby
Odborné stanovisko České kardiologické společnosti, České internistické společnosti ČLS J.E. Purkyně a České angiologické společnosti ČLS J.E. Purkyně k výsledkům studie COMPASS
Authors: Petr Widimský 1; Debora Karetová 4; Richard Češka 2; Miloš Táborský 5; Hana Rosolová 3; Jean-Claude Lubanda 4; Aleš Linhart 4
Authors‘ workplace: Kardiocentrum 3. LF UK a FN Královské Vinohrady, Praha 1; Centrum preventivní kardiologie III. interní kliniky 1. LF UK a VFN v Praze 2; Centrum preventivní kardiologie II. interní kliniky LF UK a FN Plzeň 3; II. interní klinika kardiologie a angiologie 1. LF UK a VFN v Praze 4; I. interní klinika – kardiologická LF UP a FN Olomouc 5
Published in: Vnitř Lék 2019; 65(11): 704-710
Category: Guidelines
Doporučené postupy pro sekundární prevenci ischemické choroby srdeční a ischemické choroby dolních končetin před studií COMPASS
Ischemická choroba srdeční
Kardiovaskulární onemocnění (KVO) stojí stále na prvním místě jako nejvýznamnější příčina úmrtí. V období mezi lety 1985–2012 došlo v české populaci k významnému snížení úmrtnosti na ischemickou chorobu srdeční (ICHS) o více než 50 % u mužů a o 43 % u žen. KV mortalita klesla u mužů i u žen v průměru o 52 % [1]. Na snížení KV úmrtnosti se podílela jak léčba akutních stavů (především invazivní léčba akutního infarktu myokardu), tak i preventivní opatření, nefarmakologická i farmakologická.
Primární prevence může snížit incidenci ICHS, tj. výskyt nových onemocnění ICHS včetně náhlých koronárních úmrtí, a tím redukovat i prevalenci choroby v populaci.
Úkolem sekundární prevence je zamezit recidivě koronární příhody, zabránit progresi choroby, ev. navodit regresi aterosklerózy, a tak snižovat riziko ICHS i ostatních KV onemocnění [2]. Výsledky studií EUROASPIRE I–V, které proběhly v letech 1995–2017 v řadě evropských zemí včetně ČR, však nejsou uspokojivé. Velký potenciál je v modifikaci životního stylu i v nedostatečné léčbě hypertenze a dyslipidemie (DLP), a to včetně nedostatečné adherence pacientů k léčbě [3].
Pacient s ICHS je prioritou sekundární prevence KV onemocnění. Odvykání kouření u pacientů kuřáků je jednou z nejdůležitějších úprav životního stylu, neboť po zanechání kouření se nejvíce snižuje celkové KV riziko. Fyzická aktivita nemusí mít tréninkový charakter, ale měla by být aerobní a hlavně pravidelná; 6 000 kroků denně je jednoduchý a účinný pohyb. Hlavní zásadou diety v rámci sekundární prevence ICHS je záměna nasycených mastných kyselin nenasycenými, dostatek ovoce, zeleniny, luštěnin a ořechů. Nepatří do ní nadměrné solení ani konzumace alkoholu; dle posledního doporučení lze tolerovat 1 alkoholový nápoj za den u žen a maximálně 2 alkoholové nápoje za den u muže (1 alkoholový nápoj je přibližně 1/3 l piva nebo 1 dcl vína nebo 5 cl destilátu). Doporučený body mass index (BMI) v rozmezí 20–25 kg/m² je v asociaci s nejnižší KV úmrtností.
Farmakoterapie v sekundární prevenci zahrnuje několik oblastí: antitrombotickou léčbu (antiagregancia anebo antikoagulancia), hypolipidemickou léčbu, betablokátory a inhibitory ACE. Dlouhodobá antitrombotická léčba spočívá především v podávání kyseliny acetylsalicylové (ASA, aspirin) v nízkých dávkách (75–100 mg). Další možnosti jsou stručně shrnuty v tab. 1 a v doporučených postupech Evropské kardiologické společnosti (European Society of Cardiology – ESC) [4].
Antitrombotická léčba
Antitrombotickou léčbu v dlouhodobé sekundární prevenci kardiovaskulárních chorob přehledně shrnuje tab. 1.
Table 1. Antitrombotická léčba v dlouhodobé sekundární prevenci kardiovaskulárních chorob podle doporučení Evropské kardiologické společnosti (ESC guidelines) 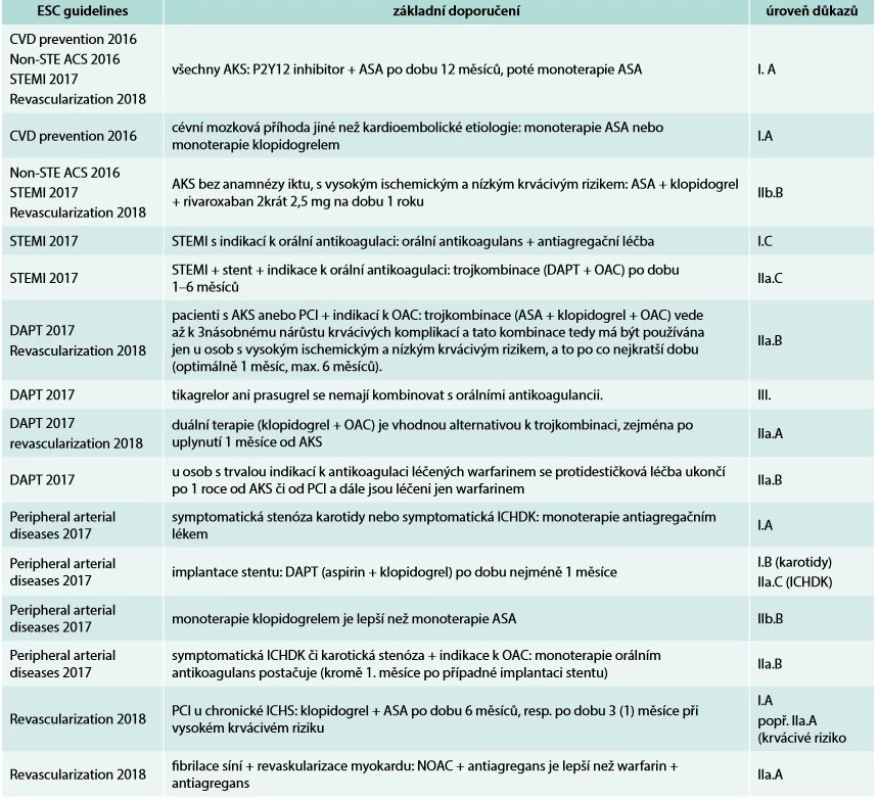
AKS/ACS – akutní koronární syndrom/Acute Coronary Syndrome ASA – kyselina acetylsalicylová/AcetylSalicylic Acid DAPT – duální protidestičková léčba/Dual Antiplatelet Therapy ICHDK – ischemická choroba dolních končetin NOAC – nová perorální antikoagulancia/New Oral AntiCoagulants OAC – perorální antikoagulancia/Oral AntiCoagulants Hypolipidemická léčba
Hypolipidemická léčba zahrnuje maximální dávku statinu (80 mg atorvastatinu nebo 40 mg rosuvastatinu), který se nasazuje od prvního dne akutní koronární příhody. K dosažení cílové hodnoty LDL-cholesterolu (LDL-C) < 1,8 mol/l nebo ještě níže je často nutno kombinovat tuto léčbu s ezetimibem. V případě, že ani kombinace statin + ezetimib nevede k dosažení cílové hodnoty LDL-C, je možné indikovat léčbu PCSK9 inhibitory. Tato léčba je v ČR hrazena, pokud má pacient při maximálně tolerované dávce statinu v kombinaci s ezetimibem LDL-C > 3 mmol/l [5].
Betablokátory a inhibitory ACE
Důležitými léky v sekundární prevenci ICHS jsou inhibitory ACE (v případě intolerance inhibitory receptorů pro angiotenzin II) a betablokátory. Příznivý účinek betablokátorů je dán především snížením rizika náhlé smrti a ischemie/infarktu myokardu. Krevní tlak pacienta s ICHS, tj. velmi vysokým celkovým KV rizikem, by měl být u většiny < 130/80 mm Hg. U diabetiků, mladších hypertoniků (do 65 let věku) nebo u nemocných s chronickým onemocněním ledvin či pacientů zároveň po cévní mozkové příhodě, by se měl zvážit systolický tlak mezi 120–130 mm Hg. V úvahu je třeba vzít toleranci pacienta k nižšímu tlaku a také jeho věk; u starších pacientů (nad 65 let věku) se spokojíme s tlakem < 140/90 mm Hg, u ještě starších (80 let a více) můžeme tolerovat i vyšší krevní tlak. Důležitá je úprava tepové frekvence; ideální tepová frekvence je mezi 60–70 /min.
Vzhledem ke známé horší adherenci pacientů k užívání více tablet se doporučuje využívat především fixní kombinace 2 a více léků v jedné tabletě [6].
Periferní tepenná onemocnění
Z mnoha dat je zřejmé, že povědomí a péče o nemocné s periferní aterosklerózou jsou oproti nemocným s ischemickou chorobou srdce horší. Tito nemocní jsou navíc často méně disciplinovaní v režimových léčebných opatřeních (proti pacientům s ICHS), méně často jsou léčeni hypolipidemiky i antitrombotiky [7]. Léčebným záměrem je zlepšení osudu nejen ischemií postiženého orgánu (nejčastěji dolní končetiny), ale i prodloužení celkového přežití.
Antitrombotickou léčbu specifikujeme podle stadia onemocnění a komorbidit: u asymptomatické ischemické choroby dolních končetin (ICHDK), u níž nejsou indicie o generalizaci procesu, je v současnosti role podávání acetylsalicylové kyseliny (ASA) zpochybněna (v evropských doporučeních – ESC 2017, se silou důkazů IIIa). Nicméně u stenóz karotických tepen > 50 % je nadále protidestičkový lék indikován. Stabilní, symptomatické nemocné (klaudikující) léčíme buď ASA nebo klopidogrelem (mírná preference klopidogrelu na základě studie CAPRIE [8]). Pokud by nemocný nemohl užívat ASA a současně nebyl respondérem na léčbu klopidogrelem, je alternativou tikagrelor (srovnatelný efekt s klopidogrelem doložen studií EUCLID [9]). Pokud je nemocný indikován k léčbě antikoagulační (např. pro fibrilaci síní), pak je tato pro stabilní nemocné s ICHDK postačující a nepodáváme dle současných doporučení protidestičkový lék navíc. Nemocní po revaskularizaci periferních tepen dostávají antitrombotickou léčbu doživotně a cíleně: po endovaskulární intervenci léčíme duální protidestičkovou léčbou obvykle 1 (až 6) měsíc, optimálně s určením délky léčby lékařem, který daný revaskularizační výkon prováděl (tedy se znalostí rozsahu postižení, kvality výtokového traktu, případných procedurálních komplikací apod), dále pak podáváme v monoterapii ASA nebo klopidogrel. Po chirurgické revaskularizaci se rozhoduje lékař buď pro protidestičkovou monoterapii acetylsalicylovou kyselinou nebo klopidogrelem (u většiny bypassů), nebo pro dočasnou duální protidestičkovou léčbu – u protetických bypassů, případně u venózních bypassů ve zvláštních situacích pro léčbu antikoagulační. Optimální antitrombotická strategie u nemocných ve fázi kritické končetinové ischemie není doporučeními stanovena, obvykle léčíme kombinací nízkomolekulárního heparinu a protidestičkového léku (zejména ve fázi hospitalizace, před definitivním revaskularizačním výkonem).
Samozřejmostí u všech nemocných s projevy periferního tepenného onemocnění je kromě opatření režimových (pravidelná denní chůze, středomořská dieta, nekouření) také tzv. „best medical therapy“ spočívající vedle zmíněných antitrombotických postupů i v intenzivní hypolipidemické léčbě k dosažení cílové hladiny LDL-C < 1,8 mmol/l a také korekci krevního tlaku, preferenčně inhibitory ACE (případně sartany). Nemocní s projevy periferní tepenné aterosklerózy jsou považováni stejně jako nemocní s ICHS za vysoce rizikové pro další kardiovaskulární příhody [10].
Cíle a hlavní výsledky studie COMPASS
Rivaroxaban (perorální přímý selektivní inhibitor koagulačního faktoru Xa) byl prokazatelně účinný u nemocných s akutním koronárním syndromem (AKS) ve studii ATLAS – ACS 2 (TIMI-51), v níž v dávce 2krát denně 2,5 mg signifikantně snížil celkovou mortalitu během 13 měsíců po AKS ve srovnání s placebem [11]. Vzhledem k tomu, že byl podáván jako třetí antitrombotikum k duální protidestičkové léčbě, byl tento benefit významně snížen častým výskytem krvácivých komplikací. Studie COMPASS proto byla zaměřena na nemocné s pokročilými formami klinicky manifestní aterosklerózy (91 % nemocných mělo významnou ICHS, 27 % mělo významnou aterosklerózu dolních končetin nebo karotid, 18 % nemocných mělo obě tyto hlavní vstupní diagnózy), kteří nejsou indikováni k duální protidestičkové léčbě, a tedy testovala účinnost a bezpečnost dvojkombinace antiagregační (aspirin) s antikoagulační (rivaroxaban) léčbou v sekundární prevenci. Podrobnosti o designu studie včetně vstupních a vylučovacích kriterií jsou uvedeny v příslušném původním článku [12] a zde je z prostorových důvodů neuvádíme. Dvojkombinace antiagregační a antikoagulační léčby (aspirin + warfarin) byla testována již v minulosti ve studii WARIS II [13], která ukázala možný potenciál takové kombinace (snížení výskytu kombinovaného end-pointu ze 20 % na 15 %, tj. o 25 %), ale benefit byl prakticky úplně vymazán významně vyšším rizikem krvácení, takže mortalita byla stejná při monoterapii aspirinem jako při kombinované léčbě. Navíc ve skupině kombinované léčby více než třetina (!) nemocných přerušila studijní medikaci předčasně.
Studie COMPASS zařadila 27 395 nemocných se stabilními, klinicky manifestními formami aterosklerózy. Dvě třetiny nemocných měly v anamnéze infarkt myokardu, 4 % iktus, 38 % bylo diabetiků, 21 % mělo chronické srdeční selhání, 27 % ischemickou chorobu dolních končetin nebo významnou stenózu karotid. Pacienti byli randomizováni do 3 skupin: (A) rivaroxaban 2krát 2,5 mg + aspirin 1krát 100 mg, (B) rivaroxaban 2krát 5 mg, (C) aspirin 1krát 100 mg. Primární end-point (kardiovaskulární úmrtí/iktus/infarkt myokardu) se vyskytl signifikantně méně často ve skupině A oproti skupině C. Stejně tak i celková mortalita byla nižší ve skupině s kombinací rivaroxabanu a aspirinu. Krvácení bylo častější v obou rivaroxabanových skupinách, avšak nešlo o fatální krvácení – v těch (stejně jako v intrakraniálních) nebyl rozdíl žádný [14]. To je nejzásadnější rozdíl proti studii WARIS II. Studie COMPASS tedy potvrdila potenciál kombinace antiagregační a antikoagulační léčby v sekundární prevenci za předpokladu, že jako antikoagulans je použit bezpečnější lék než warfarin. Při analýze podskupin byl benefit patrný ve všech podskupinách nemocných. Nesignifikantní byl benefit v podskupinách pacientů starších 75 let, bez ICHS a s hmotností < 60 kg. I v těchto podskupinách byl však trend pozitivní. Klíčové výsledky jsou shrnuty v tab. 2.
Table 2. Hlavní výsledky studie COMPASS (všichni nemocní) 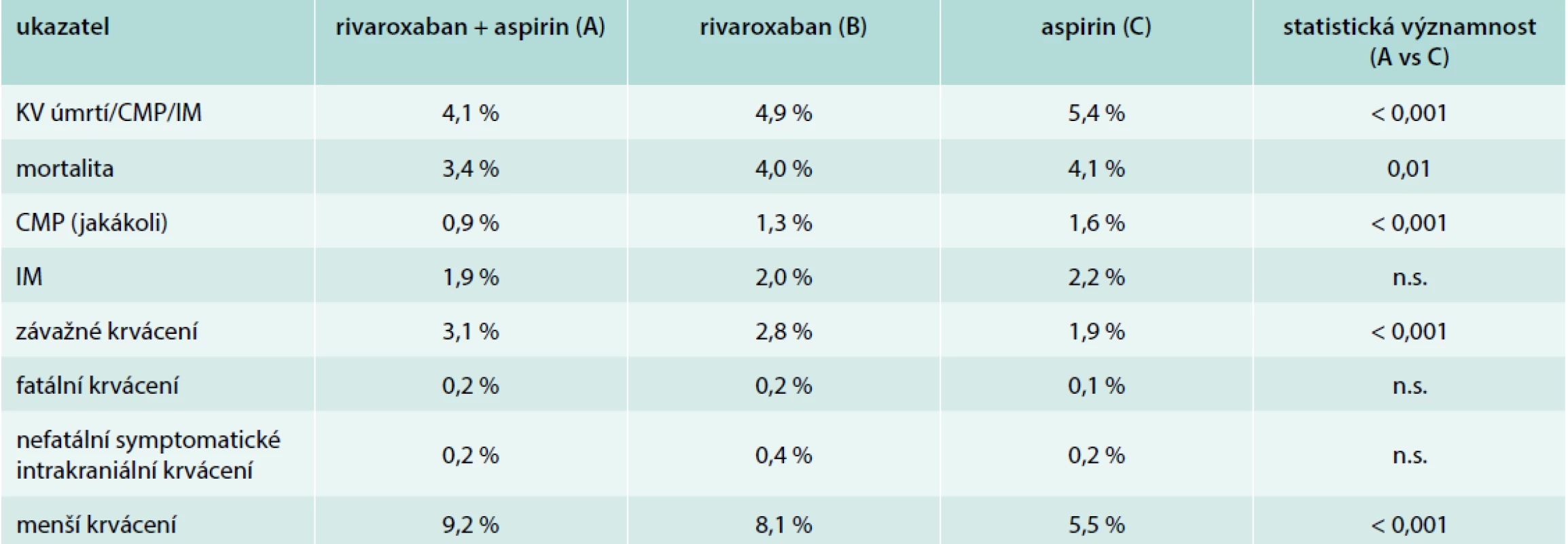
Výsledky studie COMPASS v podskupinách nemocných s cévní mozkovou příhodou v anamnéze, s ischemickou chorobou srdeční a s aortokoronárním bypassem
Pacienti s iktem v anamnéze
Takových nemocných bylo do studie zařazeno 1 032 (4 %) a výsledky se nelišily od celkových výsledků studie – tedy i u této podskupiny byl patrný benefit, zejména pokud jde o riziko ischemického iktu, které bylo kombinací rivaroxabanu s aspirinem sníženo téměř o polovinu [14]. V průběhu celé studie byl nově diagnostikován iktus u 342 nemocných (roční riziko 0,65 %), z nich 15 % bylo hemoragických a 85 % ischemických. Mezi 1 032 pacienty s anamnézou předchozího iktu bylo roční riziko dalšího iktu sníženo kombinovanou léčbou o dvě třetiny oproti samotnému aspirinu. Samotný rivaroxaban tento efekt neměl.
Pacienti se stabilními chronickými formami ICHS
Z celkového počtu 27 395 pacientů ve studii COMPASS mělo 24 824 nemocných prokázanou ischemickou chorobu srdeční [15]. Jednalo se o nemocné více než rok po prokázaném infarktu myokardu (těch bylo nejvíce, průměrná doba od infarktu činila 7 let), s koronarograficky prokázaným postižením více koronárních tepen anebo po koronární revaskularizaci (PCI či CABG). Primární end-point byl u nich snížen při kombinované léčbě na 4 % proti 6 % ve skupině se samotným aspirinem (p < 0,0001). Závažné krvácení se vyskytlo při kombinované léčbě ve 3 %, po samotném aspirinu ve 2 % (p < 0,0001). Opět se jednalo o nefatální (nejčastěji gastrointestinální) krvácení. Zásadní je signifikantní (p = 0,0012) snížení celkové mortality o 23 %, konkrétně ze 4 % (aspirin) na 3 % (rivaroxaban + aspirin).
Rivaroxaban v prevenci okluze koronárních bypassů
Jediná podskupina, která z kombinované léčby neprofitovala, byli pacienti zařazení velmi časně (4.–14. den) po operaci koronárního bypassu. Tato předem plánovaná substudie zahrnula 1 448 nemocných a jejím primárním end-pointem byla neprůchodnost bypassů (graft failure) při CT koronarografii za 1 rok po operaci. Uzavřené bypassy byly zjištěny v 9,1 % při kombinované léčbě, v 8 % při léčbě samotným aspirinem a v 7,8 % při léčbě samotným rivaroxabanem (rozdíly n.s.). Nevyskytlo se fatální krvácení či fatální tamponáda. Kombinovaná léčba měla za výsledek nižší výskyt sekundárního kombinovaného end-pointu (shodného s primárním end-pointem celé studie COMPASS), vzhledem k počtu pacientů však rozdíl nedosáhl statistické významnosti [16].
Výsledky COMPASS u podskupiny nemocných s periferní aterosklerózou
Do studie COMPASS bylo zařazeno 7 470 nemocných s diagnózou periferního aterosklerotického tepenného postižení (PAD populace – Peripheral Arterial Disease), šlo o nemocné se stabilními formami ischemické choroby dolních končetin (ICHDK) a stabilizované nemocné s aterosklerotickým postižením karotických tepen. Průměrný věk těchto nemocných byl 67,8 roku, 72 % z toho byli muži, 74 % tvořili kuřáci nebo exkuřáci a 66 % mělo současně koronární nemoc.
Přesnými kritérii těchto nemocí pro zařazení do studie bylo:
- anamnéza předchozí revaskularizace formou aortofemorálního bypassu nebo angioplastikou ilických nebo subingvinálních tepen, nebo jiná chirurgická léčba končetinových tepen
- stav po amputaci končetiny pro pokročilé fáze ICHDK
- anamnéza intermitentních klaudikací s průkazem buď poklesu hodnoty ankle-brachial indexu (ABI) pod 0,9 nebo ultrasonografický či angiografický průkaz stenózy periferní tepny > 50 %
- stav po revaskularizaci karotidy nebo asymptomatická stenóza karotické tepny ≥ 50 % (určená duplexní ultrasonografií nebo angiograficky)
- přítomnost ICHS a snížení ABI (< 0,9)
Soubor 7 470 nemocných, klasifikovaných jako „PAD“, tvořilo 55 % se symptomatickou ICHDK (4 129), 26 % bylo po revaskularizaci karotické tepny nebo s přítomností stenózy karotidy > 50 % (1 919) a dalších 20 % splňovalo diagnózu přítomné ICHS a současně u nich byla na základě měření ABI < 0,9 diagnostikována asymptomatická ICHDK (1 422). Lze tedy také říci, že počet 7 470 byl součtem nemocných s průkazem samostatné periferní tepenné nemoci (6 048) a nemocných s kombinací ICHS a ICHDK (1 422).
Ve skupině PAD byl zjišťován kromě primárního kardiovaskulárního ukazatele účinnosti MACE (Major Adverse Cardiac Event – sloučený počet – kardiovaskulární úmrtí/iktus/infarkt myokardu) také ukazatel cílený pro PAD. Šlo o ukazatel MALE (Major Adverse Limb Events), definovaný jako vznik akutní tepenné ischemie (ALI – Acute Limb Ischemia) nebo kritické končetinové ischemie (Critical Limb Ischemia – CLI) a velkých amputací (nezahrnutých v ALI nebo CLI), dále specifický ukazatel sloučeného MACE a MALE a dále kompozit MACE, MALE a velkých amputací (nezahrnutých do ALI nebo CLI).
Kombinace rivaroxabanu 2krát 2,5 mg s aspirinem v porovnání s aspirinem samotným, tedy větev A proti C, snížila kombinovaný ukazatel kardiovaskulárního úmrtí, infarktu myokardu nebo iktu o 28 % a byla superiorní proti samotnému aspirinu (HR 0,72; 95% CI 0,57–0,90; p = 0,0047). Rozdíl v celkové mortalitě mezi kombinovanou léčbou (5 %) a samotným aspirinem (6 %) nedosáhl statistické významnosti (nejspíše vzhledem k velikosti podskupiny s PAD).
V dané skupině kombinovaná léčba vedla navíc ke 46% snížení relativního rizika MALE, včetně velké amputace. Došlo i k signifikantnímu snížení vzniku akutní tepenné ischemie a ke snížení počtu velkých amputací (numericky ze 17 na 5, tedy o 70 %), tab. 3.
Table 3. Výsledky studie COMPASS v podskupině nemocných s periferním aterosklerotickým postižením (PAD): výsledky se specifickými ukazateli účinnosti 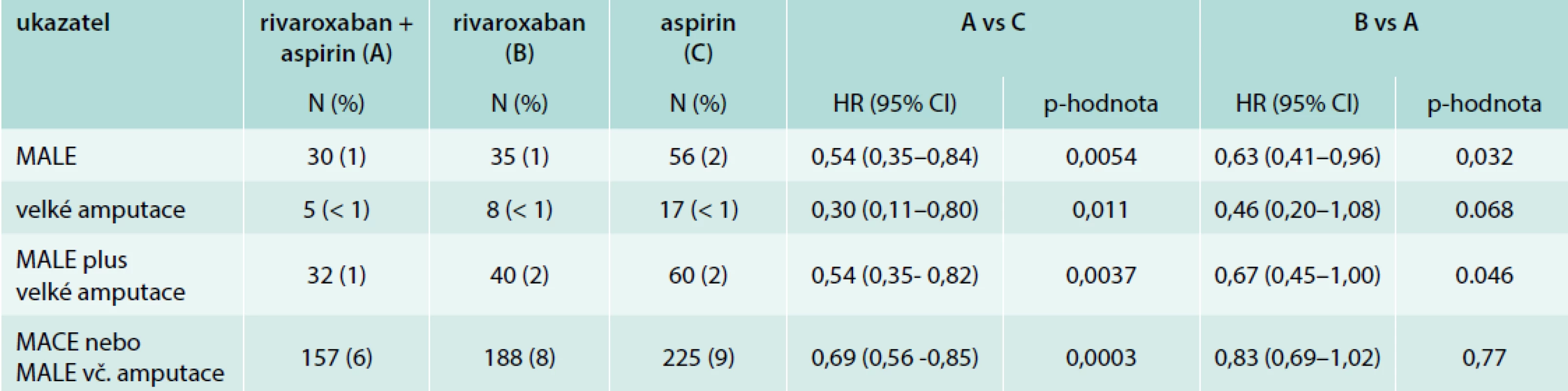
Ve studii COMPASS kombinace malé dávky rivaroxabanu 2krát 2,5 mg s ASA 100 mg prokázala, že tato léčba významně snižuje i ve skupině nemocných s periferní tepennou aterosklerózou velké kardiovaskulární příhody a příznivě ovlivňuje osud končetiny. Na každých 1 000 léčených kombinací rivaroxabanu a aspirinu lze zabránit 27 událostem typu MACE nebo MALE (včetně velkých amputací) za cenu 1 fatálního krvácení a 1 krvácení do kritického orgánu (během 21měsíční periody léčby) [17].
Změní výsledky studie COMPASS doporučené postupy pro sekundární prevenci?
Koncept kombinované léčby antiagregační + antikoagulační se jeví jako velmi atraktivní cesta ke snížení rizika ischemických a tromboembolických příhod (kardiovaskulární smrt, infarkt myokardu, cévní mozková příhoda, tzv. ischemické riziko) včetně rizika úmrtí v důsledku těchto příhod. Oba nejstarší a nejrozšířenější léky tohoto typu (aspirin + warfarin) byly opakovaně porovnávány mezi sebou a rovněž byla v řadě studií porovnávána jejich vzájemná kombinace proti monoterapii pouze jedním z těchto 2 léků. Tyto studie neprokázaly celkový prospěch nemocných z kombinované léčby warfarinem + aspirinem především kvůli přibližně 2krát vyššímu riziku krvácení ve skupině s kombinovanou léčbou, včetně rizika hemoragického iktu [18–22]. Zajímavé však je, že ve většině těchto studií warfarin snižoval ischemické riziko více než aspirin a jejich vzájemná kombinace byla ještě účinnější, do praxe se však nedostala právě kvůli zmíněnému vyššímu riziku krvácení.
Zavedení nových přímých orálních antikoagulancií (rivaroxaban, apixaban, dabigatran, edoxaban), která vykazují nižší rizika krvácení proti warfarinu, oživilo myšlenky na kombinovanou léčbu. První takto koncipované studie však skončily nepřesvědčivými výsledky, znovu pro vyšší riziko krvácivých komplikací [11,23,24]. Limitací těchto prvních studií však bylo to, že v nich zpravidla byla (kvůli tomu, že šlo o nemocné po akutním koronárním syndromu) užívána trojkombinace antitrombotik (duální protidestičková léčba + antikoagulans). Mnoho autorů (včetně autorů tohoto sdělení) je však přesvědčeno, že užívání 3kombinace antitrombotik po dobu delší než 1 měsíc je velmi rizikové pro krvácení a nevede ke snížení ischemického rizika a že tyto první studie dopadly nepřesvědčivě právě z tohoto důvodu. Nicméně ve studii ATLAS-ACS 2 (TIMI-51) vedlo přidání malé dávky rivaroxabanu (2krát denně 2,5 mg) k duální protidestičkové léčbě ke snížení celkové mortality ze 4,5 % na 2,9 % [11]. Právě tento fakt přispěl k realizaci studie COMPASS, v níž byla zkoumána dvojkombinace léků (bez inhibitoru P2Y12).
Výsledky studie COMPASS bývají někdy porovnávány s výsledky studie PEGASUS [25]. Tab. 4 shrnuje podstatná fakta z obou studií a naznačuje výhodnost dlouhodobé kombinace antiagregační + nízkodávkované antikoagulační léčby oproti dlouhodobé duální protidestičkové léčbě.
Table 4. Srovnání výsledků 2 recentních studií dlouhodobé antitrombotické léčby v sekundární prevenci ICHS (u studie COMPASS proto zde uvedena pouze data pacientů s ICHS – tedy bez nemocných, kteří měli pouze onemocnění periferních tepen) 
Závěr
Výše uvedené výsledky studie COMPASS staví před celou medicínu velkou otázku: mají se změnit doporučené postupy pro sekundární prevenci ischemické choroby srdeční a ischemické choroby dolních končetin (ev. i cévní mozkové příhody) tak, že k aspirinu se bude rutinně přidávat nízká dávka rivaroxabanu? Autoři tohoto odborného stanoviska připraveného třemi odbornými společnostmi jsou zajedno v názoru, že současná medicína má k dispozici antitrombotické strategie účinnější pro sekundární prevenci než samotné podávání ASA a že doba, v níž byla monoterapie aspirinem „zlatým standardem“, již končí. Vzhledem k tomu, rivaroxaban má nyní k dispozici data ze dvou studií (COMPASS a ATLAS ACS2), které obě prokázaly statisticky významné snížení celkové mortality, zdá se být dvojkombinace aspirinu s rivaroxabanem tím nejúčinnějším způsobem, jak dále zlepšit osudy těchto nemocných.
Jaký bude vývoj v budoucnu? Vzhledem k tomu, že v současnosti je k dispozici nejméně 6 různých perorálních léků s protidestičkovým účinkem a nejméně dalších 6 perorálních léků s antikoagulačním účinkem, bude čím dál složitější nalézt tu optimální kombinaci pro konkrétního nemocného. Jistě se bude zvyšovat role individuálního rozhodování – hledání té nejvhodnější strategie pro konkrétního nemocného. Může se zde uplatnit např. jednoduché laboratorní vyšetření (např. při vyšší hladině CRP anebo troponinu T indikovat agresivnější antitrombotickou léčbu) nebo složitější genetické vyšetření a stanovení individuální vnímavosti na konkrétní lék v konkrétní dávce.
Zajímavou možností pro dlouhodobou medikaci se může jevit i monoterapie inhibitorem P2Y12. Monoterapie klopidogrelem [8] by mohla být např. alternativou ke kombinaci ASA + rivaroxaban u nemocných s vyšším rizikem krvácení. Je však málo pravděpodobné, že bude realizována studie přímo srovnávající monoterapii klopidogrelem (nebo tikagrelorem) s dvojkombinací ASA + rivaroxaban. V současné době je tak tato dvojkombinace jediným antitrombotickým postupem v sekundární prevenci, který prokázal snížení celkové úmrtnosti při dlouhodobé léčbě ve srovnání s monoterapií aspirinem.
Doručeno do redakce 24. 4. 2019
prof. MUDr. Petr Widimský, DrSc., FESC, FACC
Kardiocentrum 3. LF UK a FN Královské Vinohrady, Praha
Sources
- Bruthans J, Cífková R, Lánská V et al. Explaining the decline in coronary heart disease mortality in the Czech Republic between 1985 and 2007. Eur J Prev Cardiol 2014; 21(7): 829–839. Dostupné z DOI: <http://dx.doi.org/10.1177/2047487312469476>.
- Piepoli MF, Hoes AW, Agewall S et al. [ESC Scientific Document Group]. 2016 European Guidelines on cardiovascular disease prevention in clinical practice. The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts). Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR). Eur Heart J 2016; 37(29): 2315–2381. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehw106>.
- Kotseva K, Wood D, De Bacquer D et al. EUROASPIRE IV: a European Society of Cardiology survey on the lifestyle, risk factors and therapeutic managements of coronary patients from 24 European countries. Eur J Prev Cardiol 2016; 23(6): 636–648. Dostupné z DOI: <http://dx.doi.org/10.1177/2047487315569401>.
- Ibanez B, James S, Agewall S et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J 2018; 39(2): 119–177. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehx393>.
- Catapano AL, Graham I, De Backer G et al. et al. [ESC Scientific Document Group]. 2016 ESC/EAS Guidelines for the Management of Dyslipidaemias. Eur Heart J 2016; 37(39): 2999–3058. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehw272>.
- Williams B, Mancia I, Spiering W et al. ESC Scientific Document Group. 2018 ESC/EHS Guidelines for the management of arterial hypertension. Eur Heart J 2018; 39(33): 3021–3104. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehy339>.
- Bhatt DL, Steg PG, Ohman EM et al. International prevalence, recognition, and treatment of cardiovascular risk factors in outpatients with atherothrombosis JAMA 2006; 295(2): 180–189. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.295.2.180>.
- [CAPRIE Steering Committee]. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). Lancet 1996; 348(9038): 1329–1339.
- Hiatt WR, Fowkes FG, Heizer G et al. [EUCLID Trial Steering Committee and Investigators]. Ticagrelor versus Clopidogrel in Symptomatic Peripheral Artery Disease. N Engl J Med 2017; 376(1): 32–40. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1611688>.
- Aboyans V, Ricco JB, Bartelink ME et al. 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in Collaboration With the European Society for Vascular Surgery (ESVS): Document Covering Atherosclerotic Disease of Extracranial Carotid and Vertebral, Mesenteric, Renal, Upper and Lower Extremity Arteries. Eur Heart J 2018; 39(9): 763–816. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehx095>.
- Mega JL, Braunwald E, Wiviott SD et al. [ATLAS ACS 2-TIMI 51 Investigators]. Rivaroxaban in patients with a recent acute coronary syndrome. N Engl J Med 2012; 366(1): 9–19. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1112277>.
- Bosch J, Eikelboom JW, Connolly SJ et al. Rationale, Design and Baseline Characteristics of Participants in the Cardiovascular Outcomes for People Using Anticoagulation Strategies (COMPASS) Trial. Can J Cardiol 2017; 33(8): 1027–1035. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cjca.2017.06.001>.
- Hurlen M, Abdelnoor M, Smith P et al. Warfarin, Aspirin or Both After Myocardial Infarction. N Engl J Med 2002; 347(13): 969–974. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa020496>.
- Eikelboom JW, Connolly SJ, Bosch J et al. [COMPASS Investigators]. Rivaroxaban with or without Aspirin in Stable Cardiovascular Disease. N Engl J Med 2017; 377(14): 1319–1330. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1709118>.
- Connolly SJ, Eikelboom JW, Bosch J et al. [COMPASS investigators]. Rivaroxaban with or without aspirin in patients with stable coronary artery disease: an international, randomised, double-blind, placebo-controlled trial. Lancet 2018; 391(10117): 205–218. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(17)32458–3>.
- Lamy A, Eikelboom J, Sheth T et l. Rivaroxaban, Aspirin, or Both to Prevent Early Coronary Bypass Graft Occlusion: The COMPASS-CABG Study. J Am Coll Cardiol 2019; 73(2): 121–130. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2018.10.048>.
- Anand SS, Bosch J, Eikelboom JW et al. [COMPASS Investigators]. Rivaroxaban with or without aspirin in patients with stable peripheral or carotid artery disease: an international, randomised, double-blind, placebo-controlled trial. Lancet. 2018; 391(10117): 219–229. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(17)32409–1>.
- [Study (CARS) Investigators]. Randomised double-blind trial of fixed low-dose warfarin with aspirin after myocardial infarction. Coumadin Aspirin Reinfarction. Lancet 1997; 350(9075): 389–396.
- Thrombosis prevention trial: randomised trial of low-intensity oral anticoagulation with warfarin and low-dose aspirin in the primary prevention of ischaemic heart disease in men at increased risk. The Medical Research Council‘s General Practice Research Framework. Lancet 1998; 351(9098): 233–241.
- Herlitz J, Holm J, Peterson M et al. [LoWASA study group]. Effect of fixed low-dose warfarin added to aspirin in the long term after acute myocardial infarction. Eur Heart J 2004; 25(3): 232–239. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ehj.2003.10.026>.
- Hurlen M, Abdelnoor M, Smith P et al. Warfarin, aspirin, or both after myocardial infarction. N Engl J Med 2002; 347(13): 969–974. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa020496>.
- Andreotti F, Testa L, Biondi-Zoccai GG et al. Aspirin plus warfarin compared to aspirin alone after acute coronary syndromes: an updated and comprehensive meta-analysis of 25,307 patients. Eur Heart J 2006; 27(5): 519–526. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehi485>.
- Alexander JH, Lopes RD, James S et al. [APPRAISE-2 Investigators]. Apixaban with Antiplatelet Therapy after Acute Coronary Syndrome. N Engl J Med 2011; 365(8): 699–708. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1105819>.
- Oldgren J, Budaj A, Granger CB et al. [RE-DEEM Investigators]. Dabigatran vs. placebo in patients with acute coronary syndromes on dual antiplatelet therapy: a randomized, double-blind, phase II trial. Eur Heart J 2011; 32(22): 2781–2789. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehr113>.
- Marc P, Bonaca MD, Deepak L et al. Long-Term Use of Ticagrelor in Patients with Prior Myocardial Infarction. N Engl J Med 2015; 372(19): 1791–1800. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1500857>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2019 Issue 11-
All articles in this issue
- Funkční onemocnění trávicího traktu a bolest
- Môže warfarín zabrániť vzniku nádorov?
- Imunodeficience v rámci diferenciální diagnostiky intersticiálních plicních procesů
- Proč je v léčbě arteriální hypertenze důležité rychle dosáhnout cílových hodnot krevního tlaku
- Interferon-alfa v léčbě myeloproliferativních onemocnění
- Pancytopenie, panhypopituitarizmus a jaterní cirhóza: rozbor složité kazuistiky
- Nedostatek vitaminu D a jeho zdravotní dopady
-
Sekundární prevence ischemické choroby srdeční a chorob periferních tepen kombinací antiagregační a antikoagulační léčby
Odborné stanovisko České kardiologické společnosti, České internistické společnosti ČLS J.E. Purkyně a České angiologické společnosti ČLS J.E. Purkyně k výsledkům studie COMPASS - Odešel profesor Ivo Dvořák
- Primář Jiří Spáčil oslavil 80. narozeniny
- Profesor Jan Petrášek slaví devadesáté narozeniny
- Mýty a fakty o liečbe artériovej hypertenzie: naozaj vieme o artériovej hypertenzii všetko?
- Epidurální absces páteře – raritní komplikace Crohnovy choroby: kazuistika
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Funkční onemocnění trávicího traktu a bolest
- Interferon-alfa v léčbě myeloproliferativních onemocnění
- Nedostatek vitaminu D a jeho zdravotní dopady
- Imunodeficience v rámci diferenciální diagnostiky intersticiálních plicních procesů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

