-
Medical journals
- Career
Pokroky v metabolizmu a výživě 2011 a cesta k personalizované léčbě
Authors: Z. Zadákihash3 1, 2 1, 2; M. Hronek 1; R. Hyšpler 2
Authors‘ workplace: Centrum pro výzkum a vývoj Lékařské fakulty UK a FN Hradec Králové, vedoucí pracoviště prof. MUDr. Zdeněk Zadák, CSc. 1; Klinika gerontologická a metabolická Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Luboš Sobotka, CSc. 2
Published in: Vnitř Lék 2011; 57(11): 970-974
Category: Birthday
Overview
Nová koncepce terapie poruch metabolizmu a výživy je založena na moderních přístupech, které staví některé nutriční postupy na úroveň farmakoterapie. Tento přístup je demonstrován na příkladu léčby multiorgánového selhání a systémové inflamatorní reakce, kdy jsou využívány nutriční substráty s farmakologickým účinkem jako arginin, glutamin, taurin, threonin a cystein. Další diskutovanou problematikou je léčba sarkopenie ve stáří. Personalizovaná výživa jako součást širšího pojetí personalizované medicíny představuje novou cestu, která je založena na poznání individuálních rozdílů v lidském genomu a jeho expresi. Tato cesta však vyžaduje zcela odlišný přístup k laboratorní diagnostice i klinickému pojetí, které je mnohem více orientováno na jednotlivého pacienta a klinickou predikci. Z tohoto hlediska se jeví nutností nahradit dosavadní klasické laboratorní testy novým systémem, který využívá molekulární biologii a bioinformatiku.
Klíčová slova:
personalizovaná medicína – nutriční farmakologie – nutrigenomika – multiorgánové selhání – sarkopenieÚvod
Ovlivnění metabolizmu a použití orgánově specifických nutričních substrátů vede k novému konceptu léčby akutních i chronických stavů v interních oborech, chirurgických oborech i v intenzivní medicíně. Tato nová koncepce terapie poruch metabolizmu a výživy je založena na moderních přístupech, které staví některé nutriční postupy na úroveň farmakoterapie. Tím jsou definovány nutriční oblasti, jako je nutriční farmakologie, imunonutrice a personalizovaná výživa.
Nový koncept metabolizmu a výživy v diagnóze multiorgánového selhání (MOF) a systémové inflamatorní reakce (SIRS)
Prevence vzniku a léčba těchto stavů patří i přes farmakologický a technologický pokrok k nejobtížnějším oblastem medicíny. Stále přetrvávající vysoká mortalita i u mladších věkových kategorií je dokladem závažnosti těchto situací.
Rozvoj multiorgánové dysfunkce probíhá většinou ve 2 směrech:
- Primární inzult orgánů, např. renální selhání, rabdomyolýza, jaterní selhání, sepse, polytrauma, které bezprostředně přejde do multiorgánové dysfunkce (first hit).
- Druhotná reakce – vzdálené orgánové poškození, které vzniká jako důsledek prvotní zánětlivé, infekční a traumatické reakce (second hit).
Z hlediska účinku mediátorů se v primární reakci uplatňuje zejména hyperinflamatorní proces, na který syndrom multiorgánové dysfunkce naváže plynule a projeví se cytokinovou bouří a specifickým výběrem mediátorů (TNF-α, IL-2, IL-6, IL-8). Charakteristická je stimulace apoptózy v lymfocytech i enterocytech, a naopak opožděná apoptóza neutrofilů [1]. Tato metabolická odezva na hypoperfuzi a následnou tvorbu reaktivních forem kyslíku (ROS) má několik forem řešení:
- hemodynamická podpora a stabilizace (volumová resuscitace, farmakologická podpora),
- zajištění ventilace (protektivní strategie mechanické ventilace),
- léčba infekce (konvenční antibiotika, nově antimikrobiální peptidy, peptaiboly, defenziny, nové náhrady konvenčních antibiotik),
- úprava fluidokoagulační rovnováhy,
- stabilizace neuroregulačních poměrů (rovnováha mezi sympatickým a parasympatickým systémem),
- metabolická a nutriční podpora (nutriční farmakologie, použití orgánově specifické výživy, imunomodulační výživa).
Nové možnosti využití nutričních substrátů s farmakologickým účinkem
Arginin
Přestože arginin není esenciální aminokyselina a jeho syntéza v organizmu je za obvyklých situací dostatečná, při stresové zátěži může vzniknout jeho nedostatek se závislostí organizmu na přívodu argininu z vnějšího prostředí. Vedle účinného transportu aminodusíku a jeho role v tvorbě močoviny je arginin důležitým článkem v produkci plynového mediátoru oxidu dusnatého – NO [2].
Deficit tvorby NO při depleci argininu se projeví následujícími změnami:
- nedostatečná klinická reakce, např. leukocytóza, pokles albuminu a malý vzestup C-reaktivního proteinu při závažné infekci a fulminantní sepsi. S tím souvisí i nedostatečná produkce hnisu v místě zánětu a celkově utlumená lokální inflamatorní reakce;
- při nedostatku argininu chybí regenerace poškozených tkání, je snížena granulační reakce v oblasti přítomnosti cizorodých tělísek a infekčních agens, je snížena produkce fibrinu. S tím souvisí i defektní vytváření bariér protiinfekčních agens a toxinů, např. ztluštění serózních membrán (peritoneum, pleura), jsou potlačeny nebo chybí vytváření adhezí v místě poškození a tendence k ohraničení místní inflamatorní reakce;
- klinicky se nedostatek argininu a snížená tvorba NO projeví jako obraz terapie kortikosteroidy;
- dochází k pomalému, ale nevyhnutelnému zhoršení klinického stavu charakterizovaného rozšířením infekce (bakteriální, virové, kandidové) s málo vyjádřenou obrannou reakcí;
- výsledkem je opožděná, avšak vysoká mortalita, která není dosti často klinikem spojována s deficitem argininu.
Glutamin
Role této neesenciální, avšak ubikvitárně se v proteinech teplokrevných živočichů vyskytující aminokyseliny, je často zdůrazňována. Role glutaminu spočívá zejména v těchto funkcích:
- zdroj energie a komponenta v proteosyntéze rychle se dělících buněk a proliferujících tkání;
- prekurzor pro syntézu nukleotidů při růstu a reparaci tkání (poškozená mukóza tenkého střeva, regenerace kostní dřeně, dělící se buňky v průběhu reparace tkáně poškozené toxiny, chemoterapií, ozářením, hypoxií a traumatem).
Role glutaminu v reparačním procesu vyjadřuje obr. 1 [8].
Image 1. Vliv glutaminu na komplikace akutní pankreatitidy (translokace, sepse, MOF). Podle [8]. ![Vliv glutaminu na komplikace akutní pankreatitidy (translokace, sepse, MOF). Podle [8].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/7f8f6e6b7d5532d75c6a6652f19e4806.jpg)
Taurin
Význam aminokyseliny poslední dobou velmi výrazně vzrostl, protože vedle udržení a vývoje funkce sítnice se ukazuje, že má nezbytnou roli jako intracelulární aminokyselina ve stabilizaci membrán, dále působí antiarytmicky a pozitivně inotropně cestou regulace transportu kalcia. V podmínkách SIRS, aktinoterapie, chemoterapie a při expozici reaktivním formám kyslíku působí jako mohutný intracelulární antioxidant. Snižuje závažný účinek endotoxinu a potlačuje efekt TNF-α.
Treonin
Negativní účinek deficitu treoninu se projevuje zejména při rozvoji kachexie a deprivace treoninu má za následek neúměrné zvýšení neužitečné energetické potřeby. Pravděpodobným mechanizmem zvýšení energetické potřeby při deficitu treoninu je odpojení mitochondriální energetiky od ATP a změna počtu mitochondrií v játrech. V důsledku toho zvýšený přívod treoninu zřetelně zlepšuje oxidační fosforylaci a tvorbu ATP v játrech.
Cystein, cystin
Tyto fyziologicky ekvivalentní aminokyseliny obsahující síru jsou nezbytné pro tvorbu glutationu a tím se zařazují do skupiny nezbytné pro antioxidační rovnováhu a detoxikační reakce. Antioxidační efekt cysteinu je důležitý pro ochranu plic při zvýšeném riziku rozvoje šokové plíce a MODS. Cystein a cystin vyrovnávají přestřelenou inflamatorní reakci a podílejí se na inhibici virů HIV v monocytech.
Novou kapitolou v chápání akutních stavů typu MODS, SIRS je vyhodnocení role sirovodíku (H2S) jako dalšího mediátorového plynu na úrovni NO a CO (obr. 2). Tento 3. endogenní plynný transmiter [2,3] se významně uplatňuje v etiopatogenezi rozvoje MODS a SIRS a pro jeho generování je nezbytná přítomnost dostatečného množství aminokyselin obsahujících síru (cystein, cystin).
Image 2. Role tří plynů – NO, H<sub>2</sub>S a CO v metabolizmu. Podle [2]. ![Role tří plynů – NO, H<sub>2</sub>S a CO v metabolizmu. Podle [2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/f5cfaae7894ecd91622a2efcf9b9b9eb.jpg)
Lipidy
Farmakonutriční účinek lipidů na vazomotoriku, fluidokoagulační rovnováhu a imunomodulaci je znám teoreticky dlouho, doznal však praktického využití až v posledním desetiletí. Mechanizmy, jakými se lipidy v regulaci fyziologických i patologických dějů uplatňují, jsou následující:
- a) ovlivnění struktury celulární a subcelulární (struktura a fluidita subcelulárních a celulárních membrán, ovlivnění aktivity enzymů, přenos buněčných signálů, tvorba lipidových mediátorů);
- b) na úrovni tkání a anatomických struktur se vliv polynesaturovaných mastných kyselin (PUFA) ω-3 a ω-6 uplatňuje zejména účinkem na vaskulární permeabilitu, viskozitu krve a vazokonstrikci v plicním i periferním řečišti, dále změnami fluidokoagulační rovnováhy.
Významnou roli hrají zejména ω-3 mastné kyseliny v potlačení rozvoje ARDS (akutní respirační distress syndrom), DIC (syndrom diseminované intravaskulární koagulace), MODS (syndrom multiorgánové dysfunkce) a SIRS (syndrom systémové zánětlivé odpovědi) svým účinkem na zlepšení krevního průtoku ve splanchnické oblasti, a tím na zlepšení funkce střevní bariéry (tab. 1). Důsledkem zlepšeného průtoku ve splanchnické oblasti je navíc pokles tvorby laktátu i při existující hypoxii. Optimální poměr ω-3 a ω-6 zároveň potlačuje nadměrnou inflamatorní reakci, produkci superoxidů a přestřelenou tvorbu NO [4]. Výsledkem je snížení mortality kriticky nemocných na translokační sepsi při porušení střevní bariéry. V dostupných studiích založených na farmakonutričním účinku tukových emulzí s vyváženým poměrem ω-6 a ω-3 byl navržen optimální poměr těchto dvou komponent v rozmezí asi 2,5–3 : 1.
Table 1. Účinek PUFA n-3 v klinice. 
Poněkud opomíjenou oblastí, kde však hrají polynesaturované mastné kyseliny ω-3 ve skutečnosti významnou roli, je hepatopatie spojená s parenterální výživou (tab. 2). Tento jev pozorujeme zhruba u 65 % případů syndromu krátkého střeva a méně často jako důsledek transplantace jater. Mezi další příčiny hepatopatie asociované s parenterální výživou (parenteral nutrition associated liver disease – PNALD) je exces příjmu energie, zejména ve formě sacharidů, nevyvážené aminokyselinové roztoky (přetížení metioninem) a pravděpodobně i přetížení fytosteroly obsaženými v konvenčních tukových emulzích. Polynesaturované mastné kyseliny řady ω-3 jsou vedle omezení příjmu energie parenterální výživou důležitým léčebným prostředkem, který jednak snižuje příjem fytosterolů v tukové emulzi, dále zlepšuje zánětlivou reakci jaterního parenchymu, zvyšuje mobilizaci lipidů akumulovaných v játrech a snižuje zátěž glukózou [5].
Table 2. Parenteral nutrition-associated liver disease (PNALD) – význam nových typů lipidových emulzí omezujících vedlejší účinky. 
Léčba sarkopenie v kritickém stavu a ve stáří
Sarkopenie (úbytek svalové hmoty) je nevyhnutelnou složkou stárnutí a projevuje se od dosažení dospělosti až do pozdního stáří. Od 40 let věku ubývá každou dekádu 5 % tělesné hmoty a po 70. roce věku se zvyšuje úbytek svalstva na každou dekádu o dalších 10 %. Z tohoto hlediska je úbytek svalstva jedním z hlavních projevů stárnutí. Bez ohledu na věk dochází k úbytku svalstva při každém těžším onemocnění, zejména pokud je spojeno s katabolizmem a tělesnou inaktivitou. V kritických stavech dochází k úbytku svalové hmoty až ve výšce 300 g za den. Sarkopenie je z tohoto hlediska jedním ze závažných projevů, který je, zejména při postižení dechového svalstva, spojen s výrazně zvýšenou mortalitou. Z tohoto hlediska je sarkopenie a její potlačení ve středu zájmu jak gerontologů, tak intenzivistů. Mezi základní prostředky snižující sarkopenii, a tím i závažné důsledky každého těžšího onemocnění je udržení dobrého stavu výživy a co nejvyšší tělesné aktivity. Nutriční podpora a rehabilitace patří z tohoto hlediska k nepostradatelným léčebným i preventivním opatřením.
Mezi nová specifická opatření typu farmakonutrice a orgánově specifické výživy patří využití β-hydroxy-β-metyl-butyrátu (HMB). Využití tohoto orgánově specifického nutrientu vychází ze skutečnosti, že rozvětvené aminokyseliny leucin, izoleucin a valin tvoří více než 1/3 svalového proteinu. Mezi nejsledovanější z těchto aminokyselin patří leucin, který má široký efekt na metabolizmus proteinů, glukózovou homeostázu a inzulinovou senzitivitu. Mechanizmus, který hraje velkou roli v pozitivním účinku leucinu na potlačení sarkopenie a zvýšení svalové hmoty, je tvorba α-ketoizokaproátu (KIC). Studie poslední doby ukazují, že hydroxymetylbutyrát vytváří antikatabolický, anabolický a lipolytický účinek, který zlepšuje energetickou rovnováhu svalu a zvyšuje jeho aerobní kapacitu. Studie z poslední doby prokazují anabolický a ergogenní účinek suplementace HMB u starých jedinců. Podání hydroxymetylbutyrátu netrénovaným starým jedincům vedlo za 8 týdnů k zvýšené výkonnosti o 13 % ve srovnání s placebem [6].
Mechanizmus účinku HMB není sice do detailu prozkoumán, předpokládá se však, že vede ke stabilizaci a zvýšení syntézy cholesterolu ve svalové sarkolemě a současně působí regulačním účinkem na ubikvitin-proteazomový komplex. Průkazný je v tomto smyslu zejména účinek HMB u nádorové kachexie s úbytkem svalové hmoty, kde byl prokázán inhibiční účinek na ubikvitin-proteazomovou proteolytickou cestu.
Nové cesty v personalizované výživě
Personalizovaná výživa jako součást širšího pojetí personalizované medicíny představuje novou cestu, která je založena na poznání individuálních rozdílů v lidském genomu a jeho expresi. Personalizovaná medicína reprezentuje využití genetiky současně s farmakologií, nutriční vědou a z genetiky odvozených „-omik“ (proteomiky, transkriptomiky, metabolomiky, lipidomiky) a dalších analogických oblastí (obr. 3).
Image 3. Současné z genetiky odvozené -omiky. 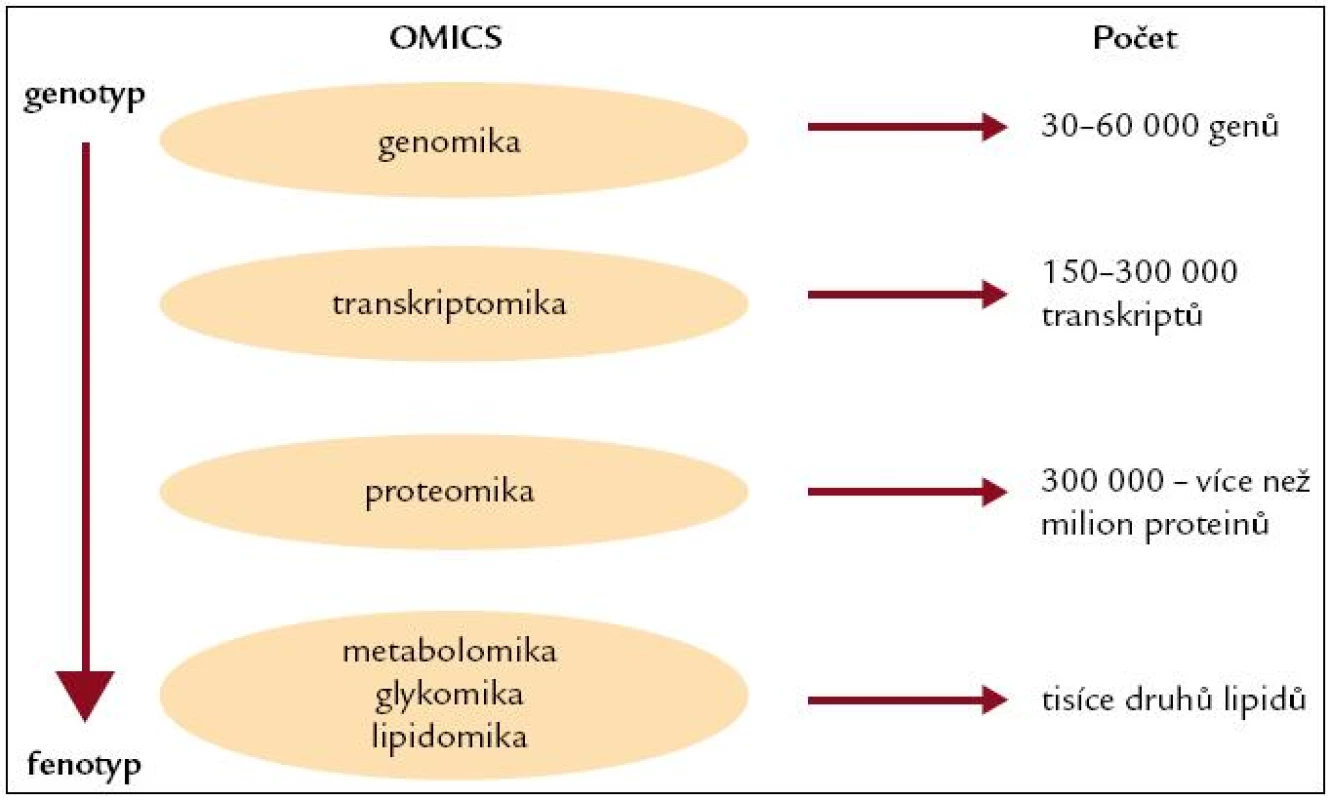
Aby personalizovaná medicína, respektive personalizovaná výživa byly prakticky použitelné a efektivní, měly by být založeny a vyvíjeny na základě zjištěných genetických odchylek jednotlivců, a tím jejich metabolických i strukturálních odlišností. Tato cesta však vyžaduje zcela odlišný přístup k laboratorní diagnostice i klinickému pojetí, které je mnohem více orientováno na jednotlivého pacienta a klinickou predikci. Z tohoto hlediska se jeví nutností nahradit dosavadní klasické laboratorní testy novým systémem, který využívá molekulární biologii a bioinformatiku.
Vzhledem k tomu, že dosavadní molekulárně biologické přístupy a praktická použitelnost bioinformatiky v klinice zatím nedovoluje rozšíření, do kliniky byl navržen hybridní způsob, který využívá fenotypické bioindikátory, jejichž kombinace s využitím role individuální variability testů pomáhá zařadit nemocného do poměrně dobře definovaného individuálního obrazu, který umožní i do značné míry individualizovanou léčbu. Takové pojetí využití kombinace klasických laboratorních testů umožňuje personalizovanou medicínu, respektive personalizovanou výživu i v oblastech, které nejsou metodami molekulární biologie a bioinformatiky dosud prakticky dostupné [7].
Závěr
Nutriční farmakologie přináší v posledních letech významný pokrok, který je jednak soustředěn na poznání metabolických reakcí v průběhu život ohrožujících stavů, jako je MODS, SIRS a DIC, jednak přináší významné rozšíření terapeutických možností. Nutriční podpora v kritických stavech se tak dostává daleko za hranici nutriční problematiky a zejména je důležité, že záhy po poznání některých patogenetických mechanizmů se rychle nutriční farmakologie orientuje na praktický vývoj dostupných prostředků jak v oblasti parenterální, tak enterální výživy. Poznání některých důležitých mechanizmů předurčujících osud nemocného, jako je např. souvislost nutričních prekurzorů s tvorbou regulačních plynů (NO, CO, H2S), jasně ukazuje, že umělá výživa a nutriční farmakologie zdaleka nepřekročily svůj zenit v praktické klinické medicíně.
Práce byla podpořena Výzkumným záměrem MZO 00179906.
prof. MUDr. Zdeněk Zadák, CSc.
www.fnhk.cz
e-mail: zadak@fnhk.cz
Doručeno do redakce: 23. 9. 2011
Sources
1. Aslami H, Juffermans NP. Induction of a hypometabolic state during critical illness – a new concept in the ICU? Neth J Med 2010; 68 : 190–198.
2. Li L, Hsu A, Moore PK. Actions and interactions of nitric oxide, carbon monoxide and hydrogen sulphide in the cardiovascular system and in inflammation – a tale of three gases! Pharmacol Therap 2009; 123 : 386–400.
3. Wagner F, Asfar P, Calzia E et al. Bench-to-bedside review: Hydrogen sulfide – the third gaseous transmitter: applications for critical care. Crit Care 2009; 13 : 213.
4. Mizock BA. The Multiple Organ Dysfunction Syndrome. Dis Mon 2009; 55 : 476–526.
5. Diamond IR, Pencharz PB, Wales PW. Omega-3 lipids for intestinal failure associated liver disease. Semin Pediatr Surg 2009; 18 : 239–245.
6. Vukovich MD, Stubbs NB, Bohlken RM. Body Composition in 70-Year-Old Adults Responds to Dietary β-Hydroxy-β-Methylbutyrate Similarly to That of Young Adults. J Nutr 2001; 131 : 2049–2052.
7. Guidi GC, Lippi G. Will „personalized medicine“ need personalized laboratory approach? Clin Chim Acta 2009; 400 : 25–29.
8. Zadák Z. Výživa v intenzivní péči. 2. vyd. Praha: Grada 2008.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2011 Issue 11-
All articles in this issue
- Aktuální a budoucí možnosti léčby osteoporózy
- Chronická pankreatitida v roce 2011
- Patofyziologické podklady inkretinové léčby: dokáže ještě více, než si myslíme?
- Jak se dívat na psychosomatickou medicínu
- Možnosti plnění mezinárodních doporučení terapie syndromu diabetické nohy v České republice
- Antibiotická léčba akutních bakteriálních infekcí
- Inkretiny změnily a dále mění strategii léčby diabetu 2. typu
- Moderní technologie v diabetologii. CSII (kontinuální subkutánní infuze inzulinu) a CGM (kontinuální glykemický monitoring) v klinické praxi
- Lze zpomalit rentgenovou progresi ankylozující spondylitidy?
- Inzulinová léčba v roce 2011
- Genetika monogénových foriem diabetu
- Terapie obezity – postupy, účinnost a perspektivy
- Patogeneze diabetes mellitus 1. a 2. typu v roce 2011 – jednotící model poruchy glykoregulace
- Nahlédnutí do budoucnosti farmakoterapie diabetes mellitus 2. typu
- Pharmacotherapy of chronic heart failure after the first decade of 21st century
- Farmakoterapie po srdečním infarktu
- Pokroky v metabolizmu a výživě 2011 a cesta k personalizované léčbě
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Antibiotická léčba akutních bakteriálních infekcí
- Moderní technologie v diabetologii. CSII (kontinuální subkutánní infuze inzulinu) a CGM (kontinuální glykemický monitoring) v klinické praxi
- Terapie obezity – postupy, účinnost a perspektivy
- Genetika monogénových foriem diabetu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

