-
Medical journals
- Career
Hladiny PAPP-A ve folikulární tekutině a krvi pacientek stimulovaných k IVF s hrozícím ovariálním hyperstimulačním syndromem
Authors: K. Řežábek 1; Martina Moosová 1; J. Pavelková 1; J. Moos 2; V. Filová 3
Authors‘ workplace: Centrum asistované reprodukce, Gynekologicko-porodnická klinika 1. LF UK a VFN, Praha přednosta prof. MUDr. A. Martan, DrSc. 1; Sigma-Aldrich spol. s r. o., Praha 2; Immunotech a. s., Praha 3
Published in: Ceska Gynekol 2009; 74(2): 80-84
Category: Original Article
Overview
Cíl studie:
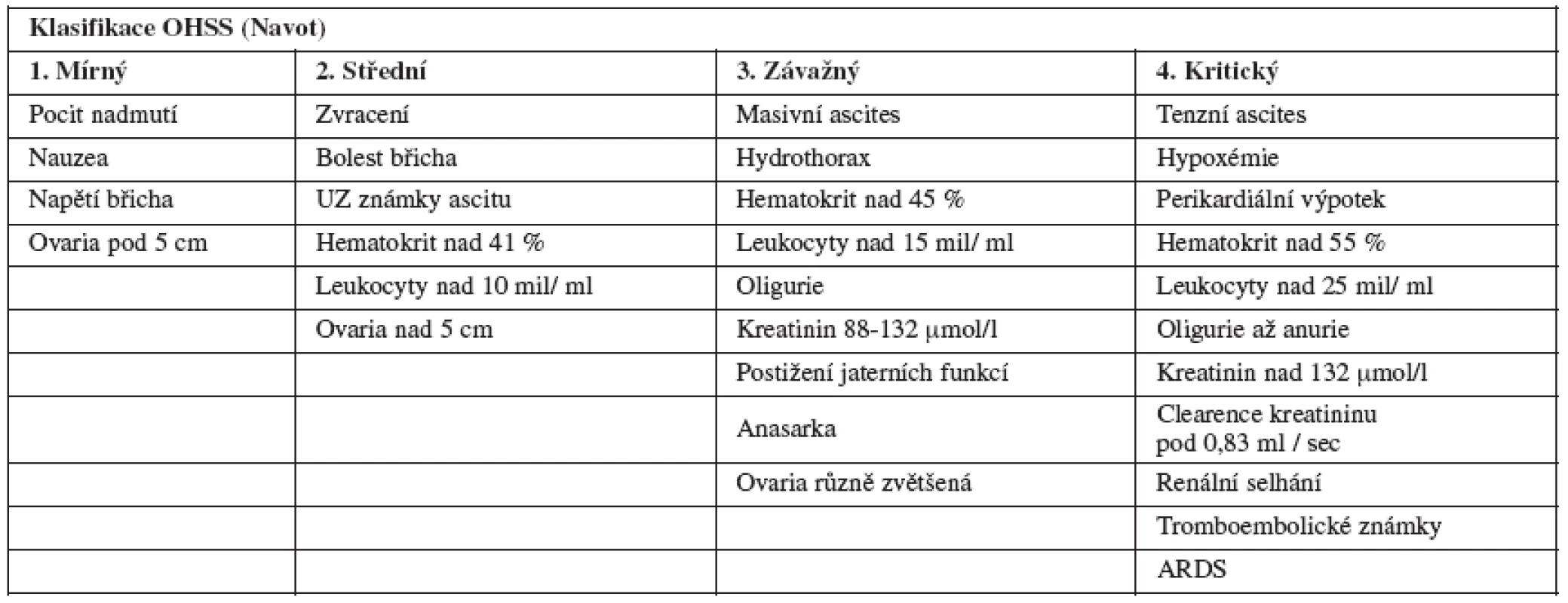
Ovariální hyperstimulační syndrom (OHSS) patří k závažným komplikacím léčby metodami in vitro fertilizace (IVF). Vyskytuje se ve své závažné formě u 3-5 % IVF léčených žen. Jeho patogeneze je nejasná, a léčba tedy pouze symptomatická. Pravděpodobnost vzniku OHSS u konkrétní ženy je obtížně předpověditelná, současné kritérium – počet punktovaných folikulů - je nespolehlivé.
Cílem práce bylo zjistit, zda u pacientek s vysokým rizikem vzniku OHSS (vzhledem k odběru oocytů punkcí velkého počtu folikulů) lze predikovat, u které z nich je pravděpodobnost OHSS vysoká a u které nízká. Jako marker byla testována hladina Pregnancy Associated Plasma Protein - A (PAPP-A) ve folikulární tekutině a krevním séru.Typ studie:
Prospektivní studie.Název a sídlo pracoviště:
Centrum asistované reprodukce, Gynekologicko-porodnická klinika 1. LF UK a VFN v Praze.Soubor a metodika:
Sledovali jsme 118 pacientek, u nichž jsme odebrali vzorky folikulární tekutiny (FF) a krve v den odběru oocytů pro IVF. Provedli jsme analýzu hladin PAPP-A ve FF a v krevním seru a porovnali je se stupněm závažnosti časného OHSS.Výsledky:
Hladiny PAPP-A ve FF jsou 0,81 ± 0,29 IU/l a v krevním séru 0,0017 ± 0,0003 IU/l. U pacientek s následným OHSS 1., 2. a 3. stupně byl v den odběru oocytů PAPP-A ve FF v koncentraci 0,81; 0,52 a 0,73IU/l , respektive 0,0017; 0,0017 a 0,0017IU/l v séru. Tyto hodnoty nekorelují s následným rozvojem OHSS.Koncentrace PAPP-A v krevním séru nekorelují ani s počtem folikulů.
Závěr:
1.
Patologická odpověď organismu na hormonální stimulaci vedoucí k rozvoji OHSS nemá vztah ke koncentraci PAPP-A ve folikulární tekutině nebo v krvi. 2. PAPP-A nepřechází ve významném množství z folikulů do krve.Klíčová slova:
IVF, OHSS, PAPP-A, folikulární tekutina.Úvod
Ročně je v České republice stimulace ovarií prováděna u 7 000–10 000 žen. Cílem u převážné části je získat oocyty pro in vitro fertilizaci. Stejně jako ve světě, i u nás se u části pacientek (15-20 %) rozvíjí OHSS mírného, středního nebo závažného stupně. Ve své závažné formě (hemokoncentrace, ascites, zvětšení ovarií, fluidothorax, zvýšená koagulační pohotovost, trombózy, oligurie, dyspnoe, tachykardie) vyžaduje hospitalizaci (2-4 týdny) a je potenciálně letální komplikací léčby neplodnosti u jinak zdravých mladých žen [1].
Patogeneze OHSS je i přes řadu prací u nás i ve světě stále nejasná. Prevence je tedy obtížná a léčba pouze symptomatická.
PAPP-A byl původně popsán jako protein izolovaný ze séra těhotných žen, pravděpodobně produkovaný placentou [7]. Další práce však ukázaly, že PAPP-A je produkován i v jiných tkáních včetně granulózních buněk lidských ovariálních folikulů [2, 14].
PAPP-A je extracelulární metaloproteáza a v séru cirkuluje hlavně ve formě heterotetrameru o velikosti 500 kDa, skládajícího se ze dvou molekul PAPP-A a dvou molekul proMBP (Major Basic Protein), které jsou navzájem kovalentně vázány pomocí disulfidových můstků [13]. Molekula proMBP je inhibitorem PAPP-A a tetramer o tomto složení je neaktivní nebo vykazuje velmi nízkou aktivitu [12]. Aktivní PAPP-A je proteázou specificky štěpící IGFBP4 [6]. IGFBP4 se váže na IGF, a zabraňuje tak interakci IGF s IGF receptorem. PAPP-A štěpí IGFBP4, uvolňuje IGF z komplexu, a tak aktivuje IGF signální kaskádu.
IGF a IGFBP4 byly navrženy jako důležité signální molekuly účastnící se regulace růstu a dozrávání ovariálních folikulů po stimulaci gonadotropiny [11]. IGF stimuluje syntézu steroidů v granulózních buňkách a tento efekt je inhibován vazbou IGF na IGFBP4. PAPP-A byl ve folikulární tekutině identifikován jako jediná proteáza specifická pro IGFBP4, a také jako marker dominantních folikulů v lidských ovariích [3]. Matsui [8] ukázal, že produkce PAPP-A v granulózních buňkách je pod kontrolou FSH. Tato práce i většina dalších dat o regulaci exprese PAPP-A/IGFBP4 v ovariích však pocházejí ze zvířecích modelů [4, 5, 9]. Není nám známa žádná práce zabývající se analýzou PAPP-A a IGFBP4 ve folikulární tekutině v souvislosti s OHSS.
HYPOTÉZA
Hormonální stimulace vyvolává změny v expresi ovariálních proteinů, růst a zrání folikulů, zvýšení objemu folikulární tekutiny a expanzi extracelulární matrix kumulárních buněk. Zvýšení koncentrace FSH stimuluje expresi PAPP-A v granulózních buňkách a jeho sekreci do folikulární tekutiny. PAPP-A reaguje jako specifická proteáza pro IGFBP4 a proteolýzou IGFBP4 se z neaktivního komplexu IGF/IGFBP4 uvolní IGF. Volný IGF pak aktivuje růst folikulu. PAPP-A je tedy klíčová signální molekula účastnící se regulace růstu folikulu po stimulaci FSH. Patologická odpověď organismu na hormonální stimulaci vedoucí k rozvoji OHSS se pravděpodobně odrazí v rozdílném stupni exprese PAPP-A, tedy v rozdílné koncentraci PAPP-A a IGFBP4 ve folikulární tekutině, ve srovnání s fyziologicky reagujícími ovarii. Změny koncentrace uvedených proteinů ve folikulární tekutině se pravděpodobně projeví i změnou v koncentracích v krvi.
Soubor a metodika
Studie byla schválena Etickou komisí Všeobecné fakultní nemocnice v Praze. Ženy byly informovány o projektu a podepsaly informovaný souhlas.
Do studie jsme zařadili 118 žen, směřujících v rámci léčby neplodnosti k in vitro fertilizaci za pomoci řízené hyperstimulace ovarií, ve standardní skupině (věk do 35 let, bazální FSH do 10 IU/l).
Ženy byly stimulovány gonadotropiny (v dlouhém protokolu s agonisty nebo v krátkém protokolu s antagonisty), indukce dozrání oocytů byla vyvolána aplikací hCG (Pregnyl, Organon) v dávce 10 000 IU, 36 hodin před odběrem oocytů.
Odběr oocytů jsme prováděli transvaginální punkcí folikulů vedenou ultrazvukem. Folikulární tekutinu jsme po vybrání oocytů v ní přítomných centrifugovali (abychom ji zbavili zbytků buněk) a vzorky zmrazili při –20 st.C. Žilní krev odebranou v den odběru oocytů jsme po koagulaci centrifugovali a takto získané sérum jsme uchovali při –70 st.C. Koncentraci PAPP-A ve folikulární tekutině jsme stanovili pomocí soupravy PAPP-A IRMA (výrobce Immunotech, Praha, Česká republika).
Koncentraci PAPP-A v krevním séru jsme stanovili ultra-senzitivním ELISA imunokitem PAPP-A US (výrobce DRG instruments GmbH - Marburg, Germany), s citlivostí 0,023 ng/ml (0,000 005 IU/l).
Hodnocení OHSS jsme prováděli sledováním klinického stavu a laboratorních známek a hodnotili podle Navota do 4 stupňů (viz tabulku 1), přičemž v našem souboru se žádný kritický OHSS nevyskytl.
Získaná data z jednotlivých vzorků folikulární tekutiny byla porovnána s tíží OHSS u dané pacientky.
Výsledky
Nejprve jsme stanovili základní rozmezí hodnot PAPP-A ve folikulární tekutině (0,81 ± 0,29 IU/l) a krevním séru (0,0017 ± 0,0003 IU/l) u žen, které neměly OHSS.
Poté jsme ověřili předpoklad, že není souvislost mezi hladinami PAPP-A ve folikulech a mezi počtem folikulů (viz graf 1). Počet folikulů je totiž odrazem vztahu intenzity stimulační dávky FSH vůči ovariální rezervě u dané pacientky. Tím jsme vyloučili možnost, že bychom museli v dalších výpočtech brát tento faktor v úvahu.
Graph 1. Počet folikulů a koncentrace PAPP-A ve folikulu 
Vzhledem k vysoké koncentraci PAPP-A ve folikulární tekutině a nízké koncentraci v krvi se nabízí předpoklad, že PAPP-A se dostává do krve převážně přestupem z folikulů, a tedy jeho koncentrace v krvi bude záviset na jeho koncentraci ve folikulech. Tento předpoklad se však již dříve z dat v našem souboru nepotvrdil [10].
Vzhledem k velké diverzitě v počtu folikulů u jednotlivých pacientek jsme ještě porovnali vztah mezi počtem folikulů a koncentrací PAPP-A v krevním séru (viz graf 2). Ani zde se neukázala významná korelace.
Graph 2. Počet folikulů a sérová hladina PAPP-A 
Folikulární membrána tedy neumožňuje přestup významného množství PAPP-A do krve. Z toho lze předpokládat, že stanovení PAPP-A v krvi tedy téměř jistě nebude mít smysl pro predikci OHSS.
Pro zjištění, zda hladina PAPP-A souvisí se vznikem OHSS a zda její hladina umožní predikci závažnosti OHSS, jsme stanovili hladiny folikulárního PAPP-A u pacientek, které vzhledem k počtu punktovaných folikulů měly empiricky vyšší riziko vzniku OHSS – tedy u žen, kde počet punktovaných folikulů byl nad 18, viz tabulku 2.
Table 2. Závislost hladin PAPP-A na stupni závažnosti OHSS 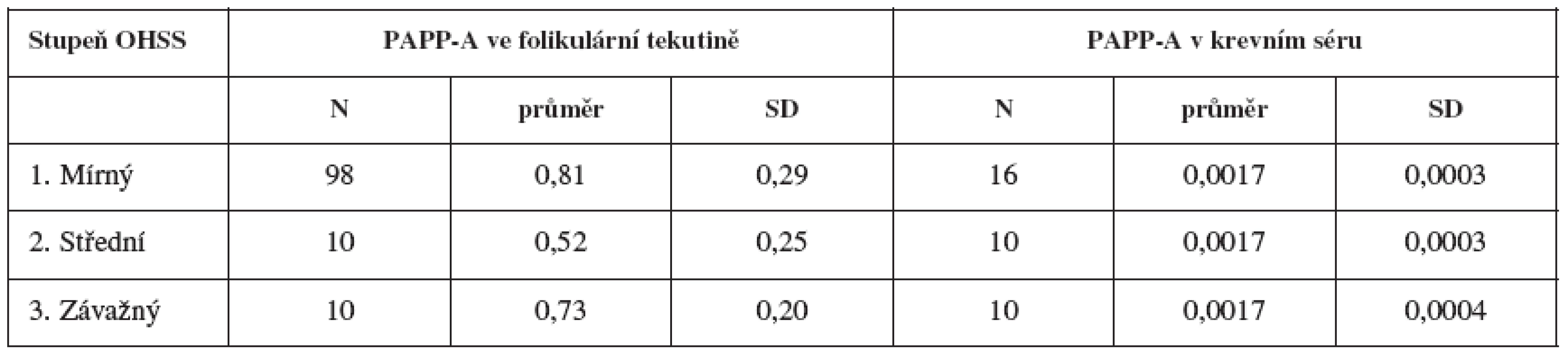
Výsledky neukazují statisticky významnou (na 5% hladině významnosti) závislost hladin PAPP-A (jak ve folikulární tekutině, tak v krevním séru) na stupni závažnosti OHSS.
Diskuse
V dostupné literatuře k datu 2. 12. 2008 jsme nenalezli žádnou práci, která by sledovala hodnoty PAPP-A ve folikulární tekutině jako prediktor OHSS.
Hodnoty koncentrace PAPP-A ve folikulární tekutině a v krevním séru námi stanovené jsou ve shodě s literaturou [15].
Ve shodě s publikací Moos et al. [10] ani přes vysoký poměr koncentrací PAPP-A ve folikulech a v krvi (přibližně 500 : 1) nedochází k výraznému přestupu do krve ve směru koncentračního spádu (není korelace sérových hladin s počtem folikulů, ani s koncentrací folikulárního PAPP-A).
Závěr
Naše práce se jako první zabývala vztahem mezi hladinami PAPP–A a OHSS.
Potvrdili jsme ve shodě s publikací Moos et al. [10], že PAPP-A nepřechází ve významném množství z folikulů do krve.
Získaná data o folikulární koncentraci PAPP-A nepotvrdila hypotézu asociace OHSS se signální drahou využívající PAPP-A. Bude vhodné prozkoumat vztah OHSS s jinými biomarkery, které by pravděpodobně optimálně bylo možné zjistit využitím proteomických technik.
Podpořeno grantem MZ ČR IGA NR/8932-3.
MUDr. Karel Řežábek, CSc.
Gynekologicko-porodnická klinika
1. LF UK a VFN
Apolinářská 18
128 00 Praha 2
e-mail: karel.rezabek@vfn.cz
Sources
1. Aboulghar, MA., Mansour, RT. Ovarian hyperstimulation syndrome: classifications and critical analysis of preventive measures. Hum Reprod Update, 2003, 9, 3, p. 275-289.
2. Conover, CA., Faessen, GF., Ilg, KE., et al. Pregnancy-associated plasma protein-a is the insulin-like growth factor binding protein-4 protease secreted by human ovarian granulosa cells and is a marker of dominant follicle selection and the corpus luteum. Endocrinology, 2001, 142, p. 2155.
3. Conover, CA., Bale, LK., Durham, SK., et al. Insulin-like growth factor (IGF) binding protein-3 potentiation of IGF action is mediated through the phosphatidylinositol-3-kinase pathway and is associated with alteration in protein kinase B/AKT sensitivity. Endocrinology, 2001, 142, 5, p. 2155.
4. Gérard, N., Oxvig, C., .et al. Proteolytic degradation of IGF-binding protein (IGFBP)-2 in equine ovarian follicles: involvement of pregnancy-associated plasma protein-A (PAPP-A) and association with dominant but not subordinated follicles. J Endocrinol., 2004, 182, 3, p. 457-466.
5. Hourvitz, A., Kuwahara, A., Hennebold, JD., et al. The regulated expression of the pregnancy-associated plasma protein-A in the rodent ovary: a proposed role in the development of dominant follicles and of corpora lutea. Endocrinology, 2002, 143, 5, p. 1833-1844.
6. Lawrence, JB., Oxvig, C., Overgaard, MT., et al. The insulin-like growth factor(IGF)-dependent binding protein-4 protease secreted by human fibroblasts is pregnancy associated plasma protein-A. Proc Natl Acad Sci USA, 96, p. 3149-3153.
8. Matsui, M., Sonntag, B., Hwang, SS., et al. Pregnancy-associated plasma protein-a production in rat granulosa cells: stimulation by follicle-stimulating hormone and inhibition by the oocyte-derived bone morphogenetic protein-15. Endocrinology, 2004, 145, p. 3686-3695.
9. Mazerbourg, S., Overgaard, MT., Oxvig, C., et al. Pregnancy-associated plasma protein-A (PAPP-A) in ovine, bovine, porcine, and equine ovarian follicles: involvement in IGF binding protein-4 proteolytic degradation and mRNA expression during follicular development. Endocrinology, 2001, 142, 12, p. 5243-5253.
10. Moos, J., Filova, V., Pavelkova, J., et al. Follicular fluid and serum levels of Inhibin A and pregnancy-associated plasma protein A in patients undergoing IVF. Fertil Steril, 2008, E pub ahead of print.
11. Nardo, LG., Bellanca, SA., Burrello, N., et al. Concentrations of insulin-like growth factor (IGF)-I and IGF binding protein-3 in the follicular fluid of women undergoing ovarian hyperstimulation with different gonadotropin preparations. Gynecol Endocrinol., 2001, 15, 6, p. 413-420.
12. Overgaard, MT., Haaning, J., Boldt, HB., et al. Expression of recombinant human pregnancy-associated plasma protein-A and identification of the proform of eosinophil major basic protein as its physiological inhibitor. J Biol Chem, 2000, 275, p. 31128-31133.
13. Oxvig, C., Sand, O., Kristensen, T., et al. Circulating human pregnancy-associated plasma protein-A is disulfide-bridged to the proform of eosinophil major basic protein. J Biol Chem, 1993, 268, p. 12243-12246.
14. Sinosich, MJ., Porter, R., Sloss, P., et al. Pregnancy-associated plasma protein A in human ovarian follicular fluid. J Clin Endocrinol Metab, 1984, 58, p.500-504.
15. Young, Sik Choi, Seung-Yup, Ku, Byung-Chul, Jee, et al. Comparison of follicular fluid IGF-I, IGF-II, IGFBP-3, IGFBP-4 and PAPP-A concentrations and their ratios between GnRH agonist and GnRH antagonist protocols for controlled ovarian stimulation in IVF-embryo transfer patients. Hum Reprod, 2006, 21, 8, p. 2015-2021.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2009 Issue 2-
All articles in this issue
- Randomizované srovnání dlouhého GnRH agonistického vs. GnRH antagonistického protokolu – hormonální parametry a charakteristiky cyklů – pilotní studie
- Hladiny PAPP-A ve folikulární tekutině a krvi pacientek stimulovaných k IVF s hrozícím ovariálním hyperstimulačním syndromem
- Heat shock protein 70 v plodové vodě u pacientek s předčasným odtokem plodové vody
- Interrupční chování a postoje k umělému přerušení těhotenství u českých žen: Výsledky národního výzkumu
- Vývoj vrozených vývojových vad u dvojčat v ČR v mezinárodním srovnání
- Srovnávací analýza ztráty heterozygozity (LOH) a profilu exprese v normální tkáni, DCIS a v tkáni invazivního karcinomu prsu
- Nádorová onemocnění u dětí narozených s vrozenou vadou Aktuální data v České republice
- Dlouhodobá úspěšnost tahuprosté vaginální pásky při léčbě stresové inkontinence moči
- Termoablace endometria systémem Thermachoice – 10 let zkušeností
- Sexuální funkce po laparoskopicky asistované vaginální hysterektomii (LAVH) a totální laparoskopické hysterektomii (TLH) u předoperačně asymptomatických žen
- Hematologické malignity v graviditě
- Surogátní mateřství – literární názory a praxe
- Syndrom ovariálního zbytku
- Fitz-Hugh-Curtis syndróm: kazuistika
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Sexuální funkce po laparoskopicky asistované vaginální hysterektomii (LAVH) a totální laparoskopické hysterektomii (TLH) u předoperačně asymptomatických žen
- Termoablace endometria systémem Thermachoice – 10 let zkušeností
- Fitz-Hugh-Curtis syndróm: kazuistika
- Syndrom ovariálního zbytku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career