-
Medical journals
- Career
Radiologické hodnocení lumbální spinální stenózy a jeho klinická korelace
: B. Adamová 1,2; M. Mechl 3; T. Andrašinová 1; J. Bednařík 1,2
: Neurologická klinika LF MU a FN Brno 1; CEITEC – Středoevropský technologický institut MU, Brno 2; Radiologická klinika LF MU a FN Brno 3
: Cesk Slov Neurol N 2015; 78/111(2): 139-147
: Review Article
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amcsnn2015130Lumbální spinální stenóza je klinicko‑radiologický syndrom, nejnovější definice zohledňují klinickou manifestaci i anatomické změny (zúžení páteřního kanálu). Za nejvhodnější neinvazivní vyšetření k potvrzení anatomického zúžení páteřního kanálu nebo přítomnosti komprese nervových kořenů u pacientů s klinickým podezřením na lumbální spinální stenózu je považována magnetická rezonance bederní páteře. K přesnějšímu hodnocení radiologického nálezu byla definována řada kvantitativních parametrů popisujících rozměry páteřního kanálu, nicméně korelace těchto parametrů s klinickým obrazem není uspokojivá. Perspektivním postupem ke zvýšení výtěžnosti radiologického vyšetření se jeví zohlednění dynamického aspektu lumbální spinální stenózy a důraz na tíži komprese nervových a cévních struktur v páteřním kanálu s využitím morfologického popisu durálního vaku a jeho obsahu.
Klíčová slova:
lumbální spinální stenóza – magnetická rezonance – počítačová tomografie – perimyelografie – skiagrafie – neurogenní klaudikaceÚvod
Cílem přehledu je poskytnout souhrnné informace o radiologických vyšetřeních využívaných v diagnostice lumbální spinální stenózy (LSS) a nejčastěji hodnocených kvantitativních a kvalitativních parametrech. Dále bude analyzována korelace radiologických nálezů s klinickou manifestací LSS.
Již samotná definice pojmu LSS není jednotná. Někteří autoři jej považují za klinicko‑radiologický syndrom, jiní jej používají pro označení radiologických změn. Z radiologického hlediska je LSS definována jako osteoligamentózní zúžení páteřního kanálu (tzv. centrální stenóza) či kořenového kanálu (tzv. laterální stenóza) v bederním úseku páteře [1,2]. Za lumbální stenózu se nepovažuje zúžení na podkladě výhřezu meziobratlového disku [2]. Nověji je pojem lumbální spinální stenóza chápán jako klinicko‑radiologický pojem a zohledňuje i klinickou manifestaci radiologických změn (zejm. neurogenní klaudikace) [3]. Klinická manifestace LSS je způsobena zmenšením prostoru pro nervové a cévní struktury v bederní páteři, přičemž symptomy jsou způsobeny buď přímou mechanickou kompresí, nebo nepřímou vaskulární kompresí nervových kořenů anebo kaudy equiny [4].
Někdy se dokonce termíny lumbální spinální stenóza a neurogenní klaudikace považují za synonyma, což nepokládáme za úplně správné, protože klinická manifestace LSS může zahrnovat i radikulární syndrom či syndrom kaudy equiny. Novější komplexní definice degenerativní LSS, která byla vytvořena Severoamerickou spinální společností, se opírá především o klinické projevy tohoto onemocnění. Degenerativní LSS je zde definována jako onemocnění, jež se vyznačuje zmenšením prostoru pro nervové a cévní struktury v bederní páteři na podkladě degenerativních změn v páteřním kanále. Pokud je symptomatická, tak vede k různým klinickým syndromům vyznačujícím se bolestí a/ nebo únavností v hýždi a/ nebo v dolní končetině, které se mohou vyskytnout s bolestí nebo bez bolesti v zádech. Pro symptomatickou LSS jsou charakteristické určité provokační a úlevové faktory. Provokační faktory zahrnují vzpřímení, jako je chůze nebo stoj, jež indukují neurogenní klaudikace. Mezi úlevové faktory patří předklon, sed a/ nebo ulehnutí [5,6]. My sami navrhujeme používat termín lumbální spinální stenóza v situaci, kdy je přítomna klinicky manifestní stenóza; pokud je zúžení asymptomatické, tak doporučujeme používat termín úzký páteřní kanál, což je ve shodě s doporučením některých autorů [2,7].
Radiologická diagnostika LSS
Rentgenový snímek – skiagrafie
Z radiologického vyšetření by na prvním místě měly být provedeny prosté rentgenové snímky bederní páteře (skiagrafie). Výhodou této metody je její velmi dobrá dostupnost a jednoduchost. Standardně zhotovujeme snímky v předozadní a bočné projekci. Rentgenové snímky přinášejí informace zejm. o degeneraci meziobratlového disku, o přítomnosti spondylartrózy, dorzálních osteofytů, spondylolistézy a skoliózy, dále slouží k ozřejmění případné sekundární příčiny zúžení páteřního kanálu (tumory, metastázy, traumatické změny apod.). Též je na snímku dobře identifikovatelný předozadní rozměr páteřního kanálu stejně jako rozměr příčný, i když máme na mysli rozměry primární. Vrozené zúžení páteřního kanálu je možné identifikovat na bočném snímku, a to zhodnocením poměru délky pediklů a obratlového těla ve výši obratle L3, pro vrozené zúžení páteřního kanálu svědčí poměr menší než 0,43 [8]. Šikmé snímky prováděné z důvodu posouzení průsvitu neuroforamin, event. kontinuity obratlových oblouků se v současné době zhotovují méně často, a to především proto, že zobrazení těchto struktur je přesnější na CT či MR vyšetření [9].
Doporučuje se provádět i dynamické (funkční) snímky bederní páteře, a to v předklonu a záklonu, případně i v úklonu, které umožní hodnocení přítomnosti možné nestability (obr. 1a,b). Bez změření změn posunu (skluzu) a úhlu skluzu („slip angle“) na funkčních snímcích nemůžeme označit pohybový segment za nestabilní. Mezi hodnocené segmentální parametry patří jednak posun obratlů (ventrálně – spondylolistéza, dorzálně – retrolistéza) a dále úhly, které svírají sousední obratle [10]. Za nestabilní je segment považován, pokud je rozdíl posunu na funkčních snímcích v daném segmentu více než 4 mm či rozdíl úhlů skluzu nad 11° (toto kritérium platí pro segmenty, v nichž není přítomna výraznější degenerace disku). Při stárnutí a degeneraci meziobratlových disků dochází k omezování pohybu mezi jednotlivými obratli. Navržené kritérium nestability v segmentech s těžší degenerací disku (v případě snížení disku o 50 % a více) je rozdíl úhlů skluzu mezi flexí a extenzí v segmentu 6° a více [11].
1. Dynamické rentgenové snímky bederní páteře. 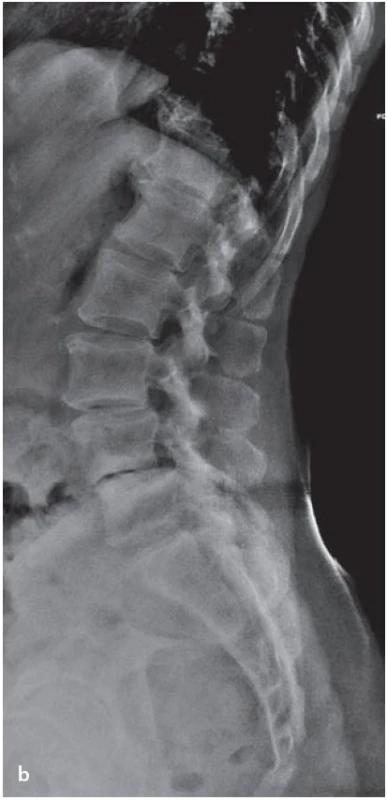
a) Snímek v předklonu s posunem obratlového těla L3 vůči L4 a taktéž L4 vůči L5 ventrálně. b) Snímek v záklonu, kdy dochází ke zmenšení ventrálního posunu obratlů. K přesnému posouzení situace v páteřním kanálu však rentgenové snímky nestačí. Je nutno provést další zobrazovací vyšetření, zvláště MR bederní páteře, event. CT bederní páteře či perimyelografii (resp. CT myelografii).
MR bederní páteře
Zobrazení struktur páteře je na MR komplexní. Výhodou tohoto vyšetření je především přesné zhodnocení měkkých tkání (meziobratlových plotének, vazů, jizevnatých změn) a zobrazení celého rozsahu bederní páteře, a tedy větší citlivost pro detekci víceetážové lumbální stenózy (obr. 2a,b). Posouzení meziobratlových plotének je doménou MR vyšetření, protože zobrazí nejen uložení ploténky a její vztah k okolním tkáním, ale i její strukturu. MR rovněž velmi dobře odliší recidivu výhřezu ploténky od pooperačních jizevnatých změn, a to i bez nutnosti nitrožilní aplikace paramagnetické kontrastní látky. Standardní T2 vážené obrazy mají totiž vysokou citlivost pro zobrazení struktury ploténky a pro její odlišení od jizevnatých změn [9]. MR rovněž umožňuje velmi dobré hodnocení neuroforamin včetně jejich obsahu (nervových kořenů). Můžeme hodnotit nejen uložení kořene, ale i jeho strukturu, např. zda je edematózně prosáklý. Pro diagnostiku LSS bývá přínosná i MR myelografie, což je zobrazení, které díky schopnosti MR identifikovat tekutinu umožní zhotovit snímky, které jsou prakticky shodné se snímky klasické perimyelografie (obr. 2c). Výtěžnost MR myelografie je srovnatelná s výtěžností klasické rentgenové perimyelografie [12]. Nevýhodou MR je nedostatečné zobrazení kostěných struktur, a to zejm. posuzování kostní kompakty, která je na MR zobrazení hypointenzní (tmavá) a může splývat s okolními tkáněmi. Tato skutečnost se týká zvláště posuzování osteofytů, které neobsahují kostní dřeň [9]. Další nevýhodou MR je omezené hodnocení dynamického aspektu LSS. Nejnovější otevřené MR přístroje, jejichž vyšetřovací prostor není omezen ve vertikální rovině, řeší i tento problém a umožňují dynamické zobrazování. Počet těchto přístrojů je však zatím velmi omezený. Zvýšení senzitivity MR v diagnostice LSS lze dosáhnout i použitím zařízení, které navozuje axiální zatížení páteře, a tím dochází ke zvýraznění lumbální stenózy [7]. Rovněž podání gadoliniové kontrastní látky intravenózně při MR vyšetření u pacientů s LSS může zvýšit specificitu vyšetření. Bylo potvrzeno, že u pacientů s LSS a neurogenními klaudikacemi dochází k sycení intratékálních nervových kořenů v místě stenózy, což napovídá o korelaci nálezu na zobrazovacím vyšetření s klinickou symptomatikou (neurogenními klaudikacemi) [13].
2. MR zobrazení bederní páteře. 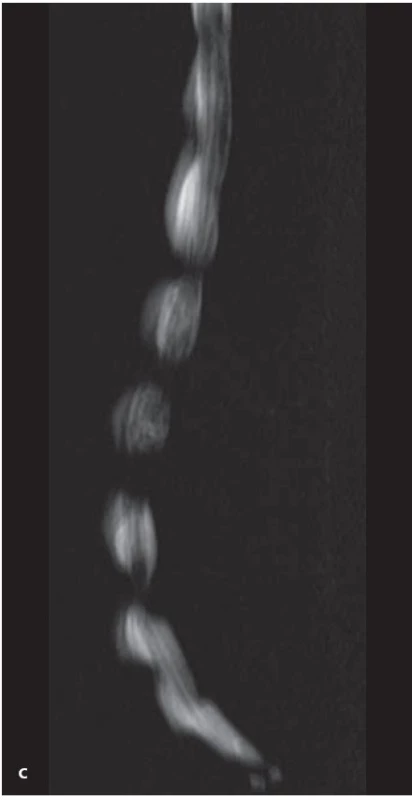
a) MR obraz v T2 sekvenci a sagitální rovině s víceetážovou stenózou páteřního kanálu a posunem obratlového těla L4 vůči L5. b) Transverzální (axiální) obraz v T2 vážení v úrovni meziobratlové ploténky je nedílnou součástí protokolu MR zobrazování páteře, v tomto případě s těsnou stenózou páteřního kanálu a kompresí vaku plen. c) Obraz tzv. MR myelografi e, tedy speciální sekvence, jež zvýrazňuje tekutinu a potlačuje signál z ostatních tkání. Dobře tak lze identifikovat omezení vaku plen, většina těchto sekvencí však postižení zvýrazňuje, jejich výsledky jsou tedy orientační. Počítačová tomografie (CT)
Princip CT je založen na zobrazení vrstvy (tomogramu) zvolené oblasti, což společně s vysokým prostorovým rozlišením je zásadní v případě posuzování struktur páteře. Dobře můžeme hodnotit kostní tkáně, ale i měkkotkáňové struktury, jako jsou vazy a ploténky. Velmi dobře je hodnotitelný primární rozměr páteřního kanálu stejně jako změny sekundární, a to bez ohledu na jejich lokalizaci vzhledem k úseku páteře či okolním strukturám (obr. 3a,b) [9]. Především kostní degenerativní změny (osteofyty, spondylofyty apod.) jsou lépe zobrazitelné na CT ve srovnání s MR, a to díky vysoké denzitě kostní tkáně na CT [14]. V zobrazení meziobratlových plotének a vazů sice CT nedosahuje kvalit MR, přesto je identifikace jejich postižení možná. Zásadní nevýhodou CT je značná radiační zátěž. Z technického hlediska není problém vyšetřit celý úsek bederní páteře, radiační dávka takového vyšetření společně se zátěží pánevních orgánů však omezuje jeho indikaci jen pro výjimečné případy, především traumatologii. Zobrazení omezeného počtu etáží na CT je spojeno s rizikem opomenutí stenózy v nevyšetřených etážích.
3. CT zobrazení bederní páteře. 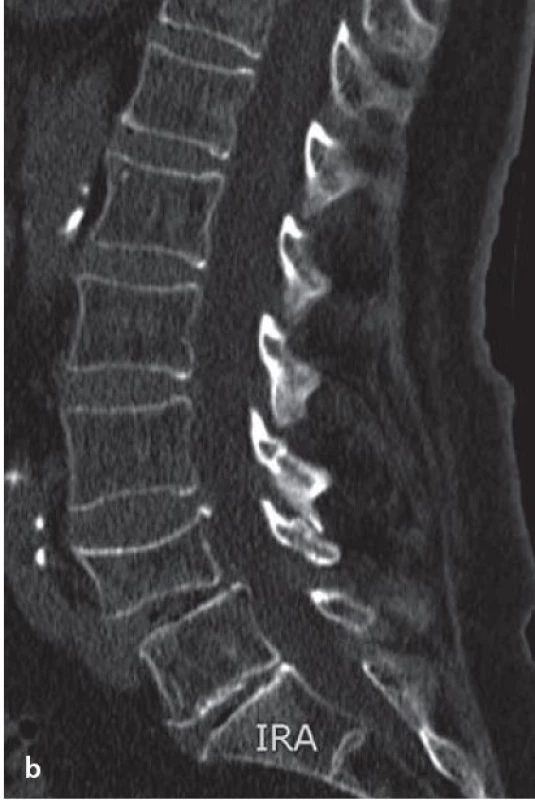
a) Transverzální obraz v úrovni meziobratlového skloubení při spondylartróze. b) Sagitální rekonstrukce bederní páteře umožňuje velmi dobře posoudit struktury skeletu, hodnocení měkkých tkání je však na CT omezené. Kontrastní perimyelografie, CT myelografie
Kontrastní rentgenová perimyelografie využívá aplikaci jodové kontrastní látky intradurálně cestou lumbální punkce, následně jsou provedeny rentgenové snímky bederní páteře, kdy se hodnotí změny v páteřním kanálu (obr. 4). Cenné může být provedení perimyelografie ve flexi a extenzi ke zhodnocení dynamického aspektu LSS (při extenzi může dojít ke zvýraznění dorzálního posunu ploténky, instability, k nařasení ligamentum flavum, zúžení foramin, a tím ke zvýraznění stenózy). S výhodou se následně provádí CT vyšetření (CT myelografie), které umožňuje detekovat plochu durálního vaku (obr. 5a,b). Za nepochybný průkaz stenózy je považována blokáda průchodu kontrastní látky stenotickou etáží. Nevýhodou těchto metod je, že jsou invazivní a jsou zatíženy radiační zátěží. Z těchto důvodů jsou v současné době využívány výjimečně, a to u pacientů s kontraindikací k MR vyšetření nebo u složitějších případů, např. u nemocných se skoliózou nebo s pooperačními změnami.
4. Rentgenová perimyelografie, resp. radikulosakografie. 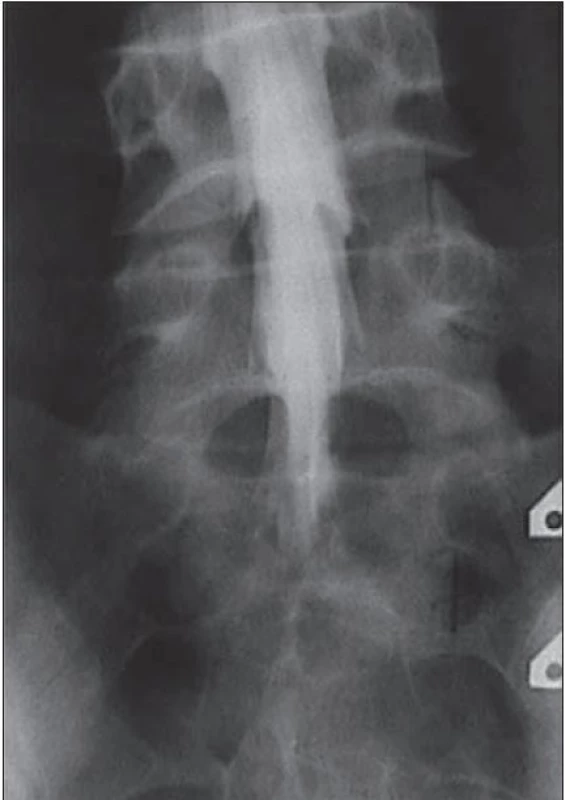
Předozadní projekce se zaměřením na kaudální část bederní páteře (L4–S1) s normálně rozvinutým vakem plen i kořenovými pochvami. 5. CT myelografie. 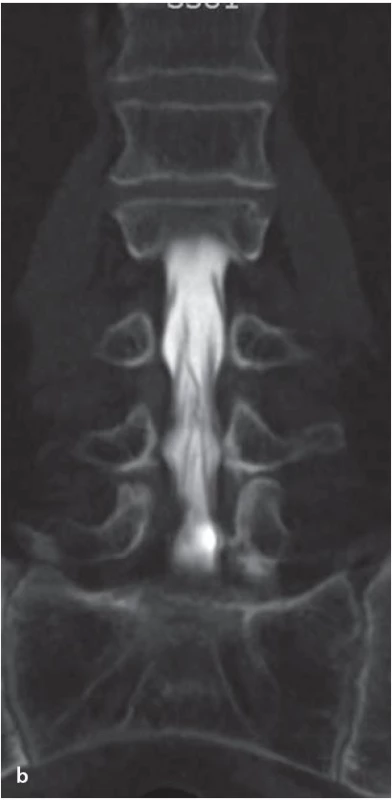
a) Transverzální obraz v poloze pacienta na břiše s kontrastní náplní vaku plen a dobrou diferenciací jednotlivých nervových kořenů. b) Rekonstrukce v koronální rovině. Hodnocené radiologické parametry u LSS
Pro radiologickou definici lumbální stenózy a její tíže se hodnotí řada parametrů a rozměrů páteřního kanálu, a to jak na MR, CT tak i myelografii. Mezi jednotlivými autory však není jednoznačná shoda ve způsobu měření ani v definovaných hraničních (cut‑off) hodnotách pro stenózu. Steurer et al v roce 2011 provedli metaanalýzu, v níž analyzovali 25 studií, které popisovaly radiologické známky LSS, a čtyři systematické přehledy [15]. Nejčastějšími deskriptory centrální stenózy byly předozadní rozměr kostěného páteřního kanálu či durálního vaku a příčná plocha (cross ‑ sectional area) durálního vaku nebo páteřního kanálu (obr. 6a,b). Stenóza byla většinou definována jako předozadní rozměr kostěného páteřního kanálu či durálního vaku menší než 10 mm nebo příčná plocha durálního vaku menší než 100 mm2. Hloubka laterálního recesu ≤ 3 mm anebo úhel laterálního recesu < 30° jsou považovány za deskriptory pro laterální stenózu (obr. 7a,b). Foraminostenóza byla definována rozměrem 2 – 3 mm [15]. Obecně platí, že předozadní rozměr páteřního kanálu měřený ve výši středu obratlového těla odráží především vrozenou (vývojovou) šíři páteřního kanálu, předozadní rozměr měřený ve výši meziobratlové ploténky je kromě vrozené šíře výrazně ovlivněn i degenerativními změnami.
6. Měření páteřního kanálu na MR. 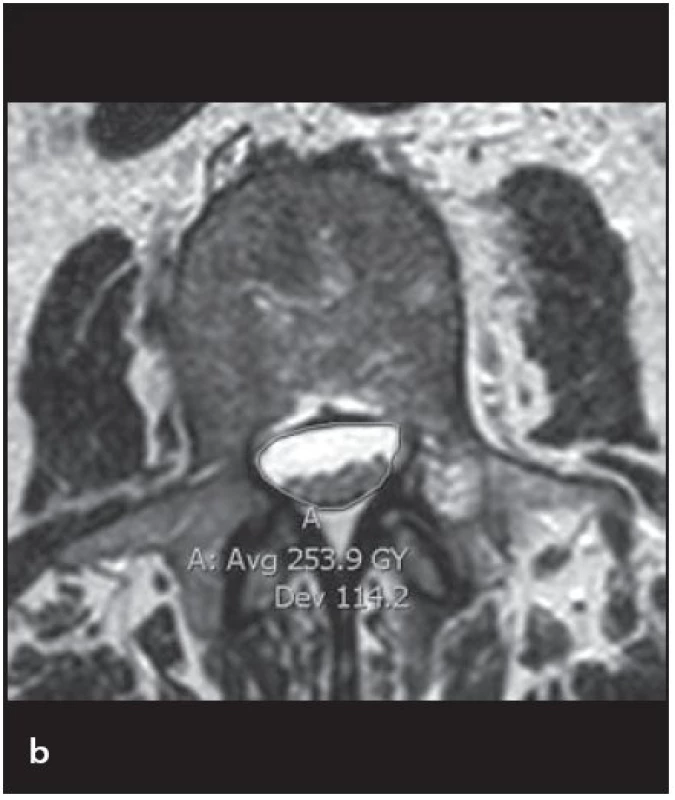
a) Předozadní primární rozměr, měření ve střední části obratlového těla. b) Plocha vaku plen v transverzálním T2 obraze. 7. Měření recesů páteřního kanálu. 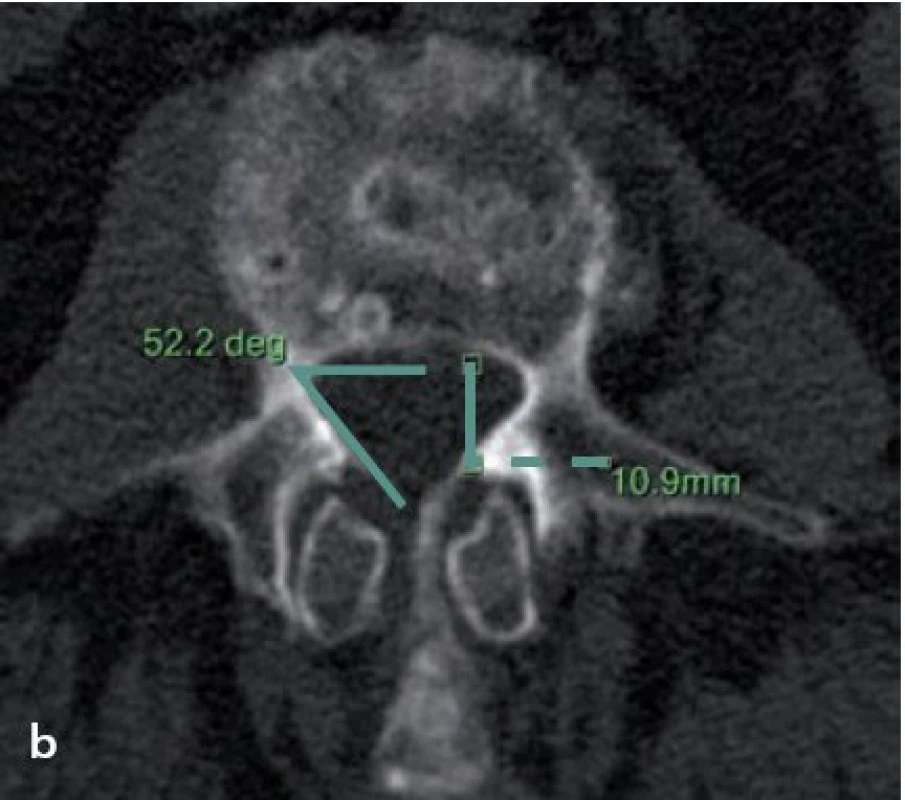
a) Hloubka recesu (6,5 mm) v úrovni obratle S1 na MR obraze – vzdálenost od zadní hrany kosti křížové po intervertebrální skloubení. b) Měření úhlu recesu na CT (52,2°) a hloubky recesu (10,9 mm). Přehled vybraných kvantitativních parametrů popisujících stenózu páteřního kanálu spolu s místem měření a definovanými hraničními hodnotami je uveden v tab. 1. Steurer et al shrnují, že je nutné vytvořit dobře definovaná a jednoznačná radiologická kritéria lumbální stenózy za účelem zvýšení diagnostické přesnosti a spolehlivosti vstupních kritérií pro klinické studie [15].
1. Přehled vybraných kvantitativních parametrů popisujících stenózu páteřního kanálu spolu s místem měření a definovanými hraničními hodnotami. 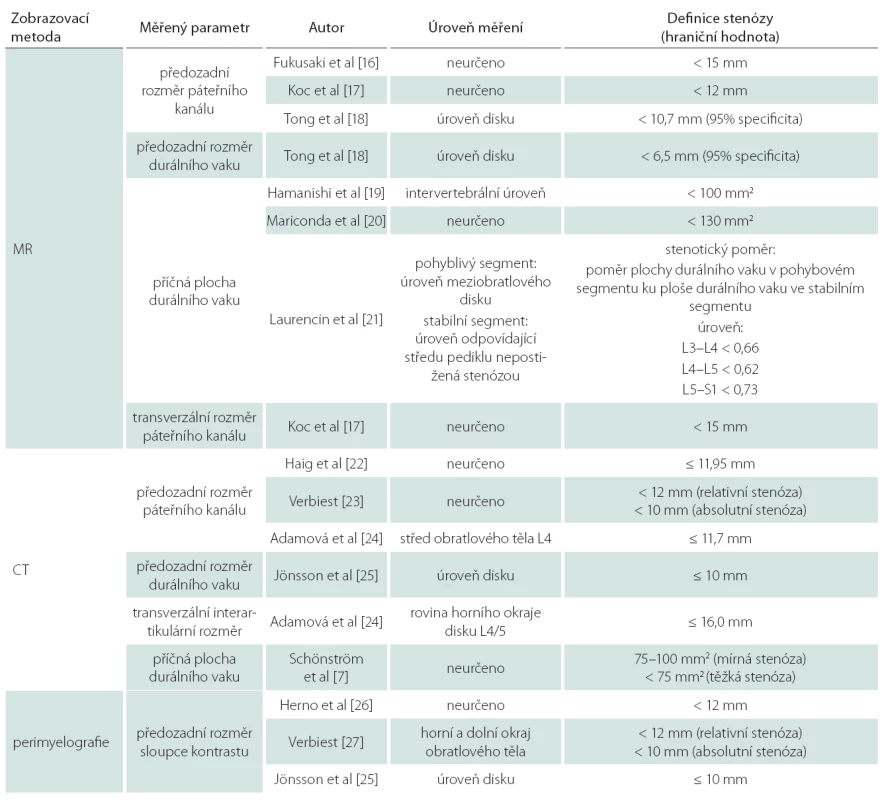
Někteří autoři začali při definici radiologické stenózy a její tíže věnovat pozornost morfologickému obrazu durálního vaku v lumbální oblasti, který zohledňuje míru komprese nervových struktur v páteřním kanále. Zajímavé je zjištění, že u osob bez podezření na lumbální stenózu MR provedená vleže na zádech prokazuje tzv. sedimentaci lumbálních nervových kořenů do dorzální části durálního vaku. Oproti tomu u pacientů se symptomy LSS se sedimentace vyskytuje zřídka a nervové kořeny zůstávají v přední či centrální části durálního vaku. Autoři tento jev nazvali jako „sedimentační znamení“ a definovali chybění sedimentace nervových kořenů jako pozitivní sedimentační znamení, které svědčí pro přítomnost lumbální stenózy [28]. Sedimentační znamení by mělo být hodnoceno v transverzální rovině na T2 vážených obrazech, a to nad či pod maximální stenózou, protože v úrovni stenózy leží nervové kořeny těsně u sebe a nemohou být dobře identifikovány. Bylo rovněž zjištěno, že u pacientů s LSS léčených konzervativně je pozitivní sedimentační znamení asociováno s horším efektem léčby [29]. Hodnocení sedimentace lumbálních kořenů má však i své omezení, a to zejm. u foraminální stenózy, kterou pomocí tohoto příznaku nelze hodnotit, u stenózy v etáži L5/ S1 (kořeny S1 a S2 opouští durální vak ventrálně, čímž je inhibována sedimentace do dorzální části durálního vaku), dále u stavů po operaci bederní páteře a u primárně úzkého páteřního kanálu.
Schizas et al vytvořili sedmistupňovou kvalitativní klasifikaci, která je založena na morfologii durálního vaku [30]. Durální vak se hodnotí na T2 vážených transverzálních obrazech a posuzuje se poměr obsahu mozkomíšního moku a nervových kořenů v bederní oblasti páteře. Bylo definováno sedm typů (stupňů) nálezů (A1, A2, A3, A4, B, C, D), přičemž stupeň A odpovídá žádné nebo malé stenóze, stupeň B střední stenóze, stupeň C těžké stenóze a stupeň D extrémní stenóze (tab. 2, obr. 8a–g). Výhodou této klasifikace je, že odráží stupeň komprese nervových struktur a obsahu durálního vaku v páteřním kanále, je jednoduchá a nevyžaduje žádné specifické měření.
2. Radiologická klasifikace lumbální spinální stenózy dle Schizase et al [30]. ![Radiologická klasifikace lumbální spinální stenózy dle Schizase et al [30].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/386b300ff32156c9ec27df00ade742cd.png)
8. Morfologická klasifikace stenózy páteřního kanálu na transverzálních T2 MR obrazech dle Schizase et al [30]. ![Morfologická klasifikace stenózy páteřního kanálu na transverzálních T2 MR obrazech dle Schizase et al [30].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/27ea609e58d5f7c666e66984336be9d7.jpg)
a) Stupeň A1. b) Stupeň A2. c) Stupeň A3. d) Stupeň A4. e) Stupeň B. f) Stupeň C. g) Stupeň D. Volba radiologického vyšetření
Vždy by u pacienta s podezřením na LSS měly být provedeny prosté snímky bederní páteře včetně funkčních (dynamických) snímků.
Kent et al provedli metaanalýzu, která hodnotila přesnost CT, MR a myelografie v diagnostice pacientů s LSS. Senzitivita MR u pacientů s LSS dosahovala 81 – 97 %, senzitivita CT 70 – 100 % a senzitivita myelografie 67 – 78 %. Tato studie tedy prokázala, že všechny tři metody jsou přínosné a žádná z nich není jasně lepší v diagnostice LSS [31].
Severoamerická spinální společnost nově vydala klinické doporučení, které se zabývá i volbou radiologických vyšetření u pacientů s podezřením na LSS. Je zde uvedeno, že u pacientů s podezřením na LSS je MR bederní páteře doporučena jako nejvhodnější neinvazivní vyšetření k potvrzení anatomického zúžení páteřního kanálu nebo přítomnosti komprese nervových kořenů (síla doporučení B). U těch pacientů, kde je MR kontraindikována nebo neprůkazná, je doporučováno provedení CT myelografie za účelem průkazu zúžení páteřního kanálu anebo komprese nervových kořenů (síla doporučení B). Za situace, kdy jsou MR bederní páteře či CT myelografie kontraindikované či neprůkazné, je doporučeno provedení prostého CT bederní páteře k potvrzení diagnózy [5,6]. V běžné klinické praxi v našich podmínkách však dáváme za situace, kdy není možno provést MR bederní páteře, přednost prostému CT bederní páteře před CT myelografií, a to pro neinvazivnost vyšetření. U pacientů s klinickým podezřením na LSS, plochou durálního vaku pod 110 mm2 a se suspektní, ale neprokázanou centrální či laterální stenózou je za užitečný doplněk k rutinním MR nebo CT považováno provedení MR anebo CT s axiálním zatížením (síla doporučení B). Dále se doporučuje, aby byla používána dobře definovaná a validovaná kritéria pro hodnocení anatomického zúžení páteřního kanálu na MR, CT či CT myelografii, která zvyšují intra - a interindividuální spolehlivost (síla doporučení B) [5,6].
Byla provedena studie, při níž byli osloveni experti zabývající se radiologií páteře (muskuloskeletální radiologové a neuroradiologové) za účelem posouzení, které parametry považují na nejpřínosnější při definici LSS. Mezi kvantitativními kritérii byl jako nejpřínosnější parametr hodnocen předozadní rozměr kostěného kanálu s hraniční hodnotou 12 mm v úrovni krycí ploténky (lamina). Další přínosné definované hraniční hodnoty zahrnovaly předozadní rozměr durálního vaku (12 mm), rozměr foramina (3 mm), hloubku laterálního recesu (3 mm), plochu durální vaku (100 mm2). Kvalitativní kritéria zahrnovala zejm. přítomnost protruze disku, chybění perineurálního intraforaminálního tuku, přítomnost degenerativní hypertrofie facetových kloubů, chybění likvoru okolo kaudy equiny, hypertrofii ligamenta flava [3].
Korelace radiologických nálezů s klinickou manifestací lumbální spinální stenózy
Korelace mezi tíží radiologických změn a klinickým nálezem či funkčním postižením je stále nedořešená otázka. Radiologická stenóza páteřního kanálu se často zachytí i u asymptomatických jedinců. Boden et al popsali signifikantní centrální stenózu na MR u 21 % asymptomatických jedinců starších 60 let [32]. Prevalence asymptomatické stenózy na MR vzrůstá s věkem, střední či těžká centrální stenóza byla zachycena u 7 % osob mladších 45 let ve srovnání s 21 % osob starších 65 let [33]. Tong et al popisují ještě vyšší výskyt centrální stenózy u asymptomatických osob nad 55 let věku – alespoň lehkou stenózu přítomnou nejméně v jedné etáži mělo 72,7 % osob, alespoň střední stenóza byla prokázána u 30,3 % osob a těžká centrální stenóza u 6,1 % osob [18].
V doporučení Severoamerické spinální společnosti je uvedeno, že existují stále nedostatečné důkazy pro vytvoření doporučení pro nebo proti korelaci mezi klinickými symptomy anebo funkcí a anatomickým zúžením páteřního kanálu na MR, CT či CT myelografii [5,6]. To je také důvod, aby do definice pro degenerativní LSS byly zahrnuty jak klinické symptomy, tak přítomnost zúženého páteřního kanálu. Zeifang et al na základě své studie uzavírají, že plocha durálního vaku na MR nekoreluje s kapacitou chůze u pacientů s LSS [34]. Také v jiné studii byla prokázána špatná korelace mezi tíží stenózy na MR a tíží disability hodnocené pomocí Oswestry dotazníku [35]. V protikladu s tímto je zjištění z další studie, kde bylo shledáno, že minimální plocha durálního vaku korelovala s bolestí dolní části zad a v dolních končetinách, s kapacitou chůze a kvalitou života u pacientů s LSS [36]. Korelaci mezi elektrodiagnostickým vyšetřením a nálezem na MR většina studií hodnotí jako špatnou [37,38].
Důvodů pro špatnou korelaci radiologických nálezů s klinickými a elektrofyziologickými nálezy je zřejmě více. Jedním z nich bude dynamický aspekt lumbální stenózy, kdy se stenóza zvýrazňuje při extenzi páteře či axiálním zatížení, přičemž rutinní radiologické vyšetření se provádí v poloze vleže. Při radiologickém vyšetření je rovněž nutné hodnotit nejen kostěný rozměr páteřního kanálu, ale musí být zohledněno i zúžení na podkladě hernie disku, hypertrofie ligament a intervertebrálních kloubů. V patofyziologii klinických projevů LSS bude hrát zřejmě nejdůležitější roli míra komprese nervových a cévních struktur v páteřním kanálu, která nemusí korelovat s běžně hodnocenými rozměry páteřního kanálu. Kompresi nervových struktur lépe odráží kvalitativní hodnocení morfologie durálního vaku, jež navrhli Schizas et al [30].
Řada studií rovněž analyzovala radiologické parametry jako prediktory úspěchu či selhání operační nebo konzervativní terapie u pacientů s LSS. Výsledky studií jsou opět nejednotné. Je popsáno, že přítomnost výrazné centrální stenózy predikuje lepší subjektivní výsledek operační léčby, naproti tomu přítomnost skoliózy predikuje horší subjektivní výsledek operační léčby [39]. U pacientů léčených konzervativně je popisováno, že radiologická tíže stenózy predikuje nepříznivý vývoj a že pacienti s výraznější skoliózou mají horší prognózu [40 – 42]. Naproti tomu Amundsen et al nenašli radiologické prediktory vývoje u pacientů s LSS léčených konzervativně [43]. Ve studii, kde tíže stenózy byla hodnocena pomocí morfologie durálního vaku, bylo prokázáno, že u pacientů se stupněm stenózy C a D (tedy s výraznou kompresí nervových struktur) je pravděpodobněji neúspěšná konzervativní léčba, zatímco pacienti se stupněm stenózy A a B pravděpodobněji nebudou vyžadovat operaci, což lze použít jako jedno z kritérií pro volbu terapie u pacientů s LSS [30].
Závěr
Radiologický průkaz stenózy páteřního kanálu v bederní oblasti je velmi častý, a to i u asymptomatických jedinců, přičemž prevalence těchto změn se zvyšuje s věkem. MR bederní páteře je považována za nejvhodnější neinvazivní vyšetření k potvrzení anatomického zúžení páteřního kanálu nebo přítomnosti komprese nervových kořenů u pacientů s klinickým podezřením na LSS. Korelace mezi klinickým a radiologickým nálezem u pacientů s LSS je většinou špatná. Proto bude nutné provést ještě další studie za účelem vyjasnění této korelace a stanovení, které radiologické parametry nejlépe korelují s klinickým obrazem a funkčním postižením. Míru komprese nervových a cévních struktur v bederním úseku páteřního kanálu, která zřejmě bude rozhodující pro klinickou manifestaci stenózy, lépe popisuje morfologické zhodnocení durálního vaku ve srovnání s kvantitativními parametry. Zvýšení výtěžnosti radiologického vyšetření lze rovněž dosáhnout důrazem na dynamický aspekt lumbální spinální stenózy, tedy provedením MR či CT s axiálním zatížením či dynamického MR bederní páteře.
Použité zkratky
CT – počítačová tomografie
LSS – lumbální spinální stenóza
MR – magnetická rezonance
Tato práce byla podpořena grantem IGA MZ ČR NT ‑ 13449 - 4 a MZ ČR – RVO (FNBr, 65269705).
Přijato k recenzi: 12. 12. 2014
Přijato do tisku: 6. 1. 2015
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Blanka Adamová, Ph.D.
Neurologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: badamova@fnbrno.cz
Sources
1. Arnoldi CC, Brodsky AE, Cauchoix J, Crock HV, Dommisse GF, Edgar MA et al. Lumbar spinal stenosis and nerve root entrapment syndromes. Definition and classification. Clin Orthop Relat Res 1976; 115 : 4 – 5.
2. Postacchini F. Management of lumbar spinal stenosis. J Bone Joint Surg Br 1996; 78(1): 154 – 164.
3. Mamisch N, Brumann M, Hodler J, Held U, Brunner F, Steurer J et al. Radiologic criteria for the diagnosis of spinal stenosis: results of a Delphi survey. Radiology 2012; 264(1): 174 – 179. doi: 10.1148/ radiol.12111930.
4. Epstein NE, Maldonado VC, Cusick JF. Symptomatic lumbar spinal stenosis. Surg Neurol 1998; 50(1): 3 – 10.
5. Kreiner DS, Shaffer WO, Baisden JL, Gilbert TJ, Summers JT, Toton JF et al. An evidence‑based clinical guideline for the diagnosis and treatment of degenerative lumbar spinal stenosis (update). Spine J 2013; 13(7): 734 – 743. doi: 10.1016/ j.spinee.2012.11.059.
6. North American Spine Society (NASS). Evidence‑based clinical guidelines for multidisciplinary spine care: diagnosis and treatment of degenerative lumbar spinal stenosis (revised 2011) [online]. Available from URL: https:/ / www.spine.org/ Documents/ ResearchClinicalCare/ Guidelines/ LumbarStenosis.pdf.
7. Schönström N, Willén J. Imaging lumbar spinal stenosis. Radiol Clin North Am 2001; 39(1): 31 – 53.
8. Maus TP. Imaging of spinal stenosis: neurogenic intermittent claudication and cervical spondylotic myelopathy. Radiol Clin North Am 2012; 50(4): 651 – 679. doi: 10.1016/ j.rcl.2012.04.007.
9. Mechl M. Zobrazovací metody lumbální spinální stenózy. In: Mičánková Adamová B (ed). Lumbální spinální stenóza. Praha: Galén 2012 : 95 – 101.
10. Chaloupka R. Hodnocení nestability bederní páteře. In: Mičánková Adamová B (ed). Lumbální spinální stenóza. Praha: Galén 2012 : 103 – 105.
11. Chaloupka R, Vališ P, Motyčka J, Leznar M. Contribution to the radiological evaluation of stability in spondylolisthesis. Bulg J Orthop Trauma 1999; 35(1): 9 – 15.
12. Eberhardt KE, Hollenbach HP, Tomandl B, Huk WJ. Three ‑ dimensional MR myelography of the lumbar spine: comparative case study to X‑ray myelography. Eur Radiol 1997; 7(5): 737 – 742.
13. Jinkins JR. Gd ‑ DTPA enhanced MR of the lumbar spinal canal in patients with claudication. J Comput Assist Tomogr 1993; 17(4): 555 – 562.
14. Eun SS, Lee HY, Lee SH, Kim KH, Liu WC. MRI versus CT for the diagnosis of lumbar spinal stenosis. J Neuroradiol 2012; 39(2): 104 – 109. doi: 10.1016/ j.neurad.2011.02.008.
15. Steurer J, Roner S, Gnannt R, Hodler J. Quantitative radiologic criteria for the diagnosis of lumbar spinal stenosis: a systematic literature review. BMC Musculoskelet Disord 2011; 12 : 175. doi: 10.1186/ 1471 ‑ 2474 ‑ 12 ‑ 175.
16. Fukusaki M, Kobayashi I, Hara T, Sumikawa K. Symptoms of spinal stenosis do not improve after epidural steroid injection. Clin J Pain 1998; 14(2): 148 – 151.
17. Koc Z, Ozcakir S, Sivrioglu K, Gurbet A, Kucukoglu S. Effectiveness of physical therapy and epidural steroid injections in lumbar spinal stenosis. Spine 2009; 34(10): 985 – 989. doi: 10.1097/ BRS.0b013e31819c0a6b.
18. Tong HC, Carson JT, Haig AJ, Quint DJ, Phalke VR, Yamakawa KS et al. Magnetic resonance imaging of the lumbar spine in asymptomatic older adults. J Back Musculoskelet Rehabil 2006; 19 : 67 – 72.
19. Hamanishi C, Matukura N, Fujita M, Tomihara M, Tanaka S. Cross ‑ sectional area of the stenotic lumbar dural tube measured from the transverse views of magnetic resonance imaging. J Spinal Disord 1994; 7(5): 388 – 393.
20. Mariconda M, Fava R, Gatto A, Longo C, Milano C. Unilateral laminectomy for bilateral decompression of lumbar spinal stenosis: a prospective comparative study with conservatively treated patients. J Spinal Disord Tech 2002; 15(1): 39 – 46.
21. Laurencin CT, Lipson SJ, Senatus P, Botchwey E, Jones TR, Koris M et al. The stenosis ratio: a new tool for the diagnosis of degenerative spinal stenosis. Int J Surg Investig 1999; 1(2): 127 – 131.
22. Haig AJ, Geisser ME, Tong HC, Yamakawa KS, Quint DJ,Hoff JT et al. Electromyographic and magnetic resonance imaging to predict lumbar stenosis, low ‑ back pain, and no back symptoms. J Bone Joint Surg Am 2007; 89(2): 358 – 366.
23. Verbiest H. The significance and principles of computerized axial tomography in idiopathic developmental stenosis of the bony lumbar vertebral canal. Spine 1979; 4(4): 369 – 378.
24. Adamová B, Bednařík J, Šmardová L, Moravcová E,Chvátalová N, Prokeš B et al. Asociace mezi cervikální a lumbální stenózou páteřního kanálu. Cesk Slov Neurol N 2000; 63/ 96(5): 261 – 267.
25. Jönsson B, Annertz M, Sjöberg C, Strömqvist B. A prospective and consecutive study of surgically treated lumbar spinal stenosis. Part I: Clinical features related to radiographic findings. Spine 1997; 22(24): 2932 – 2937.
26. Herno A, Airaksinen O, Saari T. Computed tomography after laminectomy for lumbar spinal stenosis. Patients‘ pain patterns, walking capacity, and subjective disability had no correlation with computed tomography findings. Spine 1994; 19(17): 1975 – 1978.
27. Verbiest H. Chapter 16. Neurogenic intermittent claudication in cases with absolute and relative stenosis of the lumbar vertebral canal (ASLC and RSLC), in cases with narrow lumbar intervertebral foramina, and in cases with both entities. Clin Neurosurg 1973; 20 : 204 – 214.
28. Barz T, Melloh M, Staub LP, Lord SJ, Lange J, Röder CP et al. Nerve root sedimentation sign: evaluation of a new radiological sign in lumbar spinal stenosis. Spine 2010; 35(8): 892 – 897. doi: 10.1097/ BRS.0b013e3181c7cf4b.
29. Barz T, Staub LP, Melloh M, Hamann G, Lord SJ, Chatfield MD et al. Clinical validity of the nerve root sedimentation sign in patients with suspected lumbar spinal stenosis. Spine J 2014; 14(4): 667 – 674. doi: 10.1016/ j.spinee.2013.06.105.
30. Schizas C, Theumann N, Burn A, Tansey R, Wardlaw D, Smith FW et al. Qualitative grading of severity of lumbar spinal stenosis based on the morphology of the dural sac on magnetic resonance images. Spine 2010; 35(21): 1919 – 1924. doi: 10.1097/ BRS.0b013e3181d359bd.
31. Kent DL, Haynor DR, Larson EB, Deyo RA. Diagnosis of lumbar spinal stenosis in adults: a metaanalysis of the accuracy of CT, MR, and myelography. AJR Am J Roentgenol 1992; 158(5): 1135 – 1144.
32. Boden SD, Davis DO, Dina TS, Patronas NJ, Wiesel SW.Abnormal magnetic ‑ resonance scans of the lumbar spine in asymptomatic subjects. A prospective investigation. J Bone Joint Surg Am 1990; 72(3): 403 – 408.
33. Jarvik JJ, Hollingworth W, Heagerty P, Haynor DR, Deyo RA. The longitudinal assessment of imaging and Disability of the Back (LAIDBack) Study: baseline data. Spine 2001; 26(10): 1158 – 1166.
34. Zeifang F, Schiltenwolf M, Abel R, Moradi B. Gait analysis does not correlate with clinical and MR imaging parameters in patients with symptomatic lumbar spinal stenosis. BMC Musculoskelet Disord 2008; 9 : 89. doi: 10.1186/ 1471 ‑ 2474 ‑ 9 ‑ 89.
35. Sirvanci M, Bhatia M, Ganiyusufoglu KA, Duran C,Tezer M, Ozturk C et al. Degenerative lumbar spinal stenosis: correlation with Oswestry Disability Index and MR imaging. Eur Spine J 2008; 17(5): 679 – 685. doi: 10.1007/ s00586 ‑ 008 ‑ 0646 ‑ 5.
36. Ogikubo O, Forsberg L, Hansson T. The relationship between the cross ‑ sectional area of the cauda equina and the preoperative symptoms in central lumbar spinal stenosis. Spine 2007; 32(13): 1423 – 1428.
37. Egli D, Hausmann O, Schmid M, Boos N, Dietz V, Curt A.Lumbar spinal stenosis: assessment of cauda equina involvement by electrophysiological recordings. J Neurol 2007; 254(6): 741 – 750.
38. Haig AJ, Tong HC, Yamakawa KS, Quint DJ, Hoff JT,Chiodo A et al. Spinal stenosis, back pain, or no symptoms at all? A masked study comparing radiologic and electrodiagnostic diagnoses to the clinical impression. Arch Phys Med Rehabil 2006; 87(7): 897 – 903.
39. Aalto TJ, Malmivaara A, Kovacs F, Herno A, Alen M, Salmi L et al. Preoperative predictors for postoperative clinical outcome in lumbar spinal stenosis: systematic review. Spine 2006; 31(18): E648 – E663.
40. Hurri H, Slätis P, Soini J, Tallroth K, Alaranta H, Laine Tet al. Lumbar spinal stenosis: assessment of long‑term outcome 12 years after operative and conservative treatment. J Spinal Disord 1998; 11(2): 110 – 115.
41. Adamova B, Vohanka S, Dusek L, Jarkovsky J, Chaloupka R, Bednarik J. Outcomes and their predictors in lumbar spinal stenosis: a 12‑year follow‑up. Eur Spine J2015; 24 : 369–380. doi: 10.1007/ s00586 ‑ 014 ‑ 3411 ‑ y.
42. Simotas AC, Dorey FJ, Hansraj KK, Cammisa F jr. Nonoperative treatment for lumbar spinal stenosis. Clinical and outcome results and a 3‑year survivorship analysis. Spine 2000; 25(2): 197 – 203.
43. Amundsen T, Weber H, Nordal HJ, Magnaes B, Abdelnoor M, Lilleas F. Lumbar spinal stenosis: conservative or surgical management? A prospective 10‑year study. Spine 2000; 25(11): 1424 – 1435.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2015 Issue 2-
All articles in this issue
- Progressive Dementia with Parkinsonism and Behavioral Changes – from the First Manifestations to the Neuropathological Confirmation (a Case Study)
- Congenital Central Hypoventilation Syndrome (Ondine‘s Curse)
- A Neurological Complication of Hepatitis E – a Case Study
- Neurological Manifestation of Behçet’s Disease – a Case Report
- Succesfully Treated Depression in a Patient with Epilepsy – a Case Report
- Inflammatory Pseudotumor Imitating Intracranial Meningioma – a Case Report
- Neuromyelitis Optica
- Radiologic Assessment of Lumbar Spinal Stenosis and its Clinical Correlation
- Aggressive Vertebral Hemangioma
- The Use of Antipsychotic Drugs in Patients with Dementia
- Intraluminal Shunt in Carotid Endarterectomies Increases the Risk of Ischemic Stroke
- Surgical Treatment of Lateral Lumbar Spinal Stenosis Using Percutaneous Interspinous Implant
- Surgical Approaches to Thalamic Tumors
- The Effect of Conservative Therapy on Diplopia in Patients with Paralytic Strabismus
- Functional Communication Questionnaire – Validation of the Original Czech Test
- Penile Vibratory Stimulation in Patients with Spinal Cord Injury
- A Registry of Mechanical Recanalization Procedures in Acute Stroke – Pilot Results from a Multicentre Registry
- Gender Differences in Clinical Presentation and Occurence of Sleep Disturbances in Patiens with Parkinson’s Disease – a Population‑ based Study
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Aggressive Vertebral Hemangioma
- Neuromyelitis Optica
- Congenital Central Hypoventilation Syndrome (Ondine‘s Curse)
- Radiologic Assessment of Lumbar Spinal Stenosis and its Clinical Correlation
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career














