-
Medical journals
- Career
Triple negativní karcinom prsu
: J. Navrátil 1; P. Fabian 2; M. Palacova 1; K. Petrakova 1; R. Vyzula 1; M. Svoboda 1,3,4
: Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 1; Oddělení onkologické patologie, Masarykův onkologický ústav, Brno 2; Oddělení epidemiologie a genetiky nádorů, Masarykův onkologický ústav, Brno 3; Lékařská fakulta, MU, Brno 4
: Klin Onkol 2015; 28(6): 405-415
: Reviews
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko2015405Východiska:
Karcinomem prsu každoročně onemocní v České republice okolo 6 500 žen, z toho skoro 1 000 žen právě triple negativním (trojitě negativním) subtypem. Triple negativní karcinom prsu charakterizuje chybění exprese α-estrogenových, progesteronových a HER2 receptorů. V převážné většině se jedná o nízce diferencované karcinomy, většina patří do basal-like podskupiny definované původně pomocí DNA čipů. Klinicky se vyznačují vyšší agresivitou, častějším vznikem lokálních recidiv a orgánových metastáz. Častěji se vyskytují u mladších žen a bývají spjaty s výskytem dědičných forem karcinomu prsu způsobeným patogenní mutací v BRCA1 genu, vzácněji i BRCA2.Cíl:
Cílem tohoto přehledového článku je podat ucelené informace o současných poznatcích o triple negativním karcinomu prsu. Práce shrnuje informace o epidemiologii a etiopatogenezi tohoto onemocnění, popisuje rizikové faktory jak pro sporadickou, tak i hereditární formu triple negativního karcinomu prsu, řeší histopatologickou a molekulární klasifikaci triple negativního karcinomu prsu a uvedené charakteristiky dává do souvislosti s léčbou a predikcí vývoje onemocnění. Článek se rovněž zabývá novými protinádorovými léky testovanými u triple negativního karcinomu prsu.Závěr:
Triple negativní karcinom prsu představuje heterogenní skupinu onemocnění se stále omezenými léčebnými možnostmi. Klíčem k dalšímu posunu v terapii je detailní poznání jeho klinické a molekulární rozmanitosti a identifikace prediktivních biomarkerů. Další zlepšení výsledků terapie triple negativního karcinomu prsu nelze očekávat dříve, než bude nalezena cílená terapie tohoto onemocnění.Klíčová slova:
karcinom prsu – triple negativní karcinom prsu – BRCA mutace – chemoterapie – basal-likeÚvod
Triple negativní typ karcinomu prsu (triple negative breast cancer – TNBC) charakterizuje chybění exprese α-estro-genových, progesteronových a HER2 receptorů. Jejich podíl mezi karcinomy prsu je přibližně 15 % (10 – 20 %) a vyskytují se spíše v mladším věku. Histologicky se jedná o nízce diferencované karcinomy, většina patří do basal-like podskupiny. Klinicky se vyznačují zejména vyšší agresivitou, častějším vznikem lokálních recidiv a orgánových metastáz. Tento typ nádoru prsu se často vyskytuje u dědičných forem nádoru prsu (a ovarií) s nálezem patogenních mutací v BRCA1 genu. TNBC neodpovídají obecně na léčbu cílenou na buněčné receptory, a přestože jsou z hlediska své odpovědi na chemoterapii obecně považovány za chemosenzitivní nádory, v tomto směru jsou mezi nimi patrné značné rozdíly. Na straně jedné u nich pozorujeme častý výskyt patologických kompletních remisí po neoadjuvantní chemoterapii, na straně druhé nejsou výjimkou případy spojené s primární a sekundární chemorezistencí. I proto se současně hledají prediktory léčebné odpovědi a nové možnosti cílené protinádorové léčby. Cílem tohoto přehledového článku je podat aktuální komplexní informace o TNBC.
Epidemiologie
Incidence karcinomu prsu v ČR je stále na vzestupu, za posledních 20 let vzrostla téměř dvojnásobně. V roce 2012 činila 128,1 na 100 000 žen (přibližně cca 6 850 případů), mortalita byla 34,4 případů na 100 000 žen (přibližně cca 1 840 případů). Vrchol incidence se pohybuje kolem 65. roku věku. U nemocných mladších 35 let jsou diagnostikována přibližně 2 % nově vzniklých karcinomů prsu a stoupá počet žen, u kterých byl karcinom prsu zjištěn v časném klinickém stadiu. V roce 2012 bylo v I. klinickém stadiu diagnostikováno 45 % pacientek, v II. klinickém stadiu 33 %, ve III. klinickém stadiu 12 % a ve IV. klinickém stadiu 7 % [1]. Zastoupení TNBC se v naší populaci žen s karcinomem prsu pohybuje okolo 15 % s maximem výskytu v cca 55 letech. Podíl pacientek mladších 35 let činí u tohoto onemocnění až 10 % [2]. Z toho plyne, že ročně tímto subtypem onemocní téměř 1 000 žen, z toho 100 mladších 35 let. Incidence se může lišit v závislosti na oblasti a etniku. Nejvyšší, více než 30% incidence je popisována u afroamerických žen, naopak nižší je u asijských žen [3,4]. Z hlediska klinických stadií jsou TNBC diagnostikovány častěji v pokročilejších stadiích oproti celkové populaci nemocných. Z našeho vlastního souboru 400 pacientek vyplývá, že přibližně 29 % je diagnostikováno v I., 43 % ve II., 25 % ve III. a 2 % ve IV. klinickém stadiu.
Karcinomy prsu vznikají i u mužů. V ČR je tato diagnóza stanovena u přibližně 40 pacientů (incidence 0,88 případů na 100 000 mužů) [1]. Ve srovnání s ženami jsou zjištěny častěji v pozdějším věku (medián 68 let) a v pokročilejších stadiích. Stejně tak se na jejich vzniku ve větší míře podílí mutace v BRCA genech (BRCA2 > BRCA1). Přibližně 85 % (70 – 90 %) nádorů prsu u mužů exprimuje estrogenové receptory a 80 % (70 – 85 %) progesteronový receptor, naopak exprese HER2 receptoru je nižší (2 – 11 %) ve srovnání se stavem u těchto nádorů u žen. Incidence TNBC u mužů je rovněž nižší, než je tomu u žen. V závislosti na zdroji se udává mezi 1 a 12 % [5,6]. V naší 10leté kohortě nebyl diagnostikován žádný.
Diagnostika TNBC
TNBC jsou agresivní, rychle rostoucí tumory, které nemusí mít přítomné mikrokalcifikace ani typické cípaté zobrazení v mamografickém obraze. Na straně druhé TNBC nemají žádný specifický radiologický obraz a jejich diagnostika se proto obecně neliší od ostatních typů karcinomů prsu. Se stejnou efektivitou se zde uplatňují mamografie, UZ i MRI prsou. Výjimkou je medulární karcinom prsu, který se na mamografii často zobrazuje jako ovoidní ložisko s různým stupněm nerovnosti okrajů, bez známek kalcifikací a častěji má zvětšené lymfatické uzliny, které mohou být pouze reaktivní. Protože se jedná o rychle rostoucí onemocnění vyskytující se častěji u mladších žen, jejich záchyt v rámci celoplošného screeningového programu není tak častý. Speciální screeningové programy pro rizikové pacienty mají proto zobrazovací metody zařazeny v častějších intervalech (à 6 měsíců).
Rizikové faktory
Celoživotní riziko vzniku karcinomu prsu se v populaci českých žen pohybuje okolo 6 – 7 %, u TNBC činí přibližně 1 % [7]. Nejvýznamnějším faktorem je přítomnost BRCA mutace. I pro TNBC platí, že nejvýznamnějším rizikovým faktorem je nosičství BRCA mutace, zvláště BRCA1. I z tohoto důvodu by všechny pacientky s TNBC diagnostikované do 60 let věku měly být odeslány ke klinickému genetikovi za účelem vyšetření mutace v BRCA genech. U starších pacientek platí indikační kritéria v závislosti na rodinné anamnéze. K dalším známým rizikovým faktorům pro vznik TNBC patří rasová příslušnost (Afroameričanky) a expozice ionizujícímu záření, včetně diagnostické mamografie provedené do 30 let věku u nosiček BRCA mutace [8,9].
Byla zkoumána i otázka vlivu počtu porodů a kojení na prevenci vzniku TNBC. Ženy, které nikdy nekojily a/ nebo nerodily, měly až dvojnásobné riziko vzniku TNBC ve srovnání s ženami, které kojily déle než 12 měsíců. Současně vyšší počet porodů s velmi krátkou dobou kojení riziko TNBC zvyšují. Obecně však protektivní vliv kojení převažoval nad rizikovým faktorem počtu porodů, včetně pacientek s přítomnou BRCA1 mutací, nikoliv BRCA2. Riziko z užívání hormonální antikoncepce bylo zhodnoceno rozsáhlými studiemi a bylo zjištěno, že hormonální antikoncepce nemá významný vliv na vznik TNBC, podobně jako věk v době menarche a menopauzy. Dále bylo prokázáno, že riziko TNBC snižuje pravidelná fyzická aktivita a udržování normální hmotnosti [10 – 12].
Klasifikace karcinomů prsu
Stávající histologické rozdělení karcinomů prsu vychází z WHO klasifikace, která definuje 18 různých podtypů [13]. Na základě morfologie a imunohistochemických a genetických vyšetření je pro klinickou praxi definováno pět základních podskupin (tab. 1) [14]. Toto zjednodušené členění plně nekoresponduje s původní molekulární klasifikací nádorů prsu definovanou pomocí profilů genové exprese. TNBC tak z histologického, molekulárního i klinického pohledu stále tvoří značně heterogenní skupinu nádorů. Z histologických podtypů sem patří invazivní duktální karcinom blíže nespecifikovaný, medulární, lobulární, nediferencovaný, metaplastický, apokrinní, kribriformní, adenoidně cystický, komedonový a další. Největší část, až 80 % TNBC, představuje tzv. basal-like typ exprimující biomarkery diferenciace směrem k bazálním buňkám a myoepiteliím (cytokeratiny 5/ 6, 14 a 17) a receptoru pro epidermální růstový faktor (epidermal growth factor receptor – EGFR) [15,16].
1. Charakteristika molekulárních podtypů karcinomu prsu a jejich vztah k jednotlivým histologickým typům. 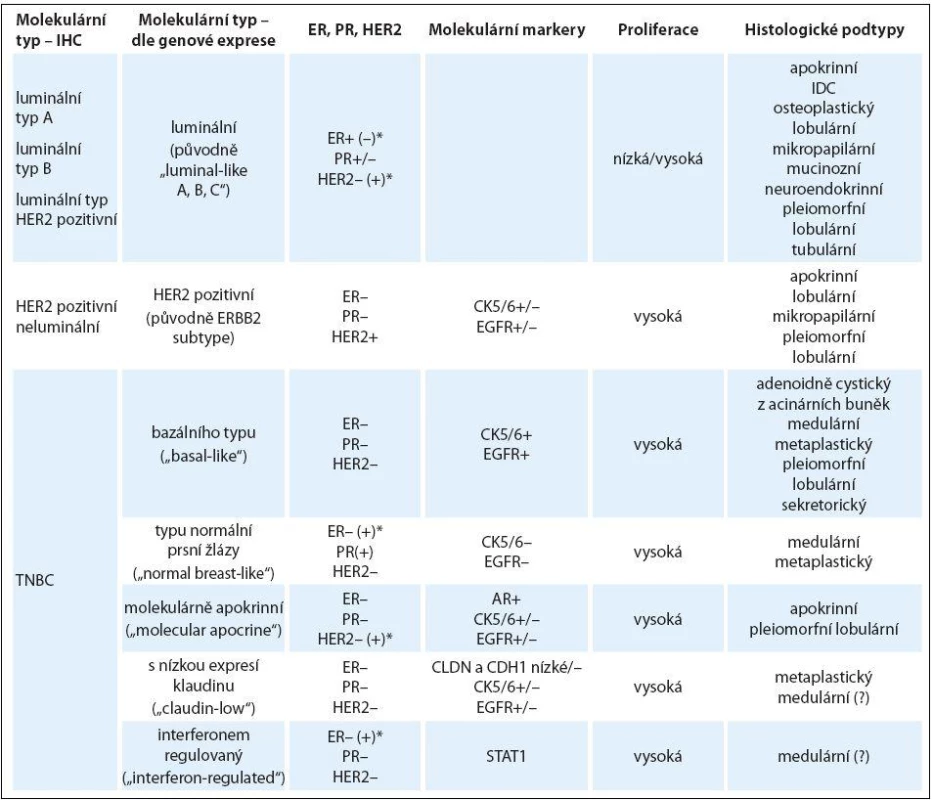
AR – androgení receptor, CDH1 – E-cadherin, CLDN – claudin, CK – cytokeratin, EGFR – epidermal growth factor receptor, ER – estrogenový receptor, IDC – invazivní duktální karcinom, PR – progesteronový receptor, STAT1 – signal transducer and activator of transcription 1, – negativní, + pozitivní, +/– příležitostně pozitivní, –/+ vzácně pozitivní Upraveno dle [29]. * Uvedené molekulární podtypy se mohou vyskytovat i u jiných než triple negativních karcinomů prsu. K dalším biomarkerům charakterizujícím TNBC patří vimentin (součást filament), c/ kit (tyrozinkinázový receptor pro růstový faktor), caveoliny (proteiny účastnící se regulace signálních drah v buňce včetně proliferace kmenových buněk apod.), androgenový receptor a další molekuly [17]. Basal-like tumory mají mnoho společných znaků i s BRCA1 mutovanými karcinomy prsu, zvláště vysoký grade, ER-α, PR a HER2 negativitu, vysokou frekvenci mutace p53, mají i podobný genový profil [18].
Vedle basal-like TNBC tvoří zbývající podskupinu TNBC bez exprese bazálních cytokeratinů a EGFR. Patří sem tzv. normal-like karcinomy, karcinomy podobné normální prsní žláze, které nemají vysoký podíl stromálních a zdravých buněk a neexprimují žádný z výše uvedených markerů. Dále je to podskupina tzv. claudin-low karcinomů, které mají nízkou expresi claudin genů [19]. Tvoří asi 5 % všech karcinomů prsu a vykazují některé vlastnosti kmenových buněk. Claudin geny kódují stejnojmenné proteiny, které jsou zapojené do procesu soudržnosti buněk. Takovým proteinem je i E-cadherin, který u těchto tumorů nebývá přítomen. Nečetnou podskupinu pak tvoří tzv. interferon-rich tumory s lepší prognózou než samotný TNBC [20,21].
1. Schematické znázornění podskupin karcinomu prsu a jejich vzájemné překrytí v expresi sledovaných znaků. 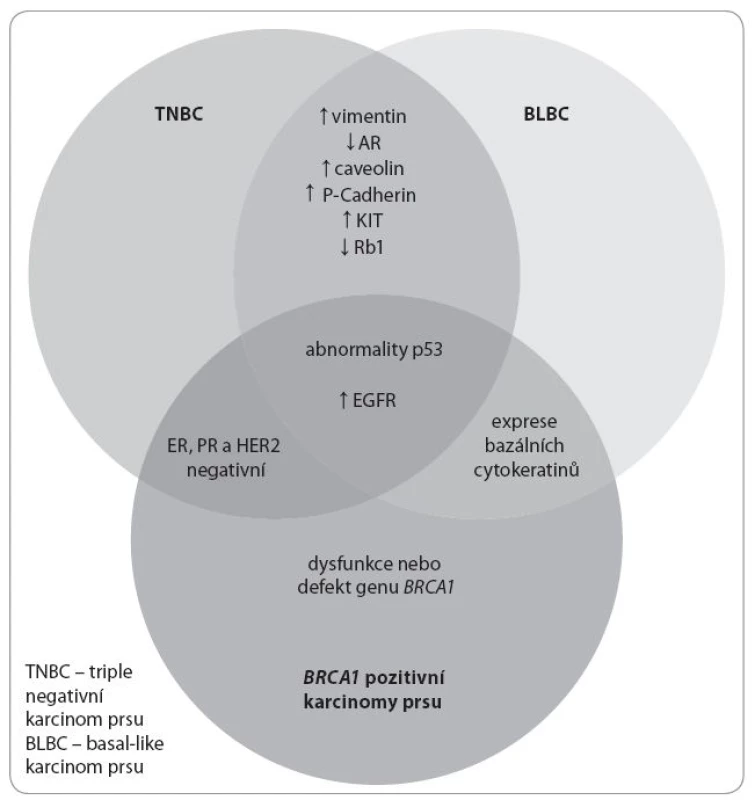
Upraveno podle [26]. V rámci molekulární klasifikace TNBC existuje několik možných schémat. Na základě analýzy genové exprese Lehmann et al vyčlenili z TNBC šest subtypů:
- Vysoce proliferující basal-like (BL1, BL2) – exprimující proliferační geny a geny signalizace DNA poškození.
- Imunomodulační (IM) – exprimující geny imunitní signalizace.
- Mezenchymální a mesenchymal stem-like (M, MSL) – exprimující geny epitelomezenchymální tranzice související s buněčnou motilitou, mezibuněčnou interakcí a řadu genů pro růstové faktory [22].
- A konečně luminální typ – exprimující androgenový receptor (LAR), který má často apokrinní morfologické rysy a je nejlépe diferencovaným subtypem [23–25].
BRCA geny
Incidence zárodečných a somatických mutací BRCA1,2 genů v populaci žen s karcinomem prsu je přibližně 2 %, u TNBC však dosahuje až 20 % [28–30]. Tyto mutace se dědí autozomálně dominantně s vysokou penetrancí. Kumulativní riziko pro vznik karcinomu prsu u BRCA1,2 mutovaných žen se pohybuje okolo 85 % do věku 70 let. Riziko vzniku druhostranného karcinomu prsu u žen s BRCA1 mutací je 4,5krát a u BRCA2 3,4krát vyšší než u pacientek bez této mutace. Karcinom prsu ale není jediný typ nádoru, který má přímou souvislost s BRCA mutacemi. Z dalších je to především karcinom ovarií, jehož celoživotní riziko je při mutaci BRCA1 až 60 % a až 20 % u mutace BRCA2 [31].
BRCA1 a BRCA2 nejsou spolu nijak příbuzné geny. Gen BRCA1 se nachází na 17. chromozomu (17q21) a gen BRCA2 na 13. chromozomu (13q12-13). Každý z obou genů kóduje protein, který se podílí na stabilitě genomu. Tyto proteiny jsou součástí komplexů řídících homologní rekombinaci a reparační procesy indukované DNA poškozením, účastní se aktivace transkripce, remodelace chromatinu a regulace buněčného cyklu [32,33]. Z patogenních mutací, které oba geny postihují, se nejčastěji jedná o delece a duplikace. BRCA1 mutace hraje roli ve vývoji luminální progenitorové buňky, a karcinomy prsu u pacientek s BRCA1 mutací jsou tak ve většině případů špatně diferencované invazivní duktální či medulární typy TNBC. Až 70 % z BRCA1 mutovaných karcinomů prsu má právě negativní hormonální receptory a méně než 5 % exprimuje HER2, většina jich spadá do basal-like podskupiny [34,35]. Atchley et al ukázali na souboru 491 pacientek, že pacientky s BRCA1 mutací mají tendenci být imunofenotypicky TNBC, zatímco pacientky s BRCA2 mutací mají sklon k expresi estrogenového receptoru [36]. Také Lackhani et al prokázali, že karcinomy prsu s mutací BRCA1 exprimují daleko častěji bazální markery než karcinomy prsu bez mutace BRCA. Přítomnost CK14, CK5/ 6 a negativita estrogenového receptoru jsou tak signifikantním prediktorem přítomnosti BRCA1 mutace. V kontrastu s tímto zjištěním ale nebyla prokázána asociace exprese těchto bazálních cytokeratinů s karcinomy prsu s mutací v BRCA2 genu [37]. Přežití pacientek s BRCA1 mutací je obecně srovnatelné s pacientkami se stejným typem karcinomu prsu bez této mutace [38].
Systémová léčba
Chemoterapie
Chemoterapie patří k základním modalitám protinádorové léčby pacientek s TNBC. Její relativní systémová efektivita vyplývá z vysoké proliferace nádorových buněk TNBC. K nejúčinnějším režimům patří ty, založené na antracyklinech a taxanech. V poslední době se ukazuje, že malá podskupina pacientek má onemocnění citlivé i na platinové deriváty [39 – 41].
2. Jednotlivé podtypy karcinomu prsu dle časového vývoje vzniku nádorové buňky ve vztahu k fyziologickému vývoji buněk prsní žlázy. 
Upraveno podle [27]. Neoadjuvantní chemoterapie
Neoadjuvantní přístup je preferovaným postupem u pacientek s klinicky pokročilým onemocněním, kdy je současně cílem provedení konzervativního operačního zákroku nebo jsou postiženy regionální lymfatické uzliny. Standardním režimem v neoadjuvanci se stala kombinace antracyklinu a alkylační látky se souběžně nebo sekvenčně podávanými taxany (např. režimy TAC, AC-T). Pacientky s TNBC léčené neoadjuvantní chemoterapií dosahují výrazně vyššího procenta patologické kompientky s TNBC nejvyšší v prvních třech letech od diagnózy a poté se již vyrovnává pacientkám non-TNBC [43,44].
BRCA mutované buňky mají defekt v reparačních mechanizmech opravy DNA pomocí homologní rekombinace, což má za následek senzitivitu k cytostatikům, která způsobují zlomy v DNA (platinové deriváty, antracykliny) [45]. Kumulace těchto poškození a nemožnost jejich oprav vede následně k dvouvláknovým zlomům DNA molekuly, což navodí apoptózu buňky. Řada autorů pozorovala vysokou účinnost platinových derivátů v neoadjuvanci [46]. Četnost pCR u pacientek s TNBC s mutací BRCA1 dosahuje až 80 %. Jedním z faktorů spojených s dobrou odpovědí na cisplatinu je nízký věk a právě metylace promotoru genu BRCA1 (tj. navázání jednouhlíkatých zbytků na cytosin molekuly DNA v místě promotoru BRCA1 genu a tím ovlivnění genové exprese). Leong pak prokázal i určitou efektivitu hodnocení p63 jako biomarkeru predikujícího senzitivitu k platině [47].
3. Rozdělení karcinomů prsu podle „intrinsic subtype“ a rozdělení TNBC dle molekulárních charakteristik. Upraveno podle [23]. ![Rozdělení karcinomů prsu podle „intrinsic subtype“ a rozdělení TNBC dle molekulárních charakteristik. Upraveno podle [23].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/1638a8fd5a785b2c0ece69a0580051bf.jpg)
Upraveno podle [23]. 4. Molekultání heterogenita TNBC. 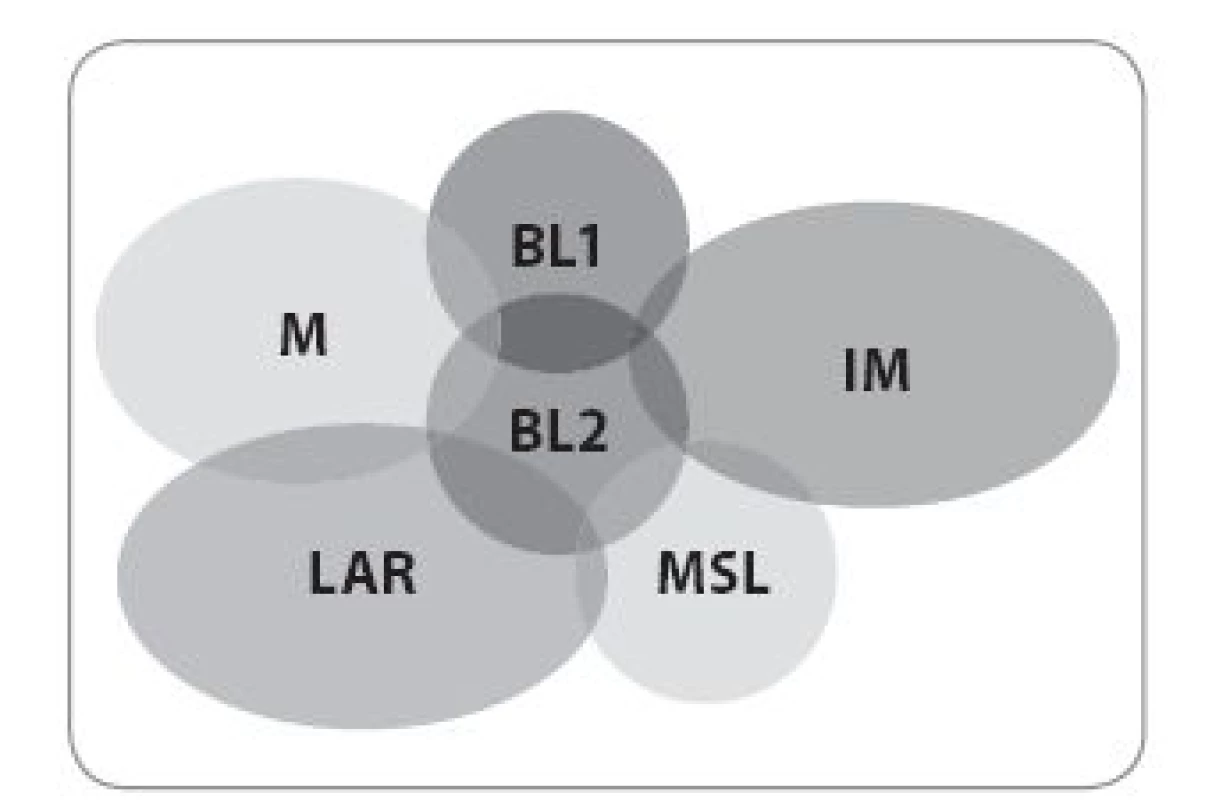
BL1 – basal-like 1, BL2 – basal-like 2, IM – imunomodulační, LAR – luminal AR, M – mezenchymální, MSL – mesenchymal stem-like Upraveno podle [23]. Byrski et al zkoumali skupinu 102 pacientek s mutací BRCA1, které podstoupily neoadjuvantní chemoterapii. Četnost pCR byla úzce spjata se zvoleným režimem: 7 % CMF (cyklofosfamid, metotrexát a fluorouracil), 8 % AT (doxorubicin, paklitaxel), 22 % AC/ FAC (doxorubicin, cykofosfamid/ fluorouracil, doxorubicin, cyklofosfamid) a 83 % u pacientek léčených cisplatinou [48]. Podobných výsledků dosáhl i Gronwald ve studii II. fáze na 25 pacientkách s karcinomem prsu s mutací BRCA1, kterým podával v neoadjuvanci cisplatinu v třítýdenním intervalu s četností pCR 72 % [49]. Zatím poslední zveřejněnou velkou studií byla studie II. fáze Gepar-Sixto, která hodnotila v neoadjuvanci přidání karboplatiny ke standardním režimům s taxany a antracykliny. Účastnilo se jí 595 pacientek s TNBC i HER2 pozitivním karcinomem prsu a benefit z přidání karboplatiny v počtu pCR měly především pacientky s TNBC (58,7 %). Navzdory slibným výsledkům není všeobecné použití platinového derivátu v neoadjuvanci doporučeno. Stále chybí důkazy o dlouhodobém benefitu, zvláště o vlivu na celkové přežití (overall survival – OS).
Adjuvantní chemoterapie
Adjuvantní chemoterapie je standardem v léčbě karcinomu prsu a má svůj nezastupitelný význam i u časných stadií TNBC, a to už při velikosti tumoru > 5 mm. Pacientky, které podstoupily adjuvantní chemoterapii po operaci, měly výrazně lepší OS ve srovnání s pacientkami, které podstoupily jen operaci. Standardním je opět kombinace antracyklinu, taxanu a alkylační látky. Většina dat pochází z retrospektivních analýz klinických studií. Rutinní použití platinových derivátů v adjuvanci není opět standardně doporučeno [50 – 52].
I přesto, že z experimentálních modelů vycházely pochybnosti o účinnosti taxanů na buňky TNBC, až metaanalýza 12 studií s více než 20 000 pacientkami ukázala, že adjuvantní chemoterapie na bázi docetaxelu prodlužuje dobu bez známek onemocnění (disease-free survival – DFS) i OS v porovnání s režimy bez taxanu, a to včetně pacientek s TNBC. Tyto výsledky byly bez závislosti na stavu postižení lymfatických uzlin [53].
Obdobně studie GEICAM 9805 potvrdila, že režim TAC (docetaxel, doxorubicin a cyklofosfamid) je efektivnější jak v OS, tak i DFS než režim FAC (fluorouracil, doxorubicin a cyklofosfamid) v adjuvantním podání u pacientek bez postižení spádových lymfatických uzlin, zvláště u pacientek vysoce rizikových a u TNBC [54]. Obdobných výsledků dosáhl Hudg u TNBC pacientek s postižením lymfatických uzlin [55].
Hayes et al zkoumali sekvenční přidání paklitaxelu ke standardnímu režimu čtyřikrát AC (doxorubicin a cyklofosfamid) a potvrdili, že přidání paklitaxelu vedlo k prodloužení DFS, zvláště u TNBC [56].
Zkoušeny byly v adjuvanci i vysokodávkované či intenzifikované režimy. Zmiňme např. studii Citrona et at, kteří zkoušeli intenzifikované (dose-dense)podání doxorubicinu, docetaxelu a cyklofosfamidu (A-C-T) oproti standardnímu AC-T v dvou - či třítýdenním podání. Nebyl pozorován rozdíl mezi sekvenčním a paralelním podáním v ovlivnění DFS i OS a jen mírně lepší výsledky intenzifikovaných režimů (čtyřletý DFS 82 vs. 75 %) byly vykoupeny velikou toxicitou [57].
Paliativní chemoterapie
Užití platinových derivátů v paliativní chemoterapii zvyšuje odpověď na léčbu u pacientek s TNBC v 1. i 2. linii léčby. O vlivu platinových derivátů na prodloužení PFS a OS jsou zatím nejednotná data, ale obecně se zdá, že jejich použití by mohlo být opodstatněné, zvláště pak u pacientek s BRCA mutací [58].
Novým preparátem v léčbě pacientek s diseminovaným karcinomem prsu je eribulin (Halaven), který ve studii III. fáze Embrace významně prodloužil medián OS zvláště u pacientek s TNBC (12,9 vs. 8,2 měsíce). Eribulin byl podáván oproti léčbě dle volby lékaře u pacientek předléčených taxany a antracykliny ve 3. a další linii léčby [59].
Dosud není přesně znám prediktivní faktor účinku neo - či adjuvantní chemoterapie. Bouchalová et al zkoumali vztah mutace BRCA a proteinu BCL2 ve vztahu k riziku relapsu u TNBC léčeného adjuvantní chemoterapií založenou na antracyklinech. Na souboru 187 pacientek prokázali, že pacientky s vysokou expresí proteinu BCL2 v kombinaci s nemutovaným genem BRCA1 měly nejhorší DFS. Tyto pacientky měly i trend k nejhoršímu OS, zatímco nízká exprese BCL2 a mutace v BRCA1 genu předpovídaly nejlepší přežití bez relapsu u pacientek léčených adjuvantní terapií založenou na antracyklinech. Exprese BCL2 v kombinaci s mutačním stavem BRCA1 genu by tak mohla usnadnit rozhodování o adjuvantní terapii. Některá data také naznačují, že pacientky s basal-like TNBC mají lepší odpověď na neoadjuvantní chemoterapii s docetaxelem a s platinou než s doxorubicinem [60].
Proliferační index Ki-67 byl dalším sledovaným parametrem ve vztahu k predikci účinku chemoterapie a zjistilo se, že pacientky s TNBC s vysokou proliferační aktivitou nádorových buněk dosahují vyššího procenta pCR po neoadjuvantní chemoterapii. Navzdory tomuto zjištění je vysoká proliferační aktivita negativním prognostickým faktorem ve vztahu k DFS i OS [61].
Cílená léčba
Bevacizumab (Avastin®)
TNBC mají výrazně vyšší intratumorózní hladinu VEGF než non-TNBC, a proto byly vkládány naděje do bevacizumabu – anti-VEGF-A protilátky [62]. Otázkou přidání bevacizumabu k neoadjuvantní chemoterapii se zabývali v rozsáhlé studii III. fáze NSABP B-40 Bear et al. Na základě protokolu studie bylo více než 1 200 pacientek rozčleněno do třech ramen dle typu chemoterapie (1. docetaxel → AC, 2. docetaxel/ kapecitabin → AC, 3. docetaxel/ gemcitabin → AC), každé z ramen dále obsahovalo podskupinu s nebo bez bevacizumabu v dávce 15 mg/ kg à 3 týdny, který byl případně podáván po celou dobu neoadjuvantní léčby. Kombinace cytostatik následovaná čtyřmi cykly doxorubicinu s cyklofosfamidem nezvýšila pCR, a naopak výrazně zvýšila toxicitu léčby. Přidání bevacizumabu vedlo ke statisticky signifikantnímu zvýšení počtu pCR v primárním tumoru (z 28,2 na 34,5 %; p = 0,02), ale nikoli v uzlinách (23 vs. 27,6 %; p = 0,08). Efekt přidání bevacizumabu byl statisticky významný jen u pacientek s pozitivní expresí extrogenových a progesteronových receptorů (16,8 vs. 11,1 %; p = 0,03). Pacientky léčené kombinací s bevacizumabem měly vyšší procento nežádoucích účinků léčby, včetně snížení ejekční frakce levé komory [63].
Statisticky významného zvýšení počtu pCR ale dosáhli Sikov et al ve studii II. fáze CALGB 40603 se 443 pacientkami s TNBC II. a III. klinického stadia. Pacientky byly léčené paklitaxelem jedenkrát týdně po dobu 12 týdnů následovaným intenzifikovaným (dose-dense) doxorubicinem s cyklofosfamidem (AC), nebo tímto režimem s přidáním bevacizumabu (10 mg/ kg à 2 týdny, 6×), nebo karboplatinou (AUC 6 à 3 týdny, 4×), nebo přidáním bevacizumabu i karboplatiny. I přes prokázaný efekt bevacizumabu na pCR autoři nepodoručili jeho standardní zařazení do neoadjuvantní léčby pacientek s TNBC, neboť zvyšoval toxicitu léčby a neprodloužil DFS ani OS [64].
Gunter von Minckwitz z německé pracovní skupiny zkoumal ve studii GeparQuinto efektivitu přidání bevacizumabu ke standardní chemoterapii na četnost pCR. U 663 pacientek s TNBC došlo po přidání bevacizumabu v dávce 15 mg/ kg à 3 týdny k signifikantnímu zvýšení pCR: EC-TA (epirubicin, cyklofosfamid – docetaxel, bevacizumab) 39,3 vs. 27,9 % EC-T (epirubicin, cyklofosfamid – docetaxel); p = 0,003. Opět i u této studie bylo přidání bevacizumabu spojeno s vyšší toxicitou a dosud se neodrazilo v zvýšení počtu pCR na OS [65].
Studie III. fáze BEATRICE zkoumala vliv přidání bevacizumabu ke standardní adjuvantní chemoterapii zvolené zkoušejícím u 2 500 žen s TNBC. V subanalýze nebyl prokázán efekt bevacizumabu (v ekvivalentní dávce 5 mg/ kg týdně) na DFS ani OS [66]. Z dalších studií III. fáze zkoumajících efektivitu bevacizumabu u pacientek s diseminovaných TNBC nutno zmínit E2100, AVADO a RIBBON-1 a -2. Navzdory prodloužení PFS a četnosti odpovědí ale nebylo nikdy dosaženo prodloužení OS. Ve studii E2100 vedlo přidání bevacizumabu (v dávce 10 mg/ kg à 2 týdny) k paklitaxelu v týdenním podání u pacientek s TNBC k prodloužení PFS v rameni s bevacizumabem (8,8 vs. 4,6 měsíce), OS však bylo v obou ramenech stejné [67].
Obdobně tomu bylo ve studii AVADO zahrnující 167 pacientek s metastatickým TNBC. Autoři pozorovali pozitivní dopad přidání bevacizumabu v dávce 15 mg/ kg, nikoli 7,5 mg/ kg, k třítýdennímu podávání docetaxelu na prodloužení PFS (HR 0,68 pro bevacizumab), ale nikoli na prodloužení OS. Obdobně ani poslední dvě studie RIBBON-1 a -2 neprokázaly efekt prodloužení OS po přidání bevacizumabu (v ekvivalentní dávce 5 mg/ kg týdně) k chemoterapii založené na kapecitabinu, taxanech nebo antracyklinech v 1. nebo 2. linii paliativní léčby. Také Miles et al v rozsáhlé metaanalýze studií AVADO, E2100 a RIBON-1 neprokázali signifikantní vliv bevacizumabu na OS ve skupině 621 pacientek s TNBC. Potvrdili pouze zlepšení PFS (HR 0,63, medián PFS 8,1 vs. 5,4 měsíce) a vyšší počet pacientek odpovídajících na léčbu v ramenech s bevacizumabem (42 vs. 23 %) [68 – 70].
Sunitinib (Sutent®)
Sunitinib patří do rodiny tyrozinkinázových inhibitorů (TKI) zasahujících zejména do signální dráhy pro destičkový růstový faktor a vaskulární endotelový růstový faktor. Curigliano et al zkoumali využití sunitinibu u pacientek s TNBC předléčených antracykliny a taxany. Zjistili, že monoterapie sunitinibem není efektivnější v porovnání s chemoterapií dle volby zkoušejícího lékaře, medián OS 9,4 vs. 10,5 měsíce pro chemoterapii s mírou odpovědi 3 % pro sunitinib a 7 % pro chemoterapii [71].
mTOR inhibitory
Další skupinou zkoušených cílených léků byly mTOR inhibitory. Na základě výzkumu víme, že u TNBC bývá zvýšená aktivace PI3K/ mTOR a MEK signální dráhy. Randomizovaná studie II. fáze u 50 pacientek s TNBC hodnotila přidání everolimu (Afinitor®) ke standardní neoadjuvantní chemoterapii: čtyřikrát T-FEC vs. RT-FEC. Přidání mTOR statisticky nesignifikantně zvýšilo pCR za cenu vyšší toxicity léčby [72]. Ani druhá studie II. fáze od Singha, zaměřená na pacientky s metastatickým TNBC, neprokázala přesvědčivý benefit přidání everolimu ke karboplatině [73]. Studie s dalšími mTOR a MEK inhibitory právě probíhají.
anti-EGFR terapie
Na základě imunohistochemického vyšetření víme, že TNBC exprimují EGFR receptor v 27 – 57 %. Rozsáhlá studie BALI-1 prospektivně hodnotila přidání cetuximabu k cisplatině v léčbě 1. a 2. linie u 173 pacientek s TNBC. Bylo prokázáno statisticky signifikantní prodloužení PFS v porovnání se samotnou cisplatinou (3,7 vs. 1,5 měsíce), ale v OS nebyl zjištěn rozdíl. Studii je také vyčítán nižší výkonnostní stav u pacientek v kontrolním rameni [74]. Kromě monoklonálních protilátek byl testován i lapatinib, selektivní duální inhibitor tyrozinkináz receptorů EGFR a HER2. Přidání lapatinibu k paklitaxelu v 1. linii u 131 pacientek s metastatickým TNBC nepřineslo žádný léčebný benefit [75]. Z dalších anti-EGFR léků je ve studii I. fáze NCT01650506 zkoumána kombinace erlotinibu (Tarceva®) a metforminu u TNBC, první výsledky lze očekávat nejdříve v roce 2016.
PARP inhibitory
Slibnou skupinou léků v terapii pacientek s TNBC s BRCA mutací jsou PARP inhibitory (poly ADP-ribose polymerase). PARP (1 a 2) a BRCA proteiny představují efektorovou složku dvou na sobě nezávislých systémů oprav zlomů v poškozené DNA. U BRCA nemutovaných karcinomů prsu se na opravách DNA účastní oba systémy, v případě BRCA mutovaných karcinomů prsu pouze PARP. Inhibice PARP 1 a 2 vede k výraznému omezení oprav jednořetězcových zlomů DNA, indukovaných např. chemoterapií, a vzhledem k současné nefunkčnosti BRCA proteinů dochází k dvouřetězcovým zlomům v DNA a k apoptóze buňky. PARP inhibitory prokázaly dobrou účinnost v léčbě karcinomů prsu a ovaria nosiček BRCA mutace. Mezi jejich zástupce patří iniparib, olaparib a veriparib. Ve studii II. fáze u 123 pacientek s metastatickým TNBC vedlo přidání iniparibu do kombinace k chemoterapii CBDCA/ gemzar k signifikantnímu prodloužení PFS i OS s dobrou tolerancí a minimální toxicitou (6,9 vs. 3,3 měsíce PFS; 9,2 vs. 5,7 měsíce OS). Ve studii III. fáze se podařilo potvrdit tyto výsledky jen pro PFS (5,1 vs. 4,1 měsíce), nikoli pro OS (11,8 vs. 11,1 měsíce). Důvodem selhání studie může být heterogenita souboru pacientek s TNBC, ale i to, že iniparib není podle in vitro studií čistým PARP inhibitorem [76]. Olaparib a veliparib dosahují slibných výsledků u BRCA1/ 2 mutovaných TNBC pacientek. Veliparib prokázal účinnost ve studii I. fáze s metronomicky podávaným cyklofosfamidem a nyní je zkoušen ve studiích II. a III. fáze s kombinací cytostatik, včetně neoadjuvance. Olaparib byl zkoušen ve studii II. fáze u předléčených pacientek s karcinomem prsu s prokázanou mutací BRCA, celková odpověď byla 41 % ve skupině pacientek s dávkou 400 mg dvakrát denně a mediánem PFS 5,7. Očekávány jsou výsledky studií III. fáze [77].
Androgenový receptor
Část TNBC exprimuje androgenový receptor (20 – 60 %) [78]. Poslední poznatky naznačují, že by mohl hrát roli v patogenezi a sloužit i jako cílová léčebná struktura. Palácová et al prokázali na souboru 186 pacientek s TNBC, že exprese AR (cut-off 10 %) je asociována s non-basal-like fenotypem TNBC (p = 0,0006) a zároveň je pozitivním prognostickým ukazatelem ve vztahu k OS [79]. Studie II. fáze s ER/ PR negativními a androgen pozitivními pacientkami s metastatickým karcinomem prsu léčených šest měsíců bicalutamidem prokázala klinický benefit (CR, PR a SD déle než šest měsíců u 19 % pacientek) [80]. Na výsledky dalších studií si musíme ale ještě počkat, např. enzalutamid je právě v klinickém hodnocení.
Další léky
Zkoušeny jsou i další léky, např. Skor et al zjistili, že in vitro mifepriston (antagonista glukokortikoidního receptoru) v kombinaci s paklitaxelem a dexamethazonem zvyšuje cytotoxické účinky chemoterapie u TNBC. Ve studiích I. fáze je zkoušen seliciclib – selektivní inhibitor CDK2, CDK7 a CDK9. Hlavní mechanizmus inhibice CKD je defosforylace Rb a zastavení buněčného cyklu v konbodu restrikce G1/ S s následnou apoptózou buňky. Dále to jsou např. PI3K a MEK inhibitory, inhibitory HSP-90 či aurora kináz a další.
Závěr
TNBC představují heterogenní skupinu onemocnění. Obecně se jedná o nádory s agresivním chováním s častějším výskytem u mladších žen. Ačkoli současná cytostatická léčba pacientek s časným stadiem TNBC dává vysokou šanci na vyléčení a významně snižuje riziko rekurence u regionálně pokročilého onemocnění, prognóza pacientek se vzdálenými metastázemi je stále značně nepříznivá. Nejúčinnější režimy jsou založeny na kombinaci antracyklinu, alkylační látky a taxanů. Velkým přínosem v léčbě TNBC se jeví platinové deriváty a eribulin. Platinové deriváty dosahují pozitivních výsledků co do míry indukce patologických kompletních remisí u BRCA mutovaných pacientek při neoadjuvantním podání. Nicméně pro nedostatek dat o jejich vlivu na parametry přežití jsou v současnosti volbou omezenou buď na klinické studie, nebo na léčbu metastatického onemocnění. Brzy však budou k dispozici informace i o jejich vlivu na přežití. To v případě eribulinu již bylo prokázáno při jeho podání ve 3. linii paliativní chemoterapie.
2. Přehled vybraných možností systémové léčby metastatického karcinomu prsu. 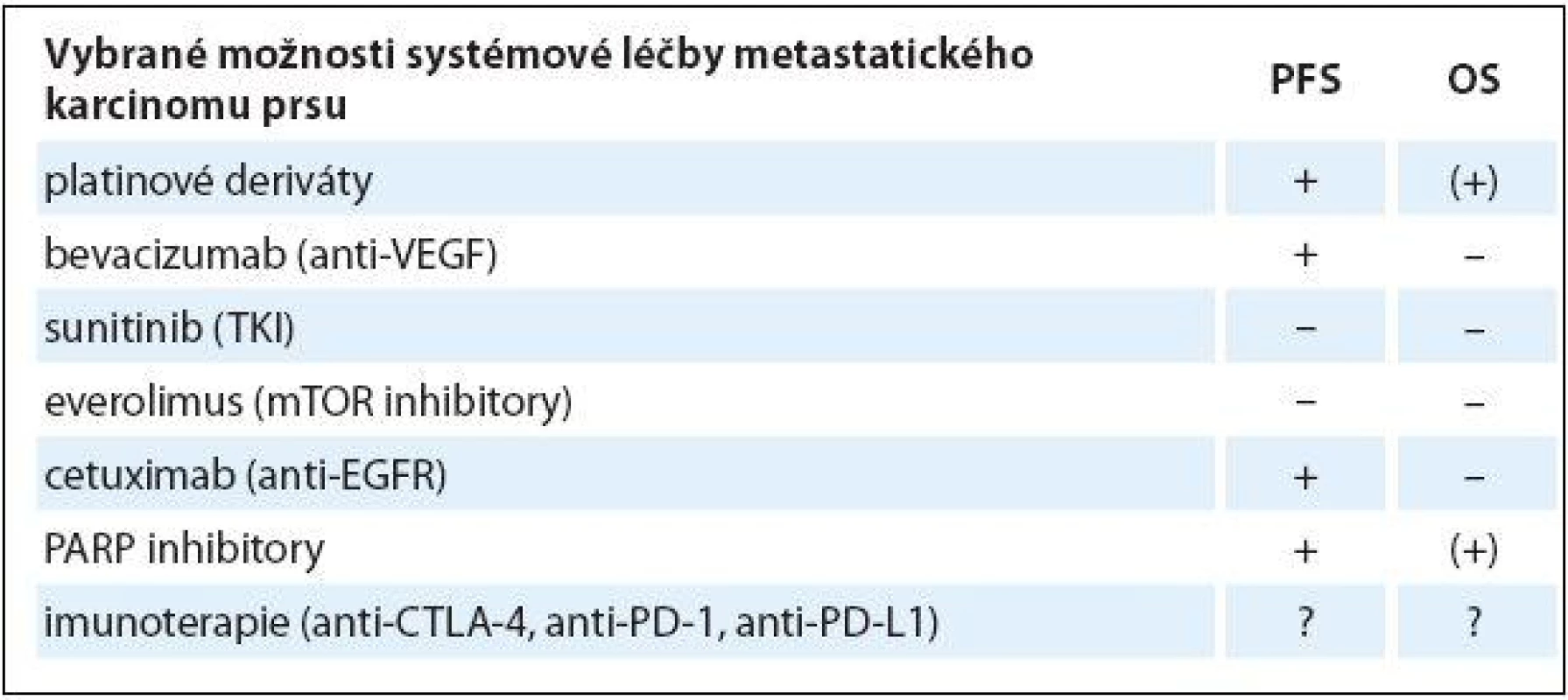
PFS – přežití bez progrese, OS – celkové přežití (+) benefi t lze předpokládat, ale zatím nebyl prokázán a čeká se na výsledky probíhajících studií, + prokázán pozitivní vliv na sledovaný parametr, – bez vlivu na sledovaný parametr, ? dosud Z cílené léčby se zdají být nadějné zejména PARP inhibitory pro pacientky s BRCA mutací, v očekávání jsou další výsledky studií III. fáze. Z ostatních cílených léčiv pouze bevacizumab prokázal výraznější prodloužení doby do další progrese. V testování jsou léčiva na bázi hormonoterapie pro nádory s expresí androgenového receptoru a velká očekávání se vkládají do nových možností imunoterapie, a to zejména do inhibitorů kontrolních bodů imunitních reakcí (immune checkpoints inhibitors). Klíčem k dalšímu posunu v terapii TNBC je nicméně bližší poznání jeho genetické i klinické rozmanitosti a identifikace cílových struktur vhodných pro cílenou léčbu, jakož i biomarkerů predikce její odpovědi.
Tato práce byla podpořena gratem MZ ČR – RVO (MOÚ, 00209805) a č. NT/14599-32013.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Marek Svoboda, Ph.D.
Klinika komplexní onkologické péče a Oddělení epidemiologie a genetiky nádorů
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: msvoboda@mou.cz
Obdrženo: 26. 11. 2015
Přijato: 3. 12. 2015
Sources
1. Úzis.cz [internetová stránka]. Ústav zdravotnických informací a statistiky ČR. Národní onkologický registr. UZIS ČR 2010 – 2014 [citováno 1. září 2015]. Dostupné z: www.uzis.cz/ registry-nzis/ nor.
2. Svoboda M, Navrátil J, Fabián P. Triple-negativní karcinom prsu: analýza souboru pacientek diagnostikovaných a/ nebo léčených v Masarykově onkologickém ústavu v letech 2004 až 2009. Klin Onkol 2012; 25(3): 188 – 198. doi: 10.14735/ amko2012188.
3. Dietze EC, Sistrunk C, Carboni MG et al. Triple-negative breast cancer in African-American women: disparities versus biology. Nat Rev Cancer 2015; 15(4): 248 – 254. doi: 10.1038/ nrc3896.
4. Kurian AW, Fish K, Shema SJ et al. Lifetime risks of specific breast cancer subtypes among women in four racial/ ethnic groups. Breast Cancer Res 2010; 12(6): R99. doi: 10.1186/ bcr2780.
5. Giordano SH. A review of the diagnosis and management of male breast cancer. Oncologist 2005; 10(7): 471 – 479.
6. Giordano SH, Cohen DS, Buzdar AU et al. Breast carcinoma in men: a population-based study. Cancer 2004; 101(1): 51 – 57.
7. Boyle P. Triple-negative breast cancer: epidemiological considerations and recommendations. Ann Oncol 2005; 16 (Suppl 6): vi7 – vi12.
8. Amirikia KC, Mills P, Bush J et al. Higher population-based incidence rates of triple-negative breast cancer among young African-American women: implications for breast cancer screening recommendations. Cancer 2011; 117(12): 2747 – 2753. doi: 10.1002/ cncr.25862.
9. Pijpe A, Andrieu N, Easton DF et al. Exposure to diagnostic radiation and risk of breast cancer among carriers of BRCA1/ 2 mutations: retrospective cohort study (GENE-RAD-RISK). BMJ 2012; 345: e5660. doi: 10.1136/ bmj.e5660.
10. Shinde SS, Forman MR, Kuerer HM et al. Higher parity and shorter breastfeeding duration: association with triple-negative phenotype of breast cancer. Cancer 2010; 16(21): 4933 – 4943. doi: 10.1002/ cncr.25443.
11. Collaborative Group on Hormonal Factors in Breast Cancer. Breast cancer and hormonal contraceptives: collaborative reanalysis of individual data on 53,297 women with breast cancer and 100,239 women without breast cancer from 54 epidemiological studies. Lancet 1996, 347(9017): 1713 – 1727.
12. Jernström H, Lerman C, Ghadirian P et al. Pregnancy and risk of early breast cancer in carriers of BRCA1 and BRCA2. Lancet 1999; 354(9193): 1846 – 1850.
13. Who.int [homepage on the Internet]. World Health Organization. Classification of Tumours of the Breast; 2012 [cited 2014 Oct 10]. Available from: http:/ / www.who.int/ .
14. Goldhirsch A, Winer EP, Coates AS et al. Personalizing the treatment of women with early breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013. Ann Oncol 2013; 24(9): 2206 – 2223. doi: 10.1093/ annonc/ mdt303.
15. Badve S, Dabbs DJ, Schnitt SJ et al. Basal-like and triple-negative breast cancers: a critical review with an emphasis on the implications for pathologists and oncologists. Mod Pathol 2011; 24(2): 157 – 167. doi: 10.1038/ modpathol.2010.200.
16. Nielsen TO, Hsu FD, Jensen K et al. Immunohistochemical and clinical characterization of the basal-like subtype of invasive breast carcinoma. Clin Cancer Res 2004; 10(16): 5367 – 5674.
17. Cheang M, Voduc D, Bajdik C et al. Basal-like breast cancer defined by five biomarkers has superior prognostic value than triple-negative phenotype. Clin Cancer Res 2008; 14(5): 1368 – 1376. doi: 10.1158/ 1078-0432.CCR-07-1658.
18. Elsheikh SE, Green AR, Rakha EA et al. Caveolin 1 and Caveolin 2 are associated with breast cancer basal-like and triple-negative immunophenotype. Br J Cancer 2008; 99(2): 327 – 334. doi: 10.1038/ sj.bjc.6604463.
19. Gautam KM, Xiangshan Z, Hamid B et al. Histological, molecular and functional subtypes of breast cancers. Cancer Biol Ther 2010; 10(10): 955 – 960.
20. Prat A, Parker JS, Karginova O et al. Phenotypic and molecular characterization of the claudin-low intrinsic subtype of breast cancer. Breast Cancer Res 2010; 12(5): R68. doi: 10.1186/ bcr2635.
21. Perou C. Molecular stratification of triple-negative breast cancers. Oncologist 2010; 15 (Suppl 5): 39 – 48. doi: 10.1634/ theoncologist.2010-S5-39.
22. Gelmon K, Dent R, Mackey JR et al. Targeting triple-negative breast cancer: optimising therapeutic outcomes. Ann Oncol 2012; 23(9): 2223 – 2234. doi: 10.1093/ annonc/ mds067.
23. Lehmann BD, Bauer JA, Chen X et al. Identification of human triple-negative breast cancer subtypes and preclinical models for selection of targeted therapies. J Clin Invest 2011; 121(7): 2750 – 2767. doi: 10.1172/ JCI45014.
24. Mackay A, Weigelt B, Grigoriadis A et al. Microarray-based class discovery for molecular classification of breast cancer: analysis of interobserver agreement. J Natl Cancer Inst 2011; 103(8): 662 – 673. doi: 10.1093/ jnci/ djr071.
25. Pistelli M, Caramanti M, Biscotti T et al. Androgen receptor expression in early triple-negative breast cancer: clinical significance and prognostic associations. Cancers (Basel) 2014; 6(3): 1351–1362. doi: 10.3390/cancers6031351.
26. Prat A, Perou C. Mammary development meets cancer genomics. Nat Med 2009; 15(8): 842 – 844. doi: 10.1038/ nm0809-842.
27. Mayer I, Abramson V, Lehmann B et al. New strategies for triple negative breast cancer-deciphering the heterogenity. Clin Cancer Res 2014; 20(4): 782 – 790. doi: 10.1158/ 1078-0432.CCR-13-0583.
28. Robertson L, Hanson H, Seal S et al. BRCA1 testing should be offered to individuals with triple-negative breast cancer diagnosed below 50 years. Br J Cancer 2012; 106(6): 1234–1238. doi: 10.1038/bjc.2012.31.
29. Weigelt B, Geyer FC, Reis-Filho JS. Histological types of breast cancer: how special are they? Mol Oncol 2010; 4(3): 192–208. doi: 10.1016/j.molonc.2010.04.004.
30. Navrátil J, Svoboda M, Navrátilová M et al. Výskyt zárodečných mutací BRCA1 a BRCA2 genu v konsekutivní kohortě pacientek s triple-negativním karcinomem prsu léčených v MOÚ. In: Sborník abstrakt. XXXVIII. brněnských onkologických dnů a XXVIII. konference pro nelékařské zdravotnické pracovníky. Brno, 24. – 25. dubna, 2014, s. 51.
31. Plevová P, Novotný J, Petráková K et al. Syndrom hereditárního karcinomu prsu a ovarií. Klin Onkol 2009; 22 (Suppl): S8 – S11. doi: 10.14735/ amko2009S8.
32. Linkos.cz [internetová stránka]. Foretová L, Macháčková E. Zásady testovani BRCA1/ 2 genů. [citováno 15. září 2014]. Dostupné z: http:/ / www.linkos.cz/ cinnost-skupiny-1/ zasady-testovani-BRCA1-2-genu/ .
33. Bartoňková H, Foretová L, Helmichová E et al. Doporučené zásady péče o nemocné s nádory prsu a vaječníků a zdravé osoby se zárodečnými mutacemi genů BRCA1 nebo BRCA2. Klin Onkol 2003; 16(1): 28 – 34.
34. Welcsh PL, Owens KN, King MC. Insights into the functions of BRCA1 and BRCA2. Trends Genet 2000; 16(2): 69 – 74.
35. Bertucci F, Finetti P, Birnbaum D. Basal breast cancer: a complex and deadly moleculas subtype. Curr Mol Med 2012; 12(1): 96 – 110.
36. Atchley DP, Albarracin CT, Lopez A et al. Clinical and pathologic characteristics of patients with BRCA-positive and BRCA-negative breast cancer. J Clin Oncol 2008; 26(26): 4282 – 4288. doi: 10.1200/ JCO.2008.16.6231.
37. Lakhani SR, Reis-Filho JS, Fulford L et al. Prediction of BRCA1 status in patients with breast cancer using estrogen receptor and basal phenotype. Clin Cancer Res 2005; 11(14): 5175 – 5180.
38. Lee LJ, Alexander B, Schnitt SJ et al. Clinical outcome of triple negative breast cancer in BRCA1 mutation carriers and noncarriers. Cancer 201; 117(14): 3093 – 3100. doi: 10.1002/ cncr.25911.
39. Rocca A, Viale G, Gelber RD et al. Pathologic complete remission rate after cisplatin-based primary chemotherapy in breast cancer: correlation with p63 expression. Cancer Chemother Pharmacol 2008; 61(6): 965 – 971.
40. Minami CA, Chung DU, Chang HR. Management options in triple-negative breast cancer. Breast Cancer (Auckl) 2011; 5 : 175 – 199. doi: 10.4137/ BCBCR.S6562.
41. Dent R, Trudeau M, Pritchard KI et al. Triple-negative breast cancer: clinical features and patterns of recurrence. Clin Cancer Res 2007; 13(1): 4429 – 4434.
42. von Minckwitz G, Untch M, Nüesch E, et al. Impact of treatment characteristics on response of different breast cancer phenotypes: pooled analysis of the German neo-adjuvant chemotherapy trials. Breast Cancer Res Treat 2011; 125(1): 145 – 156. doi: 10.1007/ s10549-010-1228-x.
43. Liedtke C, Mazouni C, Hess KR et al. Response to neoadjuvant therapy and long-term survival in patients with triple-negative breast cancer. J Clin Oncol 2008; 26(8): 1275 – 1281. doi: 10.1200/ JCO.2007.14.4147.
44. Mehta RS. Dose-dense and/ or metronomic schedules of specific chemotherapies consolidate the chemosensitivity of triple-negative breast cancer: a step toward reversing triple-negative paradox. J Clin Oncol 2008; 26(19): 3286 – 3288. doi: 10.1200/ JCO.2008.17.1116.
45. Foulkes W, Smith I, Reis-Filho S. Triple-negative breastcancer. N Engl J Med 2010; 363(20): 1938 – 1948. doi: 10.1056/ NEJMra1001389.
46. Silver D, Richardson A, Eklund A et al. Efficacy of neoadjuvant cisplatin in triple-negative breast cancer. J Clin Oncol 2010; 28(7): 1145 – 1153. doi: 10.1200/ JCO.2009.22.4725.
47. Leong CO, Vidnovic N, DeYoung MP et al. The p63/ p73 network mediates chemosensitivity to cisplatin in a biologically defined subset of primary breast cancers. J Clin Incest 2007; 117(5): 1370 – 1380.
48. Byrski T, Gronwald J, Huzarski T. Pathologic complete response rates in young women with BRCA1-positive breast cancers after neoadjuvant chemotherapy. J Clin Oncol 2010; 28(3): 375 – 379. doi: 10.1200/ JCO.2008.20.7019.
49. Gronwald J, Byrski T, Huzarski T et al. Neoadjuvant therapy with cisplatin in BRCA1-positive breast cancer patients. J Clin Oncol (Meeting Abstracts) 2009; 27 (Suppl 15): abstr. 502.
50. Joensuu H, Gligorov J. Adjuvant treatments for triple-negative breast cancers. Ann Oncol 2012; 23 (Suppl 6): vi40 – vi44.
51. Kaplan HG, Malmgren JA, Atwood M. T1N0 triple negative breast cancer: risk of recurrence and adjuvant chemotherapy. Breast J 2009; 15(5): doi: 10.1111/ j.15244741.2009.00789.x.
52. Wang J, Shi M, Ling R et al. Adjuvant chemotherapy and radiotherapy in triple-negative breast carcinoma: a prospective randomized controlled multi-center trial. Radiother Oncol 2001; 100(2): 200 – 204. doi: 10.1016/ j.radonc.2011.07.007.
53. Laporte S, Jones S, Chapelle C et al. Consistency of effect of docetaxel-containing adjuvant chemotherapy in patients with early stage breast cancer independent of nodal status: meta-analysis of 12 randomized clinical trials. Cancer Res 2009; 69 (Suppl 1): abstr. 605.
54. Martin M, Segui MA, Anton A et al. Adjuvant docetaxel for high-risk, node-negative breast cancer. N Engl J Med 2010; 363(23): 2200 – 2210. doi: 10.1056/ NEJMoa0910320.
55. Hugh J, Hanson J, Cheang MC et al. Breast cancer subtypes and response to docetaxel in node-positive breast cancer: use of an immunohistochemical definition in the BCIRG 001 trial. J Clin Oncol 2009; 27(8): 1168 – 1176. doi: 10.1200/ JCO.2008.18.1024.
56. Hayes DF, Thor AD, Dressler LG et al. HER2 and response to paclitaxel in node-positive breast cancer. N Engl J Med 2007; 357(15): 1496 – 1506.
57. Citron ML, Berry DA, Cirrincione C et al: Randomized trial of dose-dense versus conventionally scheduled and sequential versus concurrent combination chemotherapy as postoperative adjuvant treatment of node-positive primary breast cancer: first report of Intergroup Trial C9741/ Cancer and Leukemia Group B Trial 9741. J Clin Oncol 2003; 21(8): 1431 – 1439.
58. Staudacher L, Cottu PH, Dieras V et al. Platinum-based chemotherapy in metastatic triple-negative breast cancer: the Institut Curie experience. Ann Oncol 2011; 22(4): 848 – 856. doi: 10.1093/ annonc/ mdq461.
59. Cortes J, O‘Shaughnessy J, Loesch D et al. Eribulin monotherapy versus treatment of physician‘s choice in patients with metastatic breast cancer (EMBRACE): a phase 3open-label randomized study. Lancet 2011; 377(9769): 914 – 923. doi: 10.1016/ S0140-6736(11)60070-6.
60. Bouchalova K, Svoboda M, Kharaishvili G et al. BRCA-mutation status combined with BCL2 protein in prediction of relapse in triple-negative breast cancer (TNBC) treated with adjuvant anthracycline-based chemotherapy. J Clin Oncol 2014; 32 (Suppl 5): abstr. 1132.
61. Mrklic I, Capkun V, Pogorelic Z et al. Prognostic value of Ki-67 proliferating index in triple negative breast carcinomas. Pathol Res Pract 2013; 209(5): 296 – 301. doi: 10.1016/ j.prp.2013.02.012.
62. Linderholm BK, Hellborg H, Johansson U et al. Significantly higher levels of vascular endothelial growth factor (VEGF) and shorter survival times for patients with primary operable triple-negative breast cancer. Ann Oncol 2009; 20(10): 1639 – 1646. doi: 10.1093/ annonc/ mdp062.
63. Bear HD, Tang G, Rastogi P et al. Bevacizumab added to neoadjuvant chemotherapy for breast cancer. N Engl J Med 2012; 366(4): 310 – 320. doi: 10.1056/ NEJMoa1111097.
64. Sikov WM, Berry DA, Perou CM et al. Impact of the addition of carboplatin and/ or bevacizumab to neoadjuvant once-per-week paclitaxel followed by dose-dense doxorubicin and cyclophosphamide on pathologic complete response rates in stage II to III triple-negative breast cancer: CALGB 40603 (Alliance). J Clin Oncol 2015; 33(1): 13 – 21. doi: 10.1200/ JCO.2014.57.0572.
65. von Minckwitz G, Eidtmann H, Rezai M et al. Neoadjuvant chemotherapy and bevacizumab for HER2-negative breast cancer. N Engl J Med 2012; 366(4): 299 – 309. doi: 10.1056/ NEJMoa1111065.
66. Cameron D, Brown J, Dent R. Adjuvant bevacizumab-containing therapy in triple-negative breast cancer (BEATRICE): primary results of a randomised, phase 3 trial. Lancet Oncol 2013; 14(10): 933 – 942. doi: 10.1016/ S1470-2045(13)70335-8.
67. Miller K, Wang M, Gralow J et al. Paclitaxel plus bevacizumab versus paclitaxel alone for metastatic breast cancer. N Engl J Med 2007; 357(26): 2666 – 2676.
68. Miles DW, Chan A, Dirix LY et al. Phase III study of bevacizumab plus docetaxel compared with placebo plus docetaxel for the first-line treatment of human epidermal growth factor receptor 2-negative metastatic breast cancer. J Clin Oncol 2010; 28(20): 3239 – 3247. doi: 10.1200/ JCO.2008.21.6457.
69. Miles D, Diéras V, Cortés J et al. First-line bevacizumab in combination with chemotherapy for HER2-negative metastatic breast cancer: pooled and subgroup analyses of data from 2,447 patients. Ann Oncol 2013; 24(11): 2773 – 2780. doi: 10.1093/ annonc/ mdt276.
70. O‘Shaughnessy J, Brufsky AM. RiBBON 1 and RiBBON 2: phase III trials of bevacizumab with standard chemotherapy for metastatic breast cancer. Clin Breast Cancer 2008, 8(4): 370 – 373. doi: 10.3816/ CBC.2008.n.045.
71. Curigliano G, Pivot X, Cortés J et al. Randomized phase IIstudy of sunitinib versus standard of care for patients with previously treated advanced triple-negative breast cancer. Breast 2013; 22(5): 650 – 656. doi: 10.1016/ j.breast.2013.07.037.
72. Gonzalez-Angulo AM, Akcakanat A, Liu S et al. Open-label randomized clinical trial of standard neoadjuvant chemotherapy with paclitaxel followed by FEC versus the combination of paclitaxel and everolimus followed by FEC in women with triple receptor-negative breast cancer. Ann Oncol 2014; 25(6): 1122 – 1127. doi: 10.1093/ annonc/ mdu124.
73. Singh J, Novik Y, Stein S et al. Phase 2 trial of everolimus and carboplatin combination in patients with triple negative metastatic breast cancer. Breast Cancer Res 2014, 16(2): R32. doi: 10.1186/ bcr3634.
74. Baselga J, Stemmer S, Pego A et al. Cetuximab + cisplatin in estrogen receptor-negative, progesterone receptor-negative, HER2-negative (triple-negative) metastatic breast cancer: results of the randomized phase II BALI-1 trial. Cancer Res 2010; 70: abstr. PD01-01.
75. Finn RS, Press MF, Dering J et al. Estrogen receptor, progesterone receptor, human epidermal growth factor receptor 2 (HER2), and epidermal growth factor receptor expression and benefit from lapatinib in a randomized trial of paclitaxel with lapatinib or placebo as first-line treatment in HER2-negative or unknown metastatic breast cancer. J Clin Oncol 2009; 27(24): 3908 – 3915. doi: 10.1200/ JCO.2008.18.1925.
76. O‘Shaughnessy J, Schwartzberg LS, Danso MA et al. A randomized phase III study of iniparib (BSI-201) in combination with gemcitabine/ carboplatin (G/ C) in metastatic triple-negative breast cancer (TNBC). J Clin Oncol 2011; 29 (Suppl): abstr. 1007.
77. Tutt A, Robson M, Garber JE et al. Phase II trial of the oral PARP inhibitor olaparib in BRCA-deficient advanced breast cancer. J Clin Oncol 2009; 27 (Suppl 18): CRA501.
78. McGhan LJ, McCullough AE, Protheroe CA et al. Androgen receptor-positive triple negative breast cancer: a unique breast cancer subtype. Ann Surg Oncol 2014; 21(2): 361 – 367. doi: 10.1245/ s10434-013-3260-7.
79. Palácová M, Navrátil J, Fabian P et al. Exprese androgenového receptoru (AR) a estrogenového receptoru beta (ER-beta) u triple negativního karcinomu prsu a jejich klinický význam. In: Sborník abstrakt. XXXVIII. brněnských onkologických dnů a XXVIII. konference pro nelékařské zdravotnické pracovníky. Brno, 24. – 25. dubna, 2014, s. 136.
80. Gucalp A, Tolaney S, Isakoff SJ et al. Phase II trial of bicalutamide in patients with androgen receptor-positive, estrogen receptor-negative metastatic Breast Cancer. Clin Cancer Res 2013; 19(19): 5505 – 5512. doi: 10.1158/ 1078-0432.CCR-12-3327.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2015 Issue 6-
All articles in this issue
- Triple Negative Breast Cancer
- Immunotherapy for the Prevention and Treatment of Breast Cancer
- Psychological Aspects of Intravenous Treatment in Oncology and Permanent Venous Access Devices Tolerance
- A Case of Delayed Diagnosis of Acral Lentiginous Melanoma
- Possible Pitfalls of Ipilimumab Therapy in Malignant Melanoma – a Case Report
- Thiazolidinediones Regulate the Level of ABC Transporters Expression on Lung Cancer Cells
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- A Case of Delayed Diagnosis of Acral Lentiginous Melanoma
- Triple Negative Breast Cancer
- Immunotherapy for the Prevention and Treatment of Breast Cancer
- Psychological Aspects of Intravenous Treatment in Oncology and Permanent Venous Access Devices Tolerance
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

