-
Medical journals
- Career
Feochromocytom a srdce
Authors: T. Zelinka
Authors‘ workplace: Centrum pro diagnostiku a léčbu hypertenze, III. interní klinika – klinika endokrinologie a metabolismu 1. LF UK a VFN v Praze
Published in: Kardiol Rev Int Med 2018, 20(3): 181-184
Overview
Sekrece katecholaminů je doprovázena u feochromocytomu různými klinickými projevy a příznaky, jako jsou hypertenze, bolest hlavy, palpitace a pocení. V některých případech může být klinický průběh feochromocytomu narušen akutními kardiovaskulárními komplikacemi, jako jsou srdeční selhání nebo kardiogenní šok, tako-tsubo kardiomypatie, ischemie myokardu a arytmie – tachykardie (supraventrikulární nebo komorové) a méně často bradykardie (AV blok či junkční). Protože jsou mnohé z těchto komplikací život ohrožující, nejdůležitější částí diagnózy je uvědomění si feochromocytomu jako příčiny těchto klinických situací.
Klíčová slova:
feochromocytom – paragangliom – hypertenze – kardiomyopatie – arytmie
Feochromocytom je nádor vycházející z dřeně nadledvin, který velmi často produkuje katecholaminy, které jsou zodpovědné za většinu jeho klinických příznaků. Katecholaminy mohou také produkovat nádory vycházející z chromafinní tkáně sympatického nebo vzácně i parasympatického nervového systému. Tyto nádory označujeme jako paragangliomy (PPGL) – buď jako sympatické vycházející z malé pánve, retroperitonea či hrudníku (i srdce), nebo parasympatické, které se nachází v oblasti hlavy a krku. Někdy se můžeme setkat také s označením funkční nebo afunkční. Parasympatické paragangliomy bývají většinou afunkční. Feochromocytomy a PPGL jsou velmi zvláštní nádory i pro své biologické chování – mohou nejen recidivovat, ale také se vyskytovat v maligní formě, a to jak při první prezentaci, tak i v dalším sledování. Oproti jiným malignitám je v tomto případě jejím jediným kritériem nález vzdálených metastáz (lymfatické uzliny, kosti, plíce, játra) [1]. Naopak na základě samotného histologického popisu nemůžeme nádor označit za maligní. PPGL, pokud není maligní, bychom měli považovat vždy za nádor nejisté biologické povahy. PPGL jsou zajímavé také tím, že byly zjištěny mutace více než 20 genů, které souvisí s jejich výskytem. Dají se rozdělit do dvou základních skupin – pseudohypoxické a kinázové (a další nové, klinicky zcela nevýznamné s narušenou Wnt signalizací) [2]. Souvislost hypoxie a PPGL se pak ukazuje na častějším výskytu těchto nádorů u pacientů s cyanotickou vrozenou srdeční vadou [3].
Sekrece katecholaminů bývá (ale často nemusí být) doprovázena typickými záchvatovitými příznaky, jako jsou palpitace, bolesti hlavy a pocení, případně i zblednutí. Typický PPGL záchvat trvá většinou velmi krátce, třeba jen 1– 3 min, a většinou není možné identifikovat jeho vyvolavatele. To je většinou nejnápadnější rozdíl mezi panickými atakami, které bývají nejčastějším důvodem odeslání pacienta k vyšetření pro podezření na PPGL (naopak pacienti s PPGL bývají často odesíláni k psychiatrovi). Pokud bychom změřili pacientovi při záchvatu krevní tlak (TK), bude většinou výrazně zvýšený. Arteriální hypertenze je pak nejčastějším projevem PPGL, ne však ve všech případech. Méně se můžeme setkávat i s poruchami glukozového metabolizmu. V některých případech mohou být pacienti s PPGL a poruchou glukozového metabolizmu velmi nápadní – typicky se jedná o mladé hubené pacienty se záchvatovitými příznaky vč. hypertenze. Příznaků a projevů PPGL může být mnohem více, a tedy klinický průběh může být velmi variabilní. Výskyt klinických projevů nezávisí na stupni sekrece katecholaminů (či metanefrinů, methylovaných metabolitů katecholaminů, které jsou nyní považovány za základní nástroj pro diagnostiku PPGL). Z tohoto důvodu může jako první stanovit diagnózu PPGL i patolog – prevalence PPGL bývá udávána v autopsiích kolem 0,05 % [4]. S rozvojem vyšetřovacích metod pak velmi často (nelze vyloučit, že u většiny pacientů) první vysloví podezření na PPGL lékař hodnotící zobrazovací metodu, nejčastěji CT (MR) a sonografii břicha, nebo dokonce i kardiolog provádějící vyšetření ze subkostální projekce. Na paragangliomy se často nemyslí, a proto mohou být diagnostikovány až peroperačně na základě významných fluktuací TK. Tumory nadledvin, které na CT či MR neodpovídají adenomu, by měly být vždy vyšetřeny endokrinologem s cílem vyloučit či potvrdit feochromocytom s ohledem na rizika spojená s opominutím jeho diagnózy.
Diagnóza PPGL je důležitá ze dvou důvodů. Jak už bylo zmíněno výše, jedná se o nádor s nejistým biologickým chováním. Druhým důvodem je pak vlastní působení katecholaminů na organizmus vč. srdce a kardiovaskulární systém. A právě těmto projevům je věnován tento přehled. Nesmíme ale zapomenout, že i jiné klinické projevy mohou být velmi závažné. Jako příklad mohou sloužit pacienti s metastatickým PPGL, u nichž bývá častou příčinou úmrtí paralytický ileus (zácpa je totiž častým příznakem PPGL).
Působení PPGL na organizmus je zprostředkováno působením vylučovaných katecholaminů – adrenalinu, noradrenalinu a dopaminu. PPGL může produkovat jako neuroendokrinní nádor i jiné působky, které pak mohou změnit klinický obraz pacienta – např. adrenokortikotropní hormon s obrazem Cushingova syndromu nebo interleukin 6 s obrazem septického stavu. Klinický obraz PPGL může být dále modifikován rozdílnou sekrecí vlastních katecholaminů a jejich působením na adrenergní receptory – adrenalin výrazněji stimuluje β2 a α adrenergní receptory a naopak noradrenalin působí více na β1 receptory. V srdci se pak nachází jen β1 a β2 receptory. Právě přítomnost β2 receptorů v srdečním hrotu může být spojena s negativním inotropním efektem, který může vyústit až v obraz tzv. tako-tsubo kardiomyopatie [5]. V cévách se nachází α1 a případně i α2 receptory (v kůži vedou k vazokonstrikci), v kosterní svalovině, viscerální oblasti nebo v koronárních cévách jsou přítomny i β2 receptory, jejichž stimulace je spojena s vazodilatací. To je také vysvětlení skutečnosti, že podání betablokátorů bez současného zablokování α adrenergních receptorů může být spojeno s vyvoláním hypertenzní krize. Působení chronického nadbytku katecholaminů u PPGL je na druhé straně modifikováno desenzitizací adrenergních receptorů. Ta je velmi názorná při operaci – velmi často se můžeme setkat u pacientů, u nichž je odstraněn PPGL, že jim musí být až 48 hod po operaci podávány vazopresorické aminy pro protrahovanou hypotenzi, což je také jedním z důvodů, proč musí být pacienti s PPGL hemodynamicky monitorováni. Dlouhodobé působení katecholaminů může mít na srdce trvalé následky. Nedávno byla publikována studie ukazující, že pacienti s PPGL mají ve srovnání s kontrolními pacienty na MR srdce nejen sníženou systolickou funkci se snížením systolického i diastolického strainu, ale také přítomny okrsky myokarditis nebo fibrózy. Přestože se systolická funkce levé komory upravila po operaci, některé změny přetrvaly – okrsky fibrózy nebo snížený diastolický strain [6].
Arteriální hypertenze
Nejtypičtějším kardiovaskulárním projevem PPGL je arteriální hypertenze. Ve srovnání s primárním hyperaldosteronizmem jako nejčastějším představitelem léčitelné formy sekundární hypertenze se u PPGL můžeme setkat se všemi možnostmi tíže arteriální hypertenze. Nejméně v 10 % případů pak nemají pacienti s PPGL zvýšený TK. Průběh PPGL může být modifikován i vzestupy TK během záchvatů (zvýšení TK může dosahovat i extrémních hodnot – až 300 mm Hg systolického TK), a tedy hypertenze může být setrvalá nebo záchvatovitá nebo dokonce kombinace obou typů (obr. 1). S vysloveně těžkou arteriální hypertenzí se u pacientů s PPGL nesetkáváme příliš často.
Image 1. Typický 24hod záznam pacientky s feochromocytomem. 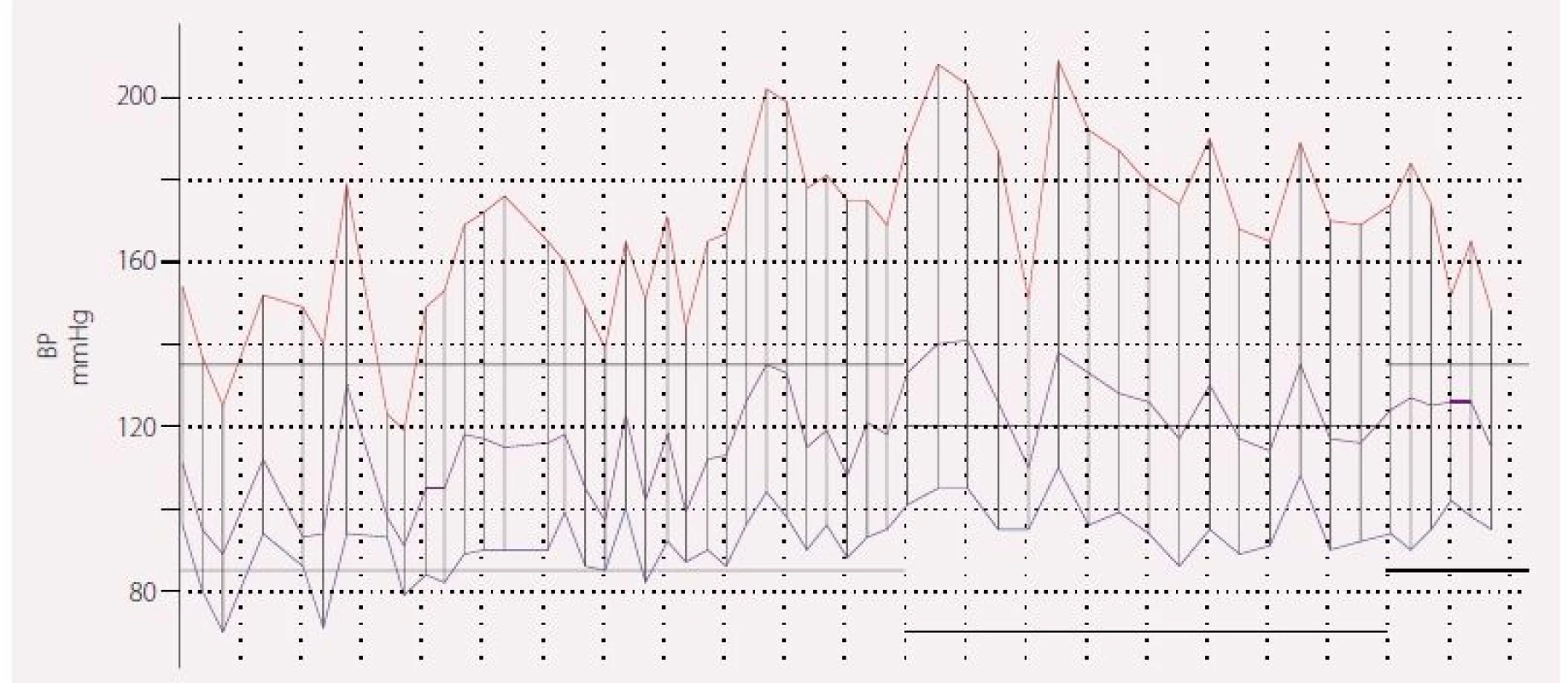
Křivka ukazuje výraznou variabilitu hodnot TK včetně rychlých vzestupů a poklesů TK, stejně tak i výrazný vzestup TK ve spánku ve srovnání s TK v aktivní části dne. Klinicky byly při měření TK vleže meřeny výrazně zvýšené hodnoty TK, naopak pacientka trpěla na velmi rychlou ztrátu vědomí při rychlých poklesech TK. Průměrný TK byl 169/93 mm Hg a SF 90/min. Záznam začíná v 10.00 hod a končí v 8.00 hod následující den, horizontální linky ukazují na mezní hodnoty pro TK ve dne a v noci.
TK – krevní tlak; SF – srdeční frekvencePPGL je však jedinečný v tom, že se může arteriální hypertenze kombinovat s náhlými poklesy TK, a to až v podobě ortostatických synkop (obr. 1). V těchto případech je jedinou záchranou pro pacienta operace, neboť medikamentózně je tento stav neřešitelný a pacienti prakticky nemohou být mimo nemocniční prostředí. Ortostatická hypotenze se může vyskytovat cca v 10– 50 % případů, jejím pravděpodobným vysvětlením může být hypovolemie, která se u pacientů s PPGL vyskytuje, a také i desenzitizace α adrenergních receptorů.
Kombinace náhlých vzestupů i poklesů TK je zodpovědná za vyšší variabilitu TK při 24hod monitorování TK, kde se můžeme také často setkat se vzestupem TK v noci (obr. 1) [7,8].
Arteriální hypertenzi stejně jako všechny pacienty s PPGL bychom měli léčit α blokátory, v případě ČR pak selektivním α1 blokátorem doxazosinem. Teprve po nastoupení účinné α blokády bychom měli přidat v případě doprovodné tachykardie β blokátor. Dávku α blokátoru bychom měli titrovat do maximální tolerovatelné dávky (můžeme přesáhnout i maximální dávku uvedenou v SPC) – limitující bývá především ortostatická hypotenze.
Ischemie myokardu
Bolest na hrudi patří také mezi časté záchvatovité příznaky PPGL. Po zavedení troponinů do klinické praxe se ukazuje, že u pacientů s PPGL dochází k ischemizaci myokardu velmi často. Často jsou tito pacienti odesíláni ke koronarografickému vyšetření, kde se zjistí maximálně neobturující koronární ateroskleróza. V některých případech můžeme i na EKG nalézt změny typické pro ischemii myokardu, které vymizí bezprostředně po operaci. Nadbytek katecholaminů vede ke zvýšené spotřebě kyslíku myokardu, vazokonstrikci nebo i k vazospazmům. Ischemická kardiomyopatie byla nejspíše příčinou úmrtí bývalého prezidenta USA D. D. Eisenhowera, u něhož byl při autopsii zjištěn 1,5cm feochromocytom [9].
Hypertrofie myokardu
U pacientů s PPGL se můžeme setkat v některých případech s hypertrofií stěn levé komory pravděpodobně kvůli působení chronického nadbytku katecholaminů. Může se na ní podílet i samotná nepoznaná arteriální hypertenze s vysokou variabilitou TK. V každém případě hypertrofie levé komory po operaci regreduje [10]. V extrémních případech se můžeme setkat až s obrazem „hypertrofické kardiomyopatie“, jejíž obraz se plně normalizuje po provedené operaci [11].
Srdeční selhání a (tako-tsubo) kardiomypatie
Změny myokardu způsobené dlouhodobým nadbytkem katecholaminů detekované při MR vyšetření byly zmíněny již dříve. Echokardiograficky pak může být u pacientů s PPGL zjišťována často systolická dysfunkce levé komory [12]. Akutní nadbytek katecholaminů pak může být doprovázen akutními stavy jak v podobě tako-tsubo (klasické nebo invertované) kardiomyopatie (dokonce PPGL je uváděn vedle neurologických příčin nebo emočního stresu jako jedna z vyvolávajících příčin) [13], tak v podobě akutní katecholaminové kardiomyopatie vedoucí až ke kardiogennímu šoku s nutností přístrojové podpory, jako je např. extrakorporální membránová oxygenace [14,15]. Na začátku těchto stavů může být obraz typického PPGL záchvatu se vzestupem TK, bolestmi hlavy, na hrudi a silným opocením nebo nauzeou. Zhoršení nebo až zhroucení pacienta může nastat velmi rychle. Tyto stavy vznikají velmi často spontánně, vyvolat je ale mohou různé podněty, jako je např. anestezie, manipulace s tumorem nebo podání určitého léku vč. budivých aminů. Někdy se může jednat i o první klinickou prezentaci PPGL vůbec [15,16]. Vyvolat je mohou i relativně malé tumory měřící jen 2– 3 cm.
Arytmie
Klinickým korelátem stimulace β receptorů jsou palpitace. Nejčastější arytmií je sinusová tachykardie, často se ale můžeme setkat se supraventrikulárními vč. fibrilace síní. Vzácné není také prodloužení QT intervalu, takže musíme počítat i s komorovými arytmiemi vč. komorové torsades de pointes. Můžeme se ale také setkat s reflexní sinusovou bradykardií, nebo dokonce s AV blokem vyššího stupně. Někdy se může stát, že se může brady - i tachyarytmie vyskytnout u jednoho pacienta [17].
Závěr
PPGL je nádor, který může být v každém věku pro pacienta život ohrožující právě pro možné kardiovaskulární komplikace [18,19]. Nejdůležitější částí diagnózy je vůbec pomyšlení na něj, neboť jeho jedinou prevencí je jeho odstranění. Pokud však PPGL není diagnostikován, mohou se kardiovaskulární komplikace vč. život ohrožujících opakovat. Naopak odstranění tumoru je spojeno s úpravou klinického stavu. S ohledem na vzácnost PPGL a jejich komplexnost by měla být péče o tyto pacienty soustřeďována do specializovaných center.
Doručeno do redakce: 30. 7. 2018
Přijato po recenzi: 6. 8. 2018
doc. MU Dr. Tomáš Zelinka, CSc.
Sources
1. Zelinka T, Eisenhofer G, Pacak K. Pheochromocytoma as a catecholamine producing tumor: implications for clinical practice. Stress 2007; 10(2): 195– 203. doi: 10.1080/ 10253890701395896.
2. Crona J, Taïeb D, Pacak K. New perspectives on pheochromocytoma and paraganglioma: toward a molecular classification. Endocr Rev 2017; 38(6): 489– 515. doi: 10.1210/ er.2017-00062.
3. Opotowsky AR, Moko LE, Ginns J et al. Pheo-chromocytoma and paraganglioma in cyanotic congenital heart disease. J Clin Endocrinol Metab 2015; 100(4): 1325– 1334. doi: 10.1210/ jc.2014-3863.
4. McNeil AR, Blok BH, Koelmeyer T et al. Phaeochromocytomas discovered during coronial autopsies in Sydney, Melbourne and Auckland. Aust N Z J Med 2000; 30(6): 648– 652.
5. Paur H, Wright PT, Sikkel MB et al. High levels of circulating epinephrine trigger apical cardiodepression in a beta2-adrenergic receptor/ Gi-dependent manner: a new model of Takotsubo cardiomyopathy. Circulation 2012; 126(6): 697– 706. doi: 10.1161/ CIRCULATIONAHA.112.111591.
6. Ferreira VM, Marcelino M, Piechnik SK et al. Pheochromocytoma is characterized by catecholamine-mediated myocarditis, focal and diffuse myocardial fibrosis, and myocardial dysfunction. J Am Coll Cardiol 2016; 67(20): 2364– 2374. doi: 10.1016/ j.jacc.2016.03.543.
7. Zelinka T, Štrauch B, Pecen L et al. Diurnal blood pressure variation in pheochromocytoma, primary aldosteronism and Cushing's syndrome. J Hum Hypertens 2004; 18(2): 107– 111. doi: 10.1038/ sj.jhh.1001644.
8. Zelinka T, Štrauch B, Petrák O et al. Increased blood pressure variability in pheochromocytoma compared to essential hypertension patients. J Hypertens 2005; 23(11): 2033– 2039.
9. Messerli FH, Loughlin KR, Messerli AW et al. The president and the pheochromocytoma. Am J Cardiol 2007; 99(9): 1325– 1329. doi: 10.1016/ j.amjcard.2006.12.043.
10. Majtan B, Zelinka T, Rosa J et al. Long-term effect of adrenalectomy on cardiovascular remodeling in patients with pheochromocytoma. J Clin Endocrinol Metab 2017; 102(4): 1208– 1217. doi: 10.1210/ jc.2016-2422.
11. Lenders JW, Duh QY, Eisenhofer G et al. Pheochromocytoma and paraganglioma: an endocrine society clinical practice guideline. J Clin Endocrinol Metab 2014; 99(6): 1915– 1942. doi: 10.1210/ jc.2014-1498.
12. Agarwal G, Sadacharan D, Kapoor A, et al. Cardiovascular dysfunction and catecholamine cardiomyopathy in pheochromocytoma patients and their reversal following surgical cure: Results of a prospective case-control study. Surgery 2011; 150(6): 1202– 1211. doi: 10.1016/ j.surg.2011.09.001.
13. Ghadri JR, Wittstein IS, Prasad A et al. international expert consensus document on takotsubo syndrome (part i): clinical characteristics, diagnostic criteria, and pathophysiology. Eur Heart J 2018; 39(22): 2032– 2046. doi: 10.1093/ eurheartj/ ehy076.
14. Giavarini A, Chedid A, Bobrie G et al. Acute catecholamine cardiomyopathy in patients with phaeochromocytoma or functional paraganglioma. Heart 2013; 99(19): 1438– 1444. doi: 10.1136/ heartjnl-2013-304073.
15. Sauneuf B, Chudeau N, Champigneulle B et al. Pheochromocytoma crisis in the ICU: a french multicenter cohort study with emphasis on rescue extracorporeal membrane oxygenation. Crit Care Med 2017; 45(7): e657– e665. doi: 10.1097/ CCM.0000000000002333.
16. Agarwal V, Kant G, Hans N et al. Takotsubo-like cardiomyopathy in pheochromocytoma. Int J Cardiol 2011; 153(3): 241– 248. doi: 10.1016/ j.ijcard.2011.03.027.
17. Gorenek B, Boriani G, Dan GA et al. European Heart Rhythm Association (EHRA) position paper on arrhythmia management and device therapies in endocrine disorders, endorsed by Asia Pacific Heart Rhythm Society (APHRS) and Latin American Heart Rhythm Society (LAHRS). Europace 2018; 20(6): 895– 896. doi: 10.1093/ europace/ euy051.
18. Zelinka T, Petrák O, Turková H et al. High incidence of cardiovascular complications in pheochromocytoma. Horm Metab Res 2012; 44(5): 379– 384. doi: 10.1055/ s-0032-1306294.
19. Riester A, Weismann D, Quinkler M et al. Life-threatening events in patients with pheochromocytoma. Eur J Endocrinol 2015; 173(6): 757– 764. doi: 10.1530/ EJE-15-0483.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2018 Issue 3-
All articles in this issue
- Hypotyreóza a srdce
- Primární hyperaldosteronizmus a hypertenze
- Feochromocytom a srdce
- Kardiovaskulární riziko u pacientů s Cushingovým syndromem
- Dyslipidemie u vybraných endokrinopatií
- Evropská doporučení pro diagnostiku a management synkop z roku 2018 – komentovaná zkrácená verze
- Gestační diabetes a možnosti jeho léčby
- Role epikardiálního tuku v patofyziologii srdečních onemocnění
- Perindopril a léčba kardiovaskulárních onemocnění aneb 25 let úspěšného působení perindoprilu v kardiologii
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Perindopril a léčba kardiovaskulárních onemocnění aneb 25 let úspěšného působení perindoprilu v kardiologii
- Hypotyreóza a srdce
- Gestační diabetes a možnosti jeho léčby
- Evropská doporučení pro diagnostiku a management synkop z roku 2018 – komentovaná zkrácená verze
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

