-
Medical journals
- Career
Rychle progredující glomerulonefritidy (srpkovité glomerulonefritidy)
Authors: O. Zakiyanov 1,2; J. Vachek 1,3; V. Tesař 1
Authors‘ workplace: Klinika nefrologie VFN a 1. LF UK v Praze 1; Ústav lékařské biochemie a laboratorní diagnostiky VFN a 1. LF UK v Praze 2; Farmakologický ústav 1. LF UK v Praze 3
Published in: Kardiol Rev Int Med 2014, 16(1): 62-66
Category: Internal Medicine
Overview
Rychle progredující glomerulonefritidy (RPGN) jsou nejzávažnější formou nefritického syndromu. Bez terapie dochází k ireverzibilní ztrátě funkce ledvin v řádu dnů až týdnů. RPGN se obvykle manifestuje proteinurií pod 3 g/ d, hematurií s dysmorfními erytrocyty a často erytrocytárními válci. RPGN se může vyskytovat samostatně nebo jako součást systémového onemocnění. Specifickým nálezem v renální biopsii je postižení více než 70 % glomerulů srpky. Nejčastějšími stavy projevujícími se jako RPGN jsou ANCA ‑ asociované vaskulitidy, antirenální nefritida, méně často se vyskytují imunokomplexové glomerulonefritidy. Základem terapie jsou glukokortikoidy, cyklofosfamid a novější imunosupresiva, nejnověji i biologická léčba (rituximab), někdy v kombinaci s plazmaferézou.
Klíčová slova:
rychle progredující glomerulonefritidy – pulmorenální syndrom – srpky – renální selhání – cyklofosfamid – plazmaferézaÚvod
Pojem rychle progredující glomerulonefritidy (RPGN) je klinickým označením pro heterogenní skupinu proliferativních glomerulonefritid, které jsou charakterizovány postižením většiny glomerulů (více než 70 %) srpky a zpravidla rychlou progresí během několika dnů (maximálně týdnů) do terminálního selhání ledvin. Tento histologický nález se vyskytuje u 2 – 5 % pacientů, kteří se podrobili renální biopsii.
V roce 1982 Davies et al jako první pozorovali přítomnost autoprotilátek proti cytoplazmě neutrofilů (ANCA) u osmi pacientů s pauciimunní rychle progredující glomerulonefritidou a systémovou vaskulitidou [1]. V roce 1984 Hall et al učinili stejné zjištění u pacientů s vaskulitidou malých tepen [2]. Pro RPGN je příznačná přítomnost srpků (crescents). Synonymem pro RPGN je označení srpkovité glomerulonefritidy.
Srpky mohou vznikat při každém závažnějším poškození glomerulární kapilární stěny, které umožňuje průnik proteinů (fibrinogenu) a buněk (monocytů) do Bowmanova prostoru. Mohou se tedy s různou frekvencí objevovat u většiny chronických glomerulopatií. Časné srpky jsou epitelové, pak fibrotizují. Při jejich vzniku se uplatňuje proliferace epitelových buněk, průnik monocytů (makrofágů) a aktivace koagulace – přeměna fibrinogenu na fibrin. Produkce kolagenu je velmi rychlá a srpky se pak mění v obliterační, tím dochází k zániku glomerulů. V bioptickém vzorku pozorujeme proliferaci, fokální nekrózy a jizvení glomerulů – jde o obraz fokálně segmentální nekrózy. V principu je zřejmě na začátku glomerulární trombóza, která ale není téměř nikdy v biopsii zachycena. Následuje vznik nekrózy, kterou také zachytíme málokdy, dalším stadiem je vznik epitelového srpku s postupnou fibrotizací.
Současně je přítomna v různé míře intersticiální fibrotizace, v jejíž patogenezi se uplatňují neutrofily, T lymfocyty a monocyty. Postupně se rozvíjí difuzní intersticiální fibróza a atrofie [3].
Klasifikace RPGN je založena na imunofluorescenčním vyšetření renální tkáně (získané biopsií) a sérologickém vyšetření. RPGN rozdělujeme na tři typy (tab.1): 1. RPGN s protilátkami proti bazální membráně (GBM) glomerulů (anti‑GBM nefritida, antirenální nefritida) (10 % všech RPGN), 2. heterogenní skupina glomerulonefritid s granulárními depozity imunoglobulinů (imunokomplexový typ), kde vznik srpků komplikuje průběh primární endokapilární proliferativní glomerulonefritidy (asi 10 – 20 % všech RPGN), 3. renální mikroskopická vaskulitida s negativní nebo chudou (pauciimunní) imunofluorescencí a protilátkami proti cytoplazmě neutrofilních leukocytů (ANCA) – ANCA asociované (70 – 80 % všech RPGN) [4,5].
Table 1. Klasifikace RPGN na základě imunofluorescenčního vyšetření. 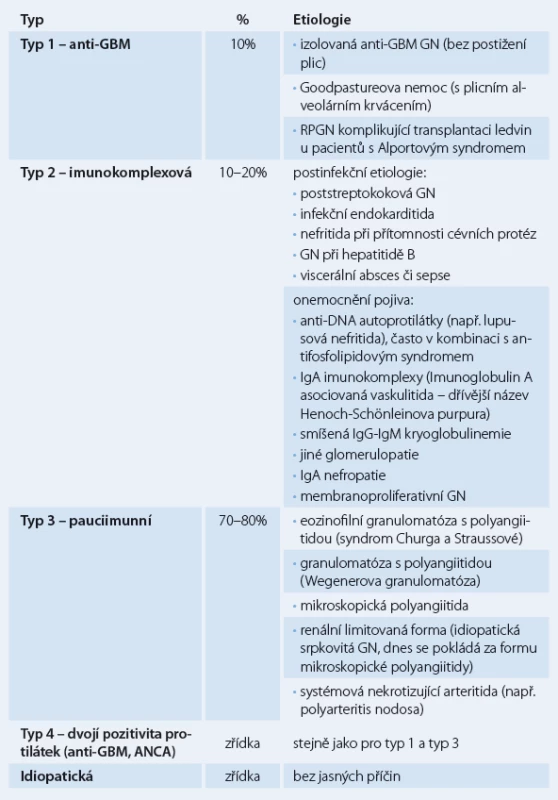
RPGN 1. typu s protilátkami proti bazální membráně může vzniknout v časové souvislosti s respirační expozicí tabákovému kouři, po virové infekci horních cest dýchacích nebo následkem jiných nox, které poškozují kolagen alveolů a spouštějí tvorbu protilátek proti kolagenu. Protilátky proti kolagenu typu IV zkříženě reagují s bazální membránou (protilátky reagují proti glomerulární a alveolární bazální membráně, protože většina jiných bazálních membrán neobsahuje alfa 3 řetězec kolagenu IV), dále fixují komplement a spouštějí buňkami zprostředkovanou zánětlivou odpověď v ledvinách a také obvykle v plicích. Pojmenování Goodpastureova nemoc je kombinací antirenální glomerulonefritidy a alveolárního krvácení při pozitivitě anti‑GBM protilátek. Glomerulonefritida bez alveolárního krvácení se nazývá anti‑GBM glomerulonefritida. Tito pacienti však mohou být ohroženi později vzniklým masivním alveolárním krvácením, i proto je nutná následná imunosupresivní terapie. Imunofluorescenční vyšetření renálních tkání ukazuje lineární umístění IgG depozit [6].
RPGN 2. typu (imunokomplexová glomerulonefritida) může komplikovat četné infekční choroby, choroby pojiva a také průběh primárních glomerulonefritid. Imunofluorescenčně prokážeme nespecifická granulární depozita [7,8].
RPGN 3. typu (pauciimunní glomerulonefritida) je charakteristická nepřítomností imunokomplexů (nebo jen jejich slabou pozitivitou) či nepřítomností depozit komplementu při imunofluorescenci. Více než 90 % pacientů má zvýšený titr ANCA protilátek (proti proteináze ‑ 3 nebo myeloperoxidáze) a známky systémové vaskulitidy [9].
RPGN 4. typu mají příznaky jak RPGN 1. typu, tak i 3. typu, tj. současné pozitivní anti‑GBM a ANCA protilátky. Jsou vzácné.
Idiopatické RPGN jsou také vzácné. Označujeme tak imunokomplexové glomerulonefritidy podobné RPGN 2. typu, kde však není zřejmá infekční příčina, onemocnění pojiva nebo onemocnění glomerulů. Označujeme tak i pauciimunní glomerulonefritidy charakteru RPGN 3. typu, kde však nejsou prokazatelné ANCA protilátky.
Na tomto místě je třeba připomenout novou klasifikaci vaskulitid podle konsenzu konference v Chapel Hill z roku 2012, která nahradila dosud užívanou klasifikaci z roku 1994. Základní princip dělení na vaskulitidy malých, středních a velkých cév zůstal i v nové klasifikaci zachován (tab. 2). Hlavní změny v názvosloví se týkají především dělení vaskulitid malých cév, které byly nově rozděleny na vaskulitidy ANCA ‑ asociované a vaskulitidy imunokomplexové. Kde to bylo možné, bylo snahou nahradit eponymická pojmenování vaskulitid systematickým názvoslovím (např. Wegenerova granulomatóza se nově nazývá granulomatóza s polyangiitidou, syndrom Churga ‑ Straussové je eozinofilní granulomatóza s polyangitidou a Henoch ‑ Schönleinova purpura je nyní IgA vaskulitida) [10,11].
Table 2. Dělení vaskulitid podle konsensu konference v Chapel Hill z roku 2012 [10]. ![Dělení vaskulitid podle konsensu konference v Chapel Hill z roku 2012 [10].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/f4a1f7e455e9b85bb58fc54dbf643191.png)
Klinický obraz
Klinický obraz je nespecifický – slabost, vyčerpání, váhový úbytek, febrilie, nauzea, zvracení, anorexie, artralgie a bolesti břicha. Část nemocných může mít symptomy podobné postreptokokové glomerulonefritidě projevující se makroskopickou hematurií. Právě mikroskopické hematurii je třeba věnovat velkou pozornost. U pacienta s nejasným plicním nálezem by přítomnost mikrohematurie měla vést k podezření na AAV nebo Goodpastureovu nemoc. Kolem 50 % pacientů má otoky a chřipkové příznaky. Během čtyř týdnů od počátku nemoci se většinou rozvíjí oligurie. Nefrotický syndrom je přítomen u 10 – 30 % pacientů. Hypertenze není obvyklá a většinou není závažná. U pacientů s pulmorenálním syndromem (při pozitivitě anti GBM nebo ANCA) zjišťujeme dušnost, kašel a přítomnost plicního krvácení, které se může projevit hemoptýzou nebo se při RTG vyšetření prokáží difuzní alveolární infiltráty charakteru mléčného skla (ground glass).
Diagnostická kritéria
- progresivní renální selhávání během týdnů až měsíců (jde o přirozený průběh onemocnění, nelze užít ke stanovení diagnózy – již při každém nejasném zvýšení kreatininu je nutné pomýšlet na možnost RPGN a pátrat po dalších kritériích),
- nefritický močový sediment (aktivní močový sediment – mikroskopická hematurie, proteinurie, válce),
- sérologické vyšetření,
- renální biopsie.
Suspekce na diagnózu RPGN by měla vyvstat u pacientů s akutním poškozením ledvin a dysmorfními erytrocyty v močovém sedimentu, případně s erytrocytárními válci. Je nutné vyšetřit sérový kreatinin, krevní obraz, moč chemicky a sediment, doplnit sérologické testy. Podezření na RPGN je absolutní indikací k biopsii ledviny. Sérologické vyšetření a renální biopsie potvrdí diagnózu.
Sérový kreatinin je prakticky vždy zvýšen, hematurie je přítomna vždy a erytrocytární válce jsou častým nálezem. Močový sediment s mnoha elementy – leukocyty, dysmorfními erytrocyty a granulárními a voskovými válci – je častý. Dalším nálezem je proteinurie pod 3 g/ den.
V červeném krevním obraze je anemie a leukocytóza. Sérologické testování zahrnuje vyšetření anti‑GBM protilátek, antistreptolysin O protilátek (ASLO), anti‑DNA protilátek, kryoglobulinů a ANCA protilátek (anti‑MPO, anti‑PR3). Vyšetření hladin složek komplementu (C3, C4) může také pomoci u imunokomplexové RPGN, u níž bývá hypokomplementemie.
Renální biopsii je třeba provést co nejdříve u všech pacientů s močovým nálezem či zhoršenou renální funkcí, pokud není diagnóza zcela jasná i bez biopsie (u systémového postižení u AAV). Hlavním nálezem u všech typů RPGN je fokální epitelová proliferace, velké množství neutrofilů, což je základem pro tvorbu srpků, které nakonec vyplní Bowmanova pouzdra ve > 70 % glomerulů. Glomerulus se obvykle jeví jako hypocelulární a dále kolabuje. Nekrózy uvnitř kliček a tvorba srpků jsou ve stanovení diagnózy hlavním vodítkem. Při všech těchto nálezech je nutné vzít v úvahu možnost vaskulitidy.
Imunofluorescenční vyšetření se liší podle typu RPGN
Při anti‑GBM nemoci (typ 1) je hlavním nálezem lineární pozitivní imunofluorescence IgG podél bazální membrány, často je doprovázena lineární a někdy i granulární depozicí C3. U imunokomplexové RPGN (typ 2) nacházíme při imunofluorescenci difuzní, nerovnoměrné IgG a C3 depozita v mezangiu. U pauciimunní RPGN (typ 3) je velmi chudá imunofluorescence bez přítomnosti depozit. Nález fibrinu uvnitř srpků je častý. U dvojité pozitivity RPGN (typ 4) je lineární pozitivita GBM (podobná typu 1). U idiopatické RPGN mají někteří pacienti imunní komplexy (podobné typu 2), u jiných bývá chudá negativní imunofluorescence a absence depozit (podobně jako u typu 3).
Prognóza
Spontánní remise RPGN je vzácná a 80 – 90 % pacientů progreduje bez léčby do stadia konečného selhání ledvin obvykle do šesti týdnů, nejpozději do šesti měsíců od propuknutí nemoci. Prognóza se zlepšuje při časné terapii [12,13,15]. Prognóza RPGN závisí na základním onemocnění, které vedlo k postižení ledvin. U části pacientů s pauciimunní RPGN se sice vyvine remise, ale nedojde u nich ke zlepšení renální funkce. Kolem 40 % non‑respondérů potřebuje dialyzační léčbu a úmrtnost je u nich kolem 33 % během čtyř let od stanovení diagnózy. Naopak z respondérů potřebuje dialyzační léčbu méně než 20 % pacientů, úmrtnost je kolem 3 % [17]. Pacienti s dvojitou pozitivitou mají prognózu mírně lepší než pacienti s anti‑GBM nemocí, ale závažnější než pacienti s pauciimunní RPGN.
V případě AAV je prognóza quoad vitam značně variabilní, renální prognóza závisí na histologickém nálezu. U anti‑GBM nefritidy je renální prognóza při přítomnosti pokročilých změn špatná, hlavně z důvodu postižení glomerulů srpky v jedné době, šance na zlepšení renálních změn je malá. Anti‑GBM glomerulonefritida však prakticky nerelabuje.
U imunokomplexových glomerulonefritid závisí prognóza na histologickém nálezu, převažují‑li sklerotické změny, je z renálního hlediska špatná [12 – 14]. Pacienti, u kterých dojde k restituci renálních funkcí po RPGN, mají reziduální histologické změny hlavně v glomerulech, přítomna je hypercelularita s menším zastoupením sklerotizace kapilárních kliček a epitelií a menší fibróza intersticia [18].
S relativně příznivou renální prognózou jsou spojeny:
- anti‑GBM glomerulonefritida, pokud je léčba zahájena včas, tj. před objevením se oligurie a zvýšením hladiny sérového kreatininu < 600 µmol/ l [16],
- systémový lupus erythematosus,
- granulomatóza s polyangitidou.
Pro spíše nepříznivou prognózu svědčí:
- věk > 60 let,
- oligurické renální selhání,vyšší hladina sérového kreatininu,
- obliterující srpky ve > 75 % glomerulů,
- absence odpovědi na léčbu u pacientů s pauciimunní RPGN.
Léčba
Vzhledem k povaze onemocnění představují základní léčbu imunosupresiva, někdy v kombinaci s plazmaferézou. Režimy a výběr imunosupresiv záleží na základním onemocnění. Symptomatická léčba zahrnuje náhradu funkce ledvin. V dnešní době, kdy je bez problémů dostupná dialyzační léčba, pacienti umírají většinou na infekci nebo z kardiálních příčin.
Léčba v indukční fázi zahrnuje:
- kortikosteroidy,
- cyklofosfamid, alternativně u některých pacientů mykofenolát ‑ mofetil,
- plazmaferézy u pacientů s pulmorenálním syndromem, zvláště při plicním krvácení a selhání ledvin,
- u některých pacientů je indikována biologická léčba (rituximab [19,20] je dnes rovnocennou léčbou první volby, zcela výjimečně je indikován alemtuzumab, který není pro tuto diagnózu registrován, užíván je jen na specializovaných pracovištích),
- výběr terapie záleží na konkrétním průběhu onemocnění (tíže postižení, věk, renální a jaterní funkce a další faktory). Je vhodné, aby pacienti s RPGN byli léčeni v centrech s odpovídajícími zkušenostmi a možností plazmaferéz, biologické léčby, řešení komplikací, účasti ve studiích atd.
K udržovací terapii se užívají:
- kortikosteroidy se snahou o podávání co nejnižších účinných dávek,
- azathioprin, alternativně mykofenolát ‑ mofetil,
- metotrexát,
- deoxyspergualin (v rámci salvage therapy na specializovaných pracovištích),
- u vybraných pacientů biologická léčba (rituximab),
- podpůrná a doplňující medikace (vitamin D, vápník, cotrimoxazol k prevenci pneumocystové pneumonie, antimykotika, antivirotika aj.).
Léčba závisí na konkrétním typu onemocnění. Je třeba ji zahájit neodkladně, nejlépe při hladině sérového kreatininu < 450 µmol/ l, dokud podle nálezu nejsou postiženy všechny glomeruly, resp. dokud nejsou přítomny organizované srpky, fibróza intersticia a atrofické tubuly. Léčba je méně úspěšná, je‑li onemocnění pokročilé. U starších pacientů je spojena s častějšími komplikacemi, např. ve smyslu častějších infekcí.
Základní schéma léčby představuje kombinace kortikosteroidů a cyklofosfamidu. U imunokomplexových a pauciimunních RPGN podáváme někdy vstupně steroidy v dávce 0,25 – 0,5 g intravenózně, jednou denně celkem 3 – 5 dnů a dále nasazujeme perorální prednison v dávce 1 mg/ kg/den. Pulzní léčba intravenózním cyklofosfamidem v rámci indukční léčby se zahajuje dávkou 15 mg/ kg, dávkování je nutné event. upravit s ohledem na věk a renální funkci, obvyklé je podání šesti pulsů během tří měsíců. Dnes již málo užívanou alternativou je perorální cyklofosfamid v dávce 1,5 – 2 mg/ den. Pulzní léčba má výhodu v podobě nižší kumulativní dávky a menšího množství nežádoucích účinků včetně leukopenie a infekce než perorální léčba při srovnatelné účinnosti. Prednison, cyklofosfamid a plazmaferézy jsou v léčbě anti‑GBM GN užívány se snahou minimalizovat tvorbu protilátek, podávají se i při nevratném postižení ledvin s cílem minimalizovat orgánové postižení vlivem autoprotilátek – především plic. Při této léčbě obvykle dochází ke zlepšení (znovuobnovení nezávislé) renální funkce [21].
U anti‑GBM nefritidy se doporučuje plazmaferéza v režimu výměny 3 – 4 litrů plazmy po dobu 14 dnů. Plazmaferézy lze také doporučit pro léčbu imunokomplexové RPGN a ANCA asociované RPGN s plicním krvácením nebo závažnou renální dysfunkcí (sérový kreatinin > 500 µmol/ l nebo závislost na dialýze). Plazmaferézy jsou účinné z důvodu rychlého odstranění volných protilátek, intaktních imunokomplexů a mediátorů zánětu (např. fibrinogen, komplement) [14].
Transplantace ledviny je možná u všech typů RPGN. Riziko relapsu AAV i anti‑GBM ve štěpu je nízké, problémem může být perzistující extrarenální aktivita nebo extrarenální relaps AAV. Riziko relapsu se zmenšuje v čase. Při anti‑GBM nefritidě by titry anti‑GBM protilátek měly být negativní přinejmenším 12 týdnů před transplantací. U pacientů s pauciimunní RPGN je vyžadována remise alespoň šest měsíců před transplantací, titr ANCA protilátek by měl být co nejnižší.
Doručeno do redakce: 22. 1. 2014
Přijato po recenzi 3. 2. 2014
MU Dr. PhDr. Oskar Zakiyanov
www.vfn.cz
zoskar@post.cz
Sources
1. Davies DJ, Moran JE, Niall JF et al. Segmental necrotising glomerulonephritis with antineutrophil antibody: possible arbovirus aetiology? Br Med J (Clin Res Ed) 1982; 285 : 606.
2. Hall JB, Wadham BM, Wood CJ et al. Vasculitis and glomerulonephritis: a subgroup with an antineutrophil cytoplasmic antibody. Aust N Z J Med 1984; 14 : 277 – 278.
3. Tesař V, Shück O et al. Klinická nefrologie: Grada Avicenum: Praha 2006.
4. Little MA, Pusey CD. Rapidly progressive glomerulonephritis: current and evolving treatment strategies. J Nephrol 2004; Suppl 8: S10 – S19.
5. Jennette JC. Rapidly progressive crescentic glomerulonephritis. Kidney Int 2003; 63 : 1164 – 1177.
6. Hellmark T, Segelmark M. Diagnosis and classification of Goodpasture's disease (anti‑GBM). J Autoimmun 2014. doi: 10.1016/ j.jaut.2014.01.024.
7. Alpers CE, Smith KD. Cryoglobulinemia and renal disease. Curr Opin Nephrol Hypertens 2008; 17 : 243 – 249. doi: 10.1097/ MNH.0b013e3282f8afe2.
8. D'Cruz D. Renal manifestations of the antiphospholipid syndrome. Curr Rheumatol Rep 2009; 11 : 52 – 60.
9. Berden A, Göçeroglu A, Jayne D et al. Diagnosis and management of ANCA associated vasculitis. BMJ 2012; 344: e26. doi: 10.1136/ bmj.e26.
10. Jennette JC, Falk RJ, Bacon PA et al. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum 2013; 65 : 1 – 11. doi: 10.1002/ art.37715.
11. Ciferská H, Vachek J. Ledvinné manifestace u revmatických chorob. Revmatologie 2013; 5 : 63 – 69.
12. Little MA, Nazar L, Farrington K. Outcome in glomerulonephritis due to systemic small vessel vasculitis: effect of functional status and non‑vasculitic co ‑ morbidity. Nephrol Dial Transplant 2004; 19 : 356 – 364.
13. Eisenberger U, Fakhouri F, Vanhille P et al. ANCA ‑ negative pauci ‑ immune renal vasculitis: histology and outcome. Nephrol Dial Transplant 2005; 20 : 1392 – 1399.
14. Levy JB, Turner AN, Rees AJ et al. Long‑term outcome of anti‑glomerular basement membrane antibody disease treated with plasma exchange and immunosuppression. Ann Intern Med 2001; 134 : 1033 – 1042.
15. Couser WG. Basic and translational concepts of immune ‑ mediated glomerular diseases. J Am Soc Nephrol 2012; 23 : 381 – 399. doi: 10.1681/ ASN. 2011030304.
16. Tang W, McDonald SP, Hawley CM et al. Anti‑glomerular basement membrane antibody disease is an uncommon cause of end‑stage renal disease. Kidney Int 2013; 83 : 503 – 510. doi: 10.1038/ ki.2012.375.
17. Tang W, Bose B, McDonald SP et al. The outcomes of patients with ESRD and ANCA‑associated vasculitis in Australia and New Zealand. Clin J Am Soc Nephrol 2013; 8 : 773 – 780. doi: 10.2215/ CJN.08770812.
18. Chen YX, Chen N. Pathogenesis of rapidly progressive glomerulonephritis: what do we learn? Contrib Nephrol 2013; 181 : 207 – 215. doi: 10.1159/ 000348633.
19. Jones RB, Tervaert JW, Hauser T et al. Rituximab versus cyclophosphamide in ANCA‑associated renal vasculitis. N Engl J Med 2010; 363 : 211 – 220. doi: 10.1056/ NEJMoa0909169.
20. Stone JH, Merkel PA, Spiera R et al. Rituximab versus cyclophosphamide for ANCA‑associated vasculitis. N Engl J Med 2010; 363 : 221 – 232. doi: 10.1056/ NEJMoa0909905.
21. Jindal KK. Management of idiopathic crescentic and diffuse proliferative glomerulonephritis: evidence‑based recommendations. Kidney Int Suppl 1999; 70: S33 – S40.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2014 Issue 1-
All articles in this issue
- Invazivní léčba karotických stenóz a možnosti její optimalizace transkraniální dopplerovskou ultrasonografií
- Trvalá kardiostimulace z pohledu nových evropských doporučení roku 2013
- Kardiohepatální syndrom u chronického srdečního selhání
- Prognostický význam elevace funkčních jaterních testů u akutních koronárních syndromů s manifestním srdečním selháním
- Vývoj renálních parametrů u pacientů s pokročilým srdečním selháním léčených levosimendanem – retrospektivní analýza
- Renální denervace – budoucnost nebo zklamání
- Hluboká žilní trombóza a plicní embolie při užívání hormonální antikoncepce
- Argumenty pro konzervativní léčbu chronické formy ischemické choroby srdeční přibývají
- Komplexní ošetřovatelská dokumentace při krátkodobé hospitalizaci pacientů indikovaných k trvalé kardiostimulaci
- Chronické onemocnění ledvin – novinky v klasifikaci a terapii
- Farmakoterapie při chronickém onemocnění ledvin
- Akutní poškození ledvin
- Rychle progredující glomerulonefritidy (srpkovité glomerulonefritidy)
- Vybrané choroby ledvin v těhotenství
- Infekce dolních a horních močových cest
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Akutní poškození ledvin
- Vybrané choroby ledvin v těhotenství
- Rychle progredující glomerulonefritidy (srpkovité glomerulonefritidy)
- Farmakoterapie při chronickém onemocnění ledvin
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


