-
Medical journals
- Career
Kardiostimulace u fibrilace síní
Authors: K. Buchtová
Authors‘ workplace: LF MU a FN U sv. Anny, Brno ; I. interní kardioangiologická klinika
Published in: Kardiol Rev Int Med 2007, 9(1): 31-39
Category: Editorial
Overview
Fibrilace síní (FiS) je jednou z nejčastějších arytmií a její incidence stoupá s věkem. K FiS nejčastěji dochází při chronickém onemocnění, například u hypertenze, srdečního selhání, ischemické choroby srdeční, chlopenních vad, kardiomyopatií, ale příčiny mohou být i nekardiální, například hypertyreóza nebo iontové dysbalance. U každého pacienta s FiS je třeba individuálně rozhodnout o léčbě farmakologické či nefarmakologické, eventuálně kombinované, tedy hybridní. V této práci se věnujeme indikacím k implantaci kardiostimulátoru u permanentní FiS, u dysfunkce sinusového uzlu s paroxyzmální FiS, u pacientů s chronickou FiS po ablaci atrioventrikulární junkce a zmiňujeme též biventrikulární stimulaci u pacientů se srdečním selháním a FiS. Implantace kardiostimulátoru většinou není metodou první volby - je nutné vždy zvážit přínos implantace kardiostimulátoru i jeho možné komplikace. Speciálně jsou rozvedeny algoritmy k prevenci síňových tachyarytmií.
Klíčová slova:
fibrilace síní, trvalá kardiostimulace, sick sinus syndrom, preventivní algoritmy, neselektivní ablace AV uzlu, srdeční resynchronizační terapieÚvod
FiS je nejčastější supraventrikulární arytmie. Její incidence stoupá s věkem, její prevalence u pacientů nad 60 let je 1 %, u pacientů nad 80 let až 6 %.
Je charakterizována rychlou nekoordinovanou aktivací síní, která je spojena s poruchou kontrakce síní, ztrátou atrioventrikulární synchronie, nepravidelným převodem na komory a často nepřiměřeně rychlou komorovou odpovědí. Všechny tyto faktory přispívají k celkovému zhoršení hemodynamiky a poklesu srdečního výdeje. Ztráta síňového příspěvku při FiS síní může způsobit snížení srdečního výdeje až o 20 %. Dlouhodobá FiS s rychlou odpovědí komor může vést až k těžké systolické depresi funkce levé komory, tzv. tachykardické kardiomyopatii.
Vznik FiS může být způsoben impulzy z jednoho či více ektopických fokusů v srdečních síních. Impulsy mohou být spouštěny jednotlivě – jednotlivé extrasystoly, nebo v salvách. Při velmi rychlých frekvencích při paroxyzmech jde většinou o fokální FiS. Pokud je přítomno více ložisek, mohou se v aktivitě střídat. V posledních letech bylo prokázáno, že FiS se nejčastěji spouští a udržuje ektopickou aktivitou vycházející z oblasti ústí plicních žil. Méně často se ložiska nacházejí i v jiných lokalizacích - v oblasti crista terminalis a ústí horní duté žily v pravé síni, v oblasti koronárního sinu či Marshalovy žíly v levé síni. Princip katetrizační ablace FiS síní spočívá ve zrušení těchto arytmogenních substrátů.
Dalším úskalím u FiS je výskyt tromboembolické nemoci, která je u těchto pacientů 5krát vyšší než u pacientů se sinusovým rytmem. Dochází ke stagnaci krve v síních, s možností tvorby trombů v oušcích. Současně dochází i k dysfunkci endotelu a celkově k navození hyperkoagulačního stavu. Antikoagulační terapie s cílovým nastavením INR 2-3 je plně indikovaná.
FiS může vzniknout z akutních příčin, například po nárazovém požití alkoholu ve vyšší dávce, incidence je relativně vysoká po kardiochirurgických zákrocích, dále u plicní embolie, u perikarditity, myokarditidy, u akutního infarktu myokardu. Nejčastěji k FiS dochází při chronickém kardiálním onemocnění, například u hypertenze, srdečního selhání, ischemické choroby srdeční, u chlopenních vad, kardiomyopatií, ale příčiny mohou být i nekardiální, například hypertyreóza nebo iontové dysbalance. FiS může vznikat i bez zjevné příčiny, jedná se o tzv. lone fibrillation, kde se uvažuje o genetické predispozici.
FiS můžeme klasifikovat podle četnosti epizod a podle možnosti verze zpět na sinusový rytmus. FiS může tedy být paroxyzmální, kdy se jedná o epizody, které většinou spontánně končí do 48 hodin. Perzistující FiS nekončí spontánně, ale až po farmakologické nebo elektrické kardioverzi. Dlouhotrvající perzistující FiS může vyústit až do chronické FiS, kdy již ani opakované pokusy o verzi na sinusový rytmus nejsou úspěšné, takovou arytmii nazýváme permanentní.
Každý pacient s nově diagnostikovanou FiS byl měl být řádně vyšetřen. Mělo by být provedeno základní hematologické a biochemické vyšetření včetně hladin hormonů štítné žlázy, dále alespoň transtorakální echokardiografické vyšetření srdce, aby se vyloučilo strukturální kardiální postižení, a podle výsledků zvolena optimální terapie [1-3].
V této práci se budeme věnovat indikacím k implantaci kardiostimulátoru u FiS z různých důvodů (obr. 1):
Image 1. Elektrofyziologie fibrilace síní (převzato z http://catalog.nucleusinc.com). 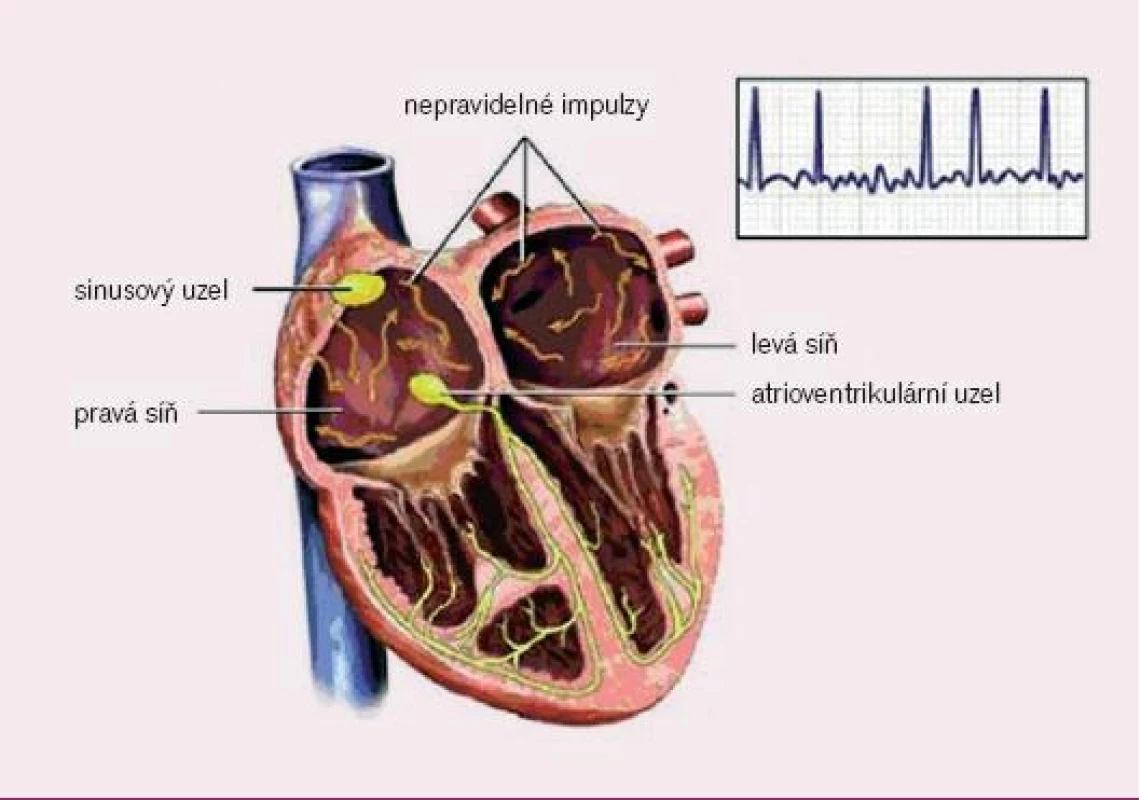
- permanentní FiS
- dysfunkce sinusového uzlu s paroxyzmální FiS
- algoritmy kardiostimulátorů v prevenci síňových tachyarytmií
- po ablaci atrioventrikulární junkce u pacientů s chronickou FiS
- biventrikulární stimulace u pacientů se srdečním selháním a s FiS
Permanentní fibrilace síní
U permanentní FiS je indikace trvalé kardiostimulace při pomalé odpovědi komor u pacientů s Morgagniho-Adamsovými-Stokesovými (MAS) ekvivalenty – závratě, pocity slabosti, méně často MAS paroxyzmy (krátkodobá bezvědomí). V případě frekvence komor pod 40 min-1 nebo při opakovaném zachycení intervalu R-R nad 3000 ms, (zvláště v denní době), je implantace PM indikována i u asymptomatických pacientů. FiS s pravidelnou pomalou odpovědí komor je obvykle spojena se současnou atrioventrikulární blokádou. Vždy je třeba vyloučit bradykardii podmíněnou bradykardizující medikací.
Dále je trvalá kardiostimulace indikována u permanentní FiS tachykardicko - bradykardické formy, kdy se střídá pomalá a nepřiměřeně rychlá komorová odpověď. Zajištění trvalým kardiostimulátorem umožní nutné podávání antiarytmik.
U permanentní FiS je indikována implantace komorového PM s adaptabilní frekvencí, VVI,R; který umožňuje zrychlení frekvence stimulace při zátěži. Komorový PM bez adaptabilní frekvence (VVI,C) používáme jen u pacientů omezeně pohyblivých. Síňová stimulace je u permanentní FiS kontraindikována.
Princip spočívá v zavedení elektrody do pravé komory, klasická poloha je v hrotu pravé komory, kdy stimulované komplexy QRS mají tvar blokády levého Tawarova raménka.
Četné studie se zabývaly optimální polohou elektrody v pravé komoře. Jednou z možností je stimulace Hisova svazku, je však limitována na pacienty s normálním HV vedením, bezpečnost této stimulace a úspěšnost nebyla ověřena širšími studiemi. V některých studiích byla prokázána lepší hemodynamika při stimulaci z výtokového traktu pravé komory. V poslední době se preferuje stimulace z midseptální polohy, kdy se šíření elektrické aktivity blíží fyziologickému šíření vzruchu. Můžeme programovat dolní a horní hranici stimulační frekvence (většinou 60-70 min-1 100-130(160) min-1, strmost vzestupu a poklesu senzorem řízené stimulace. Některé PM optimalizují nastavení senzoru automaticky.
Trvalá antikoagulační terapie je při permanentní FiS většinou nutná – neindikujeme ji jen tehdy, pokud je přítomna jednoznačná kontraindikace nebo pokud se jedná o nespolupracujícího pacienta [4,5].
Dysfunkce sinusového uzlu a paroxysmální fibrilace síní
Sick sinus syndrom je charakterizován postižením nejen sinusového uzlu, ale celého systému tvorby a převodu vzruchu v síních. Etiologie dysfunkce sinusového uzlu bývá nejčastěji ischemická nebo degenerativní. Při tachykardicko-bradykardické formě pozorujeme typický útlum sinusové automacie se zvýšenou ektopickou automacií síní. Střídají se rychlé rytmy (supraventrikulární tachykardie, tachyfibrilace síní, flutter síní) a pomalé rytmy (sinusová či junkční bradykardie s SA blokádami či zástavami).
U sick sinus syndromu s paroxyzmální FiS při neúspěchu farmakologické i nefarmakologické terapie je indikována fyziologická stimulace, kdy lze užít síňový PM AAI,R (pokud vyloučíme poruchu AV převodu) nebo 2dutinový kardiostimulátor (DDD,R). U těchto typů kardiostimulace byla prokázána významně nižší incidence paroxyzmů FiS než u pacientů po implantaci PM VVIR, který je při sick sinus syndromu nevhodný. Bylo zjištěno, že po implantaci kardiostimulátoru v režimu VVI dochází ke zhoršení hemodynamiky v důsledku ztráty síňokomorové synchronizace, poruše inter - a intraventrikulární synchronie i progresi mitrální regurgitace. V důsledku komorové stimulace při pomalém sinusovém rytmu a retrográdním převodu na síně dochází k nárůstu tlaku v síních a regurgitaci do plicních žil (pacemakerový syndrom).
Bylo zjištěno, že přítomná fokální elektrická aktivita v oblasti plicních žil a vznik napětí v síních patří k hlavním spouštěčům FiS. Dále bylo v některých studiích prokázáno, že se při komorové stimulaci redukuje průtok věnčitými tepnami, tato stimulace způsobuje nárůst hladin katecholaminů a porušuje vztah mezi srdečním výdejem a spotřebou kyslíku v myokardu. Konečně, asynchronní komorová stimulace indukuje elektrickou i mechanickou remodelaci síní i komor s dilatací síní, se vznikem dilatace a asymetrické hypertrofie levé komory. Všechny tyto mechanizmy podporují vznik FiS, dále tvorbu trombů v síních a přechod paroxyzmální FiS do chronicity [6,7].
Rozsáhlá randomizovaná studie MOST (Mode selection trial) jednoznačně prokázala, že se při stimulaci v režimu VVI(R) zvyšuje riziko FiS a srdečního selhání, stejně jako se s růstem procenta komorové stimulace u pacientů se stimulátorem DDD(R) lineárně zvyšuje riziko FiS i srdečního selhání [8].
Vzhledem k těmto nálezům je komorová stimulace považována za nevhodnou. Pokud nelze použít PM AAI(R), snažíme se po implantaci PM DDD(R) omezit komorovou stimulaci na minimum s cílem zachovat síňovou stimulaci se spontánním převodem na komory úpravou programování, např. prodloužením atrioventrikulárního (AV) intervalu nebo (v nových typech kardiostimulátorů) použitím automatické funkce preferující spontánní atrioventrikulární převod [9].
Ve studii PIPAF (Pacing in prevention of atrial fibrillation) byla potvrzena lineární závislost mezi komorovou stimulací a vznikem paroxyzmů FiS u pacientů po implantaci kardiostimulátoru DDD(R). Při nepotřebné komorové stimulaci dochází ke zrušení efektu preventivní síňové stimulace, z čehož vyplývá, že stimulace v režimu AAI(R) je k prevenci FiS vhodnější než DDD(R) [10].
Při implantaci síňového kardiostimulátoru s frekvenční adaptabilitou na zátěž AAI(R) zavádíme jen 1 elektrodu do pravé síně, klasicky do místa ouška pravé síně. Je nutné předem vyloučit poruchu AV vedení, tedy normální HV interval (norma 35-55 ms), normální nativní Wenckenbachův bod (nad 120/min). Stimulace v režimu AAI je fyziologičtější než stimulace v režimu DDD; při zachovaném AV převodu se předpokládá i lepší funkce komory. Na druhé straně může při stimulaci v režimu AAI dojít k pozdějšímu vzniku atriovetrikulární blokády, ale pak můžeme provést upgrade stimulátoru AAI na DDD.
Současné typy kardiostimulátorů umožňují preferenci síňové stimulace, sekvenčně začnou stimulovat až při významném prodloužení atrioventrikulárního intervalu a kontrolují v programovaných intervalech návrat spontánního atrioventrikulárního vedení. Při jeho zjištění přepnou PM opět do režimu síňové stimulace AAI (viz níže). Při studiích srovnávajících stimulace v režimu AAI a DDD nebyl prokázán rozdíl v přežití a vzniku chronické FiS, ale byla prokázána nižší incidence tromboembolických komplikací a také menší riziko paroxyzmů FiS (obr. 2) [11,12,13,14].
Image 2. Zavedení elektrod u PM AAI a DDD. Na 1. obrázku je pacient po implantaci síňového kardiostimulátoru, na 2. obrázku obraz po implantaci dvoudutinového kardiostimulátoru (převzato z http://www. biotronik.com). 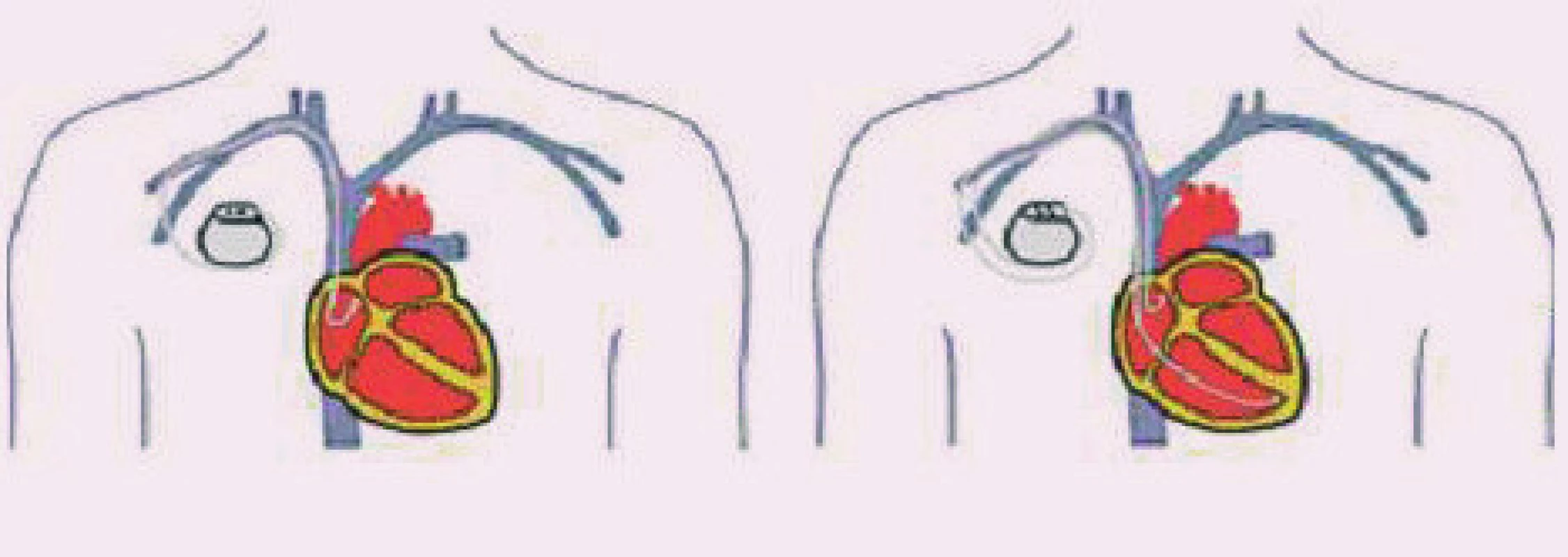
Při implantaci kardiostimulátoru DDD(R) se zavádějí 2 elektrody, síňová do pravé síně v oblasti ouška, komorová do hrotu, nebo do oblasti midsepta či výtoku pravé komory.
Kromě klasických způsobů síňové stimulace v oušku pravé síně se ve snaze o synchronizaci síňové kontrakce zkoušelo několik nových způsobů stimulace, a to z alternativních míst čí z více míst v síních.
Pokud použijeme jen 1 elektrodu, lze synchronizaci síní zlepšit jejím zavedením do oblasti mezisíňového septa, která umožňuje rychlejší aktivaci síní než při stimulaci z ouška. Byla zkoušena stimulace z Bachmanova svazku, tedy z oblasti předního horního septa, stejně jako z oblastí dolního septa, které v některých studiích prokazovaly nižší incidenci paroxyzmů FiS.
Dále lze užít biatriální stimulaci, která je ale technicky obtížnější: pravosíňová elektroda je v horní pravé síni a levosíňová elektroda se většinou zavádí do koronárního sinu do jeho větví v oblasti levé síně. Biatriální stimulace se z technických důvodů v praxi příliš nepoužívá. V některých studiích byla srovnávána stimulace z jednoho a více míst v síních. Výsledky většiny studií vykazovaly nižší výskyt FiS u biatriální stimulace [15-19].
Ve studii DAFFAP (Dual Site Atrial Pacing to Prevent Atrial Fibrillation) byla srovnávána bezpečnost, tolerance a efektivita síňové stimulace při stimulaci z horní pravé síně se stimulací ze 2 míst v pravé síni a stimulaci v režimu DDI u pacientů se symptomatickou FiS a bradykardií. Optimální stimulační režim však zůstává nejasný. Závěrem této studie bylo zjištění, že stimulace ze 2 míst v pravé síni je bezpečná a lépe tolerovaná než stimulace z pravé horní síně či při stimulaci z pravé komory. Nejlepších výsledků dosahovala síňová stimulace u pacientů, kteří současně užívali antiarytmika, bez ohledu na to, zda měli stimulaci z jednoho či více míst v pravé síni [20].
Optimálním řešením u sick sinus syndromu s tachy-/bradykardií je tzv. hybridní terapie, tedy implantace kardiostimulátoru a současná antiarytmická terapie, která redukuje počet paroxyzmů, délku jejich trvání a celkově zlepšuje stav pacienta. Nesmíme zapomenout na radiofrekvenční ablaci v léčbě zejména paroxyzmální FiS jako na samostatnou metodu či v rámci hybridní terapie.
Další otázkou je riziko tromboembolických komplikací u těchto pacientů. Antikoagulační terapii zvažujeme podle symptomů pacienta, výsledku holterovské monitorace a rizikovosti pacienta. Trvalou antikoagulační terapii u pacienta se syndromem tachy-bradykardie je nutno zvažovat individuálně.
Algoritmy kardiostimulátorů v prevenci síňových tachyarytmií
U sick sinus syndromu s paroxyzmálními FiS je indikována fyziologická kardiostimulace, tedy AAI(R) či DDD(R) s omezením komorové stimulace na minimum, jak bylo uvedeno výše. Programováním prodlouženého AV delay u pacientů bez poruchy AV převodu vyššího stupně můžeme usnadnit spontánní AV převod, čímž omezíme nepotřebnou komorovou stimulaci. Dnes je možné využití nových typů kardiostimulátorů Medtronic s funkcí Managed Ventricular Pacing (MVP), která minimalizuje komorovou a upřednostňuje síňovou stimulaci AAI,R. Jen v případě, že není aktivita v komorovém kanále, přepíná se na režim DDD(R).
Dále má většina 2dutinových kardiostimulátorů funkci AMS/AMC (automatic mode switching/ či mode conversion), která umožňuje změnu stimulačního režimu na VVI či DDI při detekci síňové tachyarytmie. Zajišťuje stabilní komorovou frekvenci při nepravidelné a rychlé frekvenci při běžící FiS, dále zajišťuje zpětný návrat k fyziologické stimulaci při ukončení arytmie.
Nové specifické algoritmy detekce síňových arytmií a preventivní síňové stimulace dále vedou k potlačení vzniku paroxyzmů síňových tachyarytmií. Z holterovských monitorací EKG se ukázalo, že vzniku FiS často předchází zvýšená síňová ektopická aktivita či bradyarytmie. Efekt uvedené léčby je možné ověřit opět holterovskými funkcemi přístroje, které evidují počet, trvání a výskyt atak arytmie během dne. Toto může lékaři pomoci k upravení antiarytmické medikace a také v rozhodování o nutnosti podání antikoagulační terapie. Prevence paroxyzmů i redukce délky paroxyzmů síňových tachyarytmií vede ke zlepšení hemodynamiky, ke snížení rizika tromboembolie a k celkovému zlepšení kvality života. U moderních přístrojů mohou být preventivní algoritmy doplněny o algoritmy terapeutické. Princip spočívá ve snaze o maximální síňovou stimulaci, která redukuje supraventrikulární ektomii, dále ve snaze o eliminaci pauz následujících po ektopických stazích a ovlivňujících i refrakterní dobu - tedy ve snaze ovlivnit mechanizmy, které jsou zřejmě odpovědné za vznik paroxyzmů síňových tachyarytmií. Tyto algoritmy mohou být založeny na spouštění přestimulování (overdriving), které se snaží ukončit paroxyzmus FiS již při jejím spuštění. Vedle toho existuje ještě tzv. kontinuální přestimulování (overdriving), které se snaží upravit aktivaci síní za pomoci dynamického overdrivingu síní. Tyto algoritmy jsou v současné době nejvíce propracovány v pacemakerech firmy Vitatron (např. PM Vitatron, serie T).
Spouštěné (triggered) algoritmy k prevenci FiS:
- odpověď PM po skončení zátěže (post excercise response): limituje rychlý pokles frekvence po ukončení zátěže
- suprese síňových extrasystol (PAC supression): redukuje vznik předčasných síňových stahů zrychlením stimulační frekvence po detekci opakovaných síňových předčasných stahů, většinou dochází k zvýšení stimulační frekvence o cca 5 min-1. Zvyšování frekvence stimulace trvá, dokud nedojde k vymizení předčasných síňových stahů či se frekvence nezvýší o 25 min-1 vyšší vzhledem k frekvenci výchozí. Tato akcelerace zůstává v plató dalších 24 cyklů, poté dochází k návratu k výchozí stimulační frekvenci, resp. sinusovému rytmu (obr. 3).
- odpověď PM na extrasystolu, resp. postextrasystolickou pauzu - post PAC Response: slouží k prevenci dlouhých postextrasystolických pauz vydáním stimulu v intervalu odpovídajícím předchozí srdeční frekvenci (obr. 4)
- odpověď PM na skončení FiS - post AF response: prevence recidivy paroxyzmu FiS po skončení předchozího paroxyzmu FiS zvýšením stimulační frekvence
- kontinuální algoritmy stimulace k prevenci FiS - pace conditioning standart: slouží k zajištění dynamické adaptace síňové stimulace na frekvenci vyšší než je spontánní sinusový rytmus. To většinou spočívá ve stimulaci se základním intervalem o 50 ms kratším než byl vnímaný sinusový stah. Tím dojde k potlačení síňových extrasystol. Po akceleračním plató v trvání po sobě následujících 16 cyklů tento režim postupně opět snižuje frekvenci až zachytí vlastní sinusový stah. Algoritmus umožňuje adaptaci na zátěž i na jiná kolísání sinusového rytmu.
Image 3. Potlačení síňových extrasystol. (převzato z http://www.vitatron.com) 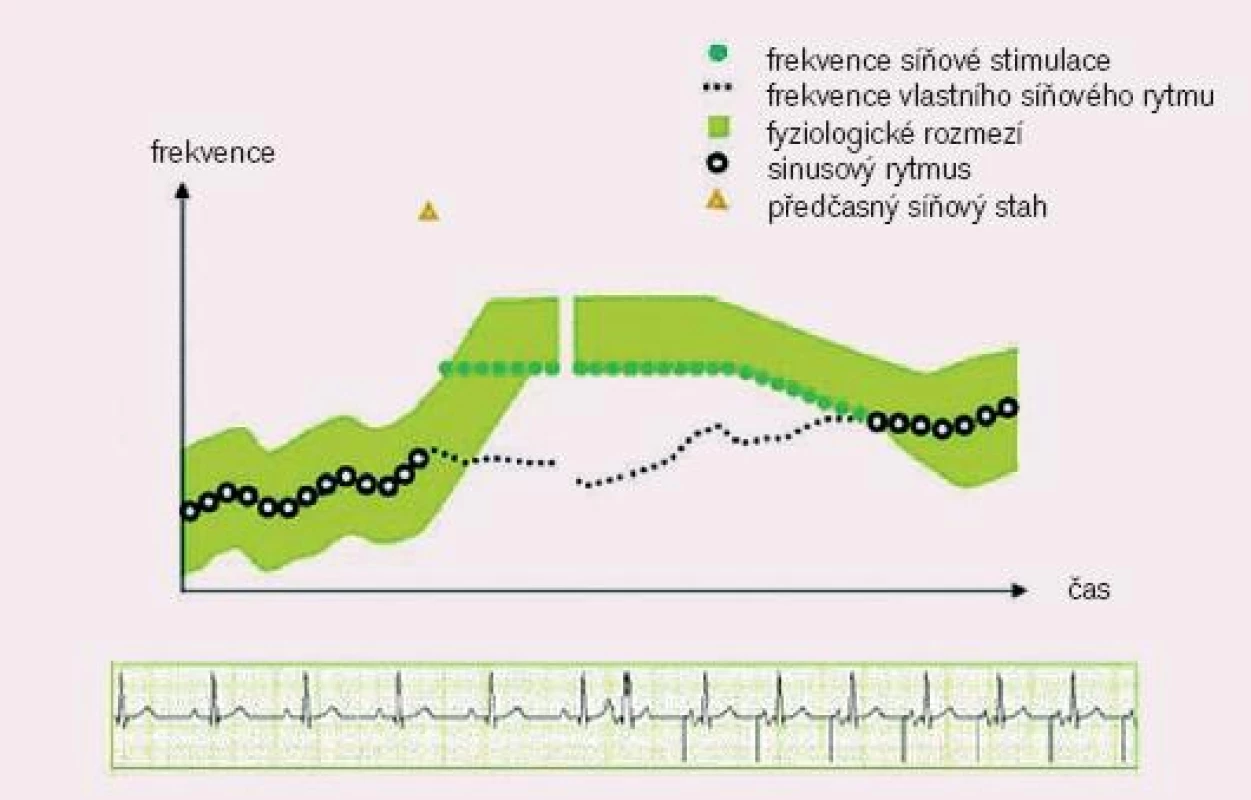
Image 4. Odpověď PM na extrasystolu. (převzato z http://www.vitatron.com) 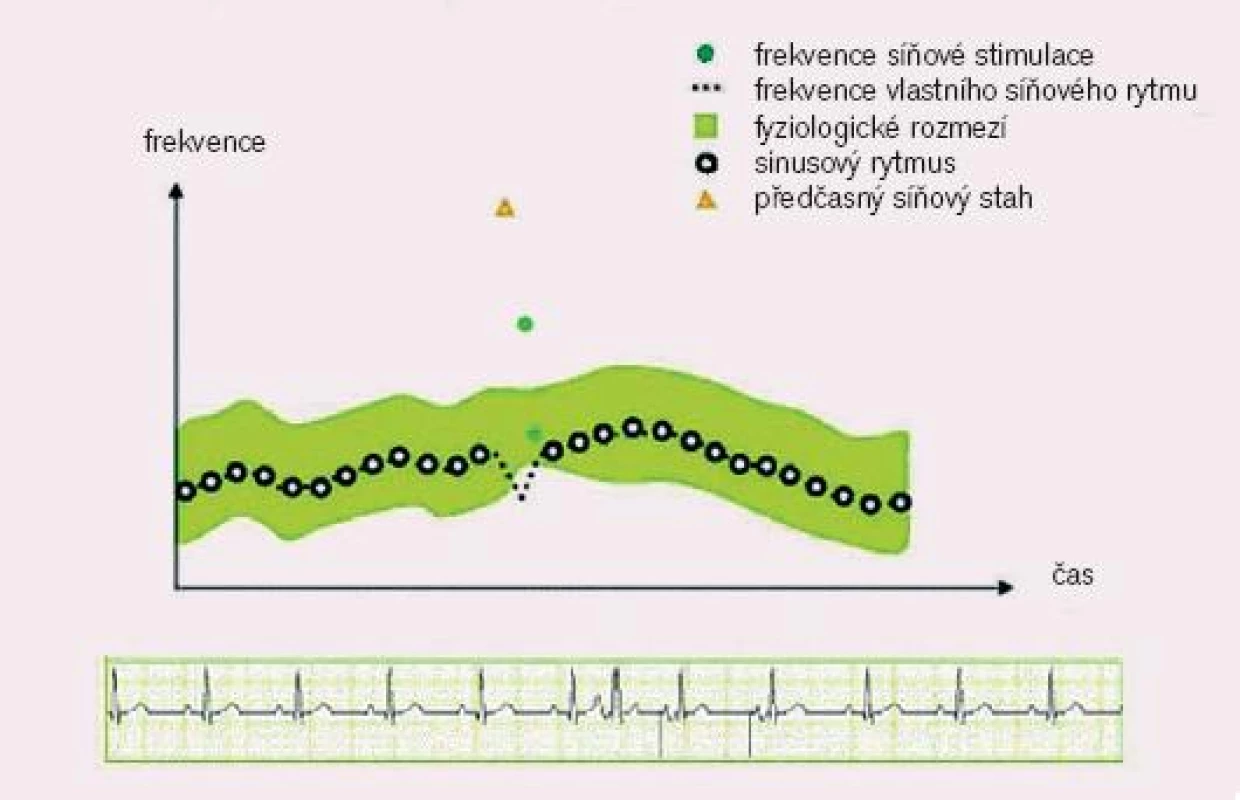
Image 5. Odpověď PM po skončení fibrilace síní. (převzato z htttp://www.vitatron.com) 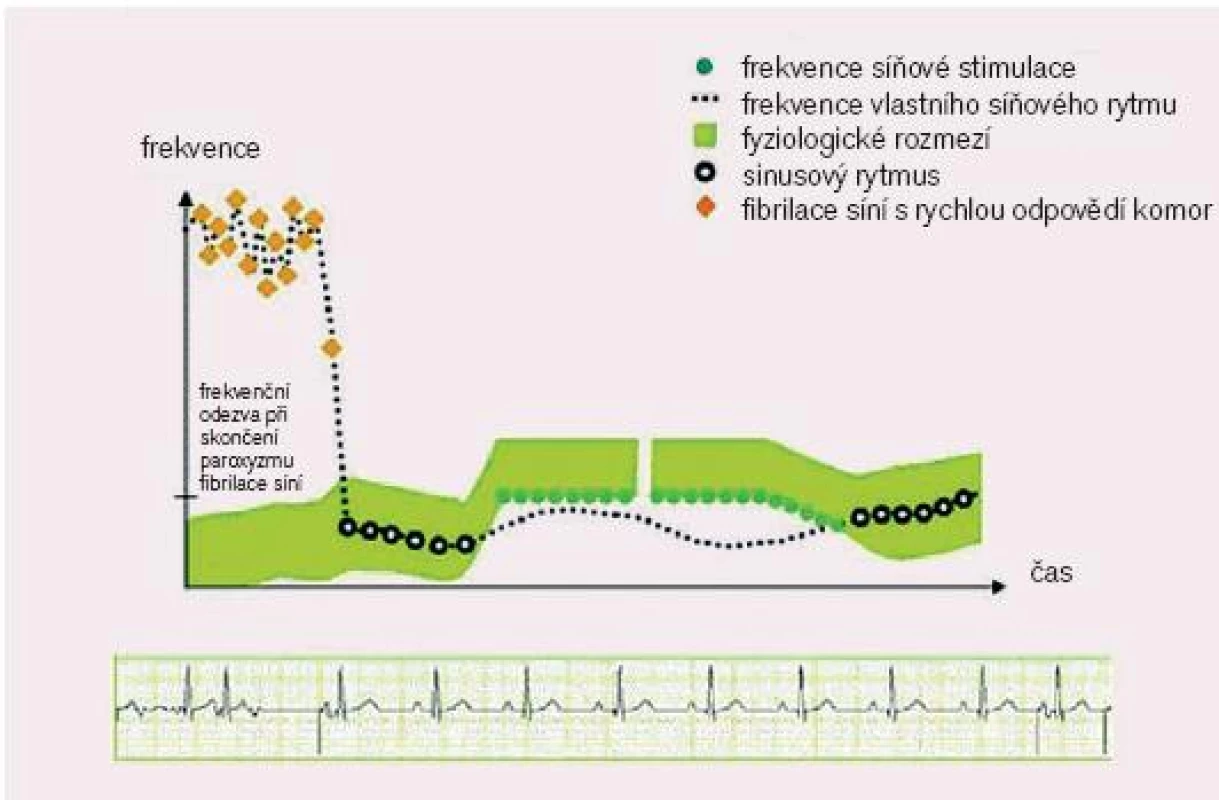
Existuje několik studií, které se zabývaly efektem těchto preventivních algoritmů v praxi, jedná se např. o studie ADOPT, AF Therapy, ATTEST, AWARE.
Studie ADOPT (The Atrial Dynamic Overdrive Pacing Trial) se zabývala účinností preventivního režimu (AF Suppresion Algorithm, St. Jude Medical), který byl vyvinut k zajištění dostatečně vysokého procenta síňové stimulace s ohledem na normální denní variabilitu srdečního rytmu. V této studii byla prokázána redukce paroxyzmů FiS až o 25 % [21].
Ablace AV junkce u pacientů s fibrilací síní
Radiofrekvenční ablace (RFA) síňokomorové junkce je indikována u pacientů, u kterých ani kombinovaná léčba antiarytmiky zpomalujícími AV převod nevede k dostatečné kontrole komorové frekvence. V dnešní době ji používáme až po vyčerpání jiných možností farmakologické i nefarmakologické léčby. Vzhledem k rychlému rozvoji kurativních výkonů, zejména RFA FiS izolací plicních žil i u chronických FiS, je RFA AV uzlu v dnešní době považována za paliativní zákrok. Tuto metodu používáme v praxi jen u pacientů výrazně symptomatických, spíše starších, zejména se závažnými komorbiditami.
U paroxyzmálních FiS a u mladších pacientů bez strukturálního onemocnění srdce je ablace AV uzlu nepřípustná.
Poměrně jednoduchá metoda spočívá v katetrizační RFA AV uzlu, kdy je pravostrannou katetrizací, nejlépe cestou vena femoralis, zaveden ablační katétr do oblasti AV uzlu, při optimálních potenciálech z Hisova svazku se provede ablace, čímž dojde k nastolení atrioventrikulární blokády III.stupně. Jedná se o nejjednodušší ablaci, její úspěšnost je prakticky 100%. Někdy je obtížné najít optimální pozice katétru, zvláště u pacientů s výrazně dilatovanou a remodelovanou pravou síní.
Další možností je modifikace AV vedení při průkazu duálního vedení AV uzlu. Spočívá v modifikací inferiorních vstupů do AV uzlu; implantace kardiostimulátoru není vždy nutná, ale efekt je cca 70% a riziko pozdního vzniku AVB III. stupně s následnou implantací trvalého kardiostimulátoru zůstává vysoké [22-24].
Po ablaci, resp. před plánovanou ablací AV uzlu je implantován komorový kardiostimulátor s adaptabilní frekvencí na zátěž VVI(R).
Jednou z výhod ablace AV uzlu s implantací kardiostimulátoru je zlepšení kvality života pacienta a zamezení či úprava tachykardické kardiomyopatie; nevýhodou je celoživotní závislost pacienta na trvalé kardiostimulaci a nevratnost arteficiálně navozené atrioventrikulární blokády. Další nevýhodou je, že výkon neléčí vlastní arytmii, síně dále fibrilují, riziko tromboembolických komplikací trvá a je nutná trvalá antikoagulační terapie.
V publikovaných studiích nebylo potvrzeno zlepšení hemodynamiky ani delší přežívání u nemocných po ablaci AV uzlu [25-29].
Ablace AV uzlu může být výhodná u pacientů se srdečním selháním ve spojení s biventrikulární stimulací. U těch bylo prokázáno zlepšení symptomů i současné zlepšení hemodynamických parametrů (viz níže).
Pozitivem stavu po ablaci AV uzlu s následnou trvalou kardiostimulací zůstává zmírnění symptomů, především potlačení až vymizení palpitací. Pacienti přestanou vnímat nepravidelnost rytmu, je zmírněna dušnost a redukována často zatěžující medikace (obr. 6).
Image 6. Pozice ablačního katétru při radiofrekvenční ablaci síňokomorové junkce. 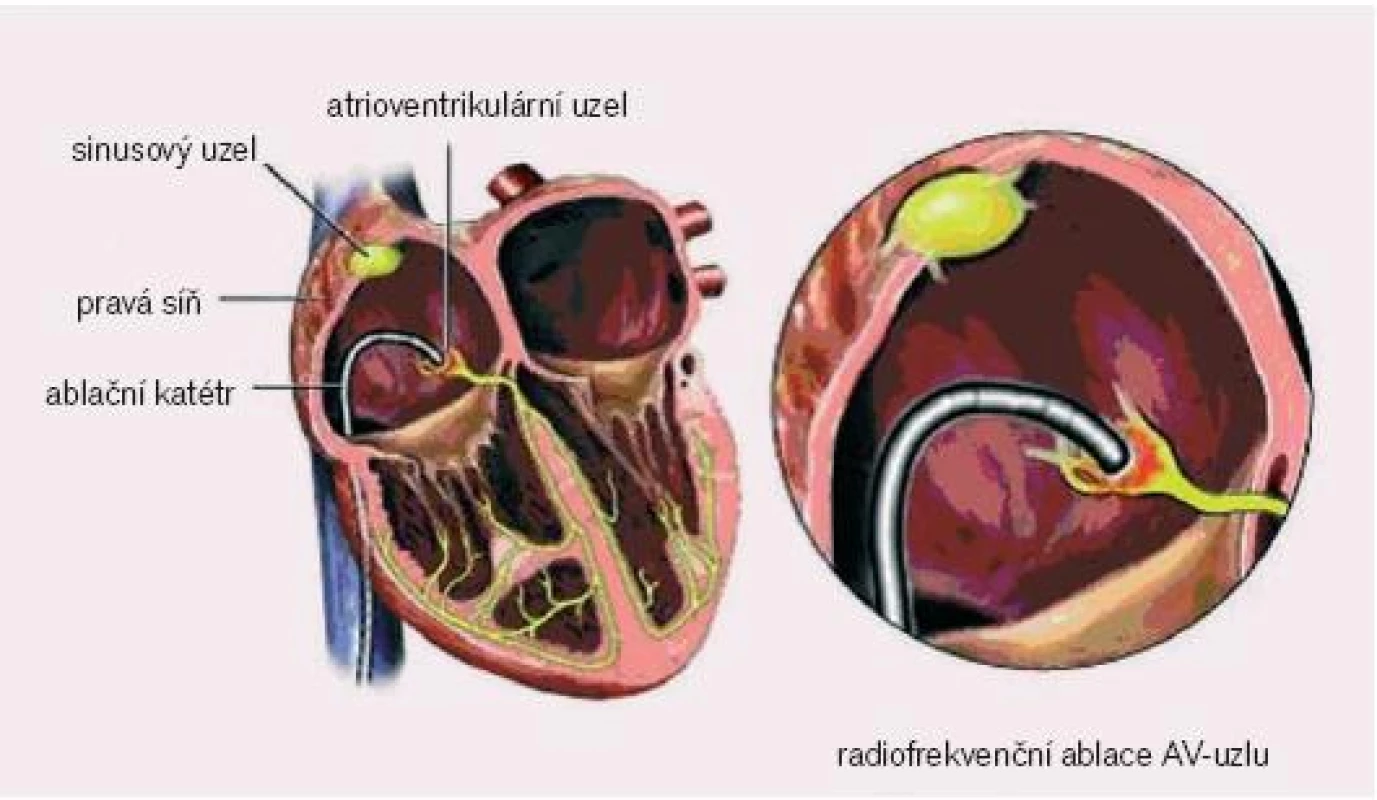
Biventrikulární stimulace u pacientů se srdečním selháním a s fibrilací síní
FiS je velmi častou arytmií vyskytující se u srdečního selhání, je spojena s vyšší mortalitou i morbiditou. Z hlediska hemodynamiky je – zvláště u srdečního selhání – důležité udržet sinusový rytmus. Po vyčerpání standardních možností je jednou z možností léčby srdečního selhání srdeční resynchronizační terapie (cardiac resynchronisation therapy - CRT).
U pacientů s FiS po implantaci kardiostimulátoru v režimu VVI(R) při stimulaci z pravé komory dochází k rozšíření komplexu QRS jako při nativní blokádě levého Tawarova raménka, která vede ke zhoršení systolické i diastolické funkce levé komory. Biventrikulární stimulace tyto parametry naopak zlepšuje, dochází k odstranění interventrikulárního i intraventrikulárního zpoždění, synchronizaci kontrakce, stimulovaný rytmus bývá provázen výrazným zúžením komplexu QRS.
Možností volby je buď upgrade na biventrikulární stimulaci u pacientů po implantaci kardiostimulátoru VVI(R), pokud dojde k progresi srdečního selhání; při nedostatečné kontrole frekvence komor je indikována i ablace atrioventrikulárního uzlu.
Biventrikulární stimulátor lze implantovat primárně u pacientů, kteří splňují indikační kritéria.
Indikace k zavedení CRT je:
- pacient ve funkční třídě NYHA II až III minimálně po dobu 6 měsíců, resp. NYHA IV (u nemocných s ischemickou i neischemickou kardiomyopatií)
- těžká systolická dysfunkce levé komory (EF LK pod 35 %)
- šířka QRS nad 150 ms, u QRS 120-150 ms s echokardiograficky prokázanou komorovou dyssynchronií.
U pacienta se sinusovým rytmem či s paroxyzmální formou FiS se zavádí systém se 3 elektrodami - pravosíňovou, pravokomorovou (dnes častěji do oblasti midsepta než do hrotu PK) a levokomorovou zavedenou do posteriorní, posterolaterální či laterální větve koronárního sinu (resp. do žíly segmentu s největším zpožděním).
U perzistující či permanentní FiS je zavedení síňové elektrody otázkou, ke spontánní konverzi na sinusový rytmus dochází výjimečně, ve studiích bylo prokázáno zmenšení rozměru levé síně po delší době CRT; ani po elektrické kardioverzi často nedojde k udržení sinusového rytmu. Výhodou zavedené síňové elektrody může být možnost vnímání v síňovém kanále s rozlišením supraventrikulárních a komorových tachyarytmií u biventrikulárních ICD (obr. 7).
Image 7. Zavedení elektrod při implantaci biventrikulárního kardiostimulátoru. 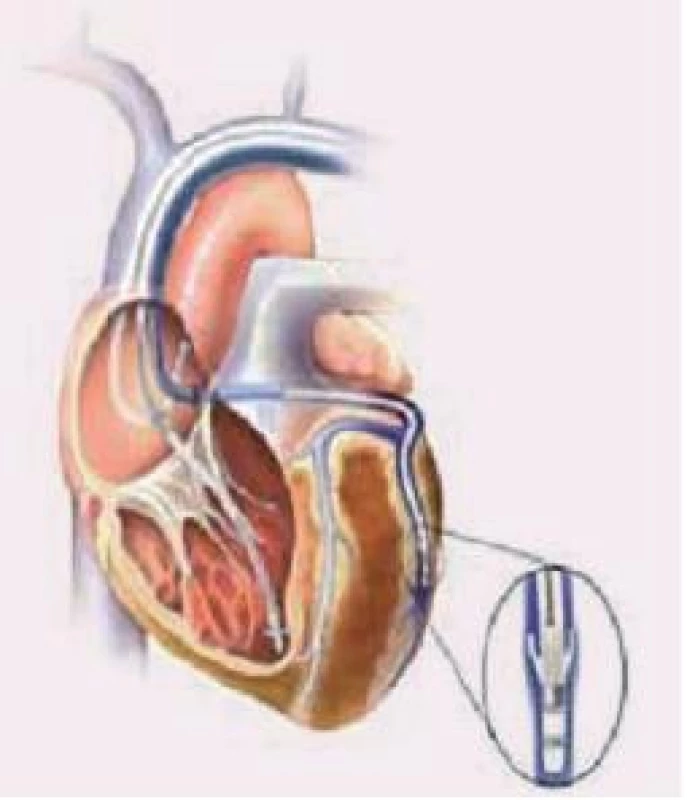
Jak u sinusového rytmu, tak u pacientů s FiS s CRT bylo prokázáno jednoznačné zlepšení hemodynamických parametrů, tedy ejekční frakce, zmenšení enddiastolického rozměru levé komory se současným zlepšením ve třídě NYHA, zlepšení kvality života, zátěžových testů při spiroergometrii, testu chůze atd. U pacientů s FiS bylo více nonrespondérů CRT než u pacientů se sinusovým rytmem. Snížení mortality u pacientů se srdečním selháním a FiS po implantaci biventrikulárního kardiostimulátoru zatím ve studiích prokázáno nebylo, pokud pacientům nebyl implantován biventrikulární ICD [30-36].
Závěr
Léčba FiS síní vyžaduje komplexní přístup. U každého pacienta je třeba individuálně rozhodnout o léčbě farmakologické (antiarytmika, antikoagulancia), léčbě nefarmakologické (RFA, ablace AV uzlu) či kombinované, hybridní. Implantace kardiostimulátoru většinou není metodou první volby - je nutné vždy zvážit přínos implantace kardiostimulátoru i jeho možné komplikace. Implantace kardiostimulátoru není metodou kurativní, ale u pacientů s dysfunkcí sinusového uzlu a paroxyzmy síňových tachykardií může omezit častost paroxyzmů FiS. Pokud je trvalá kardiostimulace indikována, je většinou nutná hybridní terapie, tedy implantace kardiostimulátoru se současným podáním antiarytmik či v kombinaci s RFA. U pacientů s FiS splňujících kritéria pro resychronizační terapii by měl být zaveden biventrikulární kardiostimulátor.
Doručeno do redakce 18. 8. 2006
Přijato k otištění po recenzi 15. 11. 2006
MUDr. Kateřina Buchtová
I. interní kardioangiologická klinika
LF MU a FN U sv. Anny, Brno
katerina.buchtova@fnusa.cz
Sources
1.Čihák R, Heinz P. Guidelines pro léčbu fibrilace síní - Česká kardiologická společnost 2004. Cor Vasa 2004; 46 : 67-77.
2.ACC/AHA/ESC Guidelines for the Management of Patients With Atrial Fibrillation: Executive Summary. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines and Policy Conferences (Committee to Develop Guidelines for the Management of Patients With Atrial Fibrillation) Developed in Collaboration With the North American Society of Pacing and Electrophysiology. Circulation. 2001; 104(17): 2118-2150.
3.Fiala M. Doporučené postupy pro diagnostiku a léčbu supraventrikulárních arytmií. Cor Vasa 2005; 47(Suppl 9): 18-69.
4.Táborský M, členové výboru PS AKS ČKS. Zásady pro implantace kardiostimulátorů a implantabilních kardioverterů-defibrilátorů pracovní skupiny Arytmie a trvalá kardiostimulace České kardiologické společnosti. Cor Vasa 2005; 47 : 59-68.
5.Gregoratos G, Abrams J, Epstein AE et al. ACC/AHA/NASPE Guidelines for implantation of cardiac pacemakers and antiarrhythmia devices Summary Article. Circulation 2002; 106 : 2145-2161.
6.Andersen HR, Nielsen JC, Thomsen PE et al. Long-term follow-up of patients from a randomized trial of atrial versus ventricular pacing for sick sinus syndrome. Lancet 1997; 350 : 1210-1216.
7.Skanes AC, Krahn AD, Yee R et al for the CTOPP investigators. Progression to chronic atrial fibrillation after pacing: the Canadian trial of physiologic pacing. J Am Cardiol 2001; 38 : 167-172.
8.Fleischmann KE, Orav EJ, Lamas GA et al. Pacemaker implantation and quality of life in the Mode Selection Trial (MOST). Heart Rhythm 2006; 3(6): 653-659.
9.Novák M, Kamarýt P, Dvořák I jr et al. Is the atrial pacemaker a reliable solution in the treatment of patients with the sick sinus syndrome? Cor Vasa 2002; 44(12): 509-512.
10.Anselme F, Saoudi N, Cribier A et al. Pacing for prevention of atrial fibrillation: the PIPAF studies. J Intervent Cardiac Electrophysiol 2000; 4 : 177-184.
11.Táborský M, Neužil P, Šedivá L, Niederle P. Trvalá kardiostimulace v prevenci vzniku a udržení fibrilace síní. Kardiol Rev 2002; 2 : 135-140 .
12.Blanc JJ et al. Atrial pacing for prevention of atrial fibrillation: accessement of simultanneously implement algorithms. Europace 2004; 6(5): 371-379.
13.Masumoto H et al. Long-term clinical performance of AAI pacing in patients with sick sinus syndrome: a comparison with dual-chamber pacing. Europace 2004; 6(5): 444-450.
14.Israel C. The role of pacing mode in the development of atrial fibrillation. Europace 2006; 8(2): 89-95.
15.Levy T, Walker S, Rochelle J et al. Evaluation of biatrial pacing, right atrial pacing, and no pacing in patients with drug refractory atrial fibrillation. Am J Cardiol 1999; 84 : 426-429.
16.Becker R, Klinkott R, Bauer A et al. Multisite pacing for prevention of atrial tachyarrhythmias: potential mechanismus. J Am Coll Cardiol 2000; 35(7): 1939-1946.
17.Bailin SJ, Adler S, Guidici M. Prevention of chronic atrial fibrillation by pacing in the region of Bachmann ´s bundle: results of a multicenter randomized trial. J Cardiovasc Electrophysiol 2001; 12 : 912-917.
18.Frohlig G, Gras D, Victor J, Mabo P et al. Use of new cardiac pacing mode designed to eliminate unnecessary ventricular pacing. Europace 2006; 8(2): 96-101.
19.Hemels M, Wiesfeld A et al. Right atrial overdrive pacing for prevention of symptomatic refractory atrial fibrillation. Europace 2006; 8 : 107-112.
20.Fitts SM, Hill MR, Mehra R et al. Design and implementation of the Dual Site Atrial Pacing to Prevent Atrial Fibrillation (DAPPAF) clinical trial. DAPPAF Phase 1 Investigators. Interv Card Electrophysiol 1998; 2(2): 139-144.
21.Carlson M et al. A New pacemaker algorithm for the treatement of atrial fibrillation, results of the atrial dynamic overdrive pacing trial ( ADOPT). J Am Coll Cardiol 2003; 42(4): 627-633.
22.Feld GK, Fleck RP, Fijimura O et al. Control of rapid ventricular response by radiofrequency catheter modification of the atrioventricular node in patients with medically refractory atrial fibrillation. Circulation 1994; 90 : 2299-2307.
23.Williamson BD et al. Radiofrequency catheter modification of the atrioventricular conduction to control ventricular rate during atrial fibrillation. N Engl Med 1994; 331 : 910-917.
24.Procleemer A, Della BP, Tondo C et al. Radiofrequency ablation of atrioventricular junction and pacemaker implantation versus modulation of atrioventricular conduction in drug refractory atrial fibrillation. Am J Cardiol 1999; 83 : 1437-1442.
25.Táborský M, Neužil P. Neselektivní ablace AV uzlu - nové aspekty v době kurativní léčby fibrilace síní a srdeční resynchronizační terapie. Kardiol Rev 2006; 8(Suppl): 10-12.
26.Fiala M. Kontrola frekvence komor při fibrilaci síní. Kardiol Rev 2002; 2 : 120-124.
27.Kay GN, Ellenboen KA et al. The ablate and pace trial. A prospective study of catheter ablation of the AV conduction system and permanent pacemaker implantation for treatement of atrial fibrillation. J Intervent Cardiac Electrophysiol 1998; 2 : 121-135.
28.Geelen P, Goethals M, de Bruyere B et al. A prospective hemodynamic evaluation of patients with chronic atrial fibrillation undergoing radiofrequency catheter ablation of the atrioventricular junction. Am J Cardiol 1997; 80 : 1606-1609.
29.Oszan C, Jaganhir A, Friedman PA et al. Long term survival after ablation of the atrioventricular node and implantation of the permanent pacemaker in patients with atrial fibrillation. N Engl J Med 2001; 344 : 1043-1051.
30.Crijns HJCG, Tjeerdsma G et al. Prognostic value of presence and development of atrial fibrillation in patients with with advanced chronic heart failure. Eur Heart J 2000; 21(15): 1238-1245.
31.Valls-Bertault V et al. Assessment of upgrading to biventricular pacing in patients with right ventricular pacing and congestive heart failure after atrioventricular junctional ablation for chronic atrial fibrillation. Europace 2004; 6 : 438-443.
32.Leclerc C, Walker S, Linde C et al. Comparative effect of permanent biventricular and right-univentricular pacing in heart failure patients with chronic atrial fibrillation. Eur Heart J 2002; 23 : 1780-1787.
33.Sweeney MO, Hellkamp AS et al. Adverse effect of ventricular pacing on heart failure and a atrial fibrillation among patients with normal baseline QRS duration in a clinical trail of pacemaker therapy for sinus node dysfunction. Circulation 2003; 107(23): 2932-2937.
34.Kies P, Leclerc C, Bleeker GB, Crocg C et al. Cardiac resynchronization therapy in chronic atrial fibrillation: impact on left atrial size and reversal to sinus rhythm. Heart 2006; 92(4): 490-494.
35.Molhoek SG, Bax JJ, Bleeker GB et al. Comparison of response to cardiac resynchronization therapy in patients with sinus rhythm versus chronic atrial fibrillation. Am J Cardiology 2004; 94(12): 1506-1509.
36.Leon RL, Greenberg JM et al. Cardiac resynchronization in patients with congestive heart failure and chronic atrial fibrillation. J Am Cardiol 2002; 6 : 438-443.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2007 Issue 1
Most read in this issue- Kardiostimulace u fibrilace síní
- Infarkt pravé komory
- Výhody fixní kombinační léčby
- Je možné perforaci pravé srdeční komory při implantaci ICD řešit konzervativně? Kazuistika.
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

