Diabetic Kidney Disease 3rd stage – laboratory markers of mineral bone disorder
Authors:
Adriana Klimentová; Ivana Ságová; Dana Prídavková; Daniela Kantárová; Pavol Makovický; Jurina Sadloňová; Marián Mokáň
Authors‘ workplace:
I. interná klinika Jesseniovej LF UK a UN Martin, Slovenská republika
Published in:
Vnitř Lék 2016; 62(6): 442-448
Category:
Original Contributions
Overview
Úvod:
Diabetes mellitus predstavuje najčastejšiu príčinu terminálneho štádia obličkových ochorení vo vyspelých krajinách. Chronické ochorenie obličiek a minerálovo kostné abnormality (chronic kidney disease – mineral and bone disorder – CKD-MBD) sa rozvíjajú s progresiou zhoršovania renálnych funkcií. Pre hemodialyzovaných diabetikov je typický nízky kostný obrat, vysoká prevalencia závažných a progredujúcich cievnych kalcifikácií s rastúcou kardiovaskulárnou morbiditou a mortalitou. Hlavným faktorom pôsobiacim pri tvorbe vaskulárnych kalcifikácií u pacientov s diabetickým ochorením obličiek (diabetic kidney disease – DKD) je zlá glykemická kontrola. Výsledky nedávnych štúdií popisujú vzájomný inverzný vzťah medzi sérovými hladinami intaktného parathormónu (iPTH) a metabolickou kompenzáciou v skupine dialyzovaných diabetikov.
Cieľ:
Cieľom predkladaného projektu bolo zhodnotiť rozdiel medzi laboratórnymi markermi MBD v skupine pacientov s DKD 3. štádia v závislosti od glykemickej kompenzácie. Zamerali sme sa na vzťah medzi metabolickou kompenzáciou diabetu (glykozylovaný hemoglobín – HbA1c) a sérovou hladinou iPTH.
Pacienti a metodika:
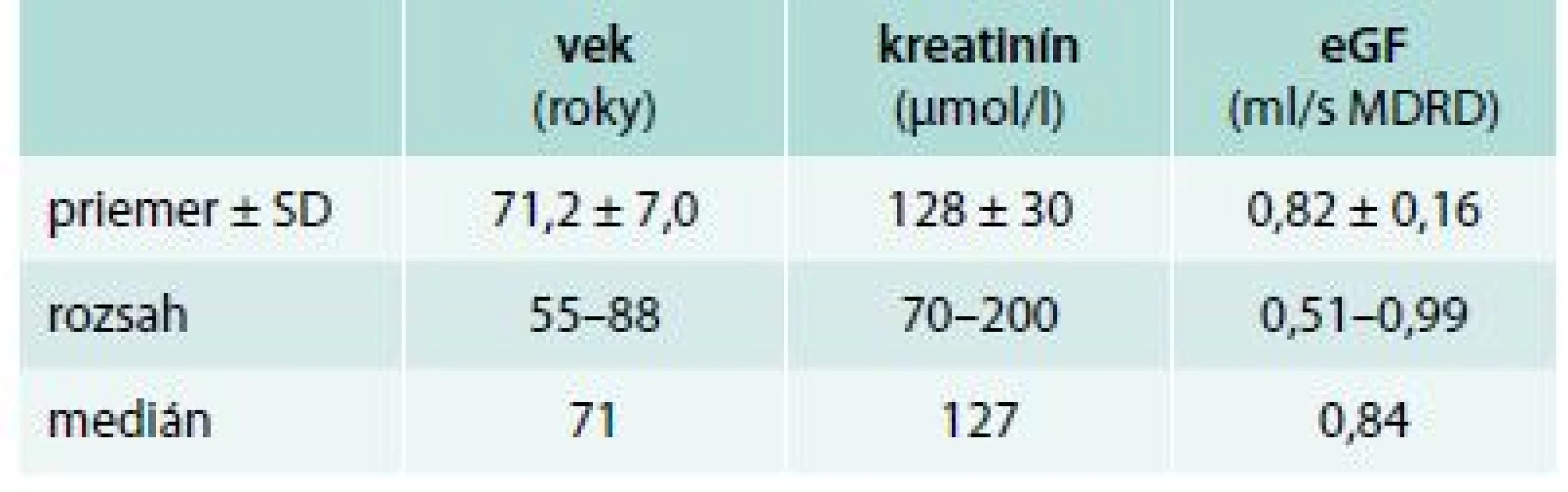
Celkovo sme vyšetrili 91 pacientov s DKD 3. štádia. Vyšetrovaný súbor tvorí 46 žien (50,5 %) a 45 mužov (49,5 %) s vekovým priemerom 71,2 ± 7,0 rokov, s priemernou hodnotou kreatinínu 128 ± 30 μmol/l a priemernou odhadovanou glomerulovou filtráciou (eGF, MDRD) 0,82 ± 0,16 ml/s. 60 pacientov malo lepšie glykemicky kompenzovaný diabetes (HbA1c < 7 %) vs 29 pacientov s nedostatočne kontrolovaným ochorením (HbA1c > 7 %). Porovnali sme markery MBD v oboch skupinách. Našich pacientov sme v ďalšom sledovaní rozdelili do 2 skupín podľa sérovej hladiny iPTH (iPTH < 35 pg/ml vs iPTH > 35 pg/ml) a porovnali sme získané výsledky laboratórnych MBD markerov. Jednotlivé premenné a ich vzájomné vzťahy boli spracované štatisticky Mannov-Whitneyov testom.
Výsledky:
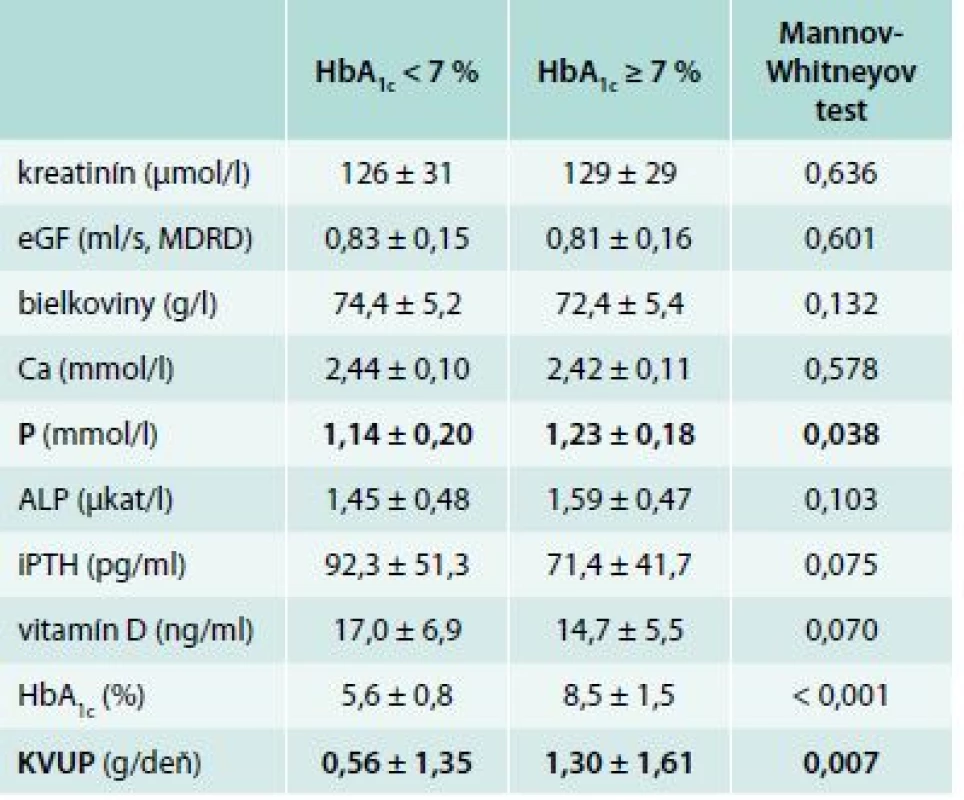
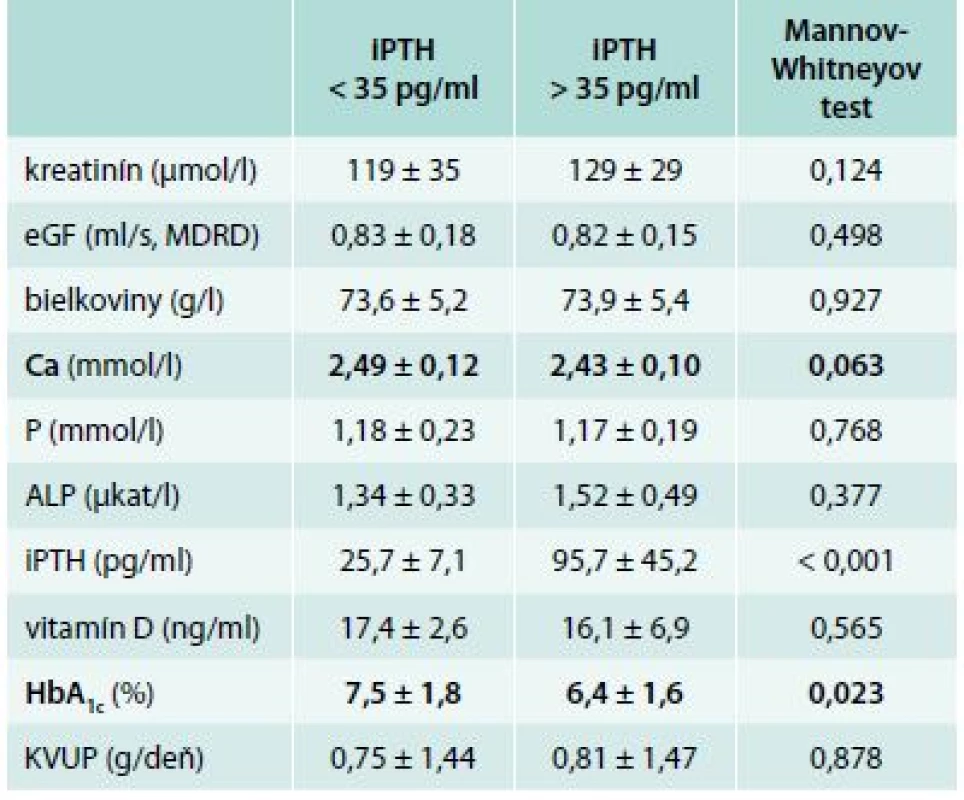
Zistili sme štatisticky významné rozdiely v sérovej hladine fosforu a proteinúrie medzi skupinami diabetikov s HbA1c < 7 %) vs diabetici s HbA1c > 7 %. Diabetici 2. typu, ktorí boli lepšie glykemicky kompenzovaní, mali štatisticky významne nižšiu hladinu sérového fosforu (1,14 ± 0,20 vs 1,23 ± 0,18 mmol/l, p = 0,038) a nižšiu 24hodinovú proteinúriu (0,56 ± 1,35 vs 1,30 ± 1,61 g/deň, p = 0,007). V skupine s predpokladaným nízkym kostným obratom (iPTH < 35 pg/ml) sme zachytili trend k vyššej hodnote sérového vápnika (2,49 ± 0,12 vs 2,43 ± 0,10 mmol/l, p = 0,063) a vyššej hodnote HbA1c (7,5 ± 1,8 vs 6,4 ± 1,0 %, p = 0,023).
Záver:
Naše výsledky poukazujú na užší vzťah medzi glykemickou kompenzáciou diabetu a minerálovo-kostným abnormalitami už v skorších štádiách CKD.
Kľúčové slová:
diabetes mellitus 2. typu (DM2T) – chronické ochorenie obličiek (chronic kidney disease – CKD) – minerálovo kostné abnormality (mineral and bone disorder – MBD)
Úvod
S poklesom renálnych funkcií v priebehu vývoja chronického ochorenia obličiek dochádza k systémovej poruche minerálového a kostného metabolizmu s funkčným a morfologickým dopadom na celý organizmus [1]. Porucha fosfokalciového metabolizmu bola v minulosti vnímaná hlavne vo vzťahu ku skeletu. Postupom času sa uhol pohľadu rozšíril a do popredia vystúpila súvislosť medzi minerálovo-kostným metabolizmom a kardiovaskulárnymi komplikáciami [2]. Zdôraznenie prepojenia minerálovo-kostných abnormalít a kardiovaskulárneho systému (KVS) vyústilo do vzniku nového termínu chronické ochorenie obličiek – minerálové a kostné abnormality (chronic kidney disease – mineral and bone disorder, CKD-MBD) [3]. V roku 2003 vznikla nadnárodná iniciatíva v nefrológii KDIGO (Kidney Disease – Improving Global Outcome), ktorá v roku 2009 vydáva odporúčané postupy pre diagnostiku a liečbu CKD-MBD. Spektrum porúch zahŕňa 3 komponenty: laboratórnu, kostnú a cievnu. Pre dennú klinickú prax je dôležitá dostupnosť laboratórnych markerov MBD: sérová koncentrácia vápnika (Ca), fosforu (P), PTH, alkalická fosfatáza (ALP) a vitamín D – 25(OH) D. Jedným zo základných ukazovateľov minerálového a kostného metabolizmu je hladina intaktného parathormónu (iPTH). Jeho hladinu, aj s ostatnými markermi, je odporúčané pravidelne monitorovať a vyhodnocovať u pacientov od CKD 3. štádia s prihliadnutím k dynamike zmien v čase, s následnou aktualizáciou individuálnej terapie [4–6].
Diabetická nefropatia (DN) predstavuje jednu z najzávažnejších neskorých orgánových mikroangiopatických komplikácií diabetu. V súčasnosti sa ako vhodnejší preferuje klinický termín diabetické ochorenie obličiek (Diabetic Kidney Disease – DKD) [7–9], reprezentujúci klinický syndróm, ktorý vzniká na podklade špecifických morfologických a funkčných zmien obličiek u pacientov s diabetes mellitus. Najčastejšou príčinou terminálneho štádia chronického renálneho ochorenia (end stage kidney disease – ESKD) vo vyspelých krajinách je práve diabetické ochorenie obličiek. Terapia diabetikov je sprevádzaná väčším počtom komplikácií a je zaťažená vyššou morbiditou aj mortalitou [10].
Minerálové a kostné abnormality majú u pacientov s DKD svoje špecifiká. Súčasné poznatky naznačujú, že základným mechanizmom minerálových a kostných zmien diabetikov je porucha funkcie osteoblastov s poklesom novotvorby kostí a kostného obratu. Pravdepodobná je aj spoluúčasť tzv. funkčnej hypoparatyreózy, pri dekompenzácii ochorenia aj negatívna kalciová bilancia a zvýšená kostná resorpcia, deficit vitamínu D, vplyv neskorých produktov glykácie v súčinnosti so špecifickými a nešpecifickými komplikáciami diabetu [11,12]. Najviac literárnych údajov k problematike DKD-MBD máme k dispozícií z preddialyzačných a dialyzačných súborov pacientov v ESKD. Pre túto skupinu pacientov je charakteristický nízky kostný obrat (väčšinou ide o adynamickú kostnú chorobu – AKCH), vyššie riziko vzniku fraktúr, vyšší výskyt extraoseálnych kalcifikácií s negatívnym dopadom na KVS s následným zvýšením celkovej morbidity a mortality [13–16].
V našej práci sme sa zamerali na pacientov s diabetickým ochorením obličiek 3. štádia s cieľom porovnať laboratórne markery MBD v závislosti od glykemickej kompenzácie (HbA1c).
Súbor a metodika
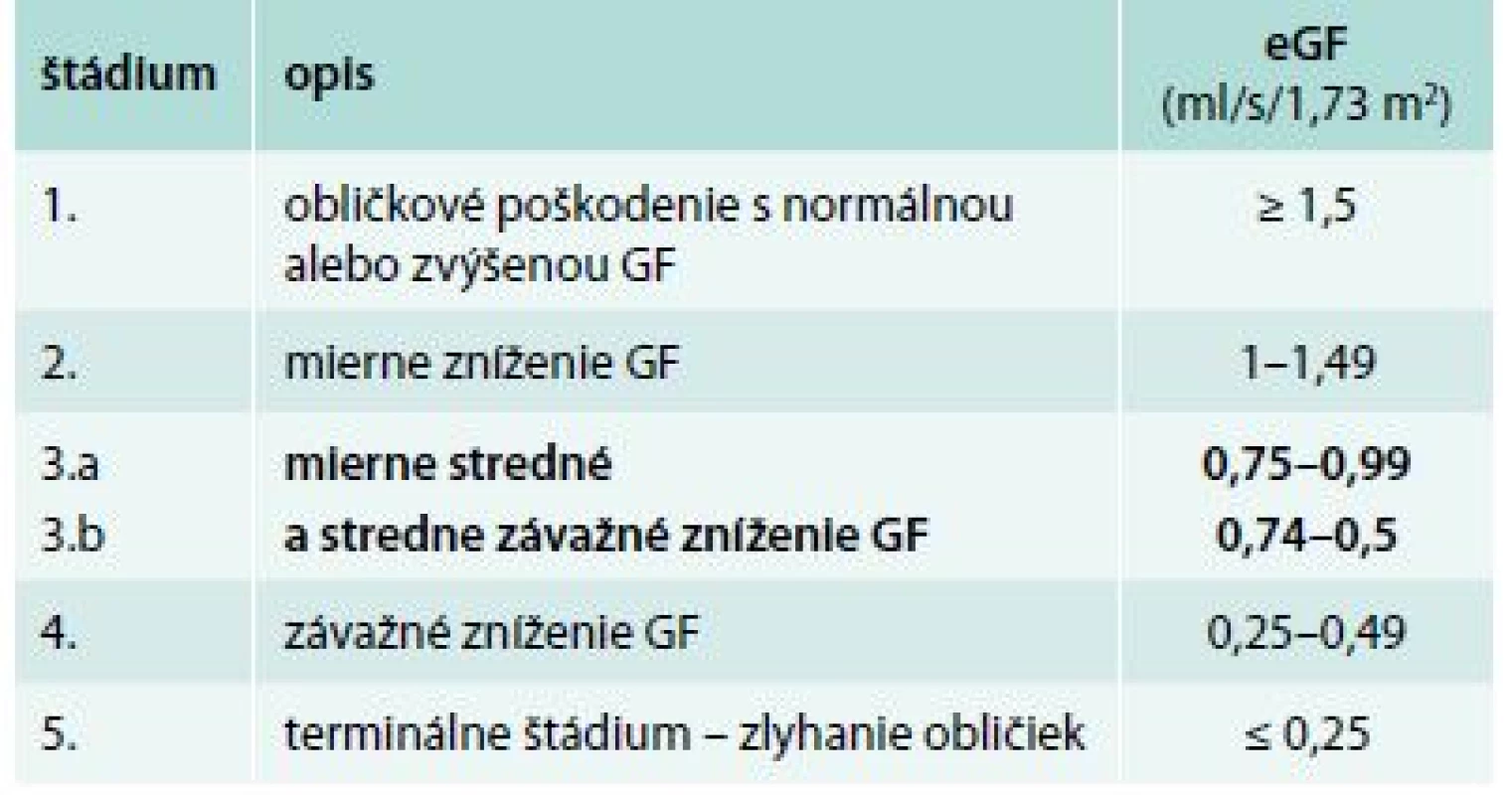
91 pacientom s diabetes mellitus 2. typu s DKD 3. štádia sme v zimnom období vyšetrili sérum a stanovili sme hladinu kreatinínu, celkové bielkoviny, sérový Ca, P, ALP, iPTH, vitamín D – 25(OH)D a HbA1c. Pacienti súčasne zozbierali 24hodinový moč, ktorý sme vyšetrili na prítomnosť proteinúrie (kvantitatívna proteinúria – KVUP). Glykozylovaný hemoglobín sme stanovili na základe chromatografickej separácie HbA1c, štandardizovane podľa NGSP/IFCC (National Glycohemoglobin Standardization Program/International Federation of Clinical Chemistry and Laboratory Medicine). Hodnoty HbA1c sú uvedené v % IFCC. Pri posudzovaní glykemickej kompenzácie diabetikov sa riadime podľa referenčného rozmedzia IFCC: kompenzácia diabetu výborná pre hodnotu HbA1c do 4,8 %, uspokojivá v rozmedzí HbA1c 4,8–5,3 %. Stanovenie koncentrácie iPTH bolo realizované chemiluminiscenčným imunoanalytickým stanovením využívajúcim paramagnetických častíc pre kvantitatívne určenie hladiny intaktného iPTH v ľudskom sére. Referenčné rozmedzie je 12–88 pg/ml (1,3–9,3 pmol/l). Do súboru neboli zaradení pacienti, ktorí v čase odberu užívali preparáty ovplyvňujúce sledované laboratórne parametre MBD (vitamín D, aktívny vitamín D a jeho analógy, kalcimimetiká a kalciové preparáty), odbery boli realizované v zimných mesiacoch s cieľom minimalizácie vplyvu slnečného žiarenia na hladinu vitamínu D. Do súboru neboli zaradení pacienti, ktorí mali anémiu stredne ťažkého a ťažkého stupňa. Veľkosť odhadovanej glomerulovej filtrácie (eGF) sme vypočítali podľa MDRD vzorca. Hladina eGF podľa jednotlivých štádií CKD (KDIGO 2012) je znázornená v tab. 1.
Vyšetrovaný súbor tvorí 46 žien (50,5 %) a 45 mužov (49,5 %) od 55 do 88 rokov, s vekovým priemerom 71,2 ± 7,0 rokov, s priemernou hodnotou kreatinínu 128 ± 30 μmol/l, tomu zodpovedajúcou priemernou odhadovanou glomerulovou filtráciou (MDRD) 0,82 ± 0,16 ml/s. Zloženie súboru je znázornené v tab. 2.
Získané výsledky sme rozdelili do skupín podľa hodnoty sledovaného parametra s koreláciou k postulovanému klinickému výstupu. Sledované kvantitatívne premenné sú uvedené pomocou priemeru, štandardnej odchýlky (SD), prípadne minimálnej a maximálnej hodnoty a mediánu. Rozdiely medzi skupinami pacientov boli testované neparametrickým Mannov-Whitneyov testom (vzhľadom na menší počet pacientov v niektorých podskupinách). Za štatistický významnú považujeme hladinu významnosti p < 0,05.
Výsledky
Glykemická kompenzácia
Analogicky k pacientom v ESKD sme sa zamerali na vzťah medzi glykemickou kompenzáciou a vyšetrovanými premennými. V tejto časti sme pacientov rozdelili na 2 skupiny: 60 diabetikov 2. typu s glykozylovaným hemoglobínom pod 7 % (HbA1c < 7 %) a 29 diabetikov s nedostatočne glykemicky kompenzovaným ochorením (HbA1c > 7 %). Po porovnaní výsledkov sme zistili 2 štatisticky významné rozdiely. Diabetici 2. typu, ktorí boli lepšie metabolicky kompenzovaní, mali nižšiu hladinu sérového fosforu (1,14 ± 0,20 vs 1,23 ± 0,18 mmol/l, p = 0,038) a nižšiu 24hodinovú proteinúriu (0,56 ± 1,35 vs 1,30 ± 1,61 g/deň, p = 0,007), ktorá však nebola vo fyziologickom pásme. V ostatných vyšetrovaných premenných neboli zachytené štatisticky významné zmeny. Hodnoty sledovaných parametrov a ich vzťah ku glykemickej kompenzácii zobrazuje tab. 3 a graf 1.

Kostný obrat (nepriamo odhadovaný podľa hladiny sérového iPTH)
Nepriamym ukazovateľom kostného obratu u pacientov s CKD je iPTH. Súbor našich pacientov sme rozdelili na skupinu s iPTH < 35 pg/ml a na skupinu s iPTH > 35 pg/ml. Po porovnaní vyšetrovaných premenných sme zistili 2 štatisticky významné rozdiely. V skupine 13 pacientov s predpokladaným nízkym kostným obratom (iPTH < 35 pg/ml) sme zachytili trend k vyššej hodnote sérového vápnika (2,49 ± 0,12 vs 2,43 ± 0,10 mmol/l, p = 0,063) a vyššej hodnote HbA1c (7,5 ± 1,8 vs 6,4 ± 1,6 %, p = 0,023) resp. horšej glykemickej kompenzácii v porovnaní so skupinou 76 pacientov s hodnotou iPTH > 35 pg/ml. Výsledky sú znázornené v tab. 4, tab. 5 a v grafe 2.

Kardiovaskulárne riziko
V odbornej literatúre je spájaná vyššia hodnota sérového fosforu (P > 1,13 mmol/l) u pacientov s CKD s vyšším kardiovaskulárnym rizikom [17]. Pacientov v našom súbore sme rozdelili do 2 skupín podľa hladiny sérového fosforu (P > 1,13 vs P < 1,13 mmol/l). Po porovnaní a štatistickom zhodnotení jednotlivých vyšetrovaných premenných sme nezachytili žiadny signifikantne významný rozdiel medzi skupinami.
Diskusia
O minerálových a kostných abnormalitách v populácii pacientov s DKD 3. štádia existuje v literatúre len limitované množstvo štúdií, zväčša s malým počtom pacientov. Pre diabetika v terminálnom štádiu renálneho ochorenia je charakteristický suprimovaný kostný obrat zo zníženej sekrécie parathormónu a dysfunkcia osteoblastov [18,19]. Z in vitro štúdií na tkanivových kultúrach prištítných teliesok vyplýva, že vysoká koncentrácia glukózy a nízka hladina inzulínu znižujú sekréciu parathormónu, spoluúčasť sa pripisuje aj negatívnemu vplyvu neskorých produktov glykácie. Klinické dôsledky nízkeho kostného obratu v terminálnom štádiu zahŕňajú algický kostný syndróm, vyššie riziko fraktúr, najmä však vyšší výskyt extraoseálnych (najmä kardiovaskulárnych) kalcifikácií [20–24]. Keďže najviac informácií o problematike DKD-MBD máme k dispozícii zo súborov pacientov v ESKD, naším predmetom záujmu sa stali pacienti s DKD 3. štádia, kde podobné analýzy chýbajú.
Analogicky k prácam s dialyzovanými diabetikmi, v ktorých bol analyzovaný vzťah medzi glykemickou kompenzáciou a laboratórnymi markermi kostného metabolizmu, sme skúmali identický vzťah na pacientoch s DKD 3. štádia. Pacienti boli rozdelení do 2 skupín podľa hodnoty glykozylovaného hemoglobínu, pričom hladina HbA1c bola zvolená na základe literárnych zdrojov analogicky k dialyzovanej populácii diabetikov [10,24,25].
Cut off pre HbA1c pre náš súbor pacientov sme stanovili na vyššiu hodnotu, pretože ide o starších pacientov, s chronickým ochorením obličiek s diabetom s vyšším kardiovaskulárnym rizikom v porovnaní s bežnou populáciou pacientov bez diabetu a CKD. Keďže sme vychádzali z prác, ktoré analyzovali dialyzovaných diabetikov, hodnota optimálneho HbA1c pre túto skupinu pacientov bola nastavená na vyššie hodnoty (v literatúre popisovaná vyššia mortalita dialyzovaných diabetikov pri hodnotách HbA1c < 6 % a > 8 %). Preto sa odporúča v tejto špecifickej skupine pacientov stanoviť „optimálnu hodnotu“ HbA1c % v rozmedzí 6–8 % (v niektorých odporúčaniach 7–9 %) [26,27].
Naše výsledky potvrdili, že 60 diabetikov 2. typu s HbA1c < 7 % malo nižšiu hladinu sérového fosforu 1,14 ± 0,20 mmol/l (p = 0,038) a nižšiu 24hodinovú proteinúriu 0,56 ± 1,35 g/deň (p = 0,007) oproti pacientom s nedostatočnou glykemickou kompenzáciou. 29 pacientov s neadekvátnou glykemickou kompenzáciou diabetu (HbA1c ≥ 7 %) malo hladinu sérového fosforu signifikantne vyššiu 1,23 ± 0,18 mmol/l oproti kontrole. 24hodinový moč bol zozbieraný v 27 prípadoch zle kompenzovaných diabetikov s nálezom štatisticky významne vyššej proteinúrie 1,30 ± 1,61 d/deň oproti glykemicky kompenzovanejšej skupine. Prehľadné údaje sú znázornené v tab. 3 a v grafe 1.
Kestenbaum et al v roku 2005 publikovali retrospektívnu populačnú štúdiu, realizovanú na veľkom súbore 3 490 amerických veteránov, v ktorej poukázali na zvýšenú mortalitu pacientov s CKD v závislosti na sérovej koncentrácii fosforu. Autori v práci zistili, že zvýšenie sérovej koncentrácie fosforu o 0,323 mmol/l zvýši riziko úmrtia o 23 %, pričom zvýšenie mortality sa preukázalo aj vo fyziologickom rozmedzí koncentrácie sérového fosforu. Štatisticky významný vzostup mortality bol zaznamenaný pre hladinu fosforu > 1,13 mmol/l [17]. Nálezy hladín sérového fosforu u našich pacientov s DKD 3. štádia boli vyššie ako 1,13 mmol/l v oboch skupinách (1,14 ± 0,20 vs 1,23 ± 0,18 mmol/l). Na základe zistenej sérovej hladiny fosforu (analogicky k výsledkom z vyššie popísanej štúdie) predpokladáme, že sú pacienti s DKD 3. štádia v našom súbore nositeľmi vyššieho kardiovaskulárneho rizika, pričom skupina s horšou glykemickou kompenzáciou má riziko kardiovaskulárnej mortality vyššie. Vo vzťahu ku 24hodinovým hodnotám proteinúrie sa potvrdil trend, ktorý je popisovaný i v nedávno publikovanom prehľade a metaanalýze, v ktorých lepšia glykemická kontrola redukuje výskyt mikroalbuminúrie a makroalbuminúrie v populácii CKD pacientov s diabetom 2. typu [26,28].
Výsledný priemer hodnôt iPTH v skupine 60 lepšie glykemicky kompenzovaných pacientov bol 92,3 ± 51,3 vs 71,4 ± 41,7 pg/ml v skupine nedostatočne kompenzovaných diabetikov (29 pacientov). Nález nebol štatisticky významný s hodnotou p = 0,075. Nález odlišných hladín iPTH v závislosti od glykemickej kompenzácie potvrdzuje trend, ktorý koreluje s literárnymi údajmi týkajúcimi sa diabetikov v pokročilých a terminálnych štádiách renálneho ochorenia [25] a tiež so závermi rezultujúcimi z in vitro štúdií. Aj v našej práci potvrdzujeme fakt, že nedostatočná glykemická kontrola je asociovaná s redukovanou hladinou sérového iPTH a lepšia glykemická kompenzácia koreluje s vyššou sérovou hladinou iPTH. Z práce Murakamiho et al vyplýva nutnosť adekvátnej glykemickej kompenzácie, ako nástroja prevencie nízkeho kostného obratu, taktiež redukcie morbidity a mortality v teréne DKD-MBD [29,30].
Ďalšiu analýzu nášho súboru sme zrealizovali po rozdelení pacientov na skupinu s predpokladaným nízkym kostným obratom s iPTH < 35 pg/ml vs skupina s iPTH > 35 pg/ml.
Cut off pre iPTH bol stanovený podľa KDOQI odporúčaní (Kidney Disease Outcomes Quality Initiative), z ktorých vychádza aj stále platné Odborné usmernenie Ministerstva zdravotníctva Slovenskej republiky na liečbu porúch minerálového a kostného metabolizmu u pacientov s chronickým ochorením obličiek z 18. 6. 2009. V tomto odporúčaní je pre každé štádium CKD stanovené rozmedzie sérového fosforu, vápnika aj iPTH (pre iPTH u pacientov v CKD 3. štádia je dané ako cieľové rozmedzie medzi 35–70 pg/ml, analogicky k tomuto údaju sme hodnotu iPTH pod 35 pg/ml považovali za nízku) [32].
Po porovnaní vyšetrovaných markerov sme zistili 2 významnejšie rozdiely. V skupine s iPTH < 35 pg/ml sme zachytili vyššiu sérovú hodnotu vápnika a vyššiu hodnotu HbA1c. U pacientov s CKD môžeme nájsť znížené, fyziologické, tak i zvýšené koncentrácie kalcia v závislosti na poškodení funkcie obličiek a na MBD [32]. Hodnoty sérového vápnika boli v oboch našich súboroch vo fyziologickom pásme, ale v skupine s iPTH < 35 pg/ml bola sérová hladina vyššia, i keď len na hranici štatistickej významnosti (2,49 ± 0,12 vs 2,43 ± 0,10 mmol/l, p = 0,063). Výsledky naznačujú, že nižší kostný obrat koreluje s vyššou hladinou sérového kalcia, aj keď v rámci fyziologického rozmedzia.
Normálne nálezy koncentrácie sérového kalcia aj fosforu až do poklesu glomerulovej filtrácie pod 0,67 ml/s potvrdila štúdia Levina et al na 1 814 neselektovaných, neliečených pacientoch s CKD s vekovým priemerom totožným s našim súborom (71,1 roka) a 48% zastúpením diabetikov [33].
V skupine pacientov s predpokladaným nízkym kostným obratom s iPTH < 35 pg/ml sme tiež zachytili štatisticky vyššiu hodnotu HbA1c (7,5 ± 1,8 vs 6,4 ± 1,6 %, p = 0,023), čo sme nepotvrdili pri nastavení hranice pre HbA1c na hodnotu 7 %. Vzťah medzi nedostatočnou glykemickou kontrolou a zníženou hladinou parathormónu bol opakovane potvrdený v štúdiách na pacientoch s ESKD (citované v diskusii vyššie). Limitom pre nami zistené nálezy zostáva malý počet pacientov s iPTH < 35 pg/ml, ktorý pozostáva z 13 probandov.
V našom súbore je celkovo zahrnutý malý počet pacientov, čo limituje interpretáciu a validitu výsledkov. Súčasne ide o široký záber v CKD 3. štádia. Podľa poslednej úpravy aktuálnej KDIGO klasifikácie je 3. štádium CKD rozdelené na 2 podskupiny podľa hodnôt glomerulovej filtrácie (tab. 1). V novej klasifikácii sa tiež zohľadňuje prítomnosť a závažnosť proteinúrie ako rizikového faktora progresie renálneho ochorenia [34]. Pacienti v nami analyzovanom súbore zodpovedali úrovňou glomerulovej filtrácie skôr k 3a štádiu CKD podľa klasifikácie KDIGO. Odlišnosť CKD 3a od 3b s ohľadom na minerálové abnormality dokladuje aj Levinova štúdia, v ktorej boli zaznamenané normálne nálezy koncentrácie sérového kalcia aj fosforu až do poklesu glomerulovej filtrácie pod 0,67 ml/s. K limitom nášho súboru patrí aj vyšší vek pacientov (71,2 ± 7,0), keďže vyšší vek je posudzovaný ako samostatný rizikový faktor vo vzťahu k vývoju minerálovo kostných abnormalít s nízkou hladinou iPTH [35].
Záver
Záverom by sme zhrnuli výsledky našej analýzy. Pacienti s DKD 3. štádia, ktorí boli lepšie glykemicky kompenzovaní (HbA1c < 7 %), mali nižšiu hladinu sérového fosforu (1,14 ± 0,20 vs 1,23 ± 0,18 mmol/l, p = 0,038) a nižšiu 24hodinovú proteinúriu (0,56 ± 1,35 vs 1,30 ± 1,61 g/deň, p = 0,007). V skupine pacientov s predpokladaným nízkym kostným obratom (iPTH < 35 pg/ml) sme zachytili trend k vyššej hodnote sérového vápnika (2,49 ± 0,12 vs 2,43 ± 0,10 mmol/l, p = 0,063) a sklon k horšej glykemickej kompenzácii (HbA1c 7,5 ± 1,8 vs 6,4 ± 1,6 %, p = 0,023). Z nálezov vyplýva potreba zlepšenia glykemickej kompenzácie pacientov s DKD 3. štádia ako nástroj prevencie vývoja MBD s nízkym kostným obratom a tiež ako nástroj prevencie nárastu kardiovaskulárnej morbidity a mortality. V našej práci sme sa zamerali na 3. štádium DKD, pretože práve v týchto štádiách majú preventívne opatrenia – glykemická kompenzácia (ako aj korekcia hypertenzie) najväčší význam vzhľadom k zastaveniu ev. spomaleniu progresie samotného renálneho ochorenia. U pacientov s DKD 3. štádia by mali byť odporúčané markery kostného metabolizmu (KDIGO) pravidelne vyšetrované a vyhodnocované s dôrazom vývoja zmien v čase, na čo by mala nadväzovať individuálna liečba so sledovaním spätnej laboratórnej a klinickej odozvy [4–8,31,34].
MUDr. Adriana Klimentová
adamorava@hotmail.com
I. interná klinika Jesseniovej LF UK a UN Martin, Slovenská republika
www.unm.sk
Doručeno do redakce 18. 1. 2016
Přijato po recenzi 25. 4. 2016
Sources
1. Dusilová Sulková S, Opatrná S, Ryšavá R et al. KDIGO doporučení pro diagnostiku a léčbu CKD-MBD: komentovaný návod pro klinickou praxi. Aktuality v nefrologii 2010; 16(4): 113–126.
2. Dusilová Sulková S. Renální osteopatie. Maxdorf: Praha 2007: 20 -21. ISBN 978–80–7345–119–6.
3. Moe SM, Druek T, Cunningham J et al. Definition, evaluation and classification of renal osteodystrophy: a position statement from Kidney Disease: Improving Global Outcomes. Kidney Int 2006; 69(11): 1945–1953.
4. Dusilová Sulková S. Co prinášejí nová KDIGO doporučení zamĕřená na CKD-MBD? 1. část. Aktuality v nefrologii 2009; 15(4): 159–165.
5. KDIGO Clinical Practice Guideline for the diagnosis, evaluation, prevention and treatment of chronic kidney disease – mineral bone disorder (CKD-MBD). Kidney Int Suppl 2009; (113): S1-S130.
6. Sotorník I, Kutílek Š et al. Kostní minerály a skelet pri chronickém onemocnení ledvin. Galén: Praha 2011: 103–106. ISBN 978–80–7262–769–1.
7. Bouček P, Kvapil M, Monhart V et al. Doporučené postupy při diabetickém onemocnění ledvin. Aktuality v nefrologii 2012;18,(1):18–26.
8. Okša A, Spústová V. Nefropatia pri diabetes mellitus – skríning, prevencia a liečba v spolupráci diabetológa a nefrológa. Diabetes a Obezita 2007; 7(Suppl): 6–13.
9. Alicic RZ, Tuttle KR. Management of the diabetic patient with advanced chronic kidney disease. Semin Dial 2010; 23(2): 140–147.
10. Tuttle KR, Bakris GL, Bilous RW et al. Diabetic Kidney Disease: A Report From an ADA Consensus Conference. Diabetes Care 2014; 37(10): 2864–2883.
11. Sotorník I, Kutílek Š et al. Kostní minerály a skelet pri chronickém onemocnení ledvin. Galén: Praha 2011: 337–349. ISBN 978–80–7262–769–1.
12. Sun YM, Su Y, Li J et al. Recent advances in understanding the biochemical and molecular mechanism of diabetic nephropaty. Biochem Biophys Res Commun 2013; 433(4): 359–361.
13. Inaba M. Chronic kidney disease (CKD) and bone. Impact of diabetes mellitus on the development of CKD-MBD. Clin Calcium 2009; 19(4): 502–507.
14. Inaba M, Okuno S, Nagasue K et al. Impaired secretion of parathyroid hormone is coherent to diabetic hemodialyzed patients. Am J Kidney Dis 2001; 38(4 Suppl. 1): S139-S142.
15. Nasri H, Kheiri S. Effect of diabetes mellitus, age, and duration of dialysis on parathormone in chronic hemodialysis patients. Saudi J Kidney Dis Transpl 2008; 19(4): 608–613.
16. Dusilová Sulková S. Renální osteopatie. Maxdorf: Praha 2007. ISBN 978–80–7345–119–6.
17. Kestenbaum B, Sampson JN, Rudser KD et al. Serum Phosphate Levels and Mortality Risk among People with Chronic Kidney Disease. J Am Soc Nephrol 2005; 16(2): 520–528.
18. Sotorník I, Kutílek Š et al. Kostní minerály a skelet pri chronickém onemocnení ledvin. Galén: Praha 2011: 344–345. ISBN 978–80–7262–769–1.
19. Spasovski GB, Bervoets AR, Behets GJS et al. Spectrum of renal bone disease in end-stage renal failure patients not yet on dialysis. Nephrol Dial Transplant 2003; 18(6): 1159–1166.
20. Dusilová Sulková S. Kostní choroba u chronického selhání ledvin a její moderní terapie. Vnitř Lék 2011; 57(7–8): 620–625.
21. Inaba M Chronic kidney disease (CKD) and bone. Impact of diabetes of mellitus on the development of CKD-MBD. Clin Calcium 2009; 19(4): 502–507.
22. Žamboch K, Zahálková J, Kosatíkova Z Minerálová a kostní nemoc při chronickém onemocnění ledvin. Interní Med 2010; 12(7–8): 357–360.
23. London GM, Marchais SJ, Guérin AP et al. Association of bone activity, calcium load, aortic stiffness, and calcifications in ESRD. J Am Soc Nephrol 2008; 19(9): 1827–1835.
24. Blahoš J, Sotorník I. Změny kalcium-fosfátového metabolizmu při chronických nefropatiách. Vnitř Lék 2012; 58(7–8): 12–18.
25. Park J, Lertdumrongluk P, Molnar MZ et al. Glycemic control in diabetic dialysis patients and the burnt-out diabetes phenomenon. Curr Diab Rep 2012; 12(4): 432–439.
26. Dan S, Aditya P, Samanta M et al. Effect of glycemic control on intact parathyroid hormone level in end stage renal disease patients on maintenance hemodialysis. Diabetes Res Clin Pract 2014; 105(3): 352–355.
27. Error in Text in: Role of Intensive Glucose Control in Development of Renal End Points in Type 2 Diabetes Mellitus: Systematic Review and Meta-analysis. Arch Intern Med 2012; 172(14): 1095.
28. Rhee MC, Leung AM, Kovesdy PC et al. Updates on the Management of Diabetes in Dialysis Patients. Semin Dial 2014; 27(2): 135–145.
29. Perkovic V, Heerspink HL, Chalmers J et al. Intensive glucose control improves kidney outcomes in patients with type 2 diabetes. Kidney Int 2013; 83(3): 517–523.
30. Murakami R, Murakami S, Tsushima R et al. Glycaemic control and serum intact parathyroid hormone levels in diabetic patients on haemodialysis therapy. Nephrol Dial Transplant 2008; 23(1): 315–320.
31. Gnudi L Serum Intact Parathyroid Hormone in Diabetic Patients on Haemodialysis: What is the Treatment Goal? Nephrol Dial Transplant 2008; 23(1): 24–26.
32. Odborné usmernenie Ministerstva zdravotníctva Slovenskej republiky na liečbu porúch minerálového a kostného metabolizmu u pacientov s chronickým ochorením obličiek. Aktuality v nefrologii 2009; 15(3): 121–126.
33. Dusilová Sulková S. Renální osteopatie. Maxdorf: Praha 2007. ISBN 978–80–7345–119–6.
34. Levin A, Bakris GL, Molitch M et al. Prevalence of abnormal serum vitamin D, PTH, calcium and phosphorus in patients with chronic kidney disease: results of the study to evaluate early kidney disease. Kidney Int 2007; 71(1): 31–38.
35. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease‘. Kidney Int Suppl 2013; 3(1): 136–150.
36. Bover J, Urena P, Brandenburg V et al. Adynamic bone disease: from bone to vessels in chronic kidney disease. Semin Nephrol 2014; 34(6): 626–640.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2016 Issue 6
Most read in this issue
- Sinusová histiocytóza s masivní lymfadenopatií: FDG-PET/CT dokumentovaná parciální remise po léčbě 2-chlorodeoxyadenozinem
- Aplikační technika inzulinu u dospělých pacientů s diabetem
- Kardiomyopatie v MR obraze
- Akútne príčiny náhlych úmrtí u pacientov so závažnou hypoglykémiou
