-
Medical journals
- Career
Význam Pneumonia Severity Index u pacientů s pneumonií hospitalizovaných na jednotce intenzivní pneumologické péče
Authors: MUDr. Beáta Hutyrová, Ph.D. 1; Petr Jakubec 1; Zdena Šindelářová 1; Jana Šubová 1; Kateřina Langová 2; Vítězslav Kolek 1
Authors‘ workplace: Klinika plicních nemocí a tuberkulózy LF UP a FN Olomouc, přednosta prof. MUDr. Vítězslav Kolek, DrSc. 1; Ústav lékařské biofyziky LF UP Olomouc, přednostka prof. RNDr. Hana Kolářová, CSc. 2
Published in: Vnitř Lék 2015; 61(1): 15-23
Category: Original Contributions
Overview
Úvod:
Cílem studie bylo hodnocení významu Pneumonia Severity Index (PSI) pro predikci 30denní mortality pacientů s komunitní pneumonií (CAP) hospitalizovaných na jednotce intenzivní pneumologické péče (JIP). U pacientů byly hodnoceny komorbidity, komplikace, fyzikální, laboratorní, RTG a mikrobiologické nálezy a jejich vztah k prognóze nemocných.Pacienti a metody:
Do studie bylo zařazeno 197 pacientů hospitalizovaných pro CAP na JIP Kliniky plicních nemocí a TBC LF UP a FN Olomouc v letech 2008–2012. U všech pacientů byla hodnocena riziková kritéria dle systému PSI.Výsledky:
V celém souboru pacientů s CAP byla průměrná hodnota PSI 115,4 ± SD 30,4 bodů. Z celkového počtu 197 pacientů zemřelo 29 nemocných (14,7 %). Při srovnání skupin zemřelých a přeživších pacientů byly prokázány statisticky významné rozdíly v PSI (průměr ± SD: 137,4; 26,1 vs 111,7 ± 29,6 bodů; p < 0,0001), věku pacientů (průměr ± SD: 76,3 ± 12,9 vs 65,5 ± 14,7 let; p < 0,0001) a výskytu onemocnění srdce (86,2 % vs 67,3 %; p = 0,04) s nejvyšším podílem ICHS (58,6 % vs 38,7 %; p = 0,04). Dále při hodnocení fyzikálních a laboratorních nálezů byla prokázána u zemřelých pacientů oproti přeživším významně vyšší frekvence výskytu tachykardie nad 90/min (51,7 % vs 27,4 %; p = 0,01), tachypnoe > 30/min (37,9 % vs 13,7 %; p = 0,001) a acidózy s pH < 7,35 (27,6 % vs 8,9 %; p = 0,004). Korelační analýza neprokázala statisticky významnou závislost mezi PSI a délkou hospitalizace u přeživších pacientů. U pacientů s infekcí Staphylococcus sp. a Klebsiella pneumoniae byla zjištěna statisticky signifikantně delší doba hospitalizace. Hodnocení souvislosti ostatních sledovaných komorbidit, fyzikálních, laboratorních nálezů a patogenů s mortalitou neprokázalo významné rozdíly.Závěr:
Naše studie prokázala, že PSI je významným prediktorem 30denní mortality pacientů s CAP na JIP, ale nekoreluje s délkou hospitalizace ani s nálezem jednotlivých patogenů. Nezávislými negativními prognostickými faktory u pacientů s CAP jsou věk, výskyt nemocí srdce (zejména ICHS), tachykardie, tachypnoe a acidóza. Výskyt infekce Staphylococcus sp. a Klebsiella pneumoniae se významně podílejí na prodloužení doby hospitalizace. Všechny tyto faktory mohou upozorňovat na potřebu zvýšené péče o pacienty s CAP.Klíčová slova:
pneumonia severity index – pneumonie – skórovací systémyÚvod
Komunitní pneumonie (community-acquired pneumonia – CAP) je poměrně časté onemocnění, které představuje významný celosvětový zdravotní i ekonomický problém. V globálním měřítku jsou pneumonie 3. nejčastější příčinou mortality [1–5]. Za účelem stratifikace nemocných, odhadu mortality a závažnosti pneumonie byla vyvinuta řada skórovacích systémů, které mají význam v rozhodování o dalším managementu pacienta a doporučení způsobu léčby (ambulantní, hospitalizace na standardním lůžku nebo na JIP). Jedním z nejčastěji používaných skórovacích systémů jsou kritéria PSI (Pneumonia Severity Index) dle Fineho [6]. PSI systém Americké hrudní společnosti (American Thoracic Society – ATS) je nepropracovanějším prediktorem mortality a možných komplikací pneumonie (tab. 1). Podle počtu rizikových bodů jsou pacienti rozděleni do 5 skupin. Předpokládaná mortalita v jednotlivých skupinách dle indexu PSI je následující:
- skupina I (< 50 bodů u mužů a < 55 bodů u žen) – 0,1 %
- skupina II (< 70 bodů) – 0,6 %
- skupina III (71–90 bodů) – 2,8 %
- skupina IV (91–130 bodů) – 8,2 %
- skupina V (> 130 bodů) – 29,2 %
Table 1. Pneumonia Severity Index (PSI) [6] ![Pneumonia Severity Index (PSI) [6]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/22d2e74e4d03931f6eac84df11bcf5f5.png)
Jako těžké pneumonie jsou označeny skupiny IV a V, které jsou vzhledem k vysoké mortalitě zejména ve skupině V indikovány k hospitalizaci na JIP.
Cílem této studie bylo hodnocení významu indexu PSI pro predikci 30denní mortality pacientů s pneumonií hospitalizovaných na JIP Kliniky plicních nemocí a tuberkulózy LF UP a FN Olomouc. U pacientů byly hodnoceny komorbidity, komplikace, fyzikální, laboratorní, RTG a mikrobiologické nálezy a jejich vztah k prognóze nemocných.
Metody
Do studie bylo zařazeno 197 pacientů, kteří byli konsekutivně hospitalizováni pro komunitní pneumonii (CAP) na JIP Kliniky plicních nemocí a tuberkulózy LF UP a FN Olomouc v letech 2008–2012. U nemocných byla diagnostikována pneumonie na základě nálezu čerstvého infiltrativního zastínění na skiagramu hrudníku spolu s nejméně 2 příznaky infekce respiračního traktu (kašel, dušnost, bolest na hrudníku, horečka a poslechový nález) [2]. U všech pacientů byla hodnocena riziková kritéria dle systému Pneumonia Severity Index dle Fineho (PSI) (tab. 1) [6]. U všech pacientů byla provedena základní laboratorní vyšetření (krevní obraz s diferenciálním rozpočtem, biochemické vyšetření) a zobrazovaní metody (skiagram hrudníku, ev. CT hrudníku). K určení etiologie pneumonie byly použity mikrobiologické metody: bakteriologická, mykologická a klasická kultivace na Mycobacterium tuberculosis komplex sputa, pleurálního výpotku nebo endosekretu získaného při bronchoskopickém vyšetření, sérologické vyšetření protilátek proti Chlamydia sp., Mycoplasma pneumoniae, Legionella pneumophila, vyšetření legionellového antigenu a antigenu Streptococcus pneumoniae v moči, Bactec MGIT diagnostika (urychlená metabolická kultivace mykobakterií), průkaz Mycobacterium tuberculosis komplex a Virus influenzae A metodou polymerázové řetězové reakce (polymerase chain reaction – PCR). Použité metody byly vybrány na základě klinického průběhu, stavu pacienta a dostupnosti biologického materiálu, nebyly použity v plném rozsahu u všech pacientů. Kultivační bakteriologické vyšetření sputa bylo ve většině případů provedeno i kvantitativně. Za pravděpodobnou infekci dolních cest dýchacích jsme považovali koncentrace CFU > 107/ml. Délka hospitalizace byla počítána jako doba strávená na Klinice plicních nemocí a tuberkulózy (celkem na JIP i standardním oddělení) u přeživších pacientů, kteří nevyžadovali překlad na Kliniku anesteziologie, resuscitace a intenzivní medicíny LF UP a FN Olomouc (KARIM). U pacientů byla hodnocena 30denní mortalita.
Statistická analýza byla provedena s použitím metod deskriptivní statistiky, testů normality (Kolmogorovův-Smirnovův test, Shapirův-Wilkův test), parametrických (Studentovy t-testy) a neparametrických metod (Mannův-Whitneyův U-test), korelační analýzy (Spearmanův korelační koeficient) a Pearsonův χ2 test. Hodnoty p ≤ 0,05 byly považovány za statisticky signifikantní.
Výsledky
Anamnéza, fyzikální, laboratorní a RTG nálezy
Do souboru bylo zařazeno 197 nemocných, z toho 134 mužů (68 %) a 63 žen (32 %). Průměrný věk pacientů byl 67,1 ± SD 14,9 let (věkové rozmezí 22–97 let).
Z přidružených nemocí (tab. 2) bylo nejčastěji registrováno onemocnění srdce u 138 nemocných (70,1 %), z toho hypertenzní nemoc 113 pacientů (57,4 %), ischemická choroba srdeční 82 pacientů (41,6 %), fibrilace síní 11 pacientů (5,6 %), kardiomyopatie 1 pacient (0,5 %).
Table 2. Komorbidity pacientů s pneumonií 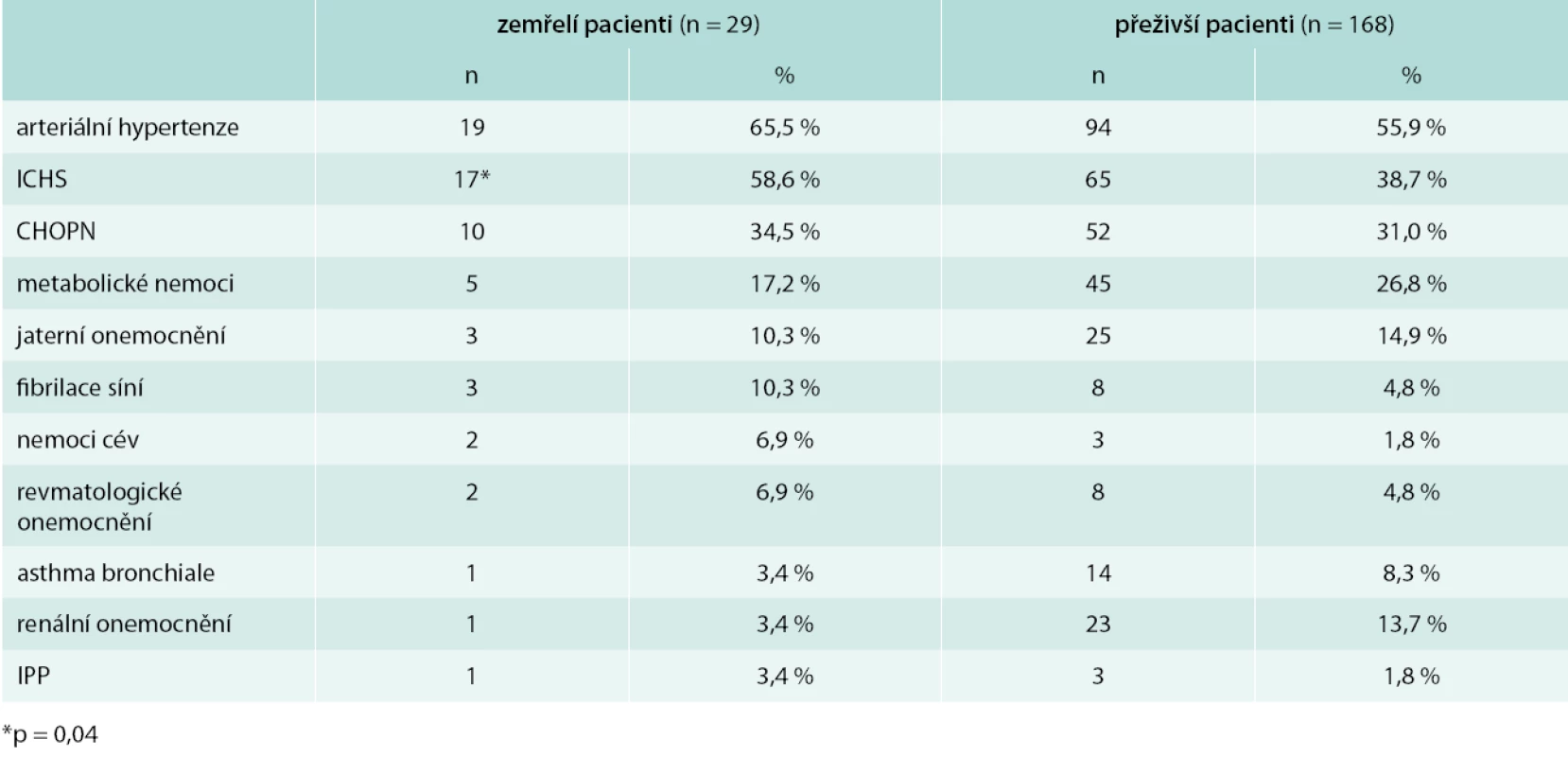
Plicní onemocnění se vyskytlo u 83 nemocných (42,1 %), z toho chronická obstrukční plicní nemoc u 62 pacientů (31,5 %), astma bronchiale u 15 pacientů (7,6 %), intersticiální plicní nemoc (IPP) u 4 pacientů (2,0 %), cystická fibróza u 1 pacienta (0,5 %), tuberkulóza anamnesticky u 2 pacientů (1 %).
Onemocnění cév bylo zjištěno u 20 pacientů (10,1 %), z toho cévní mozkové příhody – 14 pacientů (7,6 %), ischemická choroba dolních končetin – 2 pacienti (1 %), flebotrombóza – 3 pacienti (1,5 %) a embolizace do a. pulmonalis – 1 pacient (0,5 %).
Z nemocí jater, která byla přítomná u 28 pacientů (14,2 %), byla nejčastější nespecifikovaná hepatopatie – 19 nemocných (9,6 %).
Onemocnění ledvin se vyskytlo u 24 nemocných (12,2 %), z toho 17 pacientů mělo chronickou renální insuficienci (8,6 %). 50 nemocných (25,4 %) bylo dlouhodobě léčeno pro metabolické nemoci (diabetes mellitus, hyperlipidemie).
Z méně častých komorbidit se vyskytlo onemocnění kloubů u 10 pacientů (5,1 %). U 52 nemocných bylo zjištěno maligní onemocnění (26,4 %).
Ze symptomů nemocní udávali zejména dušnost – 144 pacientů (73,1 %) a kašel – 110 pacientů (55,8 %).
Z ostatních příznaků se vyskytly bolesti na hrudi u 55 pacientů (27,1 %), hemoptýza u 20 pacientů (10,2 %), alterace vědomí u 35 pacientů (17,8 %), febrilie > 38,0 °C u 64 pacientů (32,5 %).
Délka trvání příznaků udávaných pacienty byla průměrně 9,4 ± 11,4 dnů (medián 5,0 dnů, interkvartilní rozmezí/interquartile range – IQR 2–14).
Při fyzikálním vyšetření byla zjištěna hypotenze < 90/60 mm Hg u 10 pacientů (5,1 %). Hypotermie < 36,0 °C se nevyskytla u žádného nemocného. Tachykardie > 90/min byla zaznamenána u 63 nemocných (32 %), tachypnoe > 30/min u 36 pacientů (18,3 %).
Při hodnocení vstupních laboratorních výsledků byla zjištěna trombocytopenie < 150 ×109/l u 10 nemocných (5,1 %), hypoxemie pod 8,0 kPa u 97 pacientů (49,2 %), hyperkapnie > 6,5 kPa u 29 pacientů (14,7 %), acidóza s pH < 7,35 u 23 pacientů (11,7 %), leukocytóza nad 10 × 109/l u 157 pacientů (79,7 %), elevace hladiny urey > 7,0 mmol/l u 96 pacientů (48,7 %).
Na vstupním skiagramu hrudníku bylo zjištěno unilaterální infiltrativní zastínění u 146 nemocných (74,1 %), bilaterální pneumonie u 51 pacientů (25,9 %), pleurální výpotek u 30 jedinců (15,2 %) a známky abscedující pneumonie u 7 nemocných (3,6 %).
Komplikace a mortalita
Frekvence dalšího výskytu komplikujících faktorů v průběhu hospitalizace u pacientů s pneumonií je následující: pleurální výpotek 30 pacientů (15,2 %), kardiální selhání 15 pacientů (7,6 %), hemoptýza 10 pacientů (5,1 %), pneumotorax 6 pacientů (3 %), sepse 5 pacientů (2,5 %), plicní embolie 4 pacienti (2 %), cévní mozková příhoda 2 pacienti (1 %), plicní absces 7 pacientů (3,6 %).
Délka hospitalizace pacientů na JIP byla průměrně 9,0 ± SD 6,9 dnů (rozsah 1–39 dnů).
Z důvodu nutnosti umělé plicní ventilace bylo 27 nemocných (13,7 %) přeloženo na KARIM.
U 12 nemocných (6,1 %) stav umožňoval přímé propuštění z JIP do ambulantní péče, 112 pacientů (56,9 %) bylo přeloženo na standardní oddělení Kliniky plicních nemocí a tuberkulózy LF UP a FN Olomouc a 19 nemocných (9,6 %) bylo přeloženo na oddělení následné péče.
Z celkového počtu 197 pacientů zemřelo 29 nemocných (14,7 %), z toho 24 pacientů (12,2 %) na JIP a 5 pacientů (2,5 %) zemřelo po překladu na KARIM. Průměrná délka hospitalizace do úmrtí pacientů byla 10,2 ± SD 7,8 dnů (rozsah 1–28 dnů). Délka hospitalizace na KARIM do smrti pacientů byla 4–22 dní. Zastoupení pohlaví u zemřelých pacientů bylo téměř stejné: 14 mužů a 15 žen. Věkový rozdíl mezi pacienty zemřelými (průměr 76,3 ± SD 12,9 let) a přeživšími (průměr 65,5 ± SD 14,7 let) byl statisticky významný (p < 0,0001).
Výskyt komorbidit u zemřelých a přeživších pacientů je uveden v tab. 2. Ve skupině zemřelých byl signifikantně vyšší celkový výskyt onemocnění srdce ve srovnání s ostatními pacienty (86,2 % vs 67,3 %; p = 0,04; odds ratio – OR 3,0; 95% CI 1,01–9,17), nejvyšší podíl měla ischemická choroba srdeční (58,6 % vs 38,7 %; p = 0,04; OR 2,3; 95% CI 1,01–5,0). U zemřelých ve srovnání s přeživšími nemocnými nebyly zjištěny signifikantní rozdíly ve výskytu plicních onemocnění (44,8 % vs 41,7 %; p = 0,75) ani samotné CHOPN (34,5 % vs 31,0 %; p = 0,7). Při hodnocení fyzikálních a laboratorních nálezů byla prokázána u zemřelých pacientů oproti přeživším významně vyšší frekvence výskytu tachykardie > 90/min (51,7 % vs 27,4 %; p = 0,01; OR 2,8, 95% CI 1,3–6,3), tachypnoe > 30/min (37,9 % vs 13,7 %; p = 0,001; OR 3,9, 95% CI 1,6–9,2) a acidózy < 7,35 (27,6 % vs 8,9 %; p = 0,004; OR 3,9; 95% CI 1,5–10,3). Ostatní sledované komorbidity, fyzikální a laboratorní nálezy se významně nelišily mezi skupinou zemřelých a přeživších pacientů.
Terapie
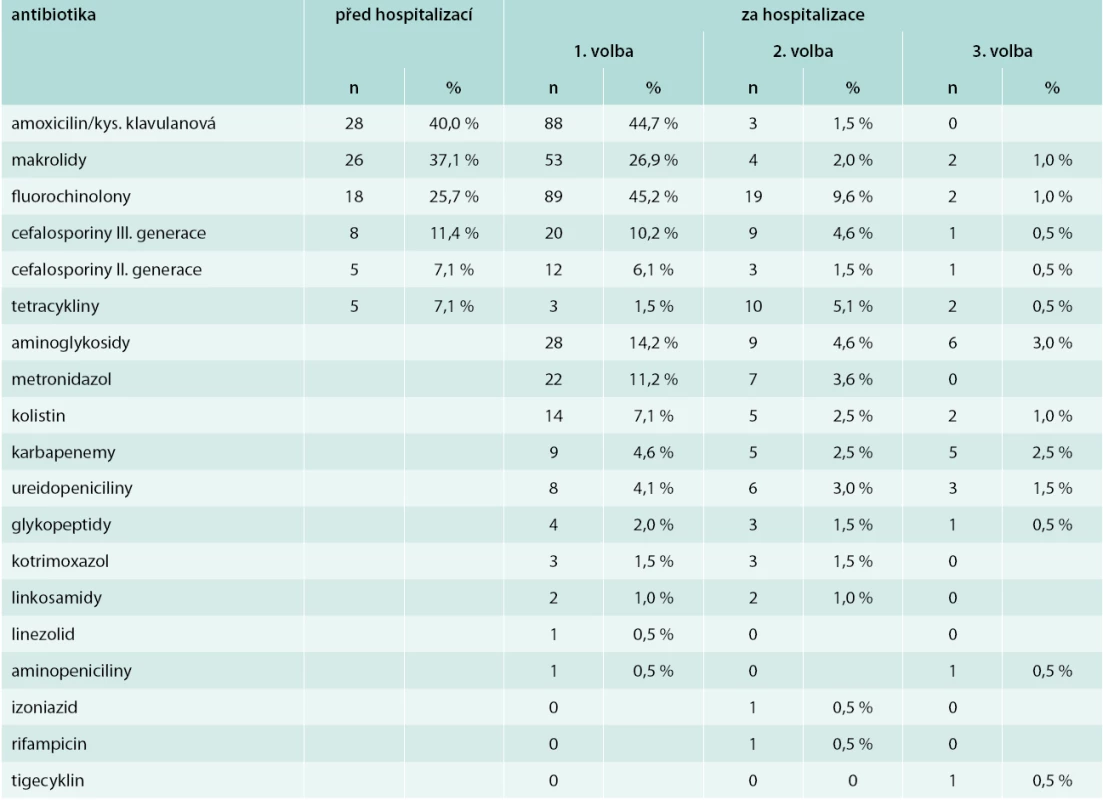
V předhospitalizačním období byla antibiotická terapie zahájena u 70 pacientů (35,5 %). Antibiotická terapie podávaná před hospitalizací, následně v průběhu hospitalizace a další nefarmakologická léčba za hospitalizace na JIP jsou uvedeny v tab. 3 a tab. 4.
Table 4. Další farmakologická a nefarmakologická terapie 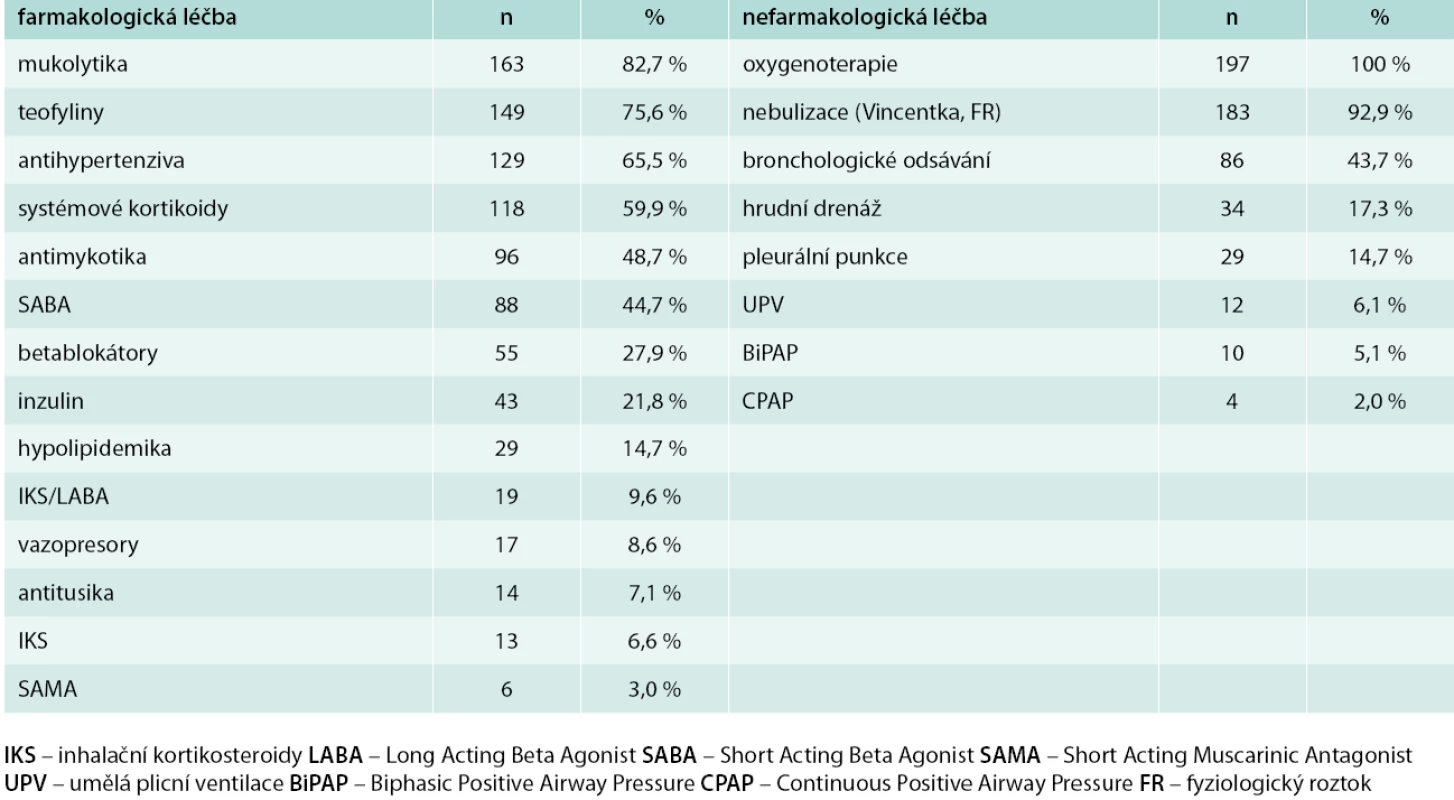
PSI a prognóza pacientů
U všech pacientů s pneumonií byla kalkulována hodnota PSI, jehož průměrné hodnoty dosahovaly 115,4 ± SD 30,4 bodů (rozsah 45–192). U mužů byla vyšší průměrná hodnota PSI (117,5 ± SD 30,7) než u žen (110,8 ± SD 29,4 bodů), rozdíl nebyl statisticky signifikantní. Dvouvýběrovým t-testem byl prokázán statisticky významný rozdíl mezi PSI zemřelých pacientů (137,4 ± SD 26,1) a pacientů, kteří nezemřeli (111,7 ± SD 29,6), p < 0,0001 (graf 1). U pacientů, kteří vyžadovali umělou plicní ventilaci na KARIM, byla zjištěna vyšší průměrná hodnota PSI (122,6 ± SD 30,3) než u pacientů, kteří nebyli přeloženi na KARIM (110,0 ± SD 29,2), rozdíl však není statisticky signifikantní (p = 0,057). Ve skupině přeživších pacientů nebyly prokázány statisticky významné rozdíly v hodnotách PSI mezi nemocnými, kteří byli propuštěni z JIP přímo do ambulantní péče, nebo přeloženi na standardní oddělení a oddělení následné péče. Korelační analýza neprokázala statisticky významnou závislost mezi PSI a délkou hospitalizace (Spearmanův korelační koeficient r = 0,12; p = 0,15).
Vliv patogenů na délku hospitalizace, PSI a mortalitu
Frekvence výskytu jednotlivých patogenů detekovaných mikrobiologickými metodami v celém souboru pacientů je uvedena v tab. 5. Ve většině případů se jednalo o smíšené infekce (60,9 % pacientů). Zcela negativní mikrobiologický nález byl přítomný pouze u 29 pacientů (14,7 %). Statisticky významný rozdíl byl prokázán mezi délkou hospitalizace pacientů s infekcí Staphylococcus sp. (včetně Staphylococcus aureus, 1 případ methicillin-rezistentní Staphylococcus aureus – MRSA) (průměr 12,3 ± SD 9,0, medián 9,5, IQR 7–16) a bez ní (průměr 8,5 ± SD 5,7, medián 8, IQR 4–11), p = 0,02 (graf 2). Taktéž infekce Klebsiella pneumoniae měla signifikantní vliv na délku hospitalizace: pacienti s nálezem Klebsiella pneumoniae (průměr 12,1 ± SD 8,2, medián 9, IQR 7–16) a bez Klebsiella pneumoniae (průměr 8,8 ± SD 6,4, medián 8, IQR 4–13), p = 0,02 (graf 3). Nebyl prokázán statisticky významný rozdíl mezi délkou hospitalizace nemocných s infekcí Pseudomonas aeruginosa (průměr 11,2 ± SD 7,2, medián 9, IQR 4–14) a bez ní (průměr 9,4 ± SD 7,1, medián 8, IQR 4–13), p = 0,16, ani pacientů s kultivačním nálezem Streptococcus sp. (průměr 10,8 ± SD 8,5, medián 9, IQR 5–13) a bez tohoto nálezu (průměr 9,5 ± SD 6,8, medián 8, IQR 4–14), p = 0,6. Taktéž délka hospitalizace u pacientů s aktivní chlamydiovou infekcí s pozitivitou protilátek IgM a IgA proti Chlamydia sp. (průměr 10,0 ± 7,8, medián 8,0, IQR 3,9–14,1) se významně nelišil od nemocných bez této infekce (průměr 9,6 ± 6,9, medián 9,0, IQR 4–13).
Table 5. Mikrobiologické nálezy u pacientů s pneumonií 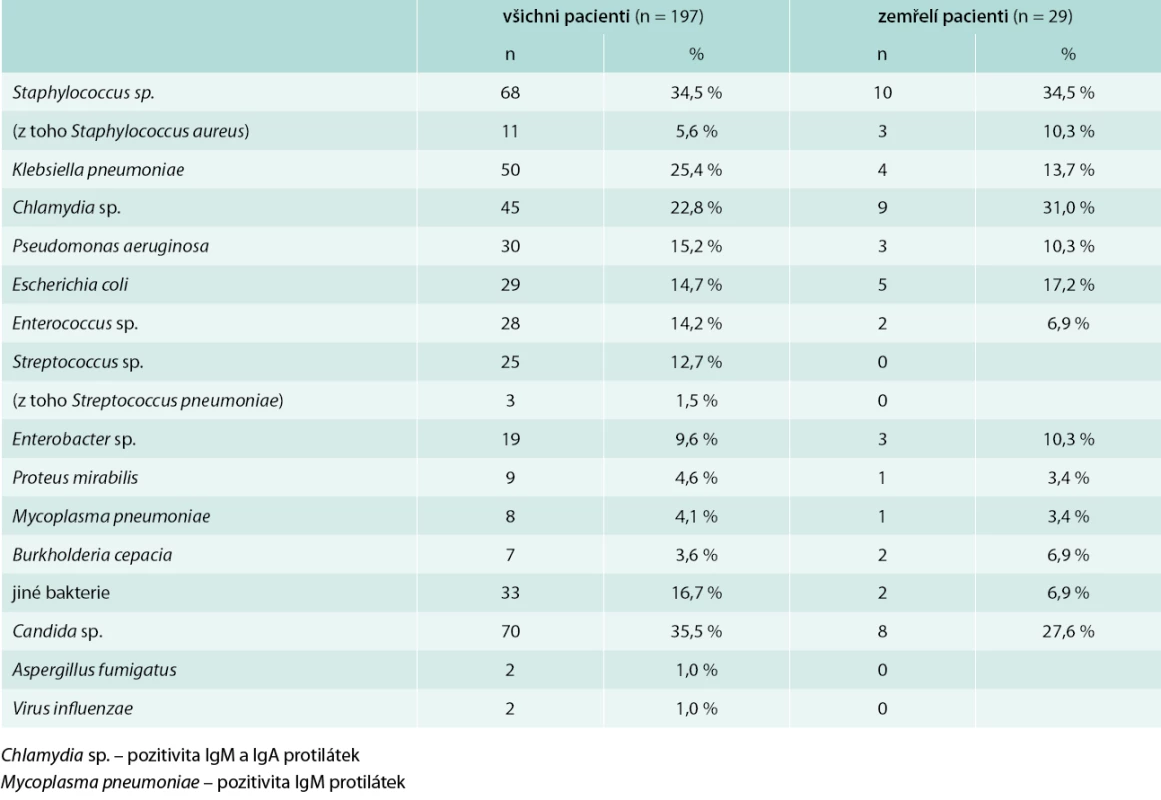
Graph 2. Délka hospitalizace a infekce Staphylococcus sp. 
Graph 3. Délka hospitalizace a infekce Klebsiella pneumoniae 
Nebyly zjištěny statisticky významné rozdíly mezi PSI pacientů v závislosti na nejčastějších patogenech: pacienti s Pseudomonas aeruginosa (průměr 106,6 ± SD 25,4) a bez Pseudomonas aeruginosa (průměr 117,1 ± SD 31,1), p = 0,069; pacienti se Staphylococcus sp. (průměr 112,8 ± SD 25,5) a bez Staphylococcus sp. (průměr 116,6 ± SD 32,5), p = 0,403; pacienti s Klebsiella pneumoniae (průměr 115,2 ± SD 27,7) a bez Klebsiella pneumoniae (průměr 115,4 ± SD 31,3), p = 0,968; pacienti se Streptococcus sp. (průměr 105,9 ± SD 26,0) a bez Streptococcus sp. (průměr 116,7 ± SD 30,8), p = 0,103; pacienti s aktivní chlamydiovou infekcí (průměr 118,7 ± SD 30,3) a bez ní (průměr 114,3 ± SD 30,5), p = 0,385. Hodnocení souvislosti patogenů s mortalitou neprokázalo statisticky významné rozdíly.
Diskuse
Komplexní americký skórovací systém PSI dle Fineho z roku 1997 zahrnuje 20 položek s různou váhou a relativně dobře predikuje komplikace a mortalitu nemocných (area under curve – AUC 0,70–0,89) [6,7]. V naší studii jsme prokázali signifikantní rozdíl v PSI mezi zemřelými a přeživšími pacienty hospitalizovanými na JIP. Tento výsledek je ve shodě s dosavadními studiemi [6,8,9]. Bylo prokázáno, že využívání tohoto systému pro stratifikaci pacientů a management léčby zlepšuje péči o nemocné, ale jako každý skórovací systém má i svoje limitace. Významnou váhu v tomto systému má věk pacienta a komorbidity. Z toho plyne i nevýhoda PSI, že pacient může být klasifikován jako těžká pneumonie (třídy IV a V) pouze na základě věku a přidružených nemocí. A naopak PSI může podhodnocovat závažnost pneumonie u mladších pacientů, u kterých nemusí predikovat nutnost hospitalizace na JIP nebo výskyt komplikací. Proto stejně jako ostatní skórovací systémy je doporučováno PSI brát v úvahu při rozhodování o hospitalizaci pouze v korelaci s celkovým klinickým stavem pacienta.
Jako nezávislé negativní prognostické faktory pro 30denní mortalitu se v naší studii ukázaly být věk, tachykardie > 90/min, tachypnoe > 30/min, acidóza s pH < 7,35 a z přidružených onemocnění zejména kardiální nemoci, z kterých největší podíl měla ischemická choroba srdeční. Překvapujícím poznatkem bylo, že chronické plicní nemoci v tomto souboru nemocných nezvyšovaly úmrtnost pacientů s pneumonií. V naší studii byla prokázána signifikantní asociace tachykardie již > 90/min s mortalitou pacientů, ačkoliv PSI a řada studií uvádí ve svých kritériích tachykardii > 125/min.
Souvislost acidózy, tachykardie a tachypnoe s mortalitou pacientů byla prokázána u pneumonie i akutního syndromu respirační tísně [10–12]. Časná respirační acidóza je prokázaným rizikovým faktorem pro vývoj postoperační pneumonie u pacientů po plicních resekčních výkonech [13]. Pokročilý věk, městnavé srdeční selhání, hypotenze, acidóza, poruchy výměny krevních plynů, hypotermie, trombocytopenie a pleurální výpotek jsou faktory asociované se selháním léčby u CAP [14]. V souboru našich pacientů byla s mortalitou asociována acidóza nezávisle na hyperkapnii nebo hypoxemii, u kterých nebyl prokázán signifikantní rozdíl mezi zemřelými a přeživšími pacienty. Jako hlavní prognostické kritérium pro rozhodnutí o hospitalizaci na JIP byla acidóza s pH < 7,3 nově navržena jako doplněk skórovacího systému Americké společnosti pro infekční nemoci a Americké hrudní společnosti (IDSA/ATS) pro CAP z roku 2007 [15]. Acidóza je ve spojitosti s pneumonií a sepsí považována za dvousečnou zbraň. Permisivní hyperkapnická acidóza je důležitým protektivním faktorem využívaným při umělé plicní ventilaci zlepšujícím prognózu pacientů [16]. Patofyziologickým podkladem je suprese imunitních reakcí, zejména vlivem na cytokinovou síť, funkci fagocytů a adaptivní imunitní odpověď. U zvířecích modelů bylo prokázáno, že hyperkapnická acidóza snižuje poškození plicní tkáně v časných fázích bakteriální pneumonie, ale u déle trvajícího zánětu může naopak zhoršovat plicní poškození mechanizmem inhibice funkce neutrofilů [16].
Dalším prokázaným závažným rizikovým faktorem ovlivňujícím prognózu nemocných s pneumonií jsou onemocnění srdce. Vztah pneumonie a kardiálních nemocí je velmi úzký. Epidemiologická data ukazují, že onemocnění myokardu a srdečních chlopní vedoucí k chronickému srdečnímu selhání jsou rizikovým faktorem pro vznik pneumonie [17]. Pacienti s chronickým srdečním selháním mají sníženou obranyschopnost z důvodu interference plicní kongesce s fyziologickými obrannými mechanizmy probíhajícími na alveolárním epiteliálním povrchu (např. snížení efektivity opsonizace nebo aktivity makrofágů), čímž se zhoršuje mikrobiální clearence a dochází k množení patogenů v plicní tkáni a rozvoji pneumonie [17,18]. A naopak u nemocných s pneumonií se velmi často vyskytují kardiální komplikace a významně zvyšují mortalitu pacientů [19]. Bylo zjištěno, že akutní onemocnění srdce (např. akutní srdeční selhání, akutní srdeční infarkt, některé klinicky závažné arytmie) jsou často předcházeny akutní respirační infekcí včetně pneumonie, a proto se předpokládá kauzální souvislost [20,21]. U pacientů s pneumonií byly prokázány mnohočetné účinky na kardiovaskulární systém – snížená reaktivní hyperemie a odezva na oxid dusný, zvýšená koncentrace endotelinu 1 a adrenomedullinu, snížená systolická funkce myokardu levé komory, myokarditida, akutní arytmie, akutní zánětlivé změny v aterosklerotických plátech koronárních arterií, koronární vazokonstrikce, zvýšení tlaku v a. pulmonalis, porucha funkce kardiovaskulárního autonomního nervového systému, zvýšená prokoagulační aktivita, zvýšená tvorba vazopresinu, snížení aktivity angiotenzin konvertujícího enzymu, retence vody a další [17]. Metaanalýza 25 studií zabývajících se incidencí kardiálních komplikací u pacientů hospitalizovaných pro pneumonii v prvních 30 dnech ukázala 14 % pacientů s nově zjištěným nebo zhoršeným srdečním selháním (rozmezí 7–33 %), 5 % pacientů s nově zjištěnými nebo zhoršenými arytmiemi (rozmezí 1–11 %) a 5 % pacientů s akutním koronárním syndromem – infarkt myokardu nebo nestabilní angina pectoris (rozmezí 1–11 %) [22]. V našem souboru pacientů srdeční selhání komplikovalo průběh hospitalizace u 7,6 % nemocných. Arytmie (fibrilace síní) byla zjištěna při přijetí u 5,6 % pacientů. Tento výskyt je v souladu s rozmezím uváděném v metaanalýze autorů Corrales-Medina et al [22].
Z důvodu vysoké incidence a mortality kardiálních příhod u pneumonie byl recentně publikován nový skórovací systém ke stratifikaci rizika kardiálních komplikací u pacientů s CAP [23]. Tento skórovací systém predikuje riziko kardiálních komplikací v prvních 30 dnech nemoci lépe než PSI. Skórovací systémy pro CAP jsou neustálým předmětem zkoumání a ověřování validity. Perspektivou je využití panelu biomarkerů, které v kombinaci s klinickými nálezy mohou zlepšit predikci dalšího vývoje pneumonie [7]. Kromě rutinně používaného C-reaktivního proteinu, je užitečným markerem prokalcitonin a N-terminální fragment natriuretického peptidu typu B (NT-proBNP) [24,25]. Podle novějších poznatků je NT-proBNP velmi silným prediktorem časné mortality u CAP nezávislým na klinických prognostických indikátorech a je srovnatelný s PSI [25]. Patofyziologický mechanizmus této asociace není dosud přesně objasněn. Předpokládá se, že srdeční dysfunkce je velmi důležitým faktorem mortality u pneumonie a pacienti s elevací NT-proBNP i bez klinických známek srdečního selhání mají vysoké riziko úmrtí na pneumonii, a proto vyžadují odlišný terapeutický přístup.
Naše studie neprokázala signifikantní souvislost mezi PSI, mortalitou a výskytem jednotlivých patogenů, avšak délku hospitalizace ovlivňovala významně infekce Staphylococcus sp. a Klebsiella pneumoniae. Staphylococcus sp. a Klebsiella pneumoniae byly nejčastějšími identifikovanými bakteriálními patogeny v našem souboru pacientů. Podíl Staphylococcus aureus z celkového počtu nálezů Staphylococcus sp. byl minoritní (pouze u 5,6 % pacientů) a většinu ostatních nalezených stafylokoků lze považovat za součást kolonizující flóry dýchacích cest, která nemá přímou kauzální souvislost s pneumonií. Proto lze usuzovat, že nejčastějším patogenem, který byl primárním etiologickým agens způsobujícím pneumonii u našich pacientů s pneumonií na JIP, byla Klebsiella pneumoniae. Souvislost etiologie pneumonie se závažností nemoci a PSI byla dříve prokázána u infekcí Pseudomonas aeruginosa a gramnegativními bakteriemi, méně senzitivní jsou skórovací systémy u smíšených infekcí [26]. Tyto patogeny se častěji vyskytují ve skupině středně těžké a těžké pneumonie. Infekce Klebsiella pneumoniae a Pseudomonas aeruginosa je asociována i s mortalitou pneumonie [26,27]. Tento fakt se v našem souboru pacientů nepotvrdil, ale limitací studie je relativně nízký počet pacientů.
Závěr
Závěrem lze říct, že PSI je významným prediktorem 30denní mortality pacientů s CAP na JIP, ale nekoreluje s délkou hospitalizace ani s nálezem jednotlivých patogenů. Nezávislými negativními prognostickými faktory u pacientů s CAP jsou věk, výskyt kardiálních onemocnění (zejména ICHS), tachykardie, tachypnoe a acidóza. Výskyt infekce Staphylococcus sp. a Klebsiella pneumoniae se signifikantně podílejí na prodloužení doby hospitalizace. Všechny tyto faktory mohou upozorňovat na potřebu zvýšené péče o pacienty s CAP.
Grantová podpora: IGA MZ ČR NT11117 a IGA_LF UP_2014_020.
MUDr. Petr Jakubec, Ph.D.
petr.jakubec@fnol.cz
Klinika plicních nemocí a tuberkulózy LF UP a FN, Olomouc
www.fnol.cz
Doručeno do redakce 21. 8. 2014
Přijato po recenzi 20. 10. 2014
Sources
1. Kolek V. Prognóza nemocných s komunitní pneumonií. Poučení z klinických doporučení, skórovacích systémů a dalších parametrů. Postgraduální medicína 2013; 15(8): 51–56.
2. Kolek V, Kolář M, Kašák V et al. Diagnostika a léčba komunitní pneumonie dospělých. In: Kolek V et al. Doporučené postupy v pneumologii. Maxdorf: Praha 2013 : 107–123. ISBN 978–80–7345–359–6.
3. Beneš J, Džupová O, Blechová Z et al. Skórovací systémy hodnotící prognózu komunitních pneumonií. Vnitř Lék 2012; 58(5): 357–364.
4. Jakubec P. Těžká komunitní pneumonie – uptodate 2013. Postgraduální medicína 2014; 16(2): 181–190.
5. Jakubec P, Kolek V, Kolář M. Diagnostika a léčba těžké pneumonie. In: Kolek V et al. Doporučené postupy v pneumologii. Maxdorf: Praha 2013 : 124–140. ISBN 978–80–7345–359–6.
6. Fine MJ, Auble TE, Yealy DM et al. A prediction rule to identify lowrisk patients with community acquired pneumonia. N Engl J Med 1997; 336(4): 243–250.
7. Chalmers JD, Rutherford J. Can we use severity assessment tools to increase outpatient management of community-acquired pneumonia? Eur J Int Med 2012; 23(5): 398–406.
8. Renaud B, Coma E, Hayon J et al. PNEUMOCOM study investigators: Investigation of the ability of the Pneumonia Severity Index to accurately predict clinically relevant outcomes: a European study. Clin Microbiol Infect 2007; 13(9): 923–931.
9. Angus DC, Marrie TJ, Obrosky DS et al. Severe community-acquired pneumonia: use of intensive care services and evaluation of American and British Thoracic Society Diagnostic criteria. Am J Respir Crit Care Med 2002; 166(5): 717–723.
10. Choudhury G, Chalmers JD, Mandal P et al. Physician judgement is a crucial adjunct to pneumonia severity scores in low-risk patients. Eur Respir J 2011; 38(3): 643–648.
11. Bhadade RR, de Souza RA, Harde MJ et al. Clinical characteristics and outcomes of patients with acute lung injury and ARDS. J Postgrad Med 2011; 57(4): 286–290.
12. Calle A, Márquez MA, Arellano M et al. Geriatric Assessment and Prognostic Factors of Mortality in Very Elderly Patients With Community-Acquired Pneumonia. Arch Bronconeumol 2014; 50(10):429–434.
13. Planquette B, Le Pimpec-Barthes F, Trinquart L et al. Early respiratory acidosis is a new risk factor for pneumonia after lung resection. Interact Cardiovasc Thorac Surg 2012; 14(3): 244–248.
14. Aliberti S, Amir A, Peyrani P et al. Incidence, etiology, timing, and risk factors for clinical failure in hospitalized patients with community-acquired pneumonia. Chest 2008; 134(5): 955–962.
15. Sibila O, Meduri GU, Mortensen EM et al. Improving the 2007 Infectious Disease Society of America/American Thoracic Society severe community-acquired pneumonia criteria to predict intensive care unit admission. J Crit Care 2013; 28(3): 284–290.
16. Corrales-Medina VF, Musher DM, Shachkina S et al. Acute pneumonia and the cardiovascular system. Lancet 2013; 381(9865): 496–505.
17. Curley G, Contreras MM, Nichol AD et al. Hypercapnia and acidosis in sepsis: a double-edged sword? Anesthesiology 2010; 112(2): 462–472.
18. Mor A, Thomsen RW, Ulrichsen SP et al. Chronic heart failure and risk of hospitalization with pneumonia: a population-based study. Eur J Intern Med 2013; 24(4): 349–353.
19. Corrales-Medina VF, Musher DM, Wells GA et al. Cardiac complications in patients with community-acquired pneumonia: incidence, timing, risk factors, and association with short-term mortality. Circulation 2012; 125(6): 773–781.
20. Khand AU, Gemmell I, Rankin AC et al. Clinical events leading to the progression of heart failure: insights from a national database of hospital discharges. Eur Heart J 2001; 22(2): 153–164.
21. Corrales-Medina VF, Madjid M, Musher DM. Role of acute infection in triggering acute coronary syndromes. Lancet Infect Dis 2010; 10(2): 83–92.
22. Corrales-Medina VF, Suh KN, Rose G et al. Cardiac complications in patients with community-acquired pneumonia: a systematic review and meta-analysis of observational studies. PLoS Med 2011; 8(6): e1001048. Dostupné z DOI: <http://doi.org/10.1371/journal.pmed.1001048>.
23. Corrales-Medina VF, Taljaard M, Fine MJ et al. Risk stratification for cardiac complications in patients hospitalized for community-acquired pneumonia. Mayo Clin Proc 2014; 89(1): 60–68.
24. Lippi G, Meschi T, Cervellin G. Inflammatory biomarkers for the diagnosis, monitoring and follow-up of community-acquired pneumonia: clinical evidence and perspectives. Eur J Intern Med 2011; 22(5): 460–465.
25. Chang CL, Mills GD, Karalus NC et al. Biomarkers of Cardiac Dysfunction and Mortality from Community-Acquired Pneumonia in Adults. PLoS One 2013; 8(5): e62612. Dostupné z WWW: <http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0062612>.
26. Cillóniz C, Ewig S, Polverino E et al. Microbial aetiology of community-acquired pneumonia and its relation to severity. Thorax 2011; 66(4): 340–346.
27. Lee YT, Chen SC, Chan KC et al. Impact of infectious etiology on the outcome of Taiwanese patients hospitalized with community acquired pneumonia. J Infect Dev Ctries 2013; 7(2): 116–124.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2015 Issue 1-
All articles in this issue
- POET2 – editorial
- Překvapivě starý kostlivec ve skříni – editorial
- HevyLite™ – nová metoda detekce monoklonálních imunoglobulinů – editorial
- Význam Pneumonia Severity Index u pacientů s pneumonií hospitalizovaných na jednotce intenzivní pneumologické péče
- Registr POET2: srovnání přímých ročních zdravotnických nákladů na léčbu diabetu 2. typu po zahájení léčby inzulinem NPH nebo inzulinem glargin v kombinaci s perorálními antidiabetiky v České republice
- Terapeutické monitorování amikacinu a gentamicinu v rutinní klinické praxi
- Asymptomatická hyperurikémia a metabolický syndróm u mladistvých
- Studium souvislostí poruch spánku, obstrukční spánkové apnoe a vzniku a léčby arteriální hypertenze – módní vlna nebo dlouhodobý trend?
- Tachykardií indukovaná kardiomyopatie
- Význam vyšetření párů těžkých/lehkých řetězců imunoglobulinu u monoklonálních gamapatií
-
Akútne a chronické aortové choroby hrudníkovej a brušnej aorty u dospelých
Odporúčania Angiologickej sekcie Slovenskej lekárskej komory pre klasifikáciu a diagnózu chorôb aorty (AS SLK, 2014) - Distribuce hodnot glykovaného hemoglobinu v populaci diabetiků 2. typu: projekt Valetudo
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Terapeutické monitorování amikacinu a gentamicinu v rutinní klinické praxi
- Asymptomatická hyperurikémia a metabolický syndróm u mladistvých
- Tachykardií indukovaná kardiomyopatie
- Význam vyšetření párů těžkých/lehkých řetězců imunoglobulinu u monoklonálních gamapatií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career