-
Medical journals
- Career
Přínosy a rizika profylaxe tromboembolické nemoci u geriatrického pacienta
Authors: D. Weberová; H. Matějovská Kubešová; P. Weber
Authors‘ workplace: Klinika interní, geriatrie a praktického lékařství LF MU a FN Brno
Published in: Kardiol Rev Int Med 2018, 20(1): 36-40
Overview
Tromboembolická nemoc je poměrně často se vyskytující kardiovaskulární onemocnění s relativně vysokou morbiditou a mortalitou. Zahrnuje dvě jednotky – hlubokou žilní trombózu a plicní embolii. Incidence a prevalence tromboembolické nemoci roste exponenciálně s věkem a není pochyb o tom, že věk je jedním ze zásadních rizikových faktorů pro vývoj tohoto onemocnění. S prodlužující se střední délkou života přibývá tedy absolutního i relativního počtu nemocných vyššího věku, u kterých se setkáváme a budeme setkávat s touto diagnózou. Vzhledem k tomu, že geriatričtí pacienti mají odlišné klinické projevy nemocí, nezřídka jsou polymorbidní a užívají více farmak současně, jsou tito více ohroženou skupinou nemocných pro vznik tromboembolie s výrazně těžšími důsledky ve srovnání s mladšími jedinci. Z těchto důvodů je nutné v primární prevenci tromboembolie brát v potaz tuto zvlášť vulnerabilní skupinu nemocných jak směrem ke srážlivosti, tak i proti ní – ke krvácení.
Klíčová slova:
tromboembolická nemoc – hluboká žilní trombóza – plicní embolie – profylaxe – stáří – NOAC – polymorbidita – polyfarmakoterapieÚvod
Tromboembolická nemoc (TEN) je jednou z nejčastějších příčin morbidity a mortality hospitalizovaných pacientů [1,2]. V populaci se s ní setkáváme přibližně u 1 – 2 % jedinců [3,4]. Zhruba 50 – 70 % symptomatických TEN vzniká u nechirurgických pacientů. Hospitalizace pro akutní interní onemocnění je tedy významným rizikovým faktorem pro vývoj TEN a je spojena s 8násobným zvýšením rizika vzniku TEN [5 – 9]. Nemocní s plicní embolií (PE) obecně jsou ohroženi až 20% mortalitou [10]. Mortalita hospitalizovaných pacientů všeobecně na interních odděleních je asi 10 %, z čehož přibližně 10 % umírá právě na PE [11,12]. Dle jiných zdrojů toto číslo může být i vyšší. U pacienta na interním lůžku bez profylaxe hrozí fatální PE až u 11 – 15 % nemocných [13]. Ve stáří se setkáváme s ještě vyšší mortalitou na PE a její průběh je výrazně těžší než u jedinců mladšího věku [8]. Nezanedbatelné jsou také dlouhodobé následky TEN, které mají ve stáří závažný dopad a delší čas rekonvalescence. Komplikace TEN představují posttrombotický syndrom (až u 40 % jedinců) a chronická tromboembolická plicní hypertenze (až u 1,5 – 4 % nemocných) [10,14].
Všeobecně je větší důraz kladen na chirurgické nemocné, u nichž jsou způsoby profylaxe TEN více propracovány. Ve skutečnosti však pouze jedna čtvrtina úmrtí na TEN v nemocnici připadá na chirurgické nemocné [7]. Ve vnitřním lékařství je situace složitější jednak pro značnou heterogenitu nemocných a dále pro rizikové faktory. Doposud neexistuje jasně daná stratifikace nemocných a jasná doporučení pro profylaxi v interních oborech. U starších nemocných se setkáváme s ještě vyšší heterogenitou obecně a vulnerabilitou k tromboembolii [6].
Přestože jsou rizikové faktory TEN dobře známé, jejich vyhodnocení je složité. Jednotlivé rizikové faktory mají různou váhu, od níž se odvíjí stratifikace rizika. V interní medicíně nelze uplatnit pouze jednoduché schéma kvantifikace rizik, ale je třeba uvážit riziko vyplývající ze samotné aktuální choroby a z léčebných metod [7]. Zatímco v léčbě TEN se řídíme doporučeními odborných společností, tedy American College of Chest Physicians (ACCP) a Evropské kardiologické společnosti (ECP) [10,14,15], jasná schémata pro profylaxi TEN u interních a geriatrických pacientů nejsou dostupná [6,7,16]. V tomto přehledovém článku je rozebírána problematika profylaxe TEN u nechirurgických pacientů vyššího věku.
Specifika TEN ve stáří
Starší nemocní si s ohledem na riziko vzniku TEN zasluhují zvláštní pozornost oproti mladším věkovým skupinám [4,17]. Vzhledem k vyššímu věku mají již sami o sobě větší sklon k vzniku TEN než mladší věkové skupiny [17,18]. Jedná se o nemocné s řadou rizikových faktorů současně, jež lze dobře rozpoznat, a tím předcházet tomuto onemocnění. TEN má ve stáří těžší a fatálnější průběh [19] a bývá spojena s dalšími komorbiditami [20]. Stáří je charakteristické polymorbiditou, užíváním polyfarmakoterapie a vzájemnými interakcemi mezi nemocemi i léky [6,21]. Odhalení diagnózy TEN je složitější pro častý asymptomatický průběh [22]. Při užití antikoagulační léčby je vyšší riziko krvácení [23]. Staří lidé jsou proto skupinou nemocných, kteří jsou výrazněji ohroženi vznikem TEN, a proto by měl být kladen zvláštní důraz na její prevenci ve stáří [4,24].
Rizikové faktory TEN ve stáří
Tromboembolická nemoc je onemocnění multifaktoriální, spojené s mnoha jinými komplexními poruchami, kde se velmi složitě uplatňuje vliv vrozených a získaných rizikových faktorů. Podstatou patofyziologického procesu pro vývoj TEN jsou tři stavy: poškození endotelu, hyperkoagulace a stáza krve, které tvoří tzv. Virchowovo trias [24 – 26]. Až u 75 % pacientů s PE je možné zjistit rizikový faktor, a to získaný a/ nebo dědičný [6,24]. Při přijetí geriatrického pacienta k hospitalizaci je třeba vyhodnotit možná rizika TEN a brát je v úvahu v kontextu stávající diagnózy (tab. 1) [27].
Table 1. Rizikové faktory TEN ve stáří. 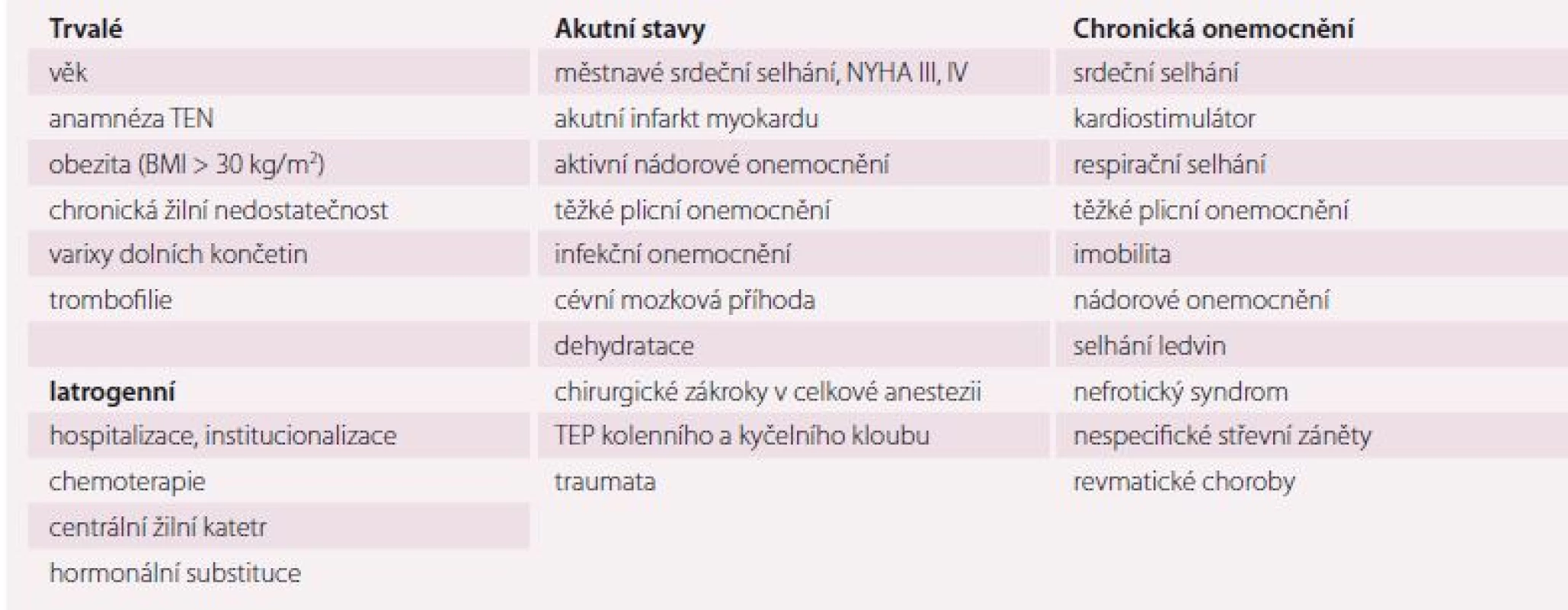
TEP – totální endoprotéza, TEN – tromboembolická nemoc Incidence TEN roste exponenciálně s věkem. U starších nemocných se více uplatňují zevní a získané rizikové faktory. Anamnéza již prodělané tromboembolie a pozitivní rodinná anamnéza patří k nejsilnějším prediktorům TEN [6,28 – 30]. Významným rizikem je také prolongovaná imobilita u hospitalizovaných seniorů nebo v instituci, obezita s BMI (body mass index) > 30 kg/ m2, přítomnost varixů dolních končetin či projevů chronické žilní insuficience. Vrozené trombofilie ustupují ve stáří spíše do pozadí proti ostatním rizikovým faktorům [5,6,31].
Z akutních interních stavů jsou pro vývoj TEN zvláště rizikové: diagnóza srdečního selhání akutního či zhoršeného chronického, zejména městnavá forma, či NYHA III a IV [3,29,31]; maligní nádorová onemocnění, zejm. solidní tumory pankreatu, žaludku, plic, ledvin, mozku, hematologické lymfomy a myelomy [32,33]; neurologická onemocnění, zejm. ischemická forma cévní mozkové příhody (CMP) a poškození míchy. U hemoragických CMP je taktéž riziko TEN, nicméně profylaxe flebotrombózy je komplikována obavami z krvácení do ložiska. Dalšími rizikovými stavy jsou plicní nemoci, zejména pokročilé formy chronické obstrukční plicní nemoci (CHOPN), event. s cor pulmonale, dehydratace, revmatické choroby, méně nespecifické střevní záněty [6,28,30].
Neopomenutelnými rizikovými faktory ve stáří jsou chirurgické intervence a traumata. Vysoké riziko vzniku TEN mají pacienti po totální endoprotéze kyčelního nebo kolenního kloubu či po intervenci v abdominopelvické oblasti [34]. Traumata jsou ve stáří často spojena s pády, kdy dochází zejména k poranění hlavy, hrudníku, stehenní kosti apod. [4,14,21,35].
Skórovací systémy v prevenci TEN
Skórovací systémy (risk-assessment models – RAM) v interních i chirurgických oborech vychází z poměrného zastoupení klinických a laboratorních rizikových faktorů. Jeden z vhodných RAM u interních pacientů je Padua Prediction Score (tab. 2). Tento systém bere v potaz jak získané rizikové faktory (RF) ve smyslu akutních interních stavů, vysokého věku, imobility, probíhající malignity, obezity či probíhající hormonální léčby, tak vrozené. Vysoké riziko vzniku TEN je při ≥ 4 bodech. Pod 4 body je riziko vzniku TEN nízké [31,36,37]. Dalším RAM je modifikovaný algoritmus dle Cohena. Tento hodnotí riziko TEN u hospitalizovaných interních nemocných s omezenou hybností [31,38,39]. U onkologických nemocných lze využít Khoranovu škálu. Ta zahrnuje pět klinických parametrů: lokalizaci primárního nádoru, BMI, hodnoty krevního obrazu (hemoglobin, počet leukocytů a trombocytů) [31,40].
Table 2. Padua Prediction Score k predikci rizika tromboembolie u interních pacientů. 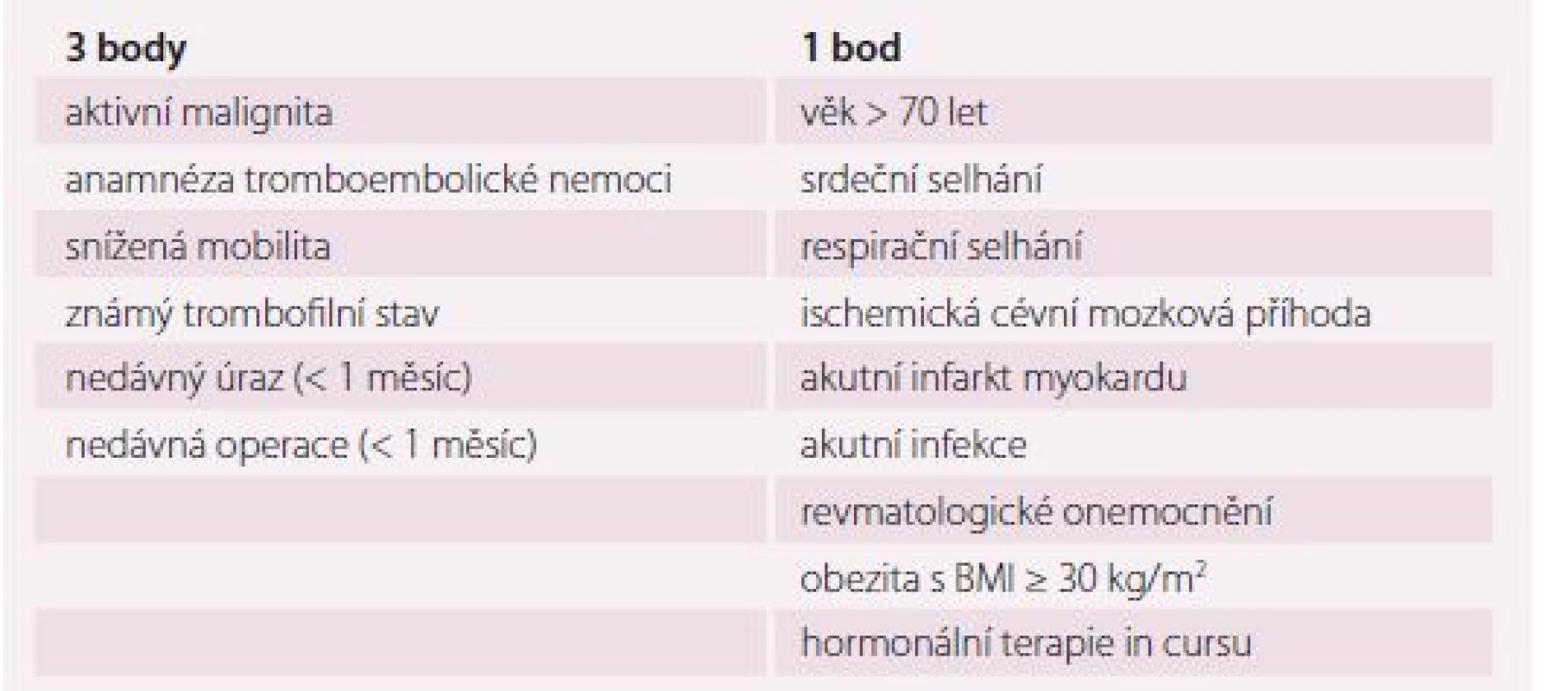
Vysoké riziko je při ≥ 4 bodech. Při < 4 bodech je riziko nízké. U chirurgických pacientů je užíváno k posouzení rizika TEN v pooperačním období a její profylaxi tzv. Capriniho skóre, kde nacházíme mnoho predisponujících faktorů i pro nechirurgické pacienty. Capriniho skóre zahrnuje rizika jako věk, druh operace, druh traumatu, obezitu, vrozené RF, varixy dolních končetin, hormonální substituci, imobilitu, těhotenství a stavy s ním spojené, některé akutní interní stavy a anamnézu TEN. Toto skóre klasifikuje pacienty do tří skupin dle rizika; pacienti s vysokým rizikem TEN mají ≥ 4 body [39,41,42].
Profylaxe TEN a její rizika ve stáří
U nechirurgických pacientů ve stáří je profylaxe TEN často indikována nesprávně, nedostatečně nebo naopak nadměrně. Ve srovnání s chirurgickými obory není v interních oborech riziko TEN dostatečně doceněno. Odhad rizika u staršího pacienta je obtížný pro heterogenitu nemocí i symptomů [16,17,24].
Farmakologická profylaxe
Při podání farmakologické profylaxe starším pacientům je třeba mít na paměti, že s věkem roste citlivost k antikoagulačním přípravkům. Současně ale také roste riziko krvácení, jeho závažnost a komplikace s ním spojené. Riziko krvácení zvyšují jaterní choroby, demence, pády, úrazy, fragilita cévní stěny. Situace podání profylaxe je navíc komplikována velmi častou polymorbiditou, polyfarmakoterapií a lékovými interakcemi [16,21,24]. Bývá změněna i efektivita medikamentózní terapie, např. při renální či jaterní insuficienci, malnutrici, hypoproteinemii aj. Při indikaci profylaxe TEN přistupujeme ke každému pacientovi vyššího věku individuálně. Zaměřujeme se na známé RF a posuzujeme jejich míru zvyšující pravděpodobnost TEN. Využíváme výše zmíněné skórovací systémy k odhadu rizika flebotrombózy [17,21,22].
Nízkomolekulární hepariny a nefrakcionovaný heparin
Tromboprofylaxe nízkomolekulárními hepariny (LMWH) a nízkými dávkami nefrakcionovaného heparinu (UFH) je lety ověřená, bezpečná a účinná. Nefrakcionovaný heparin zabraňuje přeměně fibrinogenu na fibrin a snižuje koagulační potenciál. Nízkomolekulární heparin působí na úrovni faktoru Xa (fXa) na přeměnu protrombinu na trombin. Výhoda LMWH spočívá v podání 1× denně podkožně a současně u LMWH se setkáváme s nižším počtem komplikací ve smyslu krvácení či heparinem indukované trombocytopenie. V současnosti je LMWH upřednostňováno před UFH i z důvodu předvídatelného účinku bez nutnosti pravidelné monitorace. U LMWH podáváme v profylaxi obvykle enoxaparin 40 mg denně subkutánně nebo dalteparin 5 000 U 1× denně subkutánně. Prakticky lze podat jakýkoli z LMWH, má-li v ČR schválenou indikaci žilního tromboembolizmu. V případě nefrakcionovaného heparinu podáváme profylaktickou dávku 5 000 j. 2 – 3× denně subkutánně [6,43 – 47].
Kontraindikacemi a současně i riziky vyplývajícími z této léčby jsou aktivní či nekontrolované krvácení, koagulopatie, heparinem indukovaná trombocytopenie, hypersenzitivita, aktivní vředová choroba, hemoragická CMP, trombocytopenie (≤ 50 × 109 trombocytů/ l), vážné onemocnění jater (u jaterní cirhózy Child-Pugh C), epidurální anestezie v posledních 12 hod (tab. 3). Pro UFH navíc platí kontraindikace při aktivní tuberkulóze nebo krvácejícím karcinomu. K relativním kontraindikacím této terapie patří nekontrolovaná arteriální hypertenze, recentní chirurgická intervence, pokročilá renální insuficience s clearance kreatininu (CrCl) < 30 ml/ min, primární tumory mozku. Redukce dávky je doporučena u pacientů s renální insuficiencí s CrCl 30 – 50 ml/ min u LMWH o 25 – 30 %. Naopak stavy jako sepse, vazopresorická léčba či extrémní obezita snižují účinnost těchto farmak a obvyklá dávka nemusí být dostatečná. Ve stáří je vhodné zvážit monitoraci antiXa při podávání LMWH 3 – 4 hod po aplikaci s cílovou hodnotou 0,2 – 0,4 IU/ ml [6,43 – 47].
Table 3. Kontraindikace farmakologické profylaxe nízkomolekulárními hepariny a nefrakcionovaným heparinem. 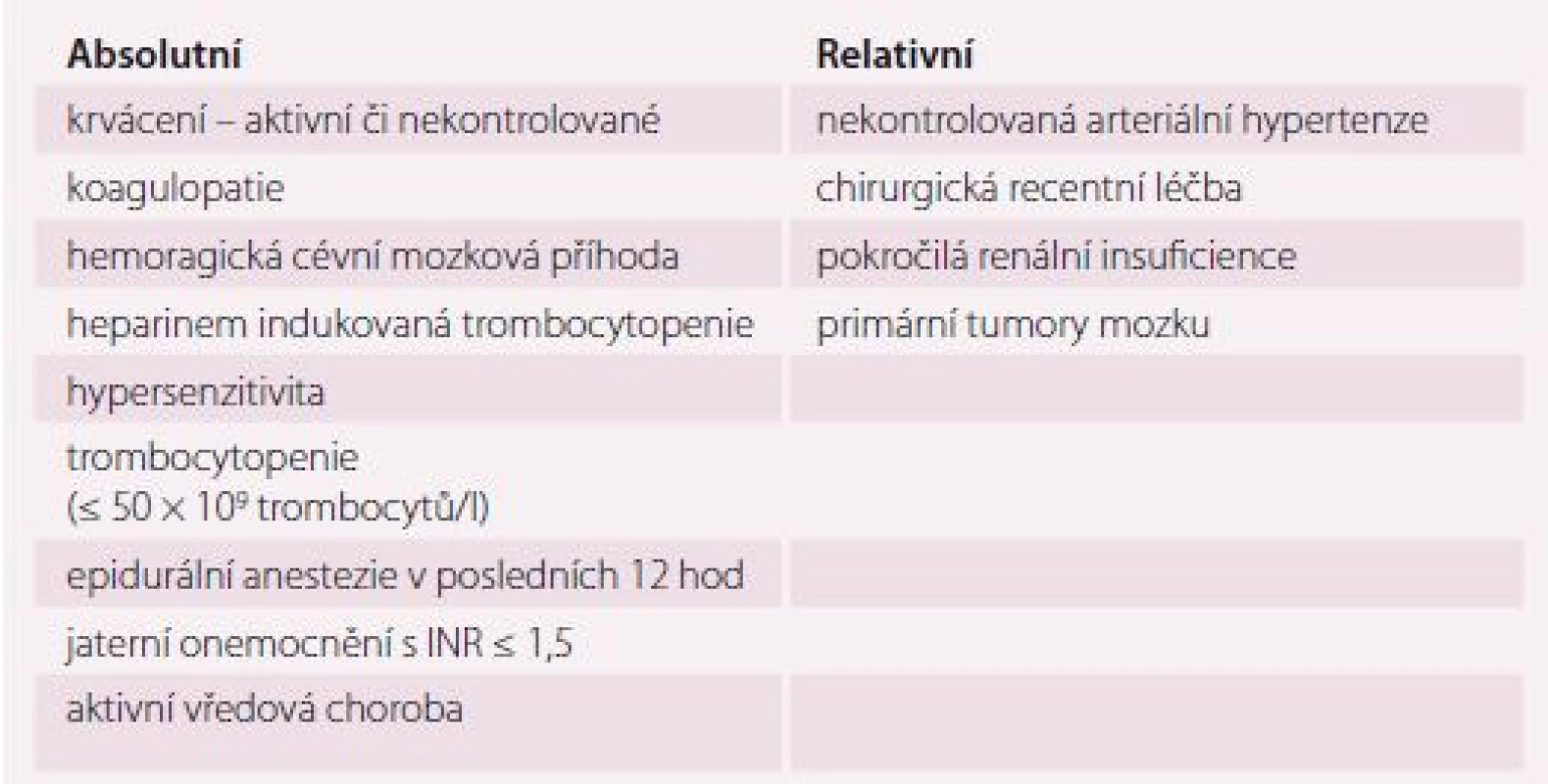
INR – international normalized ratio U starších pacientů s aktivním onkologickým onemocněním je lékem první volby LMWH za kontroly anti-Xa a lékem druhé volby UFH. Jedním z nejčastějších nežádoucích účinků protinádorové léčby je právě vliv na hematopoézu, a proto není doporučováno užití nových přímých perorálních antikoagulancií (NOAC) či warfarinu. Warfarin je možno užít až jako lék třetí volby v případě, že není možné podávání LMWH či UFH [48 – 50].
NOAC
Novou naději pro profylaxi TEN u nechirurgických starších pacientů v sobě nesou NOAC. Jejich výhodou je terapeutická účinnost při dobrém bezpečnostním profilu, jednoduché perorální podání bez nutnosti monitorace, jejich rychlý nástup účinku a vysoký poměr mezi účinkem a rizikem krvácení. Dalšími výhodami jsou žádná potravinová omezení a minimální lékové interakce. K NOAC se řadí přímé inhibitory faktoru Xa – rivaroxaban, apixaban a edoxaban – a přímý inhibitor trombinu – dabigatran etexilát [51].
Tato NOAC jsou v současnosti v ČR indikována v prevenci žilního tromboembolizmu u pacientů podstupujících elektivní náhradu kyčelního nebo kolenního kloubu, v prevenci mozkové příhody a systémové embolizace u pacientů s nevalvulární fibrilací síní s alespoň jedním rizikovým faktorem, v léčbě HŽT a PE a v prevenci jejich recidivy [52 – 56].
Výhodou přímých inhibitorů fXa je možnost jejich podání u pacientů s renální insuficiencí. Rivaroxaban se totiž vylučuje z 33 % renálně, apixaban z 25 % a edoxaban z 50 %. Pacientům s těžkou renální insuficiencí < 15 ml/ min není doporučeno tyto léky podávat. Při CrCl 15 – 49 ml/ min by měla být dávka v prevenci redukována dle doporučení v SPC. Dalšími kontraindikacemi je jaterní postižení s koagulopatií a s relevantním rizikem krvácení (u jaterní cirhózy Child-Pugh B a C), klinicky významné aktivní krvácení, stavy spojené s vysokým rizikem vážného krvácení, pacienti s umělými srdečními chlopněmi, při hypersenzitivitě, souběžná léčba jinými antikoagulancii s výjimkou převodu perorálních antikoagulancií, nekontrolovaná těžká hypertenze, těhotenství a kojení. Nedoporučuje se jejich podávání s inhibitory CYP3A4 a P-gp, tedy se systémově podávanými azolovými antimykotiky a inhibitory HIV proteáz. Při podávání NOAC s jinými antitrombotiky či nesteroidními antiflogistiky dochází ke zvýšení rizika krvácení [10,51,53 – 55].
Dabigatran etexilát se vylučuje z 80 % renálně a je kontraindikován u nemocných s CrCl < 30 ml/ min. Dále není indikován u nemocných užívajících systémově podávané interagující léky (např. ketokonazol, cyklosporin, itrakonazol, dronedaron, takrolimus). Jinak pro něj platí stejné kontraindikace jako pro přímé inhibitory fXa. Výhodou dabigatranu je existence specifického antidota – Fab fragment humanizované monoklonální protilátky, idarucizumabu – a možnost eliminace dialyzační metodou [10,51,52].
Výjimkou jsou prozatím onkologičtí pacienti, u nichž se sice NOAC jeví na základě dostupných prací jako účinné a bezpečné, nicméně tyto výsledky je třeba interpretovat v širším kontextu. Tyto práce nebyly primárně zaměřeny na onkologické pacienty, a mají tedy jisté nedostatky a jejich výsledky bude ještě třeba v budoucnu verifikovat [48,49].
V současnosti jsou pro geriatrické pacienty NOAC vhodné v prevenci TEN v jasně dané chirurgické indikaci. Ve stáří najdou v budoucnu tyto léky své místo vzhledem k jejich příznivým vlastnostem zmíněným výše. Indikaci v profylaxi TEN u nechirurgických pacientů zatím můžeme jen očekávat.
Warfarin, fondaparinux a kyselina acetylsalicylová
V případě kontraindikace podání výše zmíněných léků lze zvážit podání warfarinu (antagonista vitaminu K, kumarinový derivát). Toto užití je však vhodnější u chirurgického pacienta než u interního [6,50,57]. Dále existuje přímý inhibitor faktoru Xa fondaparinux (syntetický pentasacharid), jehož význam je jasně vymezen a cena vysoká [5]. U kyseliny acetylsalicylové nejsou dostatečná data potvrzující její účinnost a bezpečnost v prevenci primární flebotrombózy, a není tedy doporučena pro profylaxi TEN [5,35,58].
Nefarmakologická profylaxe
V případě, že je farmakologická profylaxe kontraindikována či je nutné ji při vysokém riziku TEN doplnit, užíváme mechanických metod prevence. K nim se řadí kompresivní graduovaná bandáž dolních končetin, cvičení dolních končetin, hydratace, časná mobilizace nebo intermitentní pneumatické komprese. U extrémně rizikových pacientů lze zvažovat i kavální filtry k zabránění vzniku PE, nicméně doposud není dostatek dat, která by tuto metodu v této indikaci dostatečně podpořila. Mělo by se jednat také o filtr odstranitelný. Samostatně tyto metody nejsou dostatečně účinné v prevenci TEN [5,25,43].
Závěr
Na geriatrického pacienta je třeba pohlížet jako na vulnerabilní a fragilní entitu vzhledem k vzniku tromboembolie. Tito nemocní mají již sami o sobě jeden rizikový faktor – věk; a k němu se přidávají další. Je pro ně charakteristická polymorbidita, polyfarmakoterapie a vzájemné interakce nemocí a léků. Při přijetí k hospitalizaci musíme zvažovat rizika tromboembolizmu v heterogenní skupině pacientů a váhu jednotlivých rizik [6,17,24]. K odhadu rizika je vhodné užití skórovacích systémů, např. Padua Prediction Score [36,37]. Tromboembolii se snažíme včas předcházet individuálně volenou profylaxí s ohledem na možné benefity i rizika, zejména krvácení [4,23,24].
Při podávání profylaxe TEN ve stáří máme na paměti několik zásad:
- citlivost k antikoagulačním lékům roste s věkem;
- polyfarmakoterapie (vč. doplňků stravy) vede ke zvýšení rizika lékových interakcí, které působí na protisrážlivý efekt a mohou zvyšovat riziko krvácení;
- polymorbidita rovněž zvyšuje riziko krvácení (např. renální selhání, krvácení do gastrointestinálního traktu, závažná anémie, krvácivé stavy, hemoragický iktus);
- snížená compliance a možnost monitoringu jsou faktory zvyšující riziko krvácení [4,6,24].
Doručeno do redakce: 25. 12. 2017
Přijato po recenzi: 15. 1. 2018
MU Dr. Dana Weberová
Sources
1. Musil D. Diagnostika a léčba tromboembolické nemoci z pohledu 10. ACCP doporučení. Interní Med 2017; 19(1): 7 – 9.
2. Anderson FA Jr, Wheeler HB, Goldberg RJ et al. A population-based perspective of the hospital incidence and case-fatality rates of deep vein thrombosis and pulmonary embolism. The Worcester DVT study. Arch Intern Med 1991; 151(5): 933 – 938.
3. Karetová D, Bultas J. Možnosti léčby hluboké žilní trombózy v roce 2014. Kardiol Rev Int Med 2014; 16(4): 330 – 335.
4. Lacut K, Le Gal G, Mottier D. Primary prevention of venous thrombembolism in elderly medical patients. Clin Interv Aging 2008; 3(3): 399 – 411.
5. Hirmerová J. Profylaxe žilních tromboembolických komplikací v interních oborech – rozpor mezi teorií a praxí. Vnitř Lék 2006; 52(4): 379 – 388.
6. Musil D. Žilní tromboembolická nemoc a antikoagulační léčba u seniorů. Interní Med 2013; 15(3 – 4): 94 – 98.
7. Karetová D, Chochola M, Linhart A. Prevence trombembolické nemoci ve vnitřním lékařství. Čas Lék čes 2006; 145 : 353 – 357.
8. Heit JA, O’Fallon WM, Petterson TM et al. Relative impact of risk factors for deep vein thrombosis and pulmonary embolism: a population based study. Arch Intern Med 2002; 162(11): 1245 – 1248.
9. Sandler DA, Martin JF. Autopsy proven pulmonary embolism in hospital patients: Are we detecting enough deep vein thrombosis? J R Soc Med 1989; 82(4): 203 – 205.
10. Ludka O. Antitrombotická léčba tromboembolické žilní nemoci. Interní Med 2016; 18(5): 222 – 225.
11. International Consensus Statement – Prevention and treatment of venous thromboembolism (Guidelines according to scientific evidence). Int Angiol 2006; 25(2): 101 – 161.
12. Lindbald B, Sternby NH, Bergqvist D. Incidence of venous thromboembolism verified by necropsy over 30 years. BMJ 1991; 302(6778): 709 – 711.
13. Leizorovicz A, Cohen AT, Turpie A. Randomized, placebo-controlled trial of dalteparin for the prevention of venous thromboembolism in acutely ill medical patients. Circulation 2004; 110(7): 874 – 879.
14. Rokyta R, Hutyra M, Jansa P. 2014 ESC Guidelines on the diagnosis and management of acute pulmonary embolism. Summary document prepared by the Czech Society of Cardiology. Cor Vasa 2015; 57 : 275 – 296. doi: 10.1016/ j.crvasa.2015.05.009.
15. Kearon C, Akl EA, Omelas J et al. Antithrombotic therapy for VTE disease. CHEST guideline and expert panel report. Chest 2016; 149(2): 315 – 352. doi: 10.1016/ j.chest.2015.11.026.
16. Musil D. Rizika a prevence tromboembolické choroby. Med Pro Praxi 2009; 6(2): 61 – 65.
17. Shetty HG, Campbell IA, Routledge PA. Venous thromboembolism in the elderly. In: Fillit HM, Rockwood K, Woodhouse K et al. Brocklehurst’s textbook of geriatric medicine and gerontology. 7. vyd. Philadelphia, USA: Elsevier 2010 : 356 – 360.
18. Oger E. EPI-GETBO Study Group. Incidence of venous thrombembolism: a community-based study in Western France. Thromb Haemost 2000; 83(5): 657 – 660.
19. Heit JA, Silverstein MD, Mohr DN et al. The epidemiology of venous thrombembolism in the community. Thromb Haemost 2001; 86(1): 452 – 463.
20. Kniffin WD Jr, Baron JA, Barrett J et al. The epidemiology of diagnosed pulmonary embolism and deep venous thrombosis in the elderly. Arch Intern Med 1994; 154(8): 861 – 866.
21. Weber P, Weberová D, Kubešová H. Pulmonary embolism in the elderly – Significance and particularities. In: Cobanoglu U. Pulmonary embolism. 1. vyd. Rijeka, Chorvatsko: InTech 2012 : 37 – 66.
22. Le Gal G, Righini M, Roy PM et al. Differential value of risk factors and clinical signs for diagnosing pulmonary embolism according to age. J Thromb Haemost 2005; 3(11): 2457 – 2464. doi: 10.1111/ j.1538-7836.2005.01598.x.
23. Lopez-Jimenez L, Montero M, Gonzalez-Fajardo JA et al. RIETE Investigators. Venous thrombembolism in very elderly patients: findings from a prospective registry (RIETE). Haematologica 2006; 91(8): 1046 – 1051.
24. Silverstein RL, Bauer KA, Cushman M et al. Venous thrombosis in the elderly: more questions than answers. Blood 2007; 110(9): 3097 – 3101. doi: 10.1182/ blood-2007-06-096545.
25. White RH. The epidemiology of venous thrombembolism. Circulation 2003; 107 (23 Suppl 1): 14 – 18.
26. Cobanoglu U. Risk factor for pulmonary embolism. In: Cobanoglu U. Pulmonary embolism. 1st ed. Rijeka, Chorvatsko: InTech 2012 : 1 – 18.
27. Weber P, Weberová D, Ambrošová P et al. Hluboká žilní trombóza a plicní embolie v geriatrické medicině – dvě strany jedné mince. Kardiol Rev 2012; 14(1): 17 – 21.
28. Samama MH. An epidiomologic study of risk factors for deep venous thrombosis in medical outpatients: the SIRIUS study. Arch Intern Med 2000; 160(22): 3415 – 3420.
29. Alikhan R, Cohen AT, Combe S et al. MEDENOX study. Risk factors for venous thrombembolism in hospitalized patients with acute medical illness: analysis of the MEDENOX study. Arch Intern Med 2004; 164(9): 963 – 968.
30. Vaitkus PT, Leizorovicz A, Cohen AT et al. PREVENT Medical Thromboprophylaxis Study Group. Mortality rates and risk factors for asymptomatic deep venous thrombosis in medical patients. Thromb Haemost 2005; 93(1): 76 – 79. doi: 10.1160/ TH04-05-0323.
31. Spyropoulos AC. Risk assessment of venous thromboembolism in hospitalized medical patients. Cur Opin Pulm Med 2010; 16(5): 419 – 425. doi: 10.1097/ MCP.0b013e32833b4669.
32. Khorana AA, Carrier M, Garcia DA et al. Guidance for the prevention and treatment of cancer-associated venous thrombembolism. J Thromb Thrombolysis 2016; 41(1): 81 – 91. doi: 10.1007/ s11239-015-1313-4.
33. Garcia Escobar I, Antonio Rebollo M, García Adrián S et al. Cancer and Thrombosis Working Group of the Spanish Society of Medical Oncology (SEOM). Safety and efficacy of primary thromboprophylaxis in cancer patients. Clin Transl Oncol 2017; 19(1): 1 – 11. doi: 10.1007/ s12094-016-1500-6.
34. Krška Z. Prevence TEN v chirurgii, prolongovaná tromboprofylaxe. Rozhl Chir 2012; 91(5): 256 – 261.
35. Goldhaber SZ, Turpie AG. Prevention of venous thromboembolism among hospitalized patients. Circulation 2005; 111(1): e1 – e3. doi: 10.1161/ 01.CIR.0000150393.51958.54.
36. Barbar S, Noventa F, Rossetto V et al. A risk assessment model for the identification of hospitalized medical patients at risk for venous thromboembolism: the Padua Prediction Score. J Thromb Haemost 2010; 8(11): 2450 – 2457. doi: 10.1111/ j.1538-7836.2010.04044.x.
37. Germini F, Agnelli G, Fedele M et al. Padua Prediction Score or clinical judgment for decision making on antithrombotic prophylaxis: a quasi-randomized controlled trial. J Thromb Thrombolysis 2016; 42(3): 336 – 339. doi: 10.1007/ s11239-016-1358-z.
38. Palareti G, Schellong S. Isolated distal deep vein thrombosis: chat we know and chat we are doing. J Thromb Haemost 2012; 10(1): 11 – 19. doi: 10.1111/ j.1538-7836.2011.04564.x.
39. Hlásenský J, Mihalová Z, Špinar J et al. Skórovací systémy u tromboembolické nemoci. Kardiol Rev Int Med 2015; 17(2): 126 – 130.
40. Patell R, Rybicki L, McCrae KR et al. Predicitng risk of venous thromboembolism in hospitalized cancer patients: utility of a risk assessment tool. Am J Haematol 2017; 92(6): 501 – 507. doi: 10.1002/ ajh.24700.
41. Bahl V, Hu HM, Henke PK et al. A validation study of a retrospective venous thromboembolism risk scoring method. Ann Surg 2010; 251(2): 344 – 350. doi: 10.1097/ SLA.0b013e3181b7fca6.
42. Caprini JA. Thrombosis risk assessment as a guide to quality patient care. Dis Mon 2005; 51(2 – 3): 70 – 78.
43. Geerts WH, Pineo GF, Heit JA et al. Prevention of venous thromboembolism: the Seventh ACCP Conference on Antithrombotic Therapy. Chest 2004; 126 (3 Suppl): 338S – 400S.
44. Mayer O. Nízkomolekulární hepariny v prevenci a léčbě žilního tromboembolizmu. Interní Med 2007; 1 : 39 – 41.
45. Bultas J, Karetová D. Nízkomolekulární hepariny – jejich význam v současné praxi. Interní Med 2011; 13(11): 440 – 444.
46. Kessler P. Nízkomolekulární hepariny v ambulantní praxi. Interní Med 2010; 12(7 a 8): 361 – 365.
47. Špác J. Nízkomolekulární hepariny v terapii kardiovaskulárních nemocí. Interní Med 2001; 2 : 75 – 79.
48. Palacka P, Hirmerová J. Dva pohľady na venózny tromboembolizmus u onkologických pacientov. Vnitř Lék 2017; 63(6): 431 – 440.
49. Šmrha J, Kessler P, Poul H et al. Dlouhodobá léčba tromboembolické nemoci u pacientů se zhoubným nádorem. Vnitř Lék 2016; 62(6): 449 – 452.
50. Bona RD, Sivjee KY, Hickey AD et al. The efficacy and safety of oral anticoagulation in patients with cancer. Thromb Haemost 1995; 74(4): 1055 – 1058.
51. Michalcová J, Penka M, Bulíková A. Nová – přímá perorální antikoagulancia: aktuální přehled. Vnitř Lék 2016; 62(10): 805 – 813.
52. Janský P. Účinnost a bezpečnost dabigatranu při podávání dle SPC a evropských doporučení. Vnitř Lék 2017; 63(6): 450 – 451.
53. Urbánek K. Rivaroxaban – farmakologický profil. Kardiol Rev Int Med 2017; 19(1): 39 – 44.
54. Špinar J, Špinarová L. Rivaroxaban u rizikových pacientů. Vnitř Lék 2017; 63(6): 424 – 430.
55. Lábrová R, Lábr K. Edoxaban – farmakologický profil. Kardiol Rev Int Med 2017; 19(1): 45 – 50.
56. Kessler P. Nová antitrombotika v prevenci pooperační tromboemolické nemoci. Kardiol Rev 2012; 14(2): 93 – 96.
57. Bern MM, Lokich JJ, Wallach SR et al. Very low doses of warfarin can prevent thrombosis in central venous catheters. A randomized prospective trial. Ann Intern Med 1990; 112(6): 423 – 428.
58. An VV, Phan K, Levy Y et al. Aspirin as thromboprophylaxis in hip and knee arthroplasty: a systemic review and meta-analysis. J Arthroplasty 2016; 31(11): 2608 – 2616. doi: 10.1016/ j.arth.2016.04.004.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2018 Issue 1-
All articles in this issue
- Srdeční selhání ve stáří
- Specifika diagnostiky a léčby ve stáří
- Léčba arteriální hypertenze u starších osob
- Polyfarmakoterapie ve stáří – lékové interakce nejčastěji předepisovaných lékových skupin v kardiologii
- Chronické srdeční selhání a paliativní péče
- Tyreopatie ve stáří a kardiovaskulární postižení
- Přínosy a rizika profylaxe tromboembolické nemoci u geriatrického pacienta
- Imunosenescence a infekční komplikace vyššího věku
- Duální inhibice AT1 receptoru pro angiotenzin II a neprilysinu nebo inhibice angiotenzin konvertujícího enzymu?
- Přehled echokardiografických parametrů v diagnostice srdečního selhání se zachovalou ejekční frakcí levé komory
-
Stručný komentář k novým doporučením pro léčbu hypertenze v USA
2017 ACC/ AHA High Blood Pressure Guideline - Závratě a pády jako častá symptomatologie kardiovaskulárního postižení ve vyšším věku
- Dapagliflozin a studie DECLARE – vstupní charakteristika
- Zvýšená hladina NP u stabilních pacientů 3 měsíce po STEMI je jednoduchý nástroj k predikci dlouhodobé nepříznivé prognózy
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Přehled echokardiografických parametrů v diagnostice srdečního selhání se zachovalou ejekční frakcí levé komory
- Specifika diagnostiky a léčby ve stáří
- Srdeční selhání ve stáří
- Tyreopatie ve stáří a kardiovaskulární postižení
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

