Onkopatologické aspekty inaktivace genů BRCA1 a BRCA2 v nádorech ovaria, děložní tuby a pánevního peritonea
Oncopathological aspects of BRCA1 and BRCA2 genes inactivation in tumors of ovary, fallopian tube and pelvic peritoneum
Ovarian carcinoma represents a heterogeneous group of malignant epithelial tumors which could be divided into two fundamental groups: Type I (endometrioid carcinoma, clear cell carcinoma, low grade serous carcinoma, mucinous carcinoma and more rare seromucinous carcinoma and malignant Brenner tumor) and type II (high grade serous carcinoma – HGSC). HGSC is the most frequent ovarian carcinoma which may be etiologically linked to inactivation of tumor suppressor genes BRCA1/2 and TP53 and differs from type I carcinomas by higher aggressiveness, tendency to peritoneal spread and worse prognosis. A precursor lesion of HGSC was described as a serous tubal intraepithelial carcinoma (STIC) which is usually localized in fimbria of the fallopian tube from where tumor cells are capable to implant on ovary and pelvic peritoneum. Therefore, HGSC may present itself not only as a tuboovarian tumor but also as a primary peritoneal carcinoma. HGSC constitutes a dominant group within hereditary ovarian carcinomas as a manifestation of hereditary breast and ovarian cancer or site-specific ovarian cancer syndromes which are associated with germinal mutations of BRCA1/2 genes. BRCA1 deficient HGSC show characteristic histological appearance which encompasses SET features (Solid-pseudoEndometrioid-Transitional), significant nuclear atypia and mitotic activity, geographic necrosis, marked lymphocytic infiltration and abnormalities in TP53 expression. Use of immunohistochemistry as a screening method for BRCA1/2 inactivation is questionable at this time. Bilateral adnexectomy is considered to be a standard prophylactic treatment of women affected by germinal BRCA1/2 mutation. In that case, fallopian tubes should be submitted completely for the histological evaluation according to the SEE-FIM protocol (Sectioning and Extensively Examining the FIMbria) due to the risk of STIC or occult HGSC. Tumors with BRCA1/2 inactivation show a better therapeutic response to platinum-based chemotherapeutic compounds and a more favorable prognosis. Inhibitors of poly(ADP-ribose) polymerase (PARP) are the next generation of antitumor agents comprising olaparib which is implemented in clinical practice currently. Germinal or somatic inactivation of BRCA1/2 serves as a predictor for targeted oncologic therapy by PARP inhibitors, therefore evaluation of these genes in ovarian carcinoma patients will be carried out by departments of pathology and clinical genetics. Next generation sequencing seems to be an ideal method for the reduction of the time factor and optimization of BRCA1/2 analysis. Unfortunately, a routine test for the evaluation of homologous recombination functionality and detection of “BRCAness” in sporadic tumors is still not available.
Keywords:
BRCA1 – BRCA2 – hereditary breast and ovarian cancer syndrome – high grade serous carcinoma – SEE-FIM protocol – PARP inhibitors
Autoři:
Petr Škapa 1; Pavel Dundr 2
Působiště autorů:
Ústav patologie a molekulární medicíny 2. LF UK a FN Motol, Praha
1; Ústav patologie 1. LF UK a VFN, Praha
2
Vyšlo v časopise:
Čes.-slov. Patol., 52, 2016, No. 4, p. 199-204
Kategorie:
Přehledový článek
Souhrn
Karcinom ovaria je heterogenní skupinou maligních epitelových nádorů, které lze rozdělit do dvou základních skupin: typ I (endometroidní karcinom, světlobuněčný karcinom, low grade serózní karcinom, mucinózní karcinom a vzácnější seromucinózní karcinom a maligní Brennerův nádor) a typ II (high grade serózní karcinom – HGSC). Nejčastějším ovariálním karcinomem je HGSC, který bývá etiologicky asociován s inaktivací tumor supresorových genů BRCA1/2 a TP53 a od karcinomů typu I se odlišuje vyšší agresivitou, tendencí k peritoneální diseminaci a horší prognózou. Za prekurzorovou lézi HGSC je považován serózní tubární intraepiteliální karcinom (STIC), lokalizovaný nejčastěji v oblasti fimbrií děložní tuby, odkud se nádorové buňky mohou šířit na ovarium nebo pánevní peritoneum. HGSC se proto kromě tuboovariální lokalizace může prezentovat též jako primární peritoneální karcinom. Ve skupině hereditárních karcinomů ovaria tvoří HGSC dominantní část v rámci syndromu hereditárního karcinomu prsu a ovaria nebo „site-specific“ ovariálního karcinomu, které jsou asociovány s germinálními mutacemi genů BRCA1/2. V souvislosti s inaktivací genu BRCA1 se vyskytují charakteristické histologické rysy HGSC, které zahrnují tzv. SET úpravu (Solidní-pseudoEndometroidní-Tranzicionální), vystupňované jaderné atypie a mitotickou aktivitu, geografické nekrózy, výraznější lymfocytární infiltraci a abnormality v expresi TP53. Využití imunohistochemie jako screeningového nástroje inaktivace genů BRCA1/2 je v současnosti diskutabilní. U pacientek s prokázanou germinální mutací BRCA1/2 je standardem profylaktické léčby oboustranná adnexektomie. V tom případě mají být děložní tuby z důvodu možné přítomnosti STIC nebo okultního HGSC kompletně histologicky zpracovány dle protokolu SEE-FIM (Sectioning and Extensively Examining the FIMbria). Nádory s inaktivací genů BRCA1/2 vykazují lepší terapeutickou odpověď na platinové deriváty a jsou asociovány s příznivější prognózou. Léčivy nové generace jsou inhibitory poly(ADP-riboso) polymerázy (PARP), mezi které spadá olaparib v současnosti zaváděný do klinické praxe. Prediktorem cílené onkologické léčby PARP inhibitory je germinální nebo somatická inaktivace BRCA1/2, proto bude analýza těchto genů u pacientek s karcinomem ovaria probíhat na pracovištích patologie i klinické genetiky. Pro zkrácení časového faktoru a optimalizaci vyšetření se ideální metodikou jeví sekvenování nové generace. Dosud však není k dispozici rutinní test k analýze funkčnosti homologní rekombinace a průkazu „BRCAness“ u sporadických nádorů.
Klíčová slova:
BRCA1 – BRCA2 – hereditární karcinom prsu a ovaria – high grade serózní karcinom – protokol SEE-FIM – PARP inhibitory
DUALISTICKÝ KONCEPT KARCINOMŮ OVARIA
Karcinom ovaria je společné označení pro heterogenní skupinu maligních epitelových nádorů, které se liší nejen svým histologickým vzhledem, ale též spektrem molekulárních změn, patogenezí, klinickým chováním a v neposlední řadě i prognózou. V současnosti je definováno 5 hlavních histologických typů karcinomu ovaria se značně variabilní frekvencí výskytu (obr. 1): high grade serózní karcinom (HGSC) (70 %), endometroidní karcinom (EC) (10 %), světlobuněčný karcinom (CCC) (10 %), low grade serózní karcinom (LGSC) (5 %) a mucinózní karcinom (MC) (3 %) (1). Ostatní ovariální karcinomy jsou velmi vzácné a jejich celková četnost nepřesahuje 2 % (1). Základní klinicko-patologické rozdíly jednotlivých histologických typů ovariálních karcinomů jsou shrnuty v tabulce č. 1 a příklady jejich mikroskopického vzhledu jsou znázorněny v obrázku č. 2.
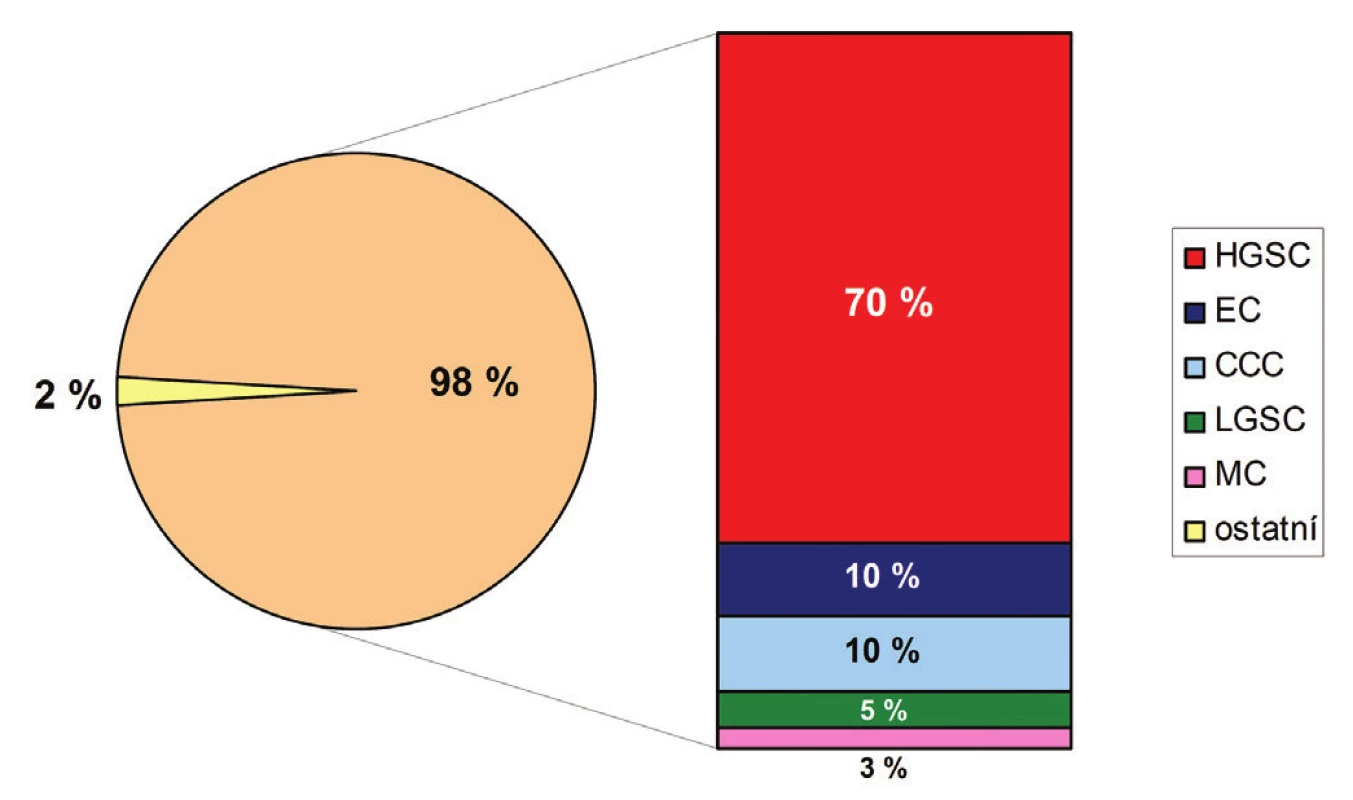
HGSC – high grade serózní karcinom; EC – endometroidní karcinom; CCC – světlobuněčný karcinom; LGSC – low grade serózní karcinom; MC – mucinózní karcinom
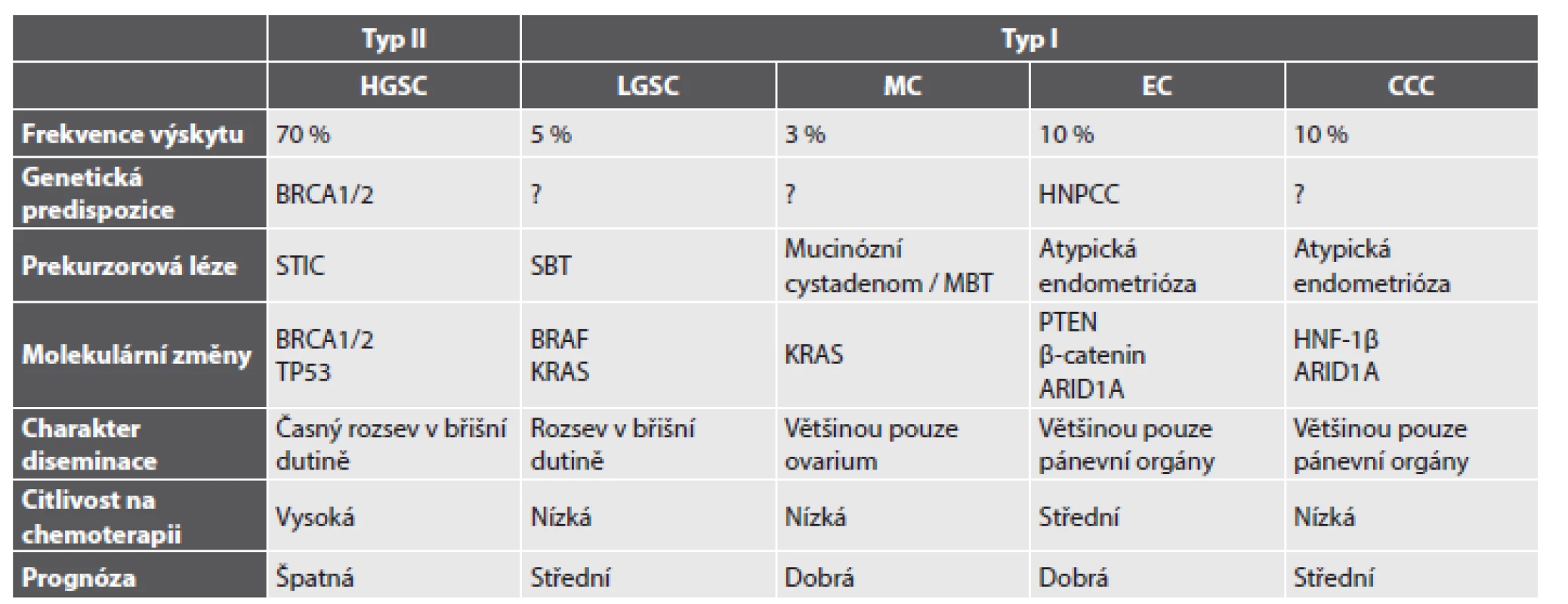
A – HGSC (HE, 200x); B – EC (HE, 200x); C – CCC (HE, 200x); D – LGSC (HE, 200x); E – MC (HE, 200x).
HGSC – high grade serózní karcinom; EC – endometroidní karcinom; CCC – světlobuněčný karcinom; LGSC – low grade serózní karcinom; MC – mucinózní karcinom
Na základě určitých společných charakteristik lze karcinomy ovaria rozdělit do dvou širších skupin – typ I a typ II (tab. 1) (2,3).
Nádory typu I jsou podle současného přístupu děleny do 3 skupin:
- nádory asociované s endometriózou (EC, CCC a seromucinózní karcinom);
- LGSC; a
- MC a maligní Brennerův nádor (4).
Většinou se jedná o pomaleji progredující karcinomy nižšího stupně malignity, které mají tendenci k lokalizovanému postižení ovaria nebo malé pánve, s nižší anebo pozdní frekvencí extraovariální a extrapelvické peritoneální diseminace. Nižší proliferační aktivita nádorových buněk přináší variabilní odpověď na chemoterapii, avšak při vhodně zvolené chirurgické léčbě je prognóza pacientek relativně dobrá. V etiopatogenezi těchto nádorů se uplatňují defekty širšího spektra genů, které vedou k postupné transformaci benigní prekurzorové léze (adenom nebo endometrióza) do borderline nádoru a následně karcinomu.
Nádory typu II (HGSC) jsou naopak vysoce agresivní karcinomy s přímým high grade prekurzorem, časným extrapelvickým peritoneálním rozsevem a špatnou prognózou, a to i přes poměrně dobrou odpověď na chemoterapii. Typickým molekulárním defektem v této skupině je ztráta funkce tumor supresorových genů BRCA1/2 a TP53.
Na tomto místě je nutno zdůraznit diametrální rozdíly mezi dvěma podtypy serózního karcinomu ovaria. LGSC a HGSC již nejsou podle současných poznatků vnímány jako různé stupně diferenciace jednoho typu nádoru, ale jako zcela rozdílná onemocnění (1,3). Jejich histopatologické odlišení hraje proto zásadní úlohu ve volbě odpovídající terapie a odhadu prognózy pacientky, ale v budoucnu i ve správné indikaci molekulární analýzy genů BRCA1/2.
HEREDITÁRNÍ KARCINOM OVARIA
Hereditární karcinom ovaria je definován familiárním výskytem v důsledku autozomálně dominantní genetické predispozice s vysokou penetrancí. Do této kategorie spadá přibližně 10 % karcinomů ovaria, z nichž je 90 % asociováno s inaktivací genů BRCA1/2 a část ze zbývajících 10 % je způsobena defekty jiných genů podílejících se na procesu homologní rekombinace, regulaci buněčného cyklu (ATM, TP53) či DNA mismatch repair genů (MMR) (především hMLH, hMSH2 a hMSH6) (5,6). V závislosti na typu genetické změny a klinické prezentaci lze hereditární karcinomy ovaria rozdělit do 3 základních skupin (5-7):
- hereditární karcinom prsu a ovaria,
- „site-specific“ ovariální karcinom (výskyt pouze ovariálního karcinomu, tj. bez karcinomu prsu) a
- karcinom ovaria v rámci syndromu hereditárního nepolypózního kolorektálního karcinomu (HNPCC).
První dva syndromy jsou spojeny se ztrátou funkce BRCA1/2 a vedou ke vzniku HGSC, zatímco HNPCC je způsoben defektem MMR genů a je typicky doprovázen vznikem EC (7-9). Vzácně byly v asociaci s germinálními mutacemi genů BRCA1/2 popsány i EC, CCC, tranzicionální karcinomy, nediferencované karcinomy, smíšené karcinomy a maligní smíšené mülleriánské nádory (8,10). Další studie však tato pozorování nepotvrdila (9), otázkou proto zůstává správnost histopatologických diagnóz a aktuálnost použité terminologie v předchozích pracích. Zpochybňován je i výběr pacientek (9), neboť u některých studií nebyla vůbec prováděna mutační analýza a do souboru byly zařazeny pouze na základě defektu BRCA1 prokázaného u některého člena rodiny pacientky (10).
Celoživotní riziko rozvoje ovariálního karcinomu u žen s germinální mutací genu BRCA1 dosahuje až 66 %, zatímco v případě ztráty funkce genu BRCA2 se riziko odhaduje na 10 - 20 % (11). Hereditární karcinomy ovaria asociované s inaktivací BRCA1 též vznikají v signifikantně mladším věku než sporadické nádory, typicky mezi 40. až 50. rokem a v téměř 10 % případů i před 40. rokem života (8).
HIGH GRADE SERÓZNÍ KARCINOM OVARIA (HGSC)
HGSC postihuje v oblasti vnitřního ženského genitálu především ovarium a děložní tubu, ale může se rozvinout i na přilehlém peritoneu, kde potom odpovídá tzv. primárnímu peritoneálnímu karcinomu. HGSC je podle literárních údajů asi ve 30 - 40 % asociován s inaktivací BRCA1 či BRCA2 a celkově až 50 % HGSC vykazuje poruchy homologní rekombinace, které kromě inaktivace genu BRCA1/2 mohou souviset např. s amplifikací či mutací EMSY, delecí PTEN či mutací některého z genů Fanconiho anémie (12,13). Tato inaktivace může být na podkladě hereditární (germinální) či somatické mutace, případně k ní dochází na podkladě metylace promotoru BRCA1 (14,15).
Histologicky je HGSC definován papilárním nebo solidním typem růstu s přítomností štěrbinovitých glandulárních lumin. Nádorové buňky vykazují jaderné atypie středního a vyššího stupně, často bývají přítomny atypické vícejaderné buňky nebo buňky s bizarními objemnými jádry. Mitotická aktivita nádorových buněk je vysoká a dle definice přesahuje 12 mitóz / 10 mikroskopických polí při vysokém zvětšení (HPF). Některé nádory obsahují psammomatózní tělíska. Často se vyskytují úseky nekrózy. Přítomnost tranzicionálních a pseudoendometroidních partií je zcela v souladu s diagnózou HGSC, stejně tak i světlobuněčné a nediferencované úseky neopravňují za přítomnosti typické komponenty HGSC k diagnóze CCC, nediferencovaného karcinomu nebo smíšeného karcinomu (1). Většina nádorů diagnostikovaných dříve jako smíšené HGSC/EC, HGSC/CCC, HGSC/tranzicionální a HGSC/nediferencované karcinomy odpovídá dle současných názorů morfologickým variantám HGSC (1).
HISTOLOGICKÉ CHARAKTERISTIKY HGSC S INAKTIVACÍ GENŮ BRCA1/2
V souvislosti s inaktivací BRCA1/2 se vyskytují určité charakteristické morfologické rysy, které v případě BRCA1 zahrnují tzv. SET úpravu (tedy Solidní-pseudoEndometroidní-Tranzicionální), výrazné jaderné pleomorfie, vysokou mitotickou aktivitu, geografické nekrózy, výraznější lymfocytární infiltraci (TIL – „tumor infiltrating lymfocytes“) a častější abnormality v expresi TP53 (12,16). Oblasti se SET úpravou se v nádorech asociovaných s BRCA1/2 inaktivací obvykle vyskytují difúzně (jako hranice pro klasifikaci nádoru se SET rysy je arbitrárně udáváno 25 % objemu vyšetřeného nádoru), oproti tomu v nádorech bez inaktivace BRCA1/2, pokud jsou tyto změny přítomny, tak spíše fokálně. Bez ohledu na význam pro odhad možného výskytu inaktivace BRCA1/2 je znalost SET morfologie zásadní s ohledem na správnou diagnózu – tranzicionální karcinom (s výjimkou maligního Brennerova nádoru) již jako samostatná jednotka dle poslední WHO klasifikace nádorů ženského genitálu neexistuje a bere se jako morfologická varianta HGSC (17). Nicméně záměna HGSC s pseudoendometroidními rysy za málo diferencovaný EC je možná, a pro pacientku může mít s ohledem na terapeutické i další aspekty (např. testování a genetické poradenství) závažné důsledky. Obecně platí, že málo diferencované EC ovaria jsou vzácné, a většina tak hodnocených nádorů byla dle jedné studie při důkladném zhodnocení všech parametrů reklasifikovaná právě jako HGSC (18). Další rys vyskytující se u nádorů s BRCA1/2 inaktivací jsou TIL – hodnotí se tzv. „hot-spots“ – tedy oblasti s nejvyšším výskytem CD8+ TIL (12,16). Zvýšená infiltrace CD8+ T lymfocyty se zdá být prognosticky příznivý faktor, naopak infiltrace CD4+ T lymfocyty je asociována s horší prognózou (19-21). V jedné studii zabývající se podrobnou analýzou morfologických znaků asociovaných s inaktivací BRCA1/2 byl nicméně medián TIL podobný u nádorů s i bez inaktivace (kolem 30 / HPF), s výjimkou případů asociovaných s metylací promotoru BRCA1, u kterých byl medián 52 / HPF (12). Stejně jako již zmíněné, i ostatní znaky (jaderné pleomorfie, mitotická aktivita, výskyt geografických nekróz) se v této studii vyskytovaly u obou skupin nádorů s různou incidencí. Algoritmický přístup v této práci zahrnoval kombinaci 3 popsaných znaků (celkem 2 různé skupiny) s tím, že ≥ 2 znaky byly hodnoceny jako suspektní z inaktivace BRCA1/2, 1 znak jako indeterminovaný, žádný znak jako negativní. Tento algoritmický přístup vykazoval s ohledem na predikci inaktivace BRCA1/2 poměrně vysokou senzitivitu, avšak nízkou specifitu a asi polovina nádorů bez prokázané inaktivace BRCA1/2 vykazovala suspektní morfologii. To může nicméně souviset s poruchou homologní rekombinace na úrovni jiných genů, které však v rámci studie nebyly analyzovány.
Nádory se ztrátou funkce genů BRCA1/2 vykazují lepší terapeutickou odpověď na platinové deriváty a celkově jsou asociovány s lepší prognózou (20). To platí i pro intraperitoneální aplikaci platinových derivátů, která má ve srovnání s intravenózní aplikací dle některých studií v indikovaných případech lepší výsledky (22-24). Logickým krokem by se tedy u nádorů s BRCA1/2 inaktivací zdálo využití imunohistochemie, alespoň jako jakéhosi screeningového nástroje. Vztah mezi hodnocením imunohistochemické exprese proteinu a přítomností inaktivace BRCA1/2 je však do určité míry diskutabilní. Dle některých studií je vazba velmi slabá a statisticky neprůkazná (16). Jiné práce se zabývaly prognostickým významem exprese BRCA1 či BRCA2 u různých nádorů, avšak bez návaznosti na mutační stav genu BRCA1/2 (25). Většina studií nicméně prokázala, alespoň s protilátkou proti BRCA1, poměrně vysokou senzitivitu i specificitu a dle těchto prací je screening pomocí imunohistochemického vyšetření založeného na ztrátě exprese BRCA1 možný (26-28).
Závěrem lze konstatovat, že morfologie nádorů s inaktivací BRCA1/2 vykazuje určité odlišnosti od zbylých nádorů a na podkladě zastoupených morfologických znaků tedy lze s poměrně vysokou mírou pravděpodobnosti predikovat výsledek genetického vyšetření. Jako alternativa použitelná pro jakési screeningové vyšetření a doplňující popsané morfologické rysy se zdá být imunohistochemická ztráta exprese proteinu BRCA1. V kontextu stávající situace, vzhledem k novým indikačním kritériím ke genetickému testování mutací v genech BRCA1/2, a také k testování souvisejícímu s možností léčbou PARP inhibitory, by však k molekulárnímu vyšetření BRCA1/2 měly být indikovány pacientky bez ohledu na morfologický charakter HGSC či výsledky imunohistochemických vyšetření (29). Znalost morfologického obrazu nádorů asociovaných s inaktivací BRCA1/2 je však zásadně důležitá i pro vlastní diagnostiku a správné určení histologického typu nádoru v rámci primární diagnózy.
CHIRURGICKÉ ASPEKTY INAKTIVACE GENŮ BRCA1/2
Poznatky získané během vyšetřování děložních tub u pacientek s BRCA1/2 mutací a profylaktickou adnexektomií vedly k zásadním změnám v nahlížení na prekurzor HGSC, kterým se zdá být u značné části pacientek serózní tubární intraepiteliální karcinom (STIC), lokalizovaný nejčastěji v oblasti fimbrií děložní tuby (obr. 3). Dále byly definovány jednotky, jako jsou p53 signatury a expanze sekrečních buněk (více než 10 sekrečních buněk v řadě) či přerůst sekrečních buněk (“secretory cells outgrowth” – SCOUT; 30 či více sekrečních buněk v řadě), které však v současné době nemají jednoznačný klinický význam, byť se vyskytují častěji u pacientek s vyšším rizikem vzniku HGSC (30). Praktický dopad těchto poznatků je zásadní, například i s ohledem na možnost preventivního odstranění děložních tub u pacientek s hysterektomií z jiné indikace, které nevyžadují zachování fertility.
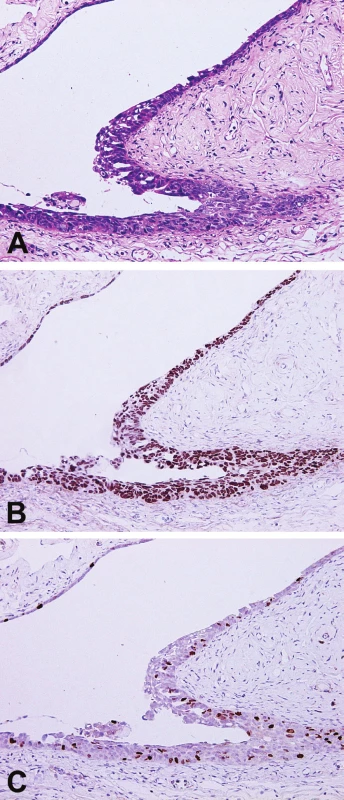
A – HE, 200x; B – imunohistochemický průkaz abnormální pozitivity proteinu p53, 200x;
C – imunohistochemický průkaz zvýšené proliferace (marker Ki-67), 200x.
U pacientek s BRCA1/2 mutací je standardem profylaktické léčby oboustranná adnexektomie. Salpingektomie bez ovarektomie je alternativou pro ženy, které si přejí zachování ovariálních funkcí. Význam profylaktické hysterektomie je diskutován, má svá pozitiva i negativa, podrobný rozbor je však nad rámec tohoto sdělení (31). V současné době panuje shoda v tom, že u pacientek s germinální BRCA1/2 mutací by měly být profylakticky odstraněné děložní tuby zpracované v celém rozsahu podle protokolu SEE-FIM (Sectioning and Extensively Examining the FIMbria) (32). Dle tohoto protokolu je zpracována tkáň děložních tub v celém rozsahu, oblast fimbrií v podélných řezech, zbylá část tuby v příčných řezech. Cílem je detekovat či vyloučit prekurzorickou lézi HGSC, tedy STIC, případně klinicky skrytý HGSC. V případě STIC se z definice i přes absenci invazivního růstu nejedná o carcinoma in situ, ale o lézi s maligním potenciálem, daným možností šíření cestou odlučování nádorových buněk a jejich následnou implantací na ovaria či peritoneum. Další zmíněné jednotky (p53 signatury, SCOUT) v současné době zřejmě nemají klinický význam a lze je často detekovat i u pacientek bez mutace genu BRCA1/2, nicméně, jak již bylo zmíněno, vyskytují se častěji u žen se zvýšeným rizikem HGSC (30). Ovaria se standardně zpracují a vyšetří v celém rozsahu, stejně jako děložní tuby ve 2 - 3 mm lamelách. V případě profylakticky odstraněné dělohy se tato vyšetřuje standardním způsobem jako při vyšetření z jiných indikací (nenádorových). Nicméně dostupný je protokol označovaný jako SEE-END (Sectioning and Extensively Examining the ENDometrium) (33). Podle tohoto protokolu se zpracovává endometrium v celém rozsahu, což má význam pro diagnostiku jinak skrytých lézí, nicméně v současné době nepředstavuje obecně akceptovaný standard. V práci, která dle tohoto protokolu vyšetřila 60 pacientek s klinicky diagnostikovaným HGSC ovaria byla u 13 (22 %) pacientek nalezena atypická hyperplázie (AH), u 3 (5 %) pacientek endometriální intraepiteliální karcinom (EIC) a u 6 (10 %) kombinace obou těchto diagnóz, tedy AH a EIC (33). Ve skupině těchto 22 pacientek s AH či EIC bylo detekováno 5 invazivních serózních karcinomů, 4 z nich autoři hodnotili jako metastázy do endometria, pátý jako primární serózní karcinom endometria u pacientky s HGSC ovaria.
CHEMOTERAPEUTICKÉ ASPEKTY INAKTIVACE GENŮ BRCA1/2
Mechanismu syntetické letality bylo u nádorů s defektními geny BRCA1/2 a tedy s poruchou homologní rekombinace využito k vývoji nového typu léčiv – inhibitorů poly(ADP-riboso) polymerázy (PARP). Na předním místě stojí orálně podávaný olaparib, u kterého byly v klinické studii vůbec poprvé demonstrovány účinky PARP inhibitoru na nádory s inaktivací BRCA1/2 (34). Pozitivní efekt olaparibu ve formě monoterapie byl pozorován jak u karcinomů ovaria senzitivních na platinové deriváty, tak i u pokročilých nádorů s rezistencí na deriváty platiny po vyčerpání standardní chemoterapie (35,36). Olaparib prokázal účinnost i jako součást kombinované terapie s karboplatinou, paklitaxelem a gemcitabinem (35,36). Léčba olaparibem je pacientkami převážně dobře tolerována, mezi nejčastější nežádoucí účinky patří nauzea, zvracení, únava a anémie (36). Vzácně byl popsán rozvoj myelodysplastického syndromu a akutní myeloidní leukémie (37). Na podkladě uspokojivých výsledků při léčbě pacientek s karcinomy ovaria byl olaparib v prosinci 2014 jako zatím jediný z PARP inhibitorů schválen k léčebnému použití v zemích Evropské Unie a v USA (38). Olaparib lze k léčbě pacientek použít pouze za jasně specifikovaných indikačních kritérií, která jsou však v současnosti podrobována analýze v klinických studiích a očekává se jejich rozšiřování, včetně zahrnutí nádorů vykazujících fenomén „BRCAness“ (36).
ANALÝZA GENŮ BRCA1/2 U PACIENTEK S OVARIÁLNÍM KARCINOMEM V ČESKÉ REPUBLICE
Cílem genetického testování u nádorových onemocnění je identifikovat rodiny, ve kterých se přenáší genetická dispozice ke vzniku příslušného nádoru. Toto se tedy týká germinálních (hereditárních) mutací nejrůznějších genů, u nichž je známá vazba na zvýšené riziko vzniku nádorového onemocnění. Do této skupiny patří i testování germinálních mutací genů BRCA1/2. Recentně byla publikována doporučená rozšířená kritéria ke genetickému testování genů BRCA1/2 v ČR, schválená Společností lékařské genetiky a genomiky ČLS JEP (29). Testování germinálních mutací je nutné provádět na pracovištích klinické genetiky a musí mít návaznost na genetické poradenství. Odlišnou problematiku doposud představovalo testování somatických mutací či dalších aberací u nádorových onemocnění jakožto prediktorů cílené onkologické léčby, které je prováděno v síti referenčních laboratoří na pracovištích patologie. Nicméně s nástupem možnosti léčby PARP inhibitory se tato situace změnila a poprvé je prediktorem zároveň germinální i somatická mutace některého genu. To vyžaduje změnu v logistickém přístupu k testování. Podstatnou roli v celém procesu hraje doba testování – v případě prediktivního markeru musí být podstatně kratší, než doposud byla doba genetického vyšetření z jiné indikace. Optimální je uvolnění výsledku do 10 pracovních dnů od obdržení žádosti do laboratoře. Moderní technologie v podobě sekvenování nové generace (next generation sequencing) toto naštěstí umožňují. Praxe ukáže, jak bude vlastní testování probíhat.
Dle současných doporučení ke genetickénu testování by testování germinálních mutací mělo proběhnout u všech pacientek s karcinomem tuby, ovaria či primárně peritoneálním, a to diagnostikovaným v jakémkoliv věku. Pokud se toto doporučení podaří realizovat, pak by tedy klinický lékař měl k dispozici údaj o mutačním stavu (germinální mutace) BRCA1/2 již v počátku léčebného procesu. S ohledem na indikaci léčby PARP inhibitory jsou tedy možné 3 situace. První je, že pacientka má prokázanou germinální mutaci BRCA1/2 (třída 4 či 5), a je tedy při splnění dalších kritérii vhodná pro léčbu PARP inhibitory. Další možností je, že pacientka byla testována na germinální mutace genu BRCA1/2 s negativním výsledkem. Ve třetím případě pacientka z nějakého důvodu nebyla testována na výskyt germinálních mutací genu BRCA1/2 a mutační stav je tedy neznámý. Ve druhém a třetím případě je tedy při zvažování léčby PARP inhibitory nutno testování genu BRCA1/2 provést. V této situaci by se provádělo testování z nádorové tkáně v některé referenční laboratoři na pracovišti patologie, která bude vyšetření nabízet. Vzhledem k očekávanému poměrně nízkému počtu vyšetření se asi nebude jednat o všechny stávající referenční laboratoře, zatím však toto není jasné. V případě pozitivního výsledku (u pacientky s již dříve provedeným negativním testováním na přítomnost germinální mutace) by byl nález hodnocen jako mutace somatická a pacientka by byla vhodná pro léčbu PARP inhibitory. Nalezení mutace u pacientky dosud netestované by s ohledem na indikaci léčby mělo stejný efekt, následně by však pacientka musela být testována v genetické laboratoři s ohledem na vyloučení či potvrzení germinální mutace genu BRCA1/2.
S ohledem na vlastní proces homologní rekombinace a počet genů, které se tohoto děje účastní je dnes jasné, že testování genů BRCA1/2 pokrývá pouze část pacientek s defektem tohoto systému reparace DNA. Jako „BRCAness“ bývá označován stav, u kterého se nepodaří prokázat mutaci genu BRCA1/2, přesto je však zřejmý defekt homologní rekombinace nejspíše tedy související s mutací některého z dalších genů nebo s epigenetickou modifikací BRCA1/2. Optimální by v tomto kontextu bylo nalezení společného jmenovatele, nejspíše v podobě testování funkčnosti procesu homologní rekombinace jakožto celku, v současné době však takový test nemáme k dispozici k využití v běžné praxi.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Petr Škapa, Ph.D.
Ústav patologie a molekulární medicíny 2. LF UK a FN Motol
V Úvalu 84,
150 06 Praha 5
tel.: +420-224 435 623
e-mail: petr.skapa@lfmotol.cuni.cz
Zdroje
1. Prat J. Ovarian carcinomas: five distinct diseases with different origins, genetic alterations, and clinicopathological features. Virchows Arch 2012; 460: 237-249.
2. Shih Ie M, Kurman RJ. Ovarian tumorigenesis: a proposed model based on morphological and molecular genetic analysis. Am J Pathol 2004; 164: 1511-1518.
3. McCluggage WG. Morphological subtypes of ovarian carcinoma: a review with emphasis on new developments and pathogenesis. Pathology 2011; 43: 420-432.
4. Kurman RJ, Shih Ie M. The dualistic model of ovarian carcinogenesis: revisited, revised, and expanded. Am J Pathol 2016; 186: 733-747.
5. Shaw PA. Hereditary carcinomas of the ovary, fallopian tube, and peritoneum. Surg Pathol Clin 2011; 4: 461-478.
6. Boyd J. Specific keynote: hereditary ovarian cancer: what we know. Gynecol Oncol 2003; 88: S8-10; discussion S11-13.
7. Prat J, Ribe A, Gallardo A. Hereditary ovarian cancer. Hum Pathol 2005; 36: 861-870.
8. Risch HA, McLaughlin JR, Cole DE, et al. Prevalence and penetrance of germline BRCA1 and BRCA2 mutations in a population series of 649 women with ovarian cancer. Am J Hum Genet 2001; 68: 700-710.
9. Shaw PA, McLaughlin JR, Zweemer RP, et al. Histopathologic features of genetically determined ovarian cancer. Int J Gynecol Pathol 2002; 21: 407-411.
10. Werness BA, Ramus SJ, Whittemore AS, et al. Histopathology of familial ovarian tumors in women from families with and without germline BRCA1 mutations. Hum Pathol 2000; 31: 1420-1424.
11. Lynch HT, Casey MJ, Snyder CL, et al. Hereditary ovarian carcinoma: heterogeneity, molecular genetics, pathology, and management. Mol Oncol 2009; 3: 97-137.
12. Soslow RA, Han G, Park KJ, et al. Morphologic patterns associated with BRCA1 and BRCA2 genotype in ovarian carcinoma. Mod Pathol 2012; 25: 625-636.
13. Schrader KA, Hurlburt J, Kalloger SE, et al. Germline BRCA1 and BRCA2 mutations in ovarian cancer: utility of a histology-based referral strategy. Obstet Gynecol 2012; 120: 235-240.
14. Press JZ, De Luca A, Boyd N, et al. Ovarian carcinomas with genetic and epigenetic BRCA1 loss have distinct molecular abnormalities. BMC Cancer 2008; 8: 17.
15. Husain A, He G, Venkatraman ES, Spriggs DR. BRCA1 up-regulation is associated with repair-mediated resistance to cis-diamminedichloroplatinum(II). Cancer Res 1998; 58: 1120-1123.
16. McAlpine JN, Porter H, Kobel M, et al. BRCA1 and BRCA2 mutations correlate with TP53 abnormalities and presence of immune cell infiltrates in ovarian high-grade serous carcinoma. Mod Pathol 2012; 25: 740-750.
17. Seidman JD, Beil DA, Crum CP, et al. Serous tumours. In: Kurman RJ, Carcangiu ML, Herrington CS, Young RH, eds. WHO classification of tumours of female reproductive organs. Lyon, PA: IARC; 2014: 15-24.
18. Lim D, Murali R, Murray MP, Veras E, Park KJ, Soslow RA. Morphological and immunohistochemical reevaluation of tumors initially diagnosed as ovarian endometrioid carcinoma with emphasis on high-grade tumors. Am J Surg Pathol 2016; 40: 302-312.
19. Curiel TJ, Coukos G, Zou L, et al. Specific recruitment of regulatory T cells in ovarian carcinoma fosters immune privilege and predicts reduced survival. Nat Med 2004; 10: 942-949.
20. Clarke B, Tinker AV, Lee CH, et al. Intraepithelial T cells and prognosis in ovarian carcinoma: novel associations with stage, tumor type, and BRCA1 loss. Mod Pathol 2009; 22: 393-402.
21. Sato E, Olson SH, Ahn J, et al. Intraepithelial CD8+ tumor-infiltrating lymphocytes and a high CD8+/regulatory T cell ratio are associated with favorable prognosis in ovarian cancer. Proc Natl Acad Sci U S A 2005; 102: 18538-18543.
22. Armstrong DK, Bundy B, Wenzel L, et al. Intraperitoneal cisplatin and paclitaxel in ovarian cancer. N Engl J Med 2006; 354: 34-43.
23. Kwa M, Muggia F. Ovarian cancer: a brief historical overview of intraperitoneal trials. Ann Surg Oncol 2014; 21: 1429-1434.
24. Kwa M, Edwards S, Downey A, et al. Ovarian cancer in BRCA mutation carriers: improved outcome after intraperitoneal (IP) cisplatin. Ann Surg Oncol 2014; 21: 1468-1473.
25. Kim SH, Park WS, Yun SI, et al. Overexpression of BRCA1 or BRCA2 in prostatectomy specimens is predictive of biochemical recurrence after radical prostatectomy. Histopathology 2016; 68: 673-679.
26. Garg K, Levine DA, Olvera N, et al. BRCA1 immunohistochemistry in a molecularly characterized cohort of ovarian high-grade serous carcinomas. Am J Surg Pathol 2013; 37: 138-146.
27. Carser JE, Quinn JE, Michie CO, et al. BRCA1 is both a prognostic and predictive biomarker of response to chemotherapy in sporadic epithelial ovarian cancer. Gynecol Oncol 2011; 123: 492-498.
28. Radosa MP, Hafner N, Camara O, et al. Loss of BRCA1 protein expression as indicator of the BRCAness phenotype is associated with favorable overall survival after complete resection of sporadic ovarian cancer. Int J Gynecol Cancer 2011; 21: 1399-1406.
29. Foretová L, Macháčková E, Palacová M, Navrátilová M, Svoboda M, Petráková K. Doporučení rozšíření indikačních kriterií ke genetickému testování mutací v genech BRCA1 a BRCA2 u hereditárního syndromu nádorů prsu a ovarií. Klin Onkol 2016; 29 Suppl 1: S9-13.
30. Wang Y, Li L, Wang Y, Tang SN, Zheng W. Fallopian tube secretory cell expansion: a sensitive biomarker for ovarian serous carcinogenesis. Am J Transl Res 2016; 8: 230-238.
31. Zikán M. Gynekologická prevence a gynekologické aspekty péče u nosiček mutací genů BRCA1 a BRCA2. Klin Onkol 2016; 29 Suppl 1: S22-30.
32. Chang PS, Crum CP. The fallopian tube and broad ligament. In: Crum CP, Lee KR, eds. Diagnostic gynecologic and obstetric pathology. Philadelphia, PA: WB Saunders; 2006: 675-712.
33. Mingels MJ, van Ham MA, de Kievit IM, et al. Mullerian precursor lesions in serous ovarian cancer patients: using the SEE-Fim and SEE-End protocol. Mod Pathol 2014; 27: 1002-1013.
34. Fong PC, Boss DS, Yap TA, et al. Inhibition of poly(ADP-ribose) polymerase in tumors from BRCA mutation carriers. N Engl J Med 2009; 361: 123-134.
35. Meehan RS, Chen AP. New treatment option for ovarian cancer: PARP inhibitors. Gynecol Oncol Res Pract 2016; 3: 3.
36. Bixel K, Hays JL. Olaparib in the management of ovarian cancer. Pharmgenomics Pers Med 2015; 8: 127-135.
37. Kaufman B, Shapira-Frommer R, Schmutzler RK, et al. Olaparib monotherapy in patients with advanced cancer and a germline BRCA1/2 mutation. J Clin Oncol 2015; 33: 244-250.
38. Kim G, Ison G, McKee AE, et al. FDA approval summary: Olaparib monotherapy in patients with deleterious germline BRCA-mutated advanced ovarian cancer treated with three or more lines of chemotherapy. Clin Cancer Res 2015; 21: 4257-4261.
Štítky
Patologie Soudní lékařství ToxikologieČlánek vyšel v časopise
Česko-slovenská patologie

2016 Číslo 4
Nejčtenější v tomto čísle
- Vyšetření mutací genů BRCA1 a BRCA2 v nádorových tkáních – možnosti a limitace
- Difúzní obrovskobuněčný tumor šlachových pochev krční páteře s destrukcí obratle C6 - kazuistika
- BRCA1 a BRCA2 – patologův startovní balíček
- Karcinomy prsu u nosiček mutací BRCA 1/2
